核桃细菌性黑斑病病原分子鉴定及室内药剂筛选
李 亚 张珍荫 肖 波 杨 斌 赵 宁,
(1. 西南林业大学生命科学学院,云南 昆明 650233;2. 玉龙县林业和草原局,云南 丽江 674100;3. 重庆三峡农业科学院,重庆 万州404100;4. 西南林业大学云南省森林灾害预警与控制重点实验室,云南 昆明 650233)
核桃(Juglans regia),又称胡桃,为胡桃科胡桃属植物。其经济价值和食药用价值在木本植物中有着不可忽视的作用,具有很大的发展潜力和发展优势[1]。核桃是云南省的支柱产业、特色产业和传统产业,全省16个地、州市,129个县、市、区均有分布及栽培[2-3]。全省核桃种植面积达350.92万hm2,产量约116万t,产值318亿元,种植面积、产量和产值均居全国首位[4],其种植面积在全球也名列前茅。但是由于云南的自然条件和地势较为复杂,以及种植管理方式的落后,导致全省各地核桃病害种类繁多[5-7]。据统计,截至2020年,全省核桃的病虫害共有160余种,病害占67种。其中核桃细菌性黑斑病是危害云南核桃的主要病害之一,严重威胁着云南核桃产业的发展,影响了核桃的产值产量,制约着农民增收致富。
核桃细菌性黑斑病是由细菌侵染引起的病害[8-9],全省多地均有发生[10-11]。黑斑病主要危害核桃的果实,感病后导致核桃果实变黑、早落或腐烂[12-14]。陈善义等[15]研究发现黄单胞杆菌属细菌(Xanthomonas campestris)是导致北京地区核桃患黑斑病的主要病原菌;王瀚等[16-17]研究表明致使陇南地区核桃患细菌性黑斑病病原菌是X.campestris和 成 团 泛 菌(Pantoea agglomerans);张琴等[18]研究表明美国山核桃黑斑病为真菌病害,其病原菌为小孢拟盘多毛孢(Pestalotiopsis microspora)。肖波等[19]通过形态特征观察和生理生化测定说明了云南地区核桃黑斑病的病原菌是黄单胞杆菌(X. arboricola)和成团泛菌。不同地区核桃黑斑病病原菌存在差异,弄清细菌性黑斑病的病原菌对于核桃黑斑病的防治具有重要意义,为开展防治工作提供一定的理论依据。瞿佳等[20]对陕西地区的核桃黑斑病防治进行了研究,发现中生菌素、噻霉酮等药剂对核桃黑斑病具有较好的防治效果;武海斌等[21]对泰安市核桃园中核桃黑斑病的发生情况进行调查,针对不同时间的核桃病害发生情况设计了化学防治的用药流程。
本研究采用分子生物学的方法进一步确定云南地区核桃细菌性黑斑病的病原,并利用牛津杯法筛选2种病原菌的防治药剂,为云南核桃黑斑病的研究和防治工作提供参考。
1 材料与方法
1.1 材料
1.1.1 供试培养基
供试培养基为LB培养基。
1.1.2 供试菌株
分离自患细菌性黑斑病的核桃,由西南林业大学生物化学教研室保存,病原菌株编号NO39、
NO119。
1.1.3 供试药剂
10%苯醚甲环唑(上海禾本药业),72%农用链霉素(重庆丰化科技),3%噻霉酮(陕西西大华特科技),30%戊唑·多菌灵(深圳诺普信农化股份有限公司),16%苯甲·中生(深圳诺普信农化股份有限公司),72%百菌清(江苏龙灯化学),33.5%咪鲜胺(江苏明德主达作物科技),6%丙灵·多菌灵(贵州道无生物)。
1.2 方法
1.2.1 病原菌的分子鉴定
将实验室保藏的菌株NO39和NO119活化到LB培养基上,参照北京百泰克生物技术有限公司试剂盒的提取方法提取基因组DNA,采用细菌16S rDNA通用引物27F(5-AGAGTTTGATCCT GGCTCAG-3)和1492R(5-TACGGCTACCTTGTT ACGACTT-3)进行PCR扩增[22],PCR反应体系(50 μL):模板2 μL,2 ×TaqMaster Mix 25 μL,正反引物各1 μL,ddH2O补满体系。PCR扩增程序:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火90 s,72 ℃延伸30 s,40个循环,72 ℃延伸10 min。将扩增产物进行电泳检测后送往北京百泰克生物技术有限公司测序。将测序结果在Gen-Bank进行BLAST比对,选取同源性高的序列在MEGA 7.0中以Neighbor-Joining法进行系统发育树的构建。
1.2.2 杀菌剂对病原菌的抑菌试验
采用牛津杯法进行室内药剂筛选测定。将所选的药剂使用牛津杯法进行初筛,筛选出对核桃细菌性黑斑病病原菌有抑制作用的药剂,初筛后,将有效药剂按高浓度到低浓度进行梯度稀释,测定出有效药剂对病原菌的半数有效浓度(EC50)。具体方法为:在制作好的LB培养基中加入300 μL菌悬液(108cfu/mL),用涂布棒涂抹均匀。在已涂菌液的培养基上呈等边三角形放置牛津杯,在其中2组中加入经过滤膜处理的100 μL同一浓度的农药,另一组加入100 μL的无菌水做空白对照,每组做3个重复。放入28 ℃的培养箱中,采用十字交叉法测量抑菌圈的生长直径并计算抑菌率[23]。

1.2.3 分析方法
采用Excel 2010软件对数据进行统计分析,以药剂浓度的对数值为横坐标,抑制率的几率值为纵坐标建立毒力回归方程,得出相关系数R2以及EC50,并根据EC50进行抑菌效果评价分析。
2 结果与分析
2.1 核桃细菌性黑斑病病原菌的分子鉴定
将得到的2种病原菌提取其DNA进行PCR扩增后送往北京百泰克生物技术有限公司进行测序。将测序得到的片段在NCBI中进行BLAST比对,选取同源性高的序列在MEGA7.0中采用Neighbor-Joining法构建分子系统发育树。根据Kimura 2-parameter法 计 算 遗 传 距 离,以NJ法Bootstrap 1 000次后构建系统发育树。菌株NO39在NCBI中比对后,发现其16S rDNA序列与GenBank中的成团泛菌同源性高达99.93%,构建的系统发育树,见图1。由图1可知,菌株NO39与4株成团泛菌聚在同一个节点,并且其可信度达到100%。而菌株NO119是黄单胞菌属下的一种,由图2可看出,菌株NO119与2株单胞杆菌在同一节点,虽然BLAST后其与X. campestris、X. oryzae的相似性也很高,但图2可看出,其在发育过程中出现了分支,并且都与假单胞菌属下的Pseudomonas aeruginosa保持着较远距离。

图 1 菌株NO39基于16S rDNA序列构建的系统发育树Fig. 1 NO39 phylogenetic tree based on 16S rDNA sequences

图 2 菌株NO119基于16S rDNA序列构建的系统发育树Fig. 2 NO119 phylogenetic tree based on 16S rDNA sequences
综上所述,可将菌株NO39确定为成团泛菌,菌株NO119确定为黄单胞杆菌,同时将2株细菌提交到NCBI中,得到菌株NO39的序列号为MH036307,菌株NO119的序列号为MG872816。
2.2 供试杀菌剂对2种病原菌的抑制效果
将8种供试药剂使用牛津杯法进行初筛,通过判断是否有抑菌圈产生分别筛选出对黄单胞杆菌和成团泛菌有抑制作用的药物(表1)。结果在8种供试药剂中,仅有72%农用链霉素、16%苯甲·中生和3%噻霉酮3种药剂有明显抑菌圈产生,对成团泛菌有抑制作用。当72%农用链霉素浓度为33.33 mg/mL时,抑菌率达到65.23%,而16%苯甲·中生和3%噻霉酮浓度为60 mg/mL时,抑菌率分别为46.09%和58.37%。

表 1 供试药剂对两种病原菌的抑制效果Table 1 The inhibitory effect of the test agent on 2 pathogens
而选用的8种杀菌剂中72%农用链霉素、3%噻霉酮、33.5%咪鲜胺、30%戊唑·多菌灵、16%苯甲·中生和6%丙灵·多菌灵对黄单胞杆菌都有一定的抑制效果,60 mg/mL的3%噻霉酮对黄单胞杆菌的抑制率达到79.84%,72%的农用链霉素对黄单胞杆菌的抑制率达到58.86%。不同的杀菌剂对黄单胞杆菌的抑菌效果存在一定差别,本研究选用对成团泛菌和黄单胞杆菌均有抑制作用的3种药剂3%噻霉酮、72%农用链霉素和16%苯甲·中生进行毒力测试。
2.3 有效杀菌剂对2种病原菌的毒力测定
以药剂浓度的对数值为横坐标,抑菌率的几率值为纵坐标,计算出3种杀菌剂对成团泛菌的毒力回归方程、相关系数和EC50值。从表2可以看出,筛选出的3种药剂对核桃细菌性黑斑病病原菌成团泛菌都有一定的抑制作用,其中3%噻霉酮抑菌效果最好,浓度为0.94 mg/mL 时,抑菌率可达到46.67%,其EC50为3.89 mg/mL;其次是72%农用链霉素,其EC50值为9.97 mg/mL;16%苯甲·中生抑制效果最差,EC50值为103.30 mg/mL。

表 2 3种药剂对病原细菌成团泛菌的毒力比较Table 2 Comparison of virulence of 3 effective bactericide to P. agglomerans
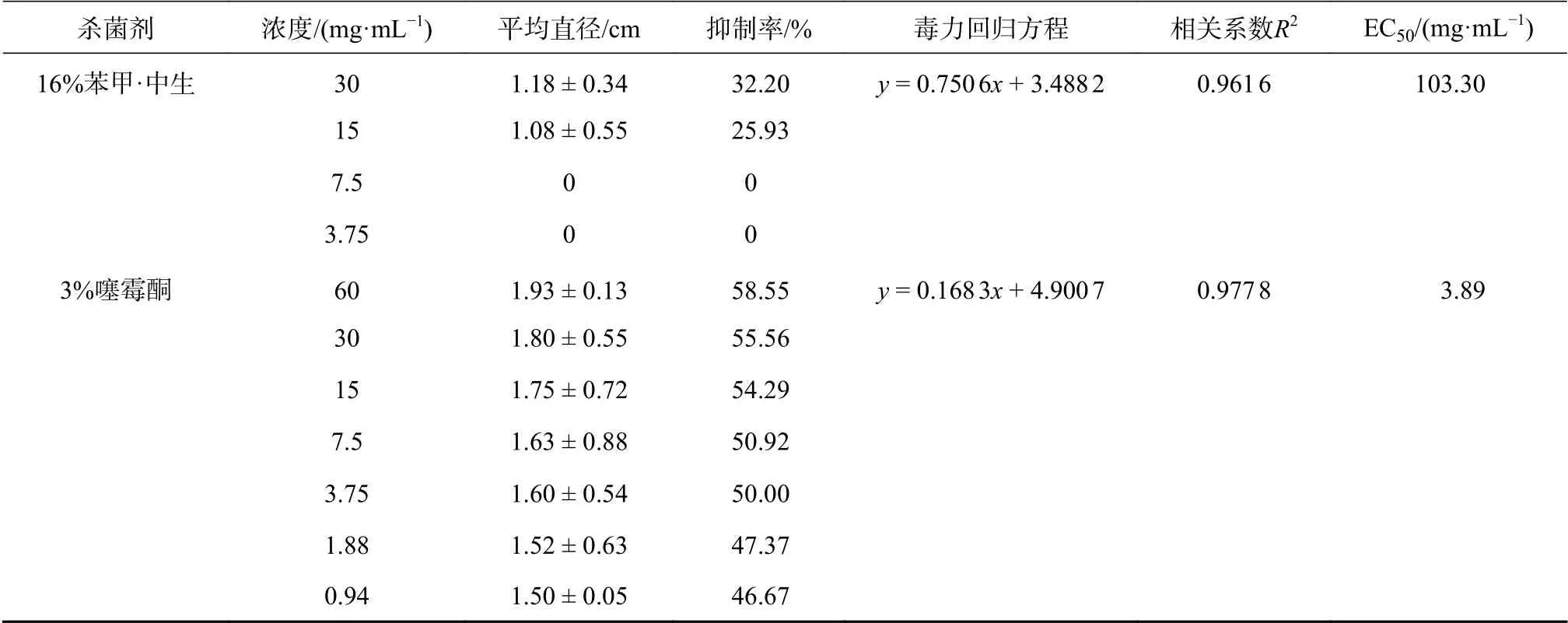
续表 2
以药剂浓度的对数值为横坐标,抑菌率的几率值为纵坐标,计算出3种杀菌剂对黄单胞杆菌的毒力回归方程、相关系数和EC50值,结果见表3。由表3可知,72%农用链霉素、3%噻霉酮和16%苯甲·中生3种药剂对黄单胞杆菌都有一定的抑制作用,但不同的药剂间抑制效果差异较大。3%噻霉酮对黄单胞杆菌的抑制效果最好,浓度为60 mg/mL时抑菌率达到81.18 %,其EC50值为4.93 mg/mL,其次是72%农用链霉素,其EC50值为14.94 mg/mL,16%苯甲·中生对黄单胞杆菌的抑菌效果最差,其EC50值为67.03 mg/mL。

表 3 三种药剂对病原细菌黄单胞杆菌的毒力比较Table 3 Comparison of virulence of 3 effective bactericide to X. arboricola
3 结论与讨论
细菌性黑斑病是一种对核桃的果实、枝干和叶片都能产生严重影响的病害,本研究通过采用分子生物学的方法鉴定出云南地区核桃黑斑病的主要病原菌是黄单胞杆菌和成团泛菌,并且采用牛津杯法分别测定8种杀菌剂对成团泛菌和黄单胞杆菌的抑制作用,筛选出了3%噻霉酮、72%农用链霉素、16%苯甲·中生3种药物对成团泛菌和黄单胞杆菌均具有良好抑制作用。
筛选出对核桃细菌性黑斑病有防治作用的药剂对核桃产业的发展具有深远的意义。已有多篇报道表明抗生素类药剂对细菌性病害有较好的防治效果[24-25],本研究筛选出的72%农用链霉素对成团泛菌和黄单胞杆菌都有一定的抑制作用。孙俊[26]采用分光光度计法也说明农用链霉素对核桃黑斑病的病原细菌有着较好的抑制作用,可用于生产实践。王瀚等[27-28]通过使用抑菌圈法和平板菌落计数法得出农用链霉素和百菌清对成团泛菌的防治有时间和剂量效应,但在本研究中,百菌清对成团泛菌的抑制效果并不明显。王琳莹[29]研究发现咪鲜胺和甲基硫菌灵混合试剂对核桃黑斑病有较好的防治效果,而本研究中咪鲜胺对成团泛菌无抑制作用,可能是由于不同地区分离出的病原菌抗病性存在差异,王琳莹研究的石棉县核桃(NO.EF178448.1)与本研究中的成团泛菌虽然都属于Pantoea agglomerans,但二者进化关系属于不同分支。因此对于不同地区的核桃黑斑病防治应因地制宜,结合当地实际进行防治试验。
不同地区核桃黑斑病的病原菌抗性有所不同,本研究筛选出的72%农用链霉素和3%噻霉酮对云南核桃细菌性黑斑病病原菌有良好的抑制作用,可为云南地区核桃细菌性黑斑病的防治提供参考依据。

