无子刺梨的体内外抗氧化活性及化学成分分析
安雪菲 但汉龙 罗旭璐 刘 云 李永和 赵 平
(1. 西南林业大学西南地区林业生物质资源高效利用国家林业局重点实验室,云南 昆明 650233;2. 云南林业职业技术学院,云南 昆明 650224)
贵州省特有植物无子刺梨(Rosa Sterills)与刺梨(R. roxburghii)同属蔷薇科(Rosaceae)蔷薇属多年生攀援灌木[1-3],其成熟果实香甜爽口,酸味适中,加工鲜食均可[4]。有关刺梨的化学成分和生物活性的研究报道较多,研究表明多酚、黄酮和三萜是刺梨的主要有效成分,具有提高免疫功能、延缓衰老、抗动脉粥样硬化、抗氧化、预防癌症、降血脂和抗糖尿病等生理活性[5-7]。自1985年时圣德[1]首次报道无子刺梨新分类群以来,国内外对无子刺梨的研究主要集中在其形态分类[2-3]、亲缘关系[8-9]、繁殖[10]、光合生理[11]和成分分析[2,12-14]等方面,而对无子刺梨果实的抗氧化活性及其主要化学成分含量分析研究至今未见报道。
活性筛选实验方法分为体外与体内实验,体外实验虽然具有快速高效的优点,但不涉及被筛选物质的吸收、分布和代谢等问题,其筛选结果往往与体内实验结果不符,而以斑马鱼(Danio rerio)建立的体内实验可以弥补体外实验的不足。斑马鱼模型既具有体外实验快速高效的优势,又具有哺乳类动物实验预测性强、可比度高等优点,加之其发育周期快、繁殖能力强、胚胎透明和易于观察,近年来已发展成为国内外高效筛选药理活性的理想模式动物模型[15-17]。本实验以贵州省兴仁县产无子刺梨新鲜成熟果实为原料,采用1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-连氮-二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)自由基清除活性和活性氧簇(ROS)清除活性测试方法评价其果汁提取物和果渣提取物的体内外抗氧化活性,并采用紫外分光光度法分别对果汁和果渣中总多酚、总黄酮和总三萜等主要化学成分的含量进行测定,以期为无子刺梨进一步的开发利用提供参考。
1 材料与方法
1.1 实验材料
1)材料 无子刺梨新鲜成熟果实,于2014年10月采自贵州省兴仁县回龙镇狮子村生长良好的植株。
2)试剂、药品 对照品没食子酸、芦丁和齐墩果酸购自中国药品生物制品检定所,福林酚试剂、DPPH、ABTS、还原型谷胱甘肽(GSH)和ROS特异性荧光染料购自Sigma公司,AB-8大孔吸附树脂购自北京慧德易科技有限责任公司,碳酸钠、抗坏血酸钠、果胶酶、亚硝酸钠、硝酸铝、氢氧化钠、香兰醛、冰乙酸、高氯酸、维生素C(Vc)、二甲基亚砜(DMSO)、甲醇和乙醇均为分析纯,水为重蒸馏水。
3)仪器 CP224C电子天平(奥豪斯仪器有限公司,美国),UV-2500紫外分光光度计(北京莱伯泰科仪器有限公司,中国),高速中药粉碎机(浙江瑞安市永历制药机械有限公司,中国),SG250HDT超声波仪(上海冠特超声仪器有限公司,中国),赛特路斯BT244S型万分之一电子天平(北京赛多利斯仪器系统有限公司,中国),EYELA旋转蒸发仪N-1001型(东京理化器械有限公司,日本),96孔酶标板(Costar Technologies Inc.,美国),Mithras LB940多功能酶标仪(Berthold Technologies Inc.,德国)。
1.2 供试样品制备
无子刺梨果实经榨汁过滤,果汁密封后冷冻备用。所得果渣置于50 ℃鼓风烘箱烘干至恒质量,粉碎过40目筛后于阴凉干燥处保存备用。冷冻果汁解冻后量取500 mL置于烧杯中,加入抗坏血酸钠12.5 mg和果胶酶25 mg,于50 ℃水浴上恒温保持4 h,过滤备用;称取无子刺梨干燥果渣粉末15 g,采用超声辅助乙醇提取法[18],在料液比1∶23、乙醇体积分数52%、提取时间70 min条件下提取4次,提取液于50 ℃减压浓缩,得到剩余水溶液备用。上述所得的2种样品溶液分别通过AB-8大孔树脂层析柱(35 mm×550 mm)吸附,依次用1 000 mL蒸馏水洗脱、1 000 mL乙醇解吸附,收集乙醇洗脱液于50 ℃减压浓缩干燥,得到果汁提取物和果渣提取物。
1.3 测定及分析方法
1.3.1 体外抗氧化活性的测定与分析
采用张镜等[19]和Feng等[20]的方法,取不同质量浓度的供试样品溶液分别与DPPH工作液、ABTS工作液反应,分别按下式计算供试样品的自由基清除率。根据供试样品溶液的DPPH和ABTS自由基清除曲线,分别计算半清除浓度(SC50值)。实验重复3次,并以Vc作为阳性对照。

式中:Aa为样品溶液和DPPH工作液反应后的吸光值,Ab为乙醇和DPPH工作液的吸光值;Ax为样品和ABTS工作液反应后的吸光值,Ax0为乙醇和样品溶液的吸光值,A0表示混合溶液为乙醇和ABTS工作液时的吸光值。
1.3.2 体内抗氧化活性的测定与分析
实验动物为成年野生型AB系斑马鱼,按照李美娟等[21]的方法进行培养。平均每对能产200~300个胚胎。在受精后6 h和24 h对胚胎进行清理(移除已死亡胚胎),并根据胚胎的发育阶段挑选合适的胚胎。在28 ℃条件下用养鱼用水孵育胚胎(养鱼用水水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为480~510 μS/cm;pH为6.9~7.2;硬度为53.7~71.6 mg/L CaCO3)。因为胚胎可以从自身的卵黄囊中获取营养物质,所以在受精后9 d不需要喂食。
样品浓度在3.0 μg/mL时,实验组斑马鱼没有出现死亡现象,因此选择3.0 μg/mL作为样品的浓度。实验在96孔板中进行,每板设计1个阴性对照组、1个模型组、1个溶剂组、1个阳性对照组和8个样品检测组,每样品组8个孔;阴性对照组没有斑马鱼,其他各组均每孔1尾鱼。活性氧模型组为ROS特异性荧光染料处理的斑马鱼;阴性对照组只含ROS染料的养鱼用水,不含斑马鱼;溶剂对照组为0.1% DMSO处理组;阳性对照组为GSH处理组;所有实验组均含有相同浓度的溶剂。化合物处理结束后,应用多功能酶标仪对各实验组进行荧光定量分析,取6孔斑马鱼荧光值作统计学处理。采用方差分析和Dunnett'st-检验进行统计学分析,P<0.05表明具有显著性差异。统计学处理结果用± SE表示。样品的ROS清除率按公式(3)计算。

1.3.3 3种主要化学成分含量的测定与分析
分别精密称取4.0 mg果汁提取物和果渣提取物,用70%乙醇溶解后定容至10 mL,配制成0.4 mg/mL的溶液。按照Lee等[22]的方法进行操作,实验重复3次,将测得的样品吸光度值带入本实验室已建立的没食子酸标准曲线的回归方程(y=3.222 3x+0.034 1,R2=0.999 9)[23],并结合稀释倍数分别计算出果汁和果渣原料中总多酚的含量。
参考梁倩等[24]的方法,以芦丁为标准品绘制其标准曲线,得线性回归方程为:y=10.174x-0.021 6(R2=0.999 6),表明芦丁在0.01~0.05 mg/mL范围内线性关系良好。精密称取10 mg果汁提取物和果渣提取物,用70%乙醇溶解后定容至100 mL,配制成0.1 mg/mL的溶液。之后按梁倩等[24]的方法进行操作,实验重复3次,将测得的样品吸光度值带入上述回归方程,并结合稀释倍数分别计算出果汁和果渣原料中总黄酮的含量。
采用毛得奖等[25]的方法,以齐墩果酸为标准品绘制其标准曲线,得线性回归方程为:y=5.782x+0.103(R2=0.999 9),表明齐墩果酸在0.06~0.42 mg/mL范围内具有良好的线性关系。准确称取10 mg提取样品,用乙醇溶解后定容至10 mL,配制成1.0 mg/mL的溶液。之后按毛得奖等[25]的方法进行操作,实验重复3次,将测得的样品吸光度值带入上述回归方程,并结合稀释倍数分别计算出果汁和果渣原料中总三萜的含量。
2 结果与分析
2.1 无子刺梨果汁和果渣提取物的体外抗氧化活性
由图1可知,Vc对DPPH自由基的清除率在10~40 μg/mL浓度范围内的线性关系较好,SC50值为(18.23±1.73) μg/mL。Vc对ABTS自由基的清除率在50~150 μg/mL浓度范围内的线性关系较好,SC50值为(77.45±1.01) μg/mL。
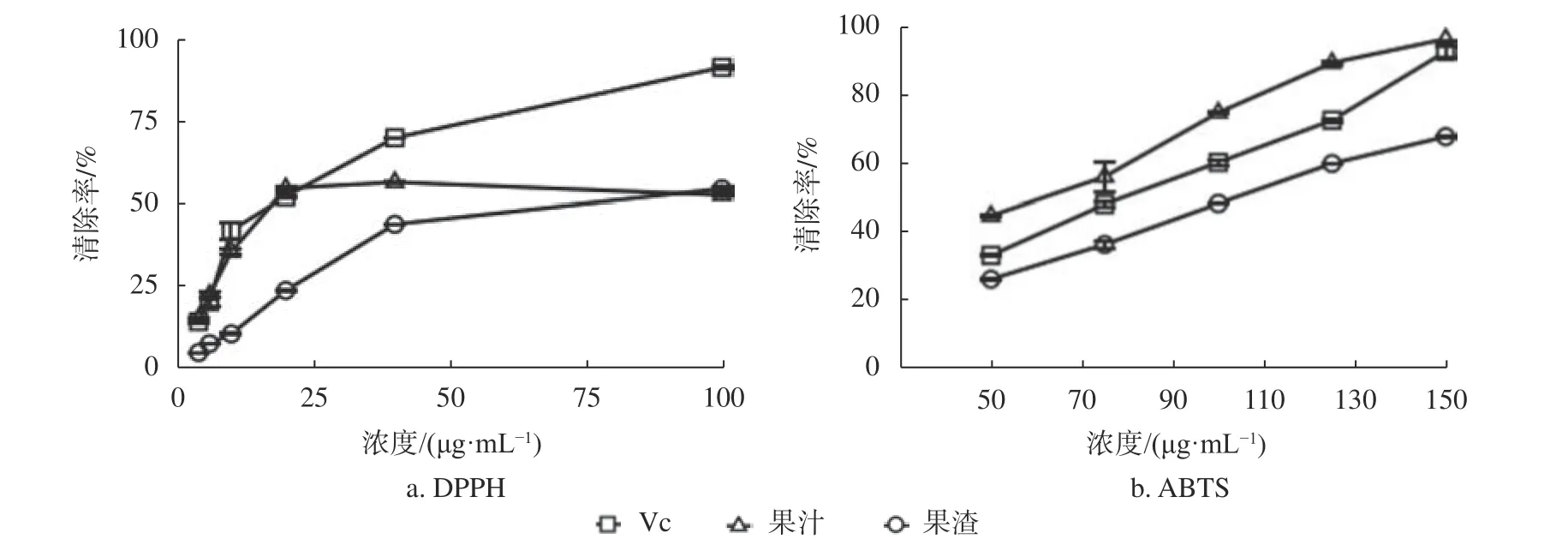
图 1 果汁和果渣提取物的DPPH和ABTS自由基清除率Fig. 1 DPPH and ABTS free radical scavenging rates of the juice and pomace extracts
由表1可知,果汁提取物对DPPH自由基的清除率在4~20 μg/mL浓度范围内的线性关系较好,SC50值为(17.58±0.48) μg/mL;对ABTS自由基的清除率在50~150 μg/mL浓度范围内的线性关系较好,SC50值为(56.26±3.07) μg/mL。与Vc清除DPPH和ABTS自由基的SC50相比,表明果汁提取物的抗氧化活性稍强于Vc。果渣提取物对DPPH自由基的清除率在4~40 μg/mL浓度范围内的线性关系较好,SC50值为(45.38±0.68) μg/mL;对ABTS自由基的清除率在50~150 μg/mL浓度范围内的线性关系较好,SC50值为(101.67±1.15) μg/mL,与Vc的SC50相比,表明果渣提取物的抗氧化活性弱于Vc。

表 1 无子刺梨果汁和果渣提取物对DPPH和ABTS自由基的半清除浓度Table 1 SC50 values of juice and pomace extracts of R. sterilis against DPPH and ABTS free radicals
2.2 无子刺梨果汁和果渣提取物的体内抗氧化活性
由表2可知,ROS清除率分别为(84.8±3.4)%(P<0.001)、(83.8±3.6)%和(52.2±6.7)%,表明无子刺梨果汁提取物和果渣提取物的ROS清除能力相当,且优于阳性对照GSH。

表 2 果汁和果渣提取物的ROS清除率Table 2 ROS scavenging rates of fruit juice and pomace extracts %
2.3 无子刺梨果汁和果渣中3种主要化学成分的含量
由表3可知,无子刺梨果汁中总多酚、总黄酮和总三萜的含量均分别高于果渣中的含量。其中,果汁总多酚达(32.81±0.19) mg/g,是果渣总多酚含量的1.51倍;果汁中的总黄酮含量为(29.62±0.06) mg/g,与果汁总多酚含量较为接近,是果渣总黄酮含量的2.45倍;果汁中的总三萜含量高达(61.88±0.62) mg/g,为果渣总三萜含量的4.08倍。

表 3 果汁和果渣中3种主要化学成分的含量Table 3 Contents of total polyphenols, total flavonoids and total triterpenoids in the juice and pomace mg/g
3 结论与讨论
本实验采用DPPH、ABTS自由基清除活性和ROS清除活性测试方法评价了无子刺梨果汁提取物和果渣提取物的体内外抗氧化活性,结果显示,果汁提取物对DPPH和ABTS自由基的SC50分别 为(17.58±0.48) μg/mL和(56.26±3.07) μg/mL,果渣提取物对DPPH和ABTS自由基的SC50分别为(45.38±0.68) μg/mL和(101.67±1.15) μg/mL,果汁提取物和果渣提取物的ROS清除率分别为(84.80±3.40) %和(83.80±3.60) %,表明果汁提取物的体外抗氧化活性强于阳性对照Vc和果渣提取物。在DPPH自由基清除活性实验中,发现果汁和果渣提取物的自由基清除率并未随着样品浓度的增加而递增,可能是由于样品溶液的颜色随着浓度的增加而增加所致[20]。果汁提取物和果渣提取物的ROS清除率分别为(84.80±3.40)%和(83.80±3.60)%,表明2种提取物的体内抗氧化活性相当,且均强于阳性对照GSH。同时,采用紫外分光光度法分别对果汁和果渣中主要有效成分总多酚、总黄酮和总三萜的含量进行了测定,果汁中总多酚、总黄酮和总三萜的含量分 别 为(32.81±0.19)、(29.62±0.06)、(61.88±0.62)mg/g,果渣中总多酚、总黄酮和总三萜的含量分别为(21.66±0.29)、(12.11±0.05)、(15.16±0.22) mg/g,表明果汁中总多酚、总黄酮和总三萜等主要化学成分的含量均高于果渣,并与其体外抗氧化能力呈正相关关系。
许多研究表明,多酚、黄酮及三萜类物质是果蔬中主要的抗氧化物质[26-29],其抗氧化能力通常和这些物质的含量呈正相关关系。如陈玉霞等[30]分析比较了常见25种蔬菜的体外抗氧化活性,发现抗氧化活性与总多酚和总黄酮含量之间存在较大的相关性。在本研究中,无子刺梨果汁中总多酚、总黄酮和总三萜等主要化学成分的含量均高于果渣中的含量,且果汁提取物的体外抗氧化能力也强于果渣,同样也呈类似的正相关关系,说明这些物质是无子刺梨体外抗氧化活性的主要化学物质基础。此外,果汁提取物和果渣提取物中的总多酚、总黄酮和总三萜的含量差异较大,但二者的体内抗氧化活性非常接近,推测可能是由于果渣提取物中含有其他的抗氧化物质所致,值得进一步深入研究。本实验仅对无子刺梨果汁提取物和果渣提取物的体内外抗氧化活性及其主要化学成分含量进行了测定,其化学成分的分离鉴定和进一步的活性评价等值得深入研究,将为无子刺梨功能性产品进一步的开发利用等提供参考。
——以民国之前文献为中心

