1 061例类风湿关节炎患者骨密度及相关危险因素分析
赵文娟 常志芳 赵剑波 王永福 李青
内蒙古科技大学包头医学院第一附属医院风湿免疫科,内蒙古 包头 014010
类风湿关节炎(rheumatoid arthritis, RA)是临床最常见的自身免疫性疾病,以对称性多关节滑膜炎、关节软骨受损、骨侵蚀、关节畸形为特征,部分病例可合并多脏器受累[1]。骨质疏松症(osteoporosis, OP)是RA常见合并症之一,以骨微结构破坏、骨密度(bone mineral density, BMD)减低、骨强度下降、易发生脆性骨折为特征的全身性骨骼疾病[2],可加重RA的骨质破坏、骨骼畸形、增加脆性骨折风险、降低生活质量、影响患者预后。本研究通过对1 061例RA及636例健康对照骨密度及相关临床因素的大样本分析,探讨RA合并OP的影响因素,指导临床合理诊疗。
1 材料和方法
1.1 研究对象
选取2016年1月至2020年8月于包头医学院第一附属医院确诊的1 061例RA患者,同期该院健康体检者636例。所有RA患者均符合美国风湿病学会1987年制定的RA诊断标准或2010年美国风湿病学会和欧洲抗风湿病联盟共同制定的RA分类诊断标准[3]。已排除甲状腺功能亢进、慢性肾功能不全、创伤性骨折、腰椎及髋关节术后、严重骨质增生、合并其他免疫系统疾病的患者。收集纳入者一般资料,包括年龄、性别、体质指数(body mass index, BMI)、病程、糖皮质激素服用大于1个月、脆性骨折史,股骨头坏死、月经史,完善疾病活动度评分(disease activity score in 28 joints, DAS28评分)评估,检测抗环瓜氨酸肽抗体(anti-cyclic cirullinated peptide antibodies,抗CCP抗体)、类风湿因子(rheumatoid factor, RF)、血沉、C-反应蛋白。两组年龄、性别、绝经人数的分布差异无统计学意义(P<0.05)。本研究已获得我院医学伦理委员会同意。
1.2 骨密度测定
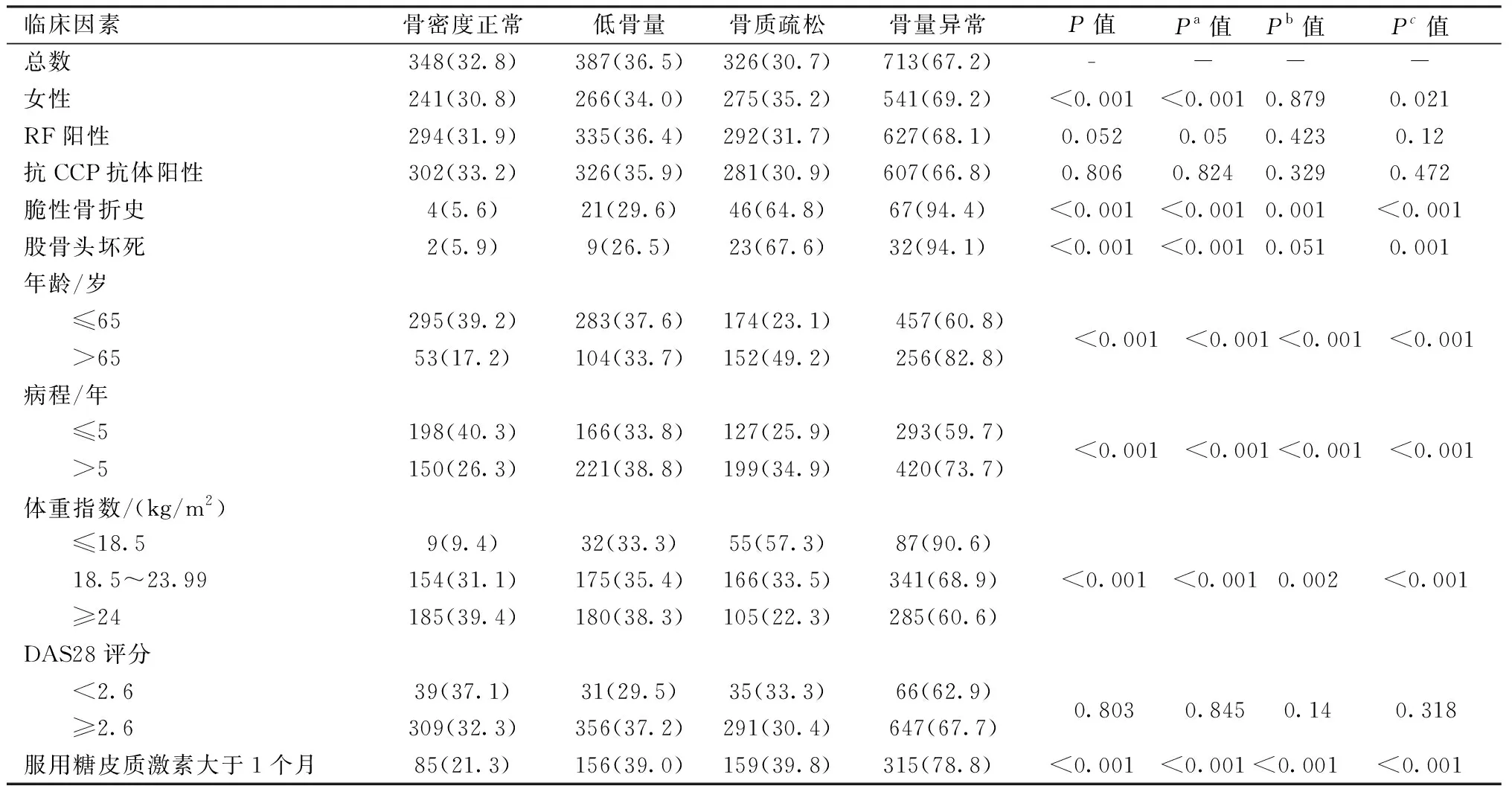
使用法国MEDILINK生产的OSTEO系列全身双能X线骨密度检测仪(dual-energy X-ray absorptiometry, DXA)检测腰椎1~4、左股骨近端骨密度。按世界卫生组织1994年制定的诊断标准判定骨密度结果,T值≤-2.5可诊断骨质疏松,T值≥-1.0为正常骨密度,-2.5 表1 RA患者与对照组骨密度比较 RA患者股骨颈、股骨转子、转子间、全髋关节、腰椎1~4、全部腰椎骨密度较对照组减低,差异具有统计学意义(P<0.001),见表1。依据T值分组,RA组骨密度正常、低骨量、骨质疏松占比分别为32.8 %、36.5 %、30.7 %,健康对照组占比分别为50.2 %、33.2 %,16.7 %,差异有统计学意义(P<0.001);RA组较对照组骨量异常占比升高,差异有统计学意义(P<0.001),见表2。 表2 以T值分组比较 RA患者与对照组骨密度[n(%)]Table 2 Comparison of bone mineral density between RA patients and healthy subjects grouped by T score[n(%)] 女性组OP占35.2 %,显著高于男性18.3 %,差异有统计学意义(P<0.05)。>65岁组OP发生率可达49.2 %,较≤65岁升高,差异有统计学意义(P<0.05)。病程>5年RA患者其骨质疏松及低骨量发生率均升高,差异有统计学意义(P<0.05)。BMI各组间低骨量、骨质疏松占比不同,差异有统计学意义(P<0.05),体质指数≤18.5 kg/m2,其骨质疏松占比最高,为57.3 %。有脆性骨折史、股骨头坏死骨质疏松发生率可达64.8 %、67.6 %,较未骨折组、无股骨头坏死组升高,差异有统计学意义(P<0.05)。DAS28评分、抗CCP抗体、RF与骨质疏松、低骨量无统计学相关(P>0.05)。曾或正在使用糖皮质激素且疗程大于1个月的RA患者有400例(37.7 %),其骨质疏松、骨量异常发生率高于未使用组(39.8 % vs 25.3%,78.8 % vs 60.2 %,P<0.05),见表3。使用糖皮质激素疗程>12个月组骨量异常发生率高于1~12个月组(82.7 % vs 72.6 %,P<0.05)。检测时仍在使用激素组骨质疏松、骨量异常发生率均高于检测时已停用激素组(44.3 % vs 32.7 %,82.2 % vs 72.4 %,P<0.05)。糖皮质激素最大使用剂量>10 mg/d(醋酸泼尼松)组骨质疏松发生率显著高于<5 mg/d组(42.9 % vs 29.8 %,P<0.05)。 表3 临床因素对RA患者骨密度的影响[n(%)]Table 3 Influence of clinical factors in bone mineral density [n(%)] 纳入年龄、性别、BMI等因素调整多分类Logistic回归模型示RA是骨质疏松、低骨量的危险因素,OR值为2.30(1.70~3.09)、1.65(1.30~2.10)(P<0.001);二分类Logistic回归模型示RA是骨量异常的危险因素,OR值为1.85(1.48~2.31)(P<0.001),见表4。 表4 RA疾病对骨质疏松、低骨量、骨量异常的Logistic回归分析(n=1 061)Table 4 Logistic regression analysis of RA on osteoporosis, osteopenia, and abnormal bone mass (n=1 061) 纳入年龄、性别、BMI、病程、服用糖皮质激素大于1个月、既往骨折史、股骨头坏死等多因素构建Logistic回归模型,结果显示BMI是RA患者低骨量、骨质疏松、骨量异常的保护因素,OR值分别为0.93(0.89~0.97)、0.82(0.77~0.86)、0.89(0.85~0.93);年龄、女性、服用糖皮质激素大于1个月、脆性骨折史、股骨头坏死是RA患者骨质疏松、骨量异常的独立危险因素,其增加骨质疏松风险OR值为1.14(1.12~1.16)、4.83(3.05~7.64)、2.31(1.57~3.41)、6.90(2.28~20.88)、16.19(3.20~81.90),详见表5。 表5 临床因素对低骨量、骨质疏松、骨量异常的logistic回归分析(n=1 061)Table 5 Logistic regression analysis of clinical factors on osteopenia, osteoporosis, and abnormal bone mass (n=1061) 类风湿关节炎是引起继发性OP最常见疾病,早期RA患者X线检查即可发现前臂、手关节及其周围骨的骨质疏松表现,其次全身性骨量流失是RA骨质疏松的另一表现,主要在腰椎及股骨近端[4]。既往研究报道RA患者较健康对照组骨密度明显减低,罹患OP、骨质疏松性骨折风险增加[5]。目前国内外RA合并OP 的大样本临床分析较少,2020年华南地区一项纳入559例RA研究[6]报告显示RA合并OP发生率为56.1 %,OR值为2.79,Choi等[7]研究479例RA患者,OP占比33.4 %。本研究通过1 061例大样本数据分析发现RA患者股骨颈、股骨转子、转子间、全髋关节、腰椎1~4、全部腰椎骨密度较对照组均减低,RA组OP 占比30.7 %,而健康对照组仅为16.7 %,进一步回归分析发现RA是OP、低骨量、骨量异常的危险因素,OR值为2.30、1.65、1.85,与上述研究结果相近。骨质疏松性骨折(又称脆性骨折)是RA严重并发症之一,可显著减低RA患者生活质量及预期寿命,是RA患者死亡第三大原因[8]。RA患者骨折风险是正常人群1.5~2.0倍[4]。骨密度减低易发生脆性骨折,一旦发生骨折,会加速骨量流失、再次骨折风险显著增高。本研究发现14.1 % OP患者发生脆性骨折,脆性骨折组64.8 %存在OP,94.4 %有骨量异常,脆性骨折是OP、骨量异常的危险因素,OR值为6.90、4.45。 本研究中高龄、女性,低BMI、服用糖皮质激素、脆性骨折史、股骨头坏死是RA合并骨质疏松的独立危险因素。病程>5年RA患者OP发生率显著增加,多因素分析结果不显著,可能原因为病程和年龄等因素高度相关。最新研究发现RA继发OP可能与年龄、性别、低BMI、雌激素缺乏、家族OP史、基因、钙和维生素D缺乏、糖皮质激素的使用、长RA病程、未使用免疫抑制剂治疗、慢性炎症等相关[4]。慢性炎症可能参与了RA继发OP的发生,TNF、IL-1、IL-6、IL-17等多种促炎细胞因子诱导破骨细胞分化,抑制成骨细胞成熟,破坏骨动态平衡,加速骨量流失,引发骨质疏松[9]。RF和抗CCP抗体是RA血清中阳性率最高的自身抗体,尤其抗CCP抗体是RA的标记性抗体。高滴度抗CCP抗体与类风湿关节炎骨侵蚀相关。近几年文献报道RF和抗CCP抗体、DAS28评分是RA合并骨质疏松的危险因素[10-12]。但曾婷婷等[13]研究发现此两抗体与类风湿关节炎合并骨质疏松无相关性。康丽荣等[14]研究提示DAS28评分于RA合并骨质疏松无关。Abdulkhaliq等[15]纳入408例RA随访3年发现RA合并OP与不合并OP组DAS28在基线及随访中均差异无统计学意义,RF、抗CCP抗体两组间差异无统计学意义,而RA合并OP组病程更长、使用糖皮质激素占比及致残率更高。也有学者认为抗CCP抗体阳性与早期RA骨密度减低相关,与长病程患者骨密度减低无显著相关[16]。本研究发现RF、抗CCP抗体、DAS28评分与RA合并OP无相关性。可能原因为RA患者普遍依从性差,间断停药加药,DAS28评分仅反映评估时疾病活动度,不能反映整个病程内的疾病活动情况,其次本研究中纳入患者病程长、曾或正在使用糖皮质激素患者比例高且多使用不规律。 糖皮质激素因其高效抗炎、免疫抑制作用可快速缓解RA临床症状,协助慢作用药物发挥作用。但糖皮质激素不良反应多,骨质疏松为其常见不良反应。全国40.6 %的RA患者不同程度地接受过糖皮质激素的治疗[17]。本研究中有37.7 %患者曾或正在使用激素控制疾病、22.9 %患者曾或正在长期(>12个月)使用激素控制疾病。使用激素组其骨质疏松、骨量异常占比显著高于未使用组,糖皮质激素是骨质疏松的独立危险因素,OR值2.31。糖皮质激素使用疗程长、最大使用剂量高以及检测时正在使用激素均易导致骨质疏松。也有研究[5]报道低剂量、短期使用糖皮质激素对RA患者骨密度有保护作用,糖皮质激素对炎症的抑制作用可能抵消其对骨重塑的不良影响。虽然2018年RA治疗指南推荐对中/高疾病活动度的RA患者建议传统合成慢作用药联合糖皮质激素治疗以快速控制症状,但是不推荐单用或长期大剂量使用糖皮质激素[3]。近年来随着国内治疗RA的生物制剂及托法替布等小分子药物品种增多和价格减低,临床医师和患者有了更多选择性,需要日益重视糖皮质激素的不良反应,尤其对骨质疏松的影响,尽量规避其不良反应,规范合理使用糖皮质激素治疗RA。 股骨头缺血性坏死后引发骨吸收和骨重建失衡、新的血管和肉芽组织再生,坏死骨组织被吸收新骨组织再生,骨密度随之改变。本研究发现3.2 % RA患者合并股骨头坏死,股骨头坏死是骨质疏松的独立危险因素,其次非创伤性股骨头坏死与骨密度减低密切有关[18]。最新一项全国研究报告显示26.8 %的股骨头坏死归因于糖皮质激素的使用,RA合并股骨头坏死患病率2.22 %[19],尤其在糖皮质激素的诱导下RA患者骨质疏松和股骨头坏死较健康人群高,全髋关节置换术后并发症较OA患者高[20]。 综上所述,RA患者较健康人群骨密度显著减低,罹患OP风险增加,对高龄、女性、长病程、低体重、有脆性骨折史、股骨头坏死、使用糖皮质激素的患者尤其需要警惕合并骨质疏松的发生,规范合理使用糖皮质激素对预防OP尤为重要。1.3 统计学处理
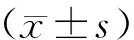
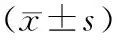
2 结果
2.1 RA与对照组骨密度比较

2.2 临床因素对RA患者骨密度的影响
2.3 RA对低骨量、骨质疏松、骨量异常的Logistic回归分析

2.4 临床因素对RA患者低骨量、骨质疏松、骨量异常的Logistic回归分析

3 讨论

