基于手机的便携式藻类显微与智能识别系统研究*
苏 昂孙凤云鲁子鹏张季儒王昭玉高 瑞*刘 剑*
(1.山东大学控制科学与工程学院生物医学工程研究所,山东 济南 250061;2.齐鲁工业大学(山东省科学院),山东省科学院海洋仪器仪表研究所,山东 青岛 266001)
微型藻类是水体的重要组成部分和水质评价的重要指标[1-2]。水中氮、磷等元素的超标会造成微型藻类爆发性繁殖,从而形成水华、赤潮等水体自然灾害[3]。不同微藻类群的时空分布特征、所产生的危害以及所形成水华的治理方法都具有显著差异性[4],因此微藻监测对水华的研究和治理具有十分重要的意义。
微藻检测主要分为宏观检测和微观检测,宏观检测有无人机或卫星遥感检测[5-6]、荧光检测[7],利用遥感或荧光监测水华,只能监测总体微藻密度,难以研究水体中微藻种类构成以及特定藻类密度。微观检测包括传统显微镜检测[8]、流式细胞仪检测[9]和基因检测[10]。传统显微镜检测和流式细胞仪检测可以精确检测特定种类微藻并分析水体中藻种构成,但是都存在检测成本高,相关设备体积大难以实现微藻现场检测等问题[11]。基因检测耗时较长,无法实现微藻的实时监测[12]。目前现场检测微藻主要以检测胡萝卜素和叶绿素为主,但是仅能检测总体的藻类含量,不能判断藻类种属和观察微藻形态[13]。因此研发一种既能开展现场藻类种属检测又能观察细节形态的便携式藻类检测仪对海洋、湖泊、河流等水域的富营养化研究与治理有重要意义。
本文设计了一种基于手机的便携式藻类显微与智能识别系统,可拍摄微藻显微图片,分辨率达2 μm,基于手机内置的微藻检测APP可实现微藻种类识别并计算密度。整体设备尺寸为156 mm×84 mm×52 mm,总重量为550 g。基于普通智能手机平台,直接取自然水样检测,简单便携,检测成本低,可实现特定种类微藻的现场检测以及水华发展过程的监测,为水华的预警、监测以及相关研究提供重要的技术支持。
1 系统设计
1.1 便携式显微镜结构设计
便携式显微镜由镜架,透镜,电源和光源四部分组成,采用单透镜结合智能手机相机成像,显微镜结构如图1(a)所示。玻片座内置LED灯作为光源,光线由透光孔发出,透过玻片经过球形透镜和手机镜头放大,在手机相机中成像。玻片座套在调焦螺栓上与调焦盘配合实现调焦。球形透镜可分为50倍镜、100倍镜、200倍镜三种。其中200倍镜分辨率为2 μm,结合手机相机,可将微藻清晰放大200倍至1 000倍。显微镜实物图如图1(b)所示,图中左上角为显微镜放大倍数为400倍时拍摄的刻度玻片视场图,图中白色标注为100 μm。

图1 便携式手机显微镜爆炸图及实物图
1.2 藻类智能识别APP的设计
当前研究中一般使用细胞计数板计数进而计算微藻密度,不仅工作量大、对识别人员专业能力要求高而且容易造成视觉疲劳降低准确度。本系统采用深度学习算法对显微镜拍摄图像中的藻类进行识别并计数。利用深度学习模型的研究一般在PC端完成[14],降低了系统的便携性,影响现场检测的实现。本文在手机端开发了基于yolov5深度学习模型的微藻检测APP,通过APP可以调用手机相机拍摄显微照片,或查看已拍摄的微藻照片进行识别计数,检测结果保存在数据库中。
基于智能手机搭建系统可以更好地做到微型化,提高系统的便携性,便于开展现场检测。同时可以依托智能手机成熟的软件开发系统开发配套APP,实现数据的存储和处理,做到显微拍摄和数据处理的一体化。智能手机不仅作为上位机进行数据处理,而且是成像系统的重要组成部分。
1.3 微藻密度检测原理
制作玻片时取5 μL水样均匀分布于18 mm×18 mm的范围内,所以水样中微藻密度计算公式如下:
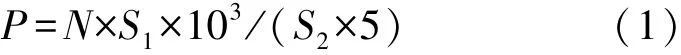
式中:N为视场可见藻类数量,S1为水样分布面积,S2为视场面积,P为水样中藻类密度。
检测水样时应先通过预检测估计水样中微藻密度,然后经过离心或稀释处理保证检测时微藻密度在系统可检测范围内。测量微藻密度时,每一次样本观察共拍摄10张显微照片并使用深度学习模型进行识别,为减小误差去掉两个浓度最低值和两个浓度最高值,取剩余6组结果平均值作为检测结果并记录。
2 实验与结果
2.1 实验材料及设备
为验证微藻检测系统的实用性和现场检测能力,本文开展了水华模拟实验,在敞口玻璃器皿中,加入取自野外的河水,并养有水生植物和小型观赏鱼类。利用水生植物、鱼类、水中微藻等在玻璃器皿中组成一个小型生态水体系统,用来模拟自然界中的水环境。通过人为调控水体的富营养化程度,模拟自然水域中水华的形成过程。在对水样镜检时发现玻璃器皿中优势藻种为羊角月牙藻(Selenastrum capricornutum)并且其他藻种极其稀少,因此以羊角月牙藻为水样中目标藻类,观察月牙藻的增殖情况和密度变化。
羊角月牙藻为月牙型单细胞藻,大小约为2 μm×20 μm,当使用200倍球形透镜和2倍手机摄像头组合时即总体放大倍数为400倍时观察效果较好,所以在以羊角月牙藻为研究对象时,均以上述透镜组合进行观察。放大倍数为400倍时显微镜视场范围为一直径0.3 mm的圆。
实验中所用主要设备为尼康E200生物显微镜、XB-K-25型血球计数板(上海求精公司)、XK-400型离心机(江苏新康公司)。
2.2 微藻识别深度学习模型
经过一个月的培养,使用便携式显微镜镜检水样时拍摄了月牙藻不同密度下显微图像共750副,去掉7副成像质量差的图像,共743张月牙藻显微照片作为深度学习模型数据集。人工标注后,通过程序按照9∶1的比例将数据集分为训练集和测试集。训练网络选用yolov5l,迭代周期300轮。训练结束后,得到的最优模型精确率(Precision)为0.94,召回率(Recall)为0.99,mAP0.5为0.99,训练结果如图2所示。
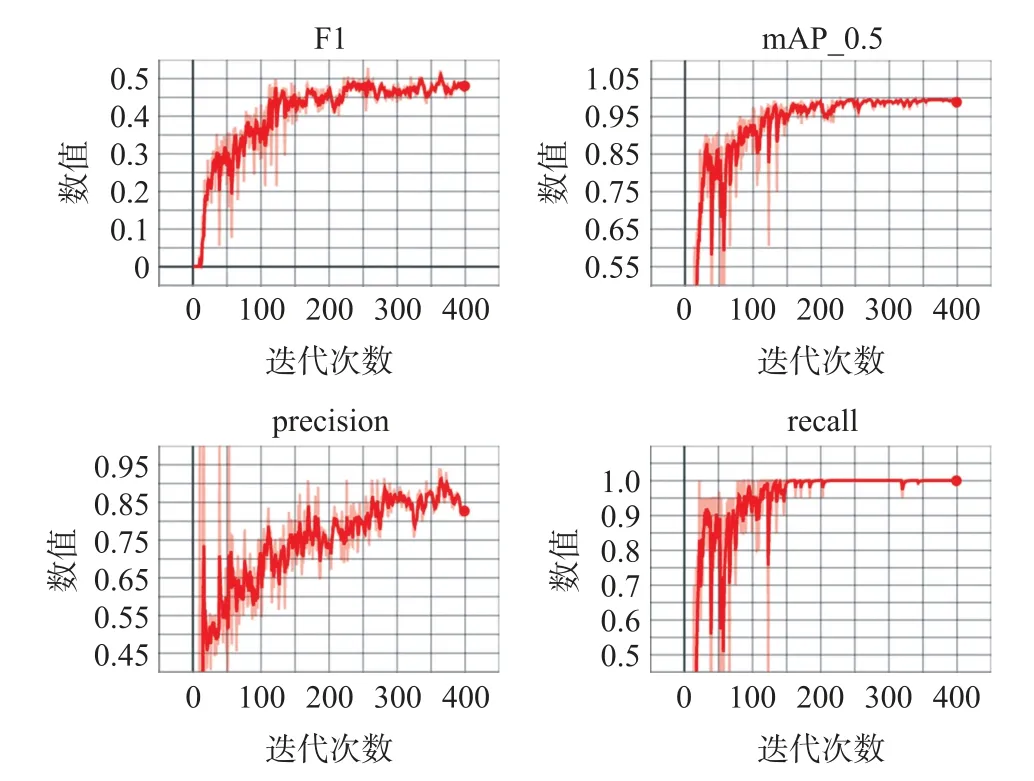
图2 目标识别模型训练结果
mAP0.5表示当置信阈值为0.5时多类别平均精度的平均值,由于本研究中仅有月牙藻一个类别,因此mAP0.5的值等于平均精度(Average Precision,AP),通过式(2)计算平均精度
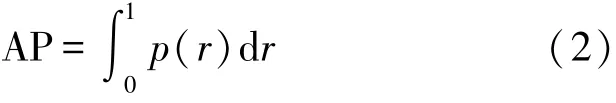
式中:p表示精确率(Precision),r表示召回率(Recall),此时AP的值等于置信阈值为0.5时,Precision-Recall曲线下方所构成区域的面积。精确率、召回率的计算公式分别如下:
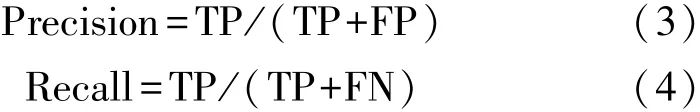
式中:TP表示正确的目标被正确识别为目标区域的数量,FP表示非正确的目标被错误识别为目标区域的数量,FN表示正确的目标被错误地识别为背景区域的数量。由上述可知,精确率、召回率和mAP0.5的值越接近于1,表示所训练模型的识别效果越好。
将最优模型部署到微藻检测APP中,微藻识别及微藻密度检测界面如图3所示。当系统检测出图像中的目标藻类时,用检测框标出微藻并显示相对应的置信值和标签,以标签“sc”代表月牙藻。检测结果页面上方为NMS及Threshold调节按钮,NMS(Non-maximum suppression)为非极大抑制,其目的是为了消除多余的检测框,找到最佳的物体检测位置,实验显示当NMS为0.7时效果较好。Threshold表示置信阈值,当目标框置信值大于设定值时,该目标判定为正确目标。本实验所训练模型检测Threshold为0.5时,效果较好。
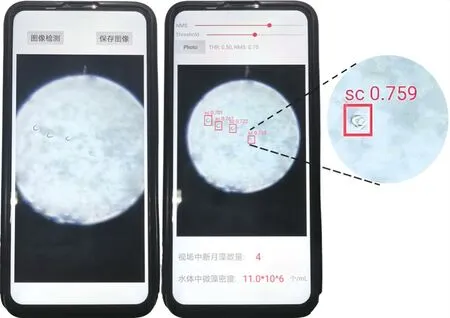
图3 手机APP识别月牙藻并计算其密度
2.3 微藻密度梯度实验
为验证本系统检测微藻的可靠性,本文开展了微藻密度梯度试验,首先配置四种藻液,标号为A、B、C、D。分别使用传统的显微镜计数法和所研制的便携式智能微藻检测系统对四种藻液进行检测,获得月牙藻密度。显微镜计数法是将经过适当稀释的藻液放在血球计数板载玻片与盖玻片之间的计数室中,在显微镜下进行计数。由于计数室的容积是一定的(0.1 mm3),所以可以根据在显微镜下观察到的微藻数目来换算成单位体积内的微藻总数目。实验中所用显微镜为尼康E200生物显微镜,血球计数板为XB-K-25型血球计数板(上海求精)。配置高浓度藻液时使用XK-400型离心机(江苏新康公司)进行离心处理。
测量结果如图4(a)所示,月牙藻在104个/mL~107个/mL范围内,传统显微镜计数法和本便携式检测系统测量结果的相对误差分别为3.03%、2.64%、4.08%、0.84%。同时针对一个数量级范围内的藻液,实验配制五种不同密度梯度,使用两种方法分别对其进行测量,结果如图4(b)所示,月牙藻在2.2×106个/mL~12.1×106个/mL范围内,便携式显微镜视场可见微藻数量与微藻密度有较好的线性相关性,拟合直线的R2为0.979 18。
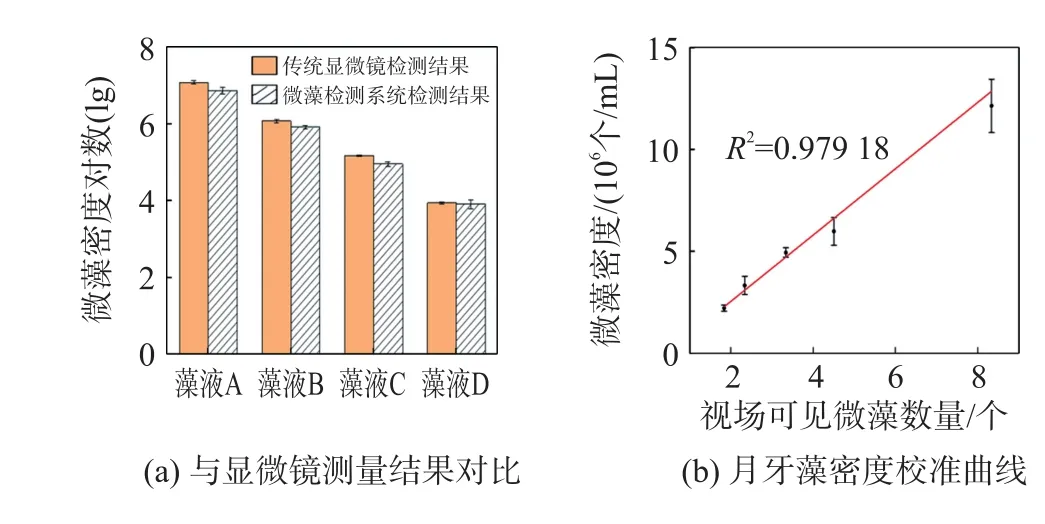
图4 微藻密度梯度实验结果
2.4 水华监测实验
培养玻璃器皿放在阳台,人为调控,加速水体的富营养化进程。每隔3 d~4 d选取光照正常日拍摄水体外观图,并取水样在微藻检测系统下进行检测,记录实验数据。每次取上、中、下层水样各0.5 mL,共1.5 mL水样,使藻液均匀混合。取5 μL藻液制成玻片放便携式显微镜下镜检。根据视野中藻类分布情况每次拍摄10张不同视场区域的月牙藻显微照片作为镜检数据保存。水华监测数据如图5所示。
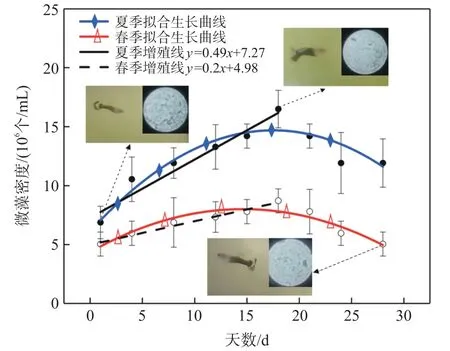
图5 水华模拟实验
在水华模拟实验中,由于随季节变化会出现温度的较大幅度改变,实验中监测到两次水华的发展过程。第一次为春季水华,发生在3月上旬至四月初,共28 d,水温变化为(19±2)℃;第二次为夏季水华,发生在五月中旬至六月中旬,共28 d,水温变化为(25±2)℃。取样日水温数据记录如表1所示。

表1 春、夏季水温对比及取样日水温变化
如图5所示,春季时培养皿中水华爆发,呈现先增长后衰退的现象,由于人为调控导致水体富营养化加剧,月牙藻大量增殖。当月牙藻增殖到临界点时,此时密度为8.7×106个/mL。由于受到温度、无机盐、溶解氧等因素制约以及鱼类和微生物捕食活动影响,月牙藻发生死亡,密度降低,其密度变化趋势与相关研究结果一致[15]。由表1可知,夏季平均水温比春季高约6.3℃,因此相关酶活性增强,月牙藻生命活动更活跃,开始增殖形成夏季水华,水华发展趋势与春季一致。由于此时温度较高,月牙藻数量临界值更高为16.5×106个/mL,超过临界值后密度出现降低至11.9×106个/mL,但仍高于春季时的临界密度值。图5中所示水体外观图与微藻检测系统检测结果相一致,水体外观图右上角为对应的便携式显微镜视场照片。同时由图5可知,夏季增殖线斜率为0.49,而春季增殖线斜率为0.2,由于微藻生命活动更活跃,夏季微藻增殖速率高于春季,此现象符合有关水华的研究结果[16]。由水华模拟实验可知,微藻检测系统可以完成对水华发展过程的监测,预警水华爆发,并且具备对水体的现场检测能力。
3 结论与展望
本文开发了基于智能手机的便携式微藻检测系统,并且通过微藻密度梯度实验和水华模拟实验,与传统显微镜检测结果对比,验证了微藻检测系统的可靠性和现场检测能力,实验结果说明该系统可以高效、快速地测量目标微藻浓度并实时监测水华发展。但是由于自然界水华发展周期长,发展状况及速率难以人为控制,所以本文仅在实验室开展了模拟水华实验,其准确度和功能还应结合自然水域检测实验进一步验证和改进。同时还应开展多藻类水华实验,建立多种微藻数据库,训练相关目标识别模型,验证该系统对多种微藻的识别及密度测量功能。

