第3代人工心脏泵研究进展及应用
刘 鑫 曲洪一 王 聪 刘建华 王秋良
1(中国科学院赣江创新研究院,江西 赣州 341000)2(中国科学技术大学稀土学院,合肥 230026)3(中国科学院电工研究所,北京 100190)
引言
心力衰竭是当今世界面临的共同难题之一,当心脏虚弱并且未能达到与人体各器官及组织需求相称的生理速率泵血时,即会被归类为不同程度的心衰。 目前全球范围内心力衰竭的患病形势极其严峻,患病数量超过2 600 万,并且增长速度持续攀升[1-2]。 除了心脏移植,心衰目前还没有通过药物根治的办法,由于心脏病的高发病率和供体心脏的严重不足,人工心脏成了众多患者延长生存期最后的希望和最有效的途径。 在过去的半个多世纪里,用人工机械泵替换衰竭的人类心脏,一直激励着科学家、工程技术人员以及临床医生不懈探索人工心脏的解决方案,目前这一努力已逐渐步入临床应用,挽救了许多重症的心衰患者[3-5]。
人工心脏分为全人工心脏(total artificial heart,TAH)和心室辅助装置(ventricular assist device,VAD)。 较低的不良事件发生率和更长的生存期提高了VAD 技术的接受度和使用率,因此其在心脏医疗的应用远超于TAH[6]。
人工心脏泵作为VAD 最关键的部件,在心脏医疗与设备领域具有巨大的应用潜力,吸引了国内外许多学者的广泛关注。 为了改善心衰病人的存活几率、功能状态和生活质量,人工心脏泵需要满足体积小、安全可靠以及较好的血液相容性的要求[7]。 目前,我国对于高端医疗器械核心技术的掌握程度还远远不够,医疗制品在全球的市场份额只占2%,高端医疗器械80%以上依赖进口[8],人工心脏泵更是如此,其相关技术涉及磁悬浮、流体力学、永磁电机制造、叶轮设计、生物医学工程、精密控制等多个学科,由于“卡脖子”技术问题,国内对于这方面的研究与应用远落后于发达国家。 另外,我国心衰患者数量庞大,而人工心脏泵造价昂贵,因此人工心脏泵在国内具有巨大的潜在市场。 加强人工心脏的研发不仅是一个科学技术问题,更是一个重大的社会和经济问题,对我国人工心脏泵的创新发展至关重要。 目前人工心脏泵已经发展至第3代,相对于第1 代人工心脏泵[9-12]和第2 代人工心脏泵[13-17],第3 代人工心脏泵具有体积更小、能耗更低、设备寿命更长、血液相容性更好等优势,其治疗及预后效果也受到了普遍认可。 第3 代人工心脏泵的研发,将心力衰竭的治疗推向一个新的台阶。
介绍第3 代人工心脏泵的研究进展,阐述其所涉及关键技术的研究现状,并根据其发展要求以及尚存不足,探讨未来人工心脏泵的发展趋势。
1 第3 代人工心脏泵的发展
1.1 第3 代人工心脏泵的研究现状
第3 代人工心脏泵在心脏医疗服务与装备研发领域具有巨大的应用潜力,吸引了许多从事医疗装备研发工作的科技人员,同时也是目前国内外人工心脏领域的研究重点。
DuraHeart VAD 是日本Terumo 公司研制的一款离心式人工心脏泵,它采用磁悬浮手段实现转子悬浮,是五自由度全磁稳定悬浮,其中叶轮与泵内壁之间留有较宽的血流间隙(250 μm),使得血液能够在泵内处于层流状态,减少对血细胞的损害[18]。 在第3 代人工心脏泵的产品中,DuraHeart VAD 的整体结构较大,尺寸为Ø72×45 mm,重约540 g,转速在1 200 ~2 400 r/min 可调,流量为2 ~8 L/min[19]。DuraHeart VAD 因其出色的泵血性能,成为首个被批准用于临床试验的第3 代人工心脏泵,且于2007年获得欧盟CE 许可。
美国Heartware 公司研制的HVAD[见图1(a)]是一款综合液力悬浮和磁悬浮技术的混合悬浮离心式人工心脏泵,尺寸为Ø48×28 mm,重约160 g,转速在1 800~4 000 r/min 可调,流量最高可达10 L/min[20-21]。 由于HVAD 体积小、能耗低且具有较好的悬浮性能,继2008年成功开展首次大范围的临床试验之后,HVAD 的临床应用急剧增加,目前有不低于7 000 例的心衰患者植入病例[22]。 但其不足之处在于,HVAD 液力悬浮时存在间隙较小的情况(约40 μm),会产生高剪切应力,极大地影响血泵的血液相容性。 一项针对HVAD 的临床试验将其与第2 代人工心脏泵HeartMate II 进行了比较,结果表明两款产品的医疗效果相差不大,HVAD 在血液相容性上甚至稍逊一筹,其脑卒中率为29.7%,而HeartMate II 仅为12.1%,但在设备故障率方面HVAD 略胜一筹[23]。 不久之后,Heartware 医疗器械公司开发出HVAD 的改进版产品——MVAD [见图1(b)],与上一代产品相比,MVAD 将离心泵改为体积更小的轴流泵,在悬浮技术上未做太多改进,但其尺寸大大缩减,仅为HVAD 的2/3,其优势体现在微型的泵体结构尺寸及超宽的转子调速范围(16 000~28 000 r/min)[24-25]。 因此,MVAD 多数用在身体体积更小的心衰病人身上。
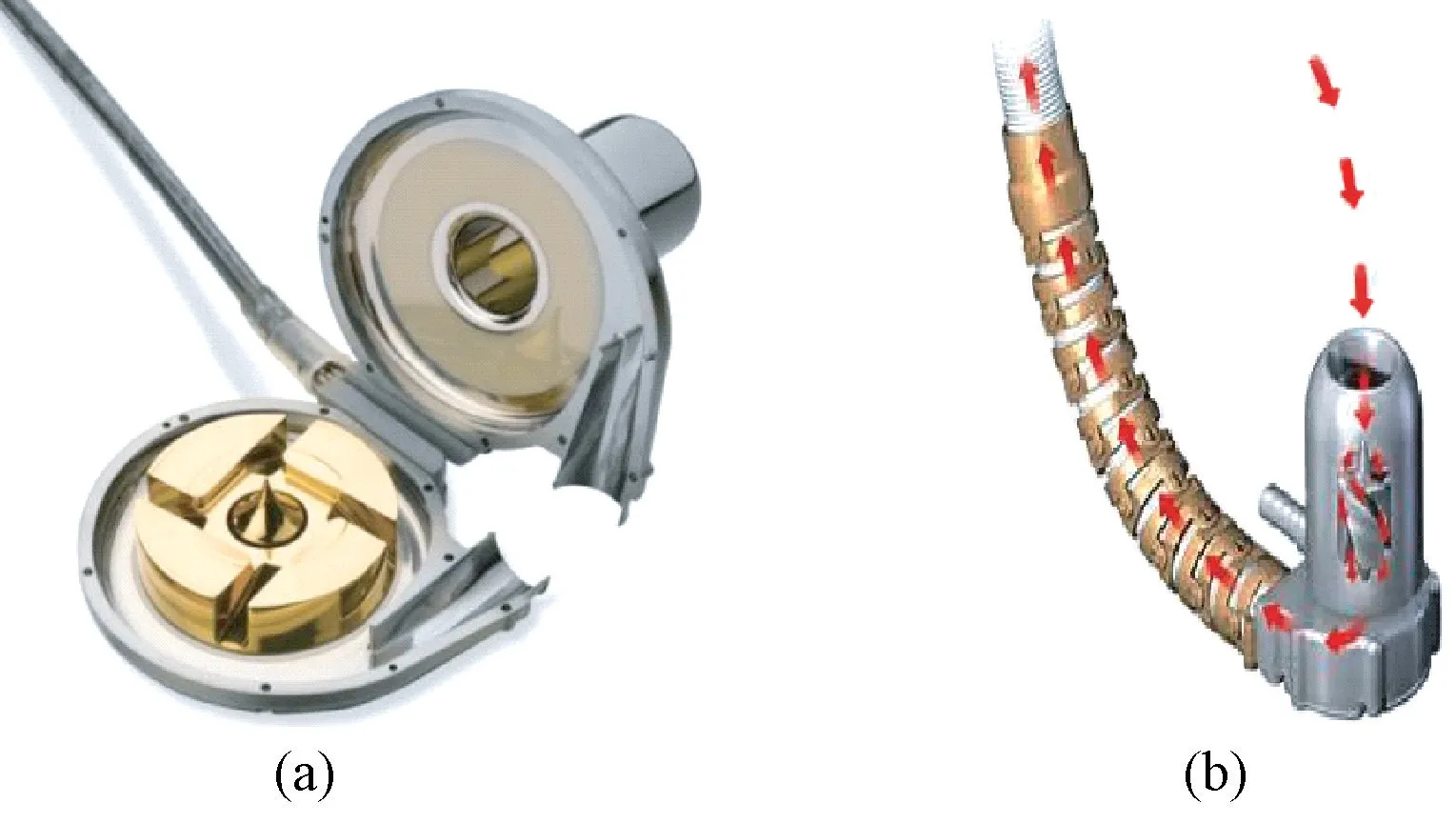
图1 Heartware 研制的人工心脏泵[20]。 (a)HVAD; (b) MVADFig.1 Artificial heart pump made by Heartware.(a) HVAD; (b) MVAD
第3 代磁悬浮人工心脏泵最具代表性的HeartMate III 出自世界最大的人工心脏医疗器械公司——美国的Thoratec,也是目前唯一上市的人工心脏泵产品(见图2)[26]。 HeartMate III 设计的初衷是提高人工心脏泵血液相容性,其工作时泵内叶轮凭借磁悬浮技术完成稳定悬浮,能够使叶轮与泵内壁留有较宽的血流通道(侧边0.5 mm,上下1 mm),可以大大降低并发症的发生概率,这点相比于HVAD 具有较大优势。 HeartMate III 近年来在欧洲开展了大量临床试验,结果表明其血液相容性和患者存活率方面明显优于第2 代人工心脏产品,并获得了欧盟的CE 认证标志[27-28]。

图2 HeartMate III 实物图[26]Fig.2 Object diagram of HeartMate III[26]
1.2 第3 代人工心脏泵的应用情况
第3 代人工心脏泵凭借其较为出色的性能,应用于心脏病相关的各种高端医疗器械中,目前应用最多的有4 种类型。
1)植入式VAD。 人工心脏泵在植入式VAD 上的应用最为广泛,本文列举的人工心脏泵产品大多属于植入式VAD 这一类。 植入式VAD 是将产品植入至人体心脏中,术后会产生一系列排斥反应,而且泵的高速运转对血液也会有不利影响,因此人工心脏泵需要在满足体积小、能耗低的同时实现对人体的伤害最低。 第3 代人工心脏泵加入了以磁悬浮技术和液力悬浮技术为基础的悬浮机制,以离心式或轴流式结构为主体,进一步缩小了产品体积,提高了血液相容性及治疗效果,它的出现使VAD 植入后的生物相容性问题得到了显著的缓解。
2)体外磁悬浮人工心脏。 体外人工心脏是人工制作的置于人体外的心脏,基本上是由人工心脏泵、驱动装置、监控系统、能源等4 个部分构成。 对于体质不适合做植入手术的病人而言,安装体外人工心脏是一种挽救生命的急救和治疗手段,能提高患者50%的存活率,为患者带来生的希望。 另外,遇到急性心脏病的情况时,往往医生需要足够的时间研判病情做出决策,体外磁悬浮人工心脏可以短暂地维持患者的生计,为医生研判病情争取时间。
3)全人工心脏。 与植入式VAD 不同的是,TAH在使用时需要移除患者本身的病损心脏,完全取代心脏独立工作,因此TAH 服务的对象往往是病情严重、有即将死亡的风险并且没有适合心脏供体的全心衰竭患者。 TAH 在结构上跟VAD 也有所不同,最明显的特征是泵的数量一般为两个,协同工作实现泵血功能。 遗憾的是,受到大尺寸和耐用性差的限制,TAH 经常出现诸如感染、神经系统事件和出血等并发症,植入体内的风险较高。
4)体外膜肺氧合。 2019年12月,新型冠状病毒爆发,截至目前全世界范围内确诊病例超过1.74亿例,累计死亡病例超375 万例,疫情依旧严峻。 体外膜肺氧合(extracorporeal membrane oxygenation,ECMO) 的应用作为挽救呼吸衰竭和重症心脏疾病的一种手段广泛进入大众视野,救治效果明显。 但由于造价高和卡脖子技术问题,目前ECMO 在国内配置非常少,且都依赖国外进口。 作为ECMO 的核心部件之一,人工心脏泵是最具有技术难度的部分,也是当前国产化的难点和关键。
1.3 国内第3 代人工心脏泵的发展状况
国内对于人工心脏泵的研究最早出现在20 世纪80年代,但总体进度缓慢,大部分均停留在模拟实验和动物实验阶段,到现在为止还未有过用于心衰患者的临床试验。 早期第1 代人工心脏泵研究较为典型的有广东心血管病研究所研制的螺旋型人工心脏泵,其核心组成部分为真空泵和空气压缩机[29]。 2008年中国协和医科大学研制出第2 代轴流式人工心脏泵,可以满足连续泵血输出的压力需要[30-31]。 随着第3 代人工心脏泵的出现,国内也陆续开展了一些相关研究。
1)“中国心”人工心脏泵(China Heart)。 China Heart (见图3)是北京安贞医院联合苏州大学以及苏州同心医疗器械公司研发的全磁悬浮人工心脏泵,其直径为50 mm,厚度为26 mm,重约130 g,能耗不低于6 W[32]。 China Heart 产品于2011年开展了动物实验,2017年完成了中国食品药品检定研究院大动物报备实验[33]。 徐创业等[34]报道了China Heart 的动物实验评估结果,证明了该产品具有较好的悬浮性能和生物性能。 目前China Heart 还处于产品优化以及进一步的临床试验阶段。

图3 “中国心”人工心脏泵[32]Fig.3 China Heart
2) “火箭心” 人工心脏泵 ( HeartCon)。HeartCon (见图4)是由泰达国际心血管病医院和中国运载火箭技术研究院共同打造的一款磁、液混合悬浮人工心脏泵,其直径为45 mm,重约180 g,流量为3 L/min,由于采用了液力被动悬浮技术,能耗仅有5 W[35]。 HeartCon 产品于2013年开展了长期动物实验,从实验结果来看,该产品具有优秀的机械性能与较好的血液相容性[36-37]。 HeartCon 人工心脏泵为纯国产自主制造,并于2019年开始了初步的临床试验。

图4 “火箭心”人工心脏泵[35]Fig.4 HeartCon
国内对于人工心脏泵的研究已经逐渐跟国际接轨,但大多都还停留在理论研究和动物实验的阶段,临床应用方面远落后于发达国家。
2 关键技术
2.1 转子悬浮技术
2.1.1 磁悬浮
近年来生物医学领域利用磁性装置进行技术创新的报道越来越多,先进电磁技术应用于生物医学领域已成主流[41]。 磁悬浮是通过磁场作用,以非接触方式让某个处于静止或运动状态的物体悬浮起来,应用该技术可实现无接触式作用模式,避免了工作时由于接触产生表面磨损及热量导致的种种不利影响,如设备寿命缩短、机械失效、血液相容性降低等。 1992年,Akamatsu 等[42]开始将磁悬浮技术应用于旋转人工心脏泵。 在此之后,越来越多团队深入进行磁悬浮人工心脏泵的研究,涌现出一系列产品,比如Dura Heart[43]、Levacor LVAD[44]、HeartMate III[45]等。
第3 代人工心脏泵的磁悬浮机制包括被动磁悬浮和主动式磁悬浮。 被动磁悬浮的悬浮力由永磁体产生,通过永磁体之间的斥力将转子叶轮悬浮起来,主动悬浮则是通过控制无轴承电机上的悬浮绕组实现悬浮。 目前人工心脏泵磁悬浮的实现通常是二者结合的混合模式。 HeartMate III(见图5)是采用混合磁悬浮机制的典型实例,当其工作时,转子的两个径向位移自由度由控制反馈系统实时控制,转子的轴向位移和倾斜通过转子和定子之间的偏置磁通实现被动悬浮[46]。 近年来,许多学者对悬浮机制有了一些新的设计思路。 Kurita 等[47]针对人工心脏泵设计了一种双边定子型混合磁悬浮模式,其特点在于驱动力和悬浮力均在轴向上产生,径向上无电磁器件。 杨石平等[48]采取了轴向永磁轴承和径向电磁轴承结合的方案,通过永磁磁环控制轴向位移实现悬浮,在一定程度上简化了控制方案。

图5 HeartMate III 结构分解[46]Fig.5 Structural decomposition diagram of HeartMate III
磁悬浮人工心脏泵虽然能够较好地实现稳定悬浮,但也存在能耗高和控制过程复杂的问题,优化控制方案与降低磁悬浮血泵主动控制带来的高能耗成为该方向研究的重点。
2.1.2 液力悬浮
液力悬浮是基于流体动压润滑理论,即通过两个物体的相邻表面发生相对移动,使两者间的流体形成高压,从而产生悬浮力。 液力悬浮人工心脏泵则是利用叶轮与泵体的流体作用,产生高压支撑转子,实现无接触悬浮。
第3 代产品中属于液力悬浮的有HH100 型和HH1 型人工心脏泵,它们均采用了阶梯形轴承,通过液力实现转子悬浮。 HH1 由Yamane 等[49]研制,稳定悬浮时叶片与泵壳之间的血流间隙仅为34 μm,容易产生较大的剪切应力。 Kosaka 等[50]在HH1 基础上进行了改进,设计出外形直径为74 mm,厚度为52 mm 的HH100,其稳定悬浮时叶片与泵壳之间的血流间隙约为45 μm,较HH1 间隙有所增加。
VentryAssist(见图6)是一款典型的第3 代液力悬浮人工心脏泵,其设计的巧妙之处在于上下表面均有斜度,在泵工作时运动流体产生动压和悬浮力,这两个力与重力平衡使得叶轮稳定悬浮在泵室中,稳定悬浮时叶片与泵壳之间的血流间隙约为90 μm[51]。VentryAssist 于2003 开始进行临床试验,结果展示了较好的可靠性和疗效,之后VentryAssist也获得了欧盟CE 批准[52]。
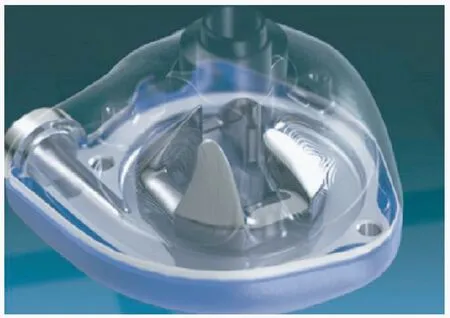
图6 VentryAssist 人工心脏泵[51]Fig.6 VentryAssist VAD
液力悬浮人工心脏泵存在的最大缺陷就是血流间隙过窄,当叶轮处于高速旋转时,在间隙中会形成高剪切应力场,血液流过时内部血细胞易受到损伤,造成溶血、血栓和出血等问题。
2.1.3 磁液混合悬浮
磁液混合悬浮是综合磁悬浮技术和液力悬浮技术的悬浮方式,其设计初衷是为了克服磁悬浮能耗高且控制复杂和液力悬浮血流间隙小的缺陷。
磁液混合悬浮典型的实例是Heartware 系列产品,其中HVAD[20]效果更为显著。 它在径向采用了电磁被动悬浮,依靠转子和泵室内壁的两个稀土永磁环的磁场相互作用产生磁斥力,使得转子在径向上达到平衡状态。 轴向上HVAD 采用了动压悬浮,转子叶片表面是特定的楔形面,在血液中会产生动压悬浮力,以实现转子在轴向上的稳定悬浮。
2015年,日本Okamoto 等[53]报道了一款磁液混合悬浮的轴流式人工心脏泵,悬浮原理与HVAD 相反,其轴向上通过永磁体斥力实现被动悬浮,而在径向上采用液力动压悬浮,通过体外悬浮实验已证明该人工心脏泵能产生足够悬浮力。 国内王伟等[54]则是将磁悬浮技术和液力悬浮技术同时应用于轴向上的悬浮控制,实现了轴向的稳定悬浮。 与传统单一磁悬浮或液力悬浮控制相比,在同一方向上采用混合悬浮具有更好的悬浮性能。
HVAD 面世之后,在人工心脏领域掀起了新的研究热潮,人们对这款采用磁液混合悬浮技术的新型人工心脏泵寄予厚望,然而HVAD 的临床试验结果虽然表现出较高可靠性和疗效,但仍存在狭窄血流通道(约40 μm)产生的高剪切力,而造成出血、血栓和感染并发症等问题。
2.2 无轴承电机
第3 代人工心脏泵大多采用无轴承电机(beardless motor,BM)驱动,而BM 性能的好坏直接影响人工心脏泵的悬浮性能,因此对BM 进行研究至关重要。
1)无轴承无刷直流电机。 无轴承无刷直流电机具有无需润滑、无摩擦磨损、体积小、质量轻、调速快等特点,已广泛应用于人工心脏领域。 王凤翔等[55]报道了采用该种电机的人工心脏泵,其中电机的悬浮转矩产生径向磁拉力,以维持人工心脏泵工作时的稳定悬浮。 通过与传统电机进行对比,发现无轴承无刷直流电机的悬浮性能提升显著,且能耗降低了1 W。 Wan 等[56]将无轴承无刷直流电机应用至离心式人工心脏泵中,在电机的结构部分,它将转子和叶轮设计成一体,放置于密封泵壳内,缠绕有转矩绕组和悬浮绕组的定子置于泵壳外,用于产生旋转转矩和径向悬浮力,混合双绕组结构(见图7)可以在提供转矩的同时保证径向的稳定悬浮。Horz 等[57]设计了一款服务于可植入人工心脏泵的无轴承无刷直流电机,该电机通过优化级数和相数实现了体积的最小化,且电机定子采用软磁材料,大大地提升了电机性能。
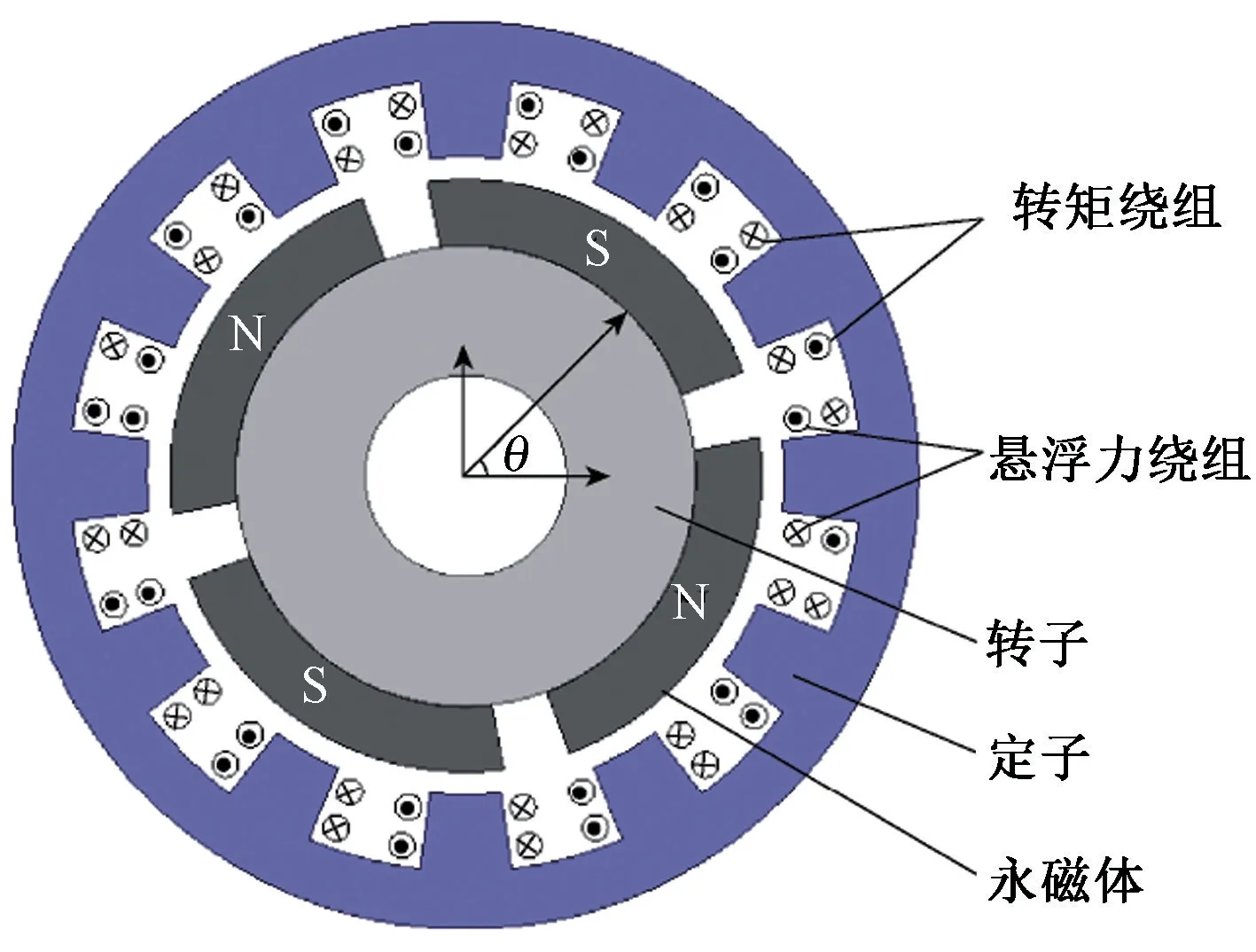
图7 无轴承无刷直流电机双绕组结构[56]Fig.7 Double-winding structure of brushless DC motor without bearing
2)无轴承永磁同步电机。 无轴承永磁同步电机的结构如图8 所示,电机由布置有绕组的定子以及定子包围的泵室组成,泵室里的叶轮依靠永磁体与悬浮绕组作用产生的悬浮力实现稳定悬浮,由于其损耗小、无需润滑、无摩擦磨损、稳定性好、概率密度高等优势性能,已被应用于人工心脏泵[58]。 典型的实例如苏黎世联邦工学院与Levitronix 医疗器械公司共同开发的可植入式人工心脏泵[59],由无轴承永磁同步电机驱动实现悬浮,具有较好的悬浮性能。
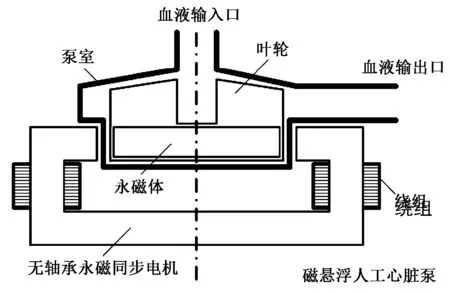
图8 采用无轴承永磁同步电机的人工心脏泵[59]Fig.8 Artificial heart pump with bearingless PMSM
3)无轴承永磁薄片电机。 无轴承永磁薄片电机的特点在于,它不仅可以依靠无轴承技术完成叶轮旋转以及径向x和y平移这两个自由度的稳定悬浮,还可以基于磁阻最小原理,通过磁阻力实现转子在轴向z平移和径向x和y倾斜这3 个自由度的被动悬浮。 近年来瑞士、日本、美国等国家在无轴承永磁薄片电机研究领域均居领先地位,其中由瑞士联邦工学院Schöb 等[60]研制的无轴承永磁薄片电机人工心脏泵已在临床上得到了广泛应用。 采用无轴承永磁薄片电机的人工心脏泵除了无需润滑、无摩擦磨损、体积小、能耗低外,临床试验结果还显示其溶血、凝血概率极低,且系统具有较高的可靠性和耐久度,因而广受青睐。 目前市面上最流行的第3 代人工心脏泵HeartMate III,就是采用无轴承永磁薄片电机实现稳定驱动(见图9)[61]。 近年来,为了更加贴合新一代人工心脏泵的需求,许多学者对无轴承永磁薄片电机进行了改进。 Gruber等创新设计了轴承磁通转换切片电机,与传统无轴承片式电动机相比,这种设计的转子不具有任何永磁体,这为采用一次性转子设备提供了优势。 金超武等[63]报道了一种定子永磁型无轴承薄片电机,它在绕组的结构上选取“准正弦”绕组代替三相绕组,结果表明“准正弦”绕组式定子永磁型无轴承薄片电机相比传统无轴承永磁薄片电机的悬浮性能显著提升。
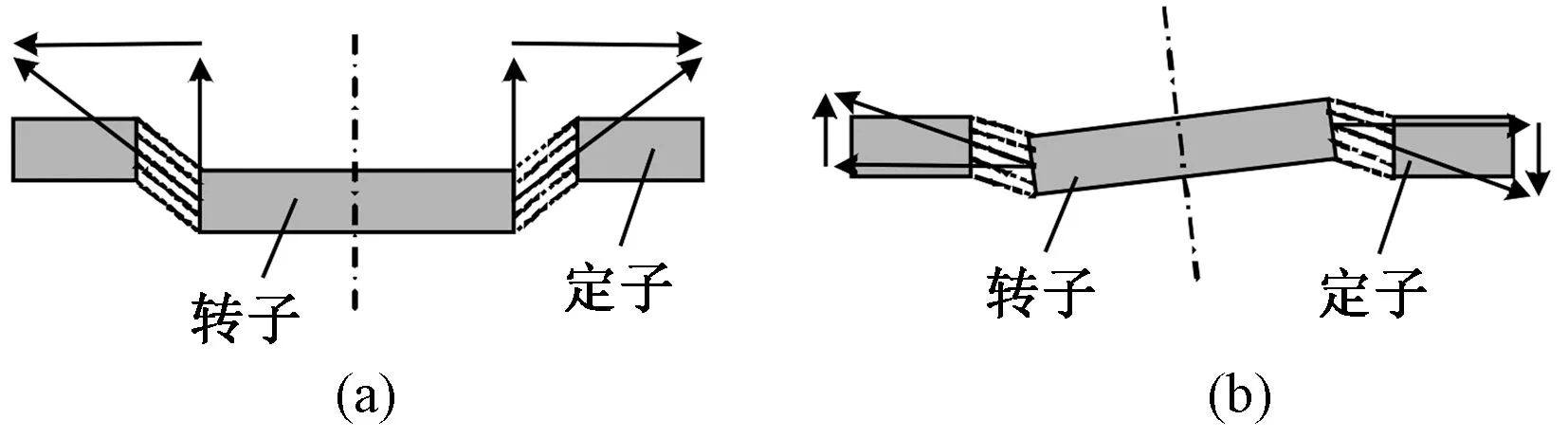
图9 无轴承永磁薄片电机轴向悬浮原理图[61]。 (a)轴向位移;(b)轴向偏转Fig.9 Schematic diagram of axial suspension of bearingless permanent magnet thin sheet motor.(a)Axial displacement; (b) Axial deflection
2.3 控制算法
控制算法的优劣直接影响人工心脏泵的悬浮控制的稳定性和鲁棒性,是人工心脏泵设计过程的研究重点之一。 目前已经应用到人工心脏泵的控制算法有PID 控制(传统PID 控制、神经网络PID控制、模糊PID 控制)、自适应鲁棒控制、无位置传感器控制等。 各控制算法在人工心脏泵的实际应用中各有优劣,下面分别对它们进行阐述。
1)PID 控制。 传统的人工心脏泵通常采用PID算法,相对其它先进控制算法而言,其应用成熟,设计简单容易实现,但控制精度稍逊一筹[64-65]。 在不同工况下,人工心脏泵内部电机参数的变化对叶轮转矩和径向悬浮力影响很大,而优化PID 参数需经历较为繁琐的调试过程,因而制约了第3 代人工心脏泵的发展。 针对传统PID 控制的这一缺陷,国内外学者试着将智能算法与传统PID 控制相结合,以增强人工心脏泵的抗干扰能力和控制精度。 朱卓玲等[66]将神经网络PID 控制应用于人工心脏泵的控制系统中,通过调整神经网络的权重,有效解决了传统PID 在控制人工心脏泵时存在的参数确定复杂和环境扰动不确定的问题。 然而,神经网络PID 控制在具体操作时也存在一定的不足,它需要将大量时间消耗在训练上,而医疗装备往往需要在控制响应方面做到快速、便捷,因此神经网络PID控制在人工心脏泵的应用也受到限制。 模糊PID控制与神经网络PID 不同,其设计思路是不依赖于数学模型,而是参照人类经验数据完成系统控制。刘佩璋等[67]将模糊PID 控制用于轴流式人工心脏泵中,使得工作时PID 参数能够得到实时自整定,实验结果表现出其控制系统具有较好的鲁棒性。Wu 等[68]针对离心式人工心脏泵搏动性较小的问题,采用模糊PID 控制算法,通过改变人工心脏泵的转速来提高其仿生搏动性,并通过体外模拟循环实验验证了该方法的有效性。
2)自适应鲁棒控制。 第3 代人工心脏泵系统具有强耦合、强干扰、非线性、不确定性等特点,在设计控制系统时要综合考虑上述因素。 自适应控制能够较好地克服非线性系统的不确定性,而鲁棒控制在干扰抑制和补偿方面表现得较为出色,自适应鲁棒控制就是将两者结合,实现优势互补。Ravanshadi 等[69]将自适应鲁棒控制用于人工心脏泵的控制中,表现出较好的自适应性和抗干扰性,即当受到外界干扰或处于不同心率状态时,其能实现控制系统参数的实时更新,从而有利于提高人工心脏泵的稳定性。
3)无传感器控制。 转子位置检测是实现人工心脏泵稳定控制的基础,目前大多采用传感器获取转子的位置和速度信息。 然而,高精度的位置传感器价格较为昂贵,且人工心脏泵植入后,工作环境复杂多变,也会影响检测的准确度。 为了降低成本,提高检测可靠性,无传感控制应运而生。 目前,无传感器控制方法主要有:基于数学模型的开环估计法、模型参考自适应法、状态观测器法、滑模观测器法等。 Kim 等[70]报道了一种新型无传感器控制技术,克服了无传感器无轴承无刷直流电机驱动器,缺乏在低速运行和瞬时状态下的位置误差问题,确保了从零到全速的高精度、高鲁棒性无传感器运行。 谭亚等[71]将基于滑模观测器的无传感器控制方法用于人工心脏泵中,实现了较好的控制效果,其能够迅速到达稳定状态,满足了人工心脏泵的不同血液灌注的工作需求。 由于无传感控制的控制精度较高,且基本不受工作环境影响,自出现以来一直广受青睐,已成为第3 代人工心脏领域的重要发展趋势。
2.4 叶轮优化设计
叶轮优化设计有助于改善产品性能,是第3 代人工心脏泵研究领域的一个重要分支。 现阶段国内外在人工心脏泵叶轮优化设计的研究中,大部分是通过改变叶轮的结构与工作参数来寻求最优参数组合,因此这种优化设计实际上是一个多目标优化问题。
研究表明,叶轮几何形状参数对人工心脏泵外特性及溶血性能的影响较大。 Chua 等[72]研究了叶轮的叶片形状及叶片数对人工心脏泵水利特性的影响规律,发现叶片前弯的效果最好,且叶片数多时有利于提高泵的水利效率。 Takano 等[73]探讨了两种叶片形状(直叶片、弯叶片)对人工心脏泵叶轮工作性能的影响,发现直叶片的工作性能明显优于弯叶片。 Curtas 等[74]研究了出口叶片高度对人工心脏泵叶轮工作性能的影响,结果显示出口高度越高其工作性能也越好,该结果与传统叶轮设计理论求解出来的结果相悖。 胡婉倩等[75]分析了不同的运行参数(泵入口流量,叶轮转速)以及不同的结构参数(叶片出口宽度与蜗壳入口宽度)与血细胞在泵内所受切应力之间的关系。
近年来的研究还表明叶轮的表面粗糙度对溶血性能也有影响。 人工心脏泵内表面通常采用粗糙材料制成,有助于得到类似于血管内表面的结构,以提高血液相容性。 Yoshiyuki 等[76]研究了叶片特定区域的表面粗糙度对人工心脏泵溶血效应的影响,发现叶轮背面的表面粗糙度对溶血影响最大,叶片的表面粗糙度对溶血影响最小。 Yasuharu等[77]报道了氟掺杂氢化非晶碳涂层的表面特性,发现其具有增加表面粗糙度和表面负电荷的趋势,可用于改善人工心脏泵的溶血性能。
如何优化人工心脏泵叶轮的几何形状参数以及表面粗糙度,降低叶轮在高速运转时对血红细胞的损伤,保持在治疗期间良好的血液相容性,仍是现阶段设计人工心脏泵的重点之一。
2.5 血液相容性
人工心脏泵的血液相容性是表征产品性能好坏的重要指标,其定义为人工心脏泵在工作过程中对流过泵体的血液不产生或者尽可能少产生损害的性能。 国内外研究均表明,相对于前面两代人工心脏泵,第3 代人工心脏泵具有更好的血液相容性。Mehra 等[78]在《新英格兰医学杂志》上报道了有史以来最大的人工心脏泵试验,涉及1000 多名心衰患者,这项研究证实了相比于前两代人工心脏泵,第3代离心式磁悬浮人工心脏泵在性能上更优越,植入更安全,溶血性能也得到了显著改善。 Sidhu 等[79]报道了类似的结果,他们发现与第2 代人工心脏泵相比,在接受HeartMate III 的患者中观察到任何卒中的相对风险降低了53%。 王义文等[80]从流动产生溶血的机理入手,完善了现有人工心脏泵的体外溶血性能评价方法。 浙江大学李寰等[81]分析了叶片曲率对离心式磁悬浮人工心脏泵溶血特性的影响,认为引入叶片曲率可提高离心泵的溶血性能。Ozturk 等[82]对叶轮式磁悬浮人工心脏泵进行流场仿真分析,并通过实验测量溶血值,结果表明该泵具有较好的溶血性能。 图10 为人工心脏泵工作后的血液损伤图。
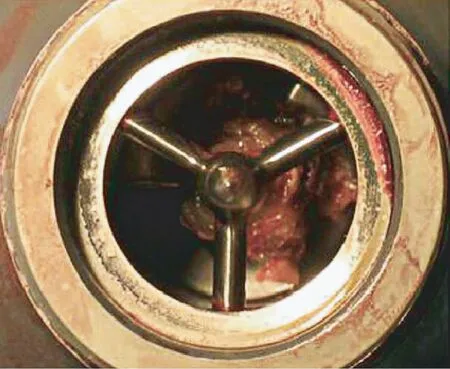
图10 人工心脏泵造成的血液损伤[81]Fig.10 Blood damage from artificial heart pumps
通过计算流体动力学(computational fluid dynamics,CFD)的方法能够实现溶血性能的数值估算。 流场计算的精度直接决定了溶血估算的准确性,而人工心脏泵结构精细复杂,对其内部流场进行流体计算也是一项不小的工程。 Fraser 等[83]将CFD 方法在人工心脏泵流场分析中的应用情况做了一个总结,其中提到人工心脏泵CFD 计算的重点在于需建立适用于泵内部流场的溶血模型。 Taskin等[84]研究了几种目前较为常用的基于应力的人工心脏泵溶血模型,对比分析发现通过应力计算得到的溶血估算值跟实验获得的数据有不小的出入。Arora 等[85]建立了基于应变的人工心脏泵溶血模型,并在模型中提出人工心脏泵工作时血液中的红细胞膜会产生应变,从而导致血细胞损伤的发生。Morshed 等[86]则提出了基于能耗的人工心脏泵溶血模型,表示能量耗散是发生血液损伤和溶血的主要原因。 以上几种人工心脏泵的溶血估算模型各有优缺点,在设计时可根据实际流场情况和工作环境进行选择。
超出血细胞生理承受能力的剪切力是出现血细胞受损的重要原因。 Giersiepen 等[87]发现流动剪切会导致血细胞受损,进而提出了血液损伤的幂律定律,通过测量血液中血红蛋白的含量可以算出红细胞破损率,红细胞破损率与剪切力大小、受剪切时间呈幂指数关系。 Boreda 等[88]以红细胞溶血模型为基础,建立了血小板损伤激活模型。 Mehrabadi等[89]研究了剪切率和红细胞比积对血小板激活的影响及其对血栓形成概率的影响。 就目前的技术而言,第3 代人工心脏泵血液相容性的研究尚未成熟,在提升理论研究、改进材料表面性能和优化心脏泵结构等方面的研究还需进一步深化。
3 展望
目前,国内外对人工心脏泵的研究正处于关键的上升时期,临床应用也在快速发展,但国内尚处于实验阶段。 为使第3 代人工心脏泵切实满足安全可靠、高性能、低成本的要求,并进一步应用于临床实践,得到更多实际应用,其发展趋势和研究重点应就以下重点发力。
1)小型化、轻量化以及微型化。 一直以来小型化、轻量化都是人工心脏泵发展的重要目标,目前几款典型的人工心脏泵,如HeartMate III、HVAD 等产品均已实现极小的结构尺寸。 然而,微型人工心脏泵更便于手术植入,减少植入风险,且更符合长期植入的兼容性。 另外,随着微创手术技术的快速发展,微型化人工心脏泵更适于微创植入,手术成功率会显著提升。 因此微型化人工心脏泵,必将是努力的终极目标。 总之,小型化和轻量化,特别是微型化的人工心脏泵可以减小手术创伤,降低植入手术后出血、血栓和感染等并发症的发生率,进一步缩短术后恢复时间,有助于提高心衰患者的生活质量。
2)仿生搏动性。 虽然人工心脏泵已在医疗辅助供血上得到了广泛应用,但目前98%以上的人工心脏泵仍采用非搏动性的恒流供血模式,这与心脏的搏动式供血模式差别较大。 具有一定节律的搏动是人类心血管系统最基本的生理属性,研究表明搏动性血流驱动在许多生理功能方面均优于非搏动性血流驱动[90]。 一方面,对于衰竭心脏的恢复和支持,特别是心肌功能的恢复,搏动性血流也更具优势;另一方面,搏动性血流可以更好地保持血管弹性,预防动脉硬化,从而更有助于减少心脑血管疾病的发生。 由此可见,搏动性血流比连续性血流更适用于人体的生理要求,更适于长期安全循环供血。 目前,第3 代人工心脏泵已经可以通过周期性地调制人工心脏泵转速,实现仿生搏动性的血流灌注,这有助于心衰患者恢复正常机体的生理功能,有助于受损心脏的后期治疗,这方面的快速发展将是心衰患者的福音。 因此,在人工心脏泵研制过程中切实提高其仿生搏动性是未来发展的一个热点。
3)高精度智能控制技术。 随着智能控制技术和无轴承电机的不断发展,人工心脏泵的控制策略也得到了改进。 其中,高精度智能控制技术将成为主流,其精度高、稳定性好、鲁棒性强强大优势,将成为第3 代人工心脏泵控制系统研究的必然趋势。
近年来,一些新型高性能智能控制策略被应用于人工心脏泵的控制系统中。 Zulkifli 等[91]报道了一种鲁棒控制策略,在设计中引入了3 个灵敏度加权函数,显著提升了系统的控制精度。 赵君等[92]提出了一种基于频域奇异值曲线控制的LQG/LTR 控制策略,并通过电机控制实验验证了该策略的可行性,整体控制性能较优,但是否能应用到人工心脏泵的控制中还需进一步研究。 可以预见的是,未来会研发出更多的模块化、集成化的高精度智能控制器,这有利于进一步提高第3 代人工心脏泵的产品性能。
4)高可靠性及容错技术。 无轴承电机作为人工心脏泵的核心部件,除了满足基本的驱动转矩及悬浮需求外,其可靠性及容错能力逐渐受到重视,未来对这方面的要求也越来越高。 目前,对人工心脏泵无轴承电机性能的核心目标是提升悬浮机制的可靠性与稳定性,高可靠性有利于提升人工心脏泵植入后的工作寿命,降低机械失效率。 对于容错技术,传统的容错模式通常容易出现相电流和相反电动势发生失真现象,从而导致电机中旋转转矩和悬浮力波动较大。 针对以上问题,有必要拓展新型容错控制方法,进一步提高无轴承电机设备的稳定性和可靠性。
5)低成本。 目前国外主流第3 代人工心脏的价格高得惊人,其中装置本身价格可达10 万美元,植入和维护所需要的费用也很可观。 对于我国心衰患者来说,这样的价格是难以承受的。 因此,非常有必要开发具有自主知识产权且更具经济性的国产人工心脏泵,让人民生命安全得到保障的同时,用到性价比更高的产品。 降成本一直是新一代人工心脏泵研发时不可或缺的一项考虑因素。 通常第3 代人工心脏泵价值较高的部分包括:转子叶轮上的永磁体、定子上转矩绕组和悬浮绕组的电磁线圈以及不规则形状的外壳。 未来的研发可以从这3 个方面出发,在保证人工心脏泵设计合理的前提下,进一步研究降低产品成本的可能性。
6)进一步提高血液相容性。 血液相容性是人工心脏领域的一大难题,目前对此的研究十分不足,即使是植入后医疗效果表现不俗的HeartMate III,也依旧存在着出血、溶血、血栓等风险。 为了提高人工心脏泵的血液相容性,减少泵内出血、感染、卒中、血栓等并发症的发生,未来针对此问题需从以下几个方面深入研究:
(1)加强对人工心脏泵血液相容性的基础理论研究,从产生出血、溶血、血栓的机理入手,通过理论推导建立出综合考虑材料属性、血液特征、血液抗溶血破坏能力、血液流动、血小板激活及血液凝聚等因素的数学模型,并基于CFD 流动数值模拟验证模型的正确性及开展模型优化,最后通过实验验证模型的有效性和可行性。 另外,采用更为先进的技术和设备是必不可少的,以便于检测出血、溶血、血栓等并发症的形成过程。
(2)开发用于人工心脏泵的新型材料,提升与血液直接接触的材料表面机械性能,减少不良反应的发生。 随着新型材料的开发和应用,未来人工心脏泵有望采用智能仿生材料与生物活性材料来提高血液相容性。 同时,人工心脏泵表面的形貌结构在设计时应与生物功能有机结合,通过优化形貌结构和表面粗糙度降低血液的排斥作用以及对血液的损伤,可进一步提高血液相容性。
(3)改进叶轮结构,优化叶轮结构参数及工作参数。 研究表明,叶轮结构优化对人工心脏泵性能影响很大,由于人工心脏泵比较特殊,目前关于叶轮优化设计的研究缺乏理论指导,人工心脏泵在叶轮结构参数及工作参数的优化设计上,仍然还有很大的提升空间。 可以考虑将更多新型智能优化算法应用至叶轮优化设计中,寻得更优的参数组合,使得叶轮在泵内高速运转时对血液的损伤最小。
(4)提升人工心脏泵在抗凝和溶栓中的表现。国外的人工心脏泵在临床试验时往往都会参照国际抗凝药物使用标准,选择合适的抗凝药物及合理的剂量,减少并发症的发生,降低患者的痛苦。 国内由于尚未开展大范围的临床试验,对于抗凝和溶栓药物在人工心脏泵中的应用缺乏经验积累和技术支撑。 因此,未来对于抗凝和溶栓相关的研究还需进一步深入。
4 总结
人工心脏泵经过多年的发展,到第3 代已经能够做到体积小、可靠度高及拥有良好的血液相容性,在一定程度上提高了心力衰竭的治疗效率,挽救了不少心衰患者的生命。 但国内关于第3 代人工心脏泵的研究还仅处于起步阶段,尚未形成成熟产品,难于满足实际临床应用的要求。
就目前的技术而言,第3 代人工心脏泵的研究还远没有成熟,在提升理论基础、加强悬浮系统稳定性、改进材料表面性能、优化泵结构、提高血液相容性和仿生搏动性等方面的研究还需进一步深化。与此同时,国内对于第3 代人工心脏泵的研发处于初级阶段,临床试验尚未开展,因此缺乏临床应用上的经验和数据支撑,极大限制了其发展进度。
随着国家对生命医学及生物医学工程等重大学科领域的重视,以第3 代人工心脏泵为代表的高端医疗设备具有极大的发展潜能。 掌握人工心脏泵的相关核心技术,可以为人工心脏泵的开发提供理论支持,有助于实现人工心脏泵的国产化,促进其推广和应用。

