甜菜盐胁迫分子机制研究进展
李俊良,罗成飞
(哈尔滨工业大学,哈尔滨 150000)
0 前言
甜菜(Betavulgaris)是一种两年生草本植物,分类上属于石竹目藜科,二倍体染色体(2n=18),基因组大小估计有714-758 MB[1],全世界甜菜糖的产量约占糖总产量的35 %[2]。甜菜从野生甜菜Betavulgarisssp.maritima继承了一定的耐盐性[3]。许多栽培品种具有较高的耐受性,对盐渍土也具有一定适应能力,甚至低浓度的盐分还能促进其生长,是一种适于在盐渍土壤上耕种且极具价值的经济作物。近年来关于植物耐盐机制的研究方向已经逐渐从生理反应深入到分子应答研究上。近年来有少量文献从转录水平[3-5]、蛋白质水平[6-9]和代谢物水平[16]对甜菜适应盐胁迫的分子机制进行了初步研究。
1 盐份对植物生长发育的危害
当土壤中某种盐类含量过高时,会形成以该盐的离子为主要成分的土壤溶液,使得植物对离子吸收的可选性降低,迫使植物过量累积某些离子而破坏体内离子平衡,从而产生离子毒害作用。NaCl是大部分盐渍土中的常见盐分,它通过Na+和Cl-的积累引起渗透胁迫和离子毒性。钾是酶的活化剂,适当的K+浓度是细胞内多种酶类维持活性所必须的。过量积累的Na+会打破Na+/K+平衡,从而影响光合作用和蛋白质合成等生物过程。同时过量的Na+和Cl-还会破坏膜组织并对细胞内的各种代谢活动直接产生离子毒害作用。离子毒害对作物的伤害虽然缓慢,但通常持需时间较长,它会加速老叶的衰落甚至导致主干死亡[10]。
在植株失水严重且离子失衡的情况下,细胞内环境受到了破坏,这会进一步诱发活性氧(ROS)如单线态氧、超氧阴离子自由基、羟基自由基和过氧化氢等的产生,造成氧化胁迫[11]。过量的ROS一方面会造成膜质的过氧化,破坏膜系统的完整性;另一方面可以直接氧化氨基酸和核酸,影响酶的活性、生物大分子如蛋白质和核酸的结构和功能,如DNA链断裂和酶活降低等[12]。
2 植物对盐胁迫的应答机制
植物在对外界环境变化的长期适应过程中进化出了一系列的盐胁迫应答调控机制。在遭受盐胁迫后,植物自身会主动关闭气孔降低蒸腾作用、削弱叶片的生长并抑制光合作用、合成/释放渗透调节物质恢复渗透平衡、激活ROS清除系统缓解氧化物质对细胞的毒害、合成伴侣蛋白保障生物大分子活性以及减少生物量[13],这些机制大大提高了植物对盐胁迫的抵抗能力。
2.1 渗透调节作用
对于环境胁迫造成的渗透压失衡,植物可以通过迅速合成并累积一些低分子量有机溶质来降低体内水势,完成渗透调节过程。这类被称为渗透保护剂(osmolytes)有机溶质,包括海藻糖、苹果酸、甜菜碱、脯氨酸、多元醇(甘露醇和山梨醇)等。这些物质不但有助于植物调节细胞内的渗透压,还可以稳定蛋白质的空间结构[14]。
甘氨酸甜菜碱(Glycinebetaine)被誉为最佳渗透调节剂,它不仅参与细胞的渗透调节,而且具有稳定大分子的作用。高盐环境下酶的活性会受到抑制,甜菜碱可以使许多重要的酶类如TCA循环的主要酶类、末端氧化酶类和光系统外周肽等在胁迫条件下保持活性,从而对生物体提供耐盐保护[15-17]。甜菜碱的积累与植物胁迫下代谢方向的调整有关,胁迫条件下可以合成甜菜碱的植物以胆碱(Choline)为底物经两步氧化反应迅速合成。催化第一步反应的酶是胆碱单加氧酶(Choline monooxygenase,CMO),合成中间产物甜菜碱醛,催化第二部反应的酶是菜碱醛脱氢酶(Betaine-aldehyde dehydrogenase,BADH)。有研究指出,转化BADH基因的烟草耐低温能力显著提高[18-19]。
2.2 离子解毒作用
植物在遭受盐胁迫后需要重建体内离子平衡以保障细胞可以进行正常的生命活动。植物盐超敏感(Salt Overly Sensitive,SOS)途径是目前已知的调控盐胁迫下细胞离子稳态的重要机制。该系统包含3个关键组件:SOS1属于Na+/H+逆转运蛋白(NHX),SOS2属于SnRK3(sucrose non-fermenting-1-related protein kinase-3)蛋白激酶家族的丝氨酸/苏氨酸蛋白激酶,SOS3属于肉豆蔻酰化钙结合蛋白(myristoylated calcium-binding protein)。盐胁迫后细胞内激增的Ca2+信号激活SOS途径,SOS3首先识别这种Ca2+信号,SOS3与Ca2+结合后可以与SOS2发生相互作用,这种相互作用会将SOS2招募到等离子体膜上,进而激活膜上的SOS1(NHX),SOS1可以促进细胞将多余的Na+排出细胞质[20](图1)。植物吸收盐分后积累到液泡中,控制胞质盐浓度在一定水平,维持胞质内较高的K+/Na+比的过程被称为盐的区隔化作用。高等植物Na+的外排和区隔化主要依赖于质膜上的 NHX来完成。
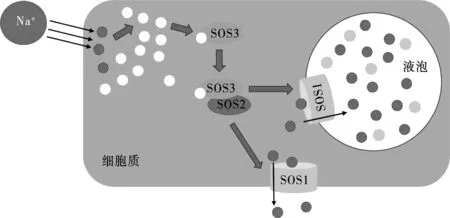
图1 植物盐超敏感途径调控离子平衡示意图
2.3 ROS清除作用
活性氧是有氧代谢不可避免的副产物,为避免ROS积累对细胞造成氧化伤害,植物进化出了一系列的ROS清除机制。超氧物歧化酶(SOD)、过氧化物酶(POD)、过氧化氧酶(CAT)等保护酶可以通过酶促反应清除多余的ROS。对不同植物的研究表明,耐盐植物体内SOD、POD和CAT的活性更高,具有更强的ROS清除能力[21]。一些小分子抗氧化物质如抗坏血酸(ASA)和谷胱甘肽(GSH)可以形成抗坏血酸-谷胱甘肽循环(ASA-GSH)还原细胞中的强氧化性物质。Zhao等的研究显示非共生血红蛋白(NsHb)可以通过提高抗氧化酶系统的活性来减少氧化应激造成的损伤[22]。
2.4 胁迫信号传递
植物激素是植物中最重要的第一信使。盐胁迫可以诱发多种植物激素的合成。脱落酸(ABA)是一种可以调控盐胁迫应答的重要植物激素,它能激活一系列信号转导过程,调控多种胁迫应答基因如蛋白激酶、转录因子、渗透调节蛋白、膜转运蛋白、抗氧化酶类等的表达,进而调控盐胁迫应答过程。有报道指出,盐胁迫下过量的生长素(IAA)会抑制主根的生长,高浓度的乙烯会抑制侧根的萌发,而迅速累积ABA则可以抑制植物侧根的伸长[10]。NO也是植物细胞中重要的第一信使,研究指出内外源NO均能缓解盐胁迫对苗生长的抑制,适量的NO可以诱导植物细胞内多种抗氧化酶的活性,从而提高植物的抗逆能力[23]。
环境胁迫信号的感知和传递可以通过质膜上存在的各种受体蛋白和跨膜蛋白激酶来完成。Ca2+是植物细胞中最重要的第二信使。目前植物细胞中发现的钙信号系统有依赖Ca2+的蛋白激酶(CDPKs)、钙调素(CaM)和钙调磷酸酶B类似蛋白(CBLs)等多类钙结合蛋白家族。此外,Ca2+可以诱导γ-氨基丁酸(GABA)的合成,有研究指出GABA也可以作为一种信号分子调控植物对盐胁迫的应答[24]。
PA(Phosphatidic acid,PA)被称为脂类第二信使,盐胁迫下NO可以促进二酰甘油二酯激酶(DGK)催化1,2-二酰甘油(DAG)生成PA。蛋白质的磷酸化/去磷酸化是细胞应对外界环境变化并调节细胞功能的重要机制,该机制由蛋白激酶催化的蛋白磷酸化将环境信号进行逐级放大,借此调节细胞的生理应答过程。PA可以激活丝裂原活化蛋白激酶(MAPK),将胁迫信号进行放大,激活下游应答反应。三磷酸肌醇(IP3)可以调控液泡内Ca2+离子的释放,同时条还可以被磷脂酰肌醇特异性磷脂酶C(PI-PLC)水解生成DAG,也是植物细胞中重要的第二信使[25]。
总的来看,各信号通路之间相互交叉和联系,形成逆境胁迫信号转导网络,共同调节植物中逆境响应的下游应答基因(图2)。

图2 植物调控盐胁迫的信号分子示意图红色:第一信使,紫色:第二信使,黑色:其他信号分子,ABA:脱落酸,IAA:生长素,DAG:1,2-二酰甘油,IP3:三磷酸肌醇,PA:磷脂酸,cAMP:环磷酸腺苷,cGMP:环磷酸鸟苷,GABA:γ-氨基丁酸,MAPK:丝裂原活化蛋白激酶,CDPK:钙依赖蛋白激酶,SOS3:肉豆蔻酰化钙结合蛋白,ROS:活性氧
3 甜菜耐盐机制研究现状
3.1 甜菜生理水平上对盐胁迫的应答研究
早期对甜菜研究发现,甜菜生理水平上独特的耐盐性主要源于以下3点:
(Ⅰ)甜菜在遭受盐胁迫后可以迅速合成甜菜碱。这是许多农作物如水稻、土豆、番茄等所不具备的能力。甜菜碱不但可以调节渗透压,还能保护生物大分子物质的结构与功能;此外,胞质内的甜菜碱含量升高还可以促进Na+向液泡中流动。
(Ⅱ)甜菜可以利用Na+部分取代K+的功能。Subbarao等的研究指出,红甜菜中95%的K+被Na+被替代后可以正常生长且不影响产量[26]。目前的研究显示,甜菜中除去叶绿素形成的过程必须要K+参与外,K+的非专性功能都可以被Na+替代,如渗透调节、辅助阴离子长距离运输、控制气孔开合、调节酶活性以及叶绿体增殖等[27-29]。
(Ⅲ)甜菜可以通过区隔化作用将盐分“锁”在体内。甜菜将从环境中吸收的盐分运输至地上部分,研究显示叶柄和老叶中盐分含量较高,而光合强度较高的叶片中盐分含量较低。此外,甜菜体内的K+、Na+分布也有利于保证功能叶片中K+的功能。
3.2 甜菜分子水平上对盐胁迫的应答研究
甜菜虽然对盐胁迫表现出较强的耐受性,然而不同品种(基因型)之间的耐盐能力存在显著差异。甜菜对盐胁迫的分子应答过程十分复杂,既涉及到植物激素、糖类、脂类和氨基酸等有机化合物参与的多种信号转导,也包含了基因指导的多种功能蛋白和功能化合物的生物合成。
Lv等使用转录组测序对甜菜M14单体附加系在盐胁迫下的差异基因进行鉴定,结果显示大部分差异表达基因的GO注释集中在氧化还原平衡,信号转导和蛋白质磷酸化上;同时参与ROS清除系统的基因如APX,SOD,硫氧还蛋白(TRX),谷胱甘肽S-转移酶(GST)等在盐胁迫下呈现显着差异[4]。Skorupa等使用转录组测序研究了海甜菜对盐胁迫的应答,结果发现与渗透调节剂、分子伴侣和氧化还原蛋白合成有关的基因在盐胁迫下显著差异表达,这些基因可能在甜菜盐胁迫应答过程中发挥关键作用[5]。
Wang等使用iTRAQ蛋白质组学方法比较了盐敏感和耐盐甜菜品种在盐胁迫下蛋白质组学上的差异,结果显示涉及蛋白质修饰,TCA循环,细胞壁合成和ROS清除的几种蛋白质在敏感和耐性品种之间存在显著差异,表明这些途径可能与甜菜的耐盐性高度相关[29]。Li等iTRAQ蛋白质组学研究了 M14微粒体膜蛋白,结果显示质膜ATPase 11和液泡ATPase H亚基响应盐胁迫而增加,这些蛋白质参与产生质子梯度,分别用于离子穿过质膜和液泡膜的转运[7]。Yu等使用无标记的定量蛋白质组学分析了短期盐胁迫下M14的磷酸化蛋白质组变化,发现促分裂原活化蛋白激酶(MAPK),14-3-3s受体激酶和钙依赖性蛋白激酶(CDPK)在盐胁迫下表现出显着改变[8]。
4 各组学研究对揭示植物盐胁迫应答分子机制的作用
4.1 转录组学
4.1.1 表达谱测序
基于RNA-seq的表达谱测序技术通过构建处于特定状态下的细胞或组织的非偏性cDNA文库,通过大规模的测序工作,最终完成对样本中基因表达种类和丰度的定性和定量分析。表达谱测序技术是一种高性价比的转录鉴定和表达定量方法,适用于大规模研究转录水平基因的表达变化。
加权基因共表达网络分析(WGCNA)是一种网络分析方法,可以根据样本中共表达基因之间的高度相关性将基因分组到特定的模块中,然后使用模块内连接性,基因重要性等来识别调控目标途径的Hub基因。WGCNA相比于差异表达基因包含更多的信息,通过考虑各转录本之间的关系可以更加完整地解析表达谱数据。然而WGCNA分析依赖于充足的样本量,因此大规模的表达谱测序搭配WGCNA分析成为解析植物盐胁迫应答中复杂性状的有效手段。例如Zhu等采用WGCNA方法筛选了水稻(OryzasativaL.)的候选耐盐基因[30]。Zhou等利用WGCNA方法对烟草(NicotianaTabacum)响应低温胁迫的转录组数据进行分析[31]。
4.1.2 小RNA测序和降解组测序
miRNA(microRNA)是一类内生小分子非编码RNA,长度在18~25个核苷酸之间,它们通过抑制翻译过程或直接断裂靶标mRNA从而在转录后水平调控基因的表达[32]。研究表明,miRNA参与调控多种生理和生化过程,如幼苗的生长[33]、花的发育[34]以及对环境胁迫的反应[35]。此外,一项新的研究发现,植物可以输出miRNAs来抑制真菌病原体中的毒力基因表达[36]。识别miRNA及其靶基因对阐明其调控机制至关重要。
Small RNA测序是研究生物样品中小RNA的最主要方法之一,该技术首先分离样品中18-30nt的RNA片段;再利用高通量测序技术获取小RNA的序列和表达量信息。在植物中,大多数miRNA拥有与其靶基因完美互补或接近完美互补的序列,因此可以使用生物信息学工具来预测其靶基因[37]。此外,一种使用高通量测序技术的5′-快速扩增cDNA末端(RACE)的改良版本称为Degradome测序,已越来越多地用于预测miRNAs的靶点[38-39]。许多先前被证实和预测的miRNA靶点已经被这种方法所证实,它提供了一种分析miRNA对靶标RNA编辑模式的综合手段。Degradome测序与小RNA测序相结合,大大提高了在植物中识别miRNAs及其靶点的速度[48]。目前关于甜菜中miRNA的分布及功能研究还相对较少,在miRBase数据库中尚未收录有关于甜菜的miRNA信息注释。
4.1.3 全转录组测序
除编码RNA外,非编码RNA的调控作用对于植物适应环境胁迫也是必不可少的。全转录组测序可以同时分析同一样本中的多种RNA(mRNA、lncRNA和circRNA等),它在揭示细胞生理活动规律和生物代谢机理的研究中发挥越来越重要的作用。
长非编码RNA(long non-coding RNA,lncRNA)是一种长度> 200 nt的非编码RNA[40],它可以从表观遗传水平、转录调控及转录后加工等多种层面实现对基因表达的调控[41]。lncRNAs通常具有和mRNA类似的结构,经剪接后5′端通常有一个7mC帽子,3′端即可以带polyA也可以不带polyA尾。lncRNA的分布与表达通常具有组织特异性和时空特异性,并且lncRNA在不同物种间的保守性较差。最近的研究显示,lncRNA参与植物对非生物胁迫的应答,例如在毛果杨(PopulusTrichocarpa)中发现504条响应干旱胁迫的lncRNA[42],在陆地棉(GossypiumhirsutumL.)中发现了44个响应盐胁迫的lncRNA[43]。对苹果(Malusdomestica)lncRNA的研究显示,MSTRG.85814.11促进SAUR32的表达,从而激活与缺铁反应相关的质子排出[44]。
环状RNA(circular RNA,circRNA)是具有共价闭合环状结构的非编码RNA[45]。大多数circRNA在不同物种间具有保守性和稳定性,而且circRNA的表达同样具备时空特异性。研究发现circRNAs在植物中具有强大的调控作用[46]。对小麦(TriticumAestivumL.)的研究发现了62条响应脱水胁迫的circRNA[47]。对番茄(solanumlycopersicumL.)的研究鉴定了163条响应低温胁迫的circRNA[48]。
基于对大量非编码RNA功能的研究,哈佛大学的研究人员提出了一种竞争性内源RNA(competing endogenous RNA,ceRNA)调控假说,即mRNA、lncRNA、circRNA及假基因转录物通过miRNA应答元件(MicroRNA Response Element,MRE)竞争结合相同的miRNA来影响靶基因的稳定性或翻译活性,实现转录后水平的基因表达调节[49]。全转录组测序技术和生物信息学分析方法的进步将ceRNA的研究扩展到了其他领域。例如,它参与了杨树[50]对低氮的适应、香橙[51]对铜毒性的反应,以及黄瓜[52]对热胁迫的反应。这些结果大大提高了我们对植物非生物胁迫反应机制的认识。
4.2 蛋白质组学
蛋白质组学是以蛋白质为对象,研究机体内蛋白质组成及含量变化规律的科学。由于蛋白质是生理功能的执行者,对蛋白质结构和功能的研究将有助于直接从生理水平上阐明植物对环境胁迫的应答机制。相对和绝对定量标记(Isobaric tags for relative and absolute quantitation,iTRAQ)是当前最可靠的蛋白质组定量标记技术之一[53],广泛应用于非生物胁迫下植物蛋白质组变化的研究。Li等使用iTRAQ研究了甜菜单体附加系M14盐胁迫下膜蛋白的变化[2]。Yu等人研究了短期盐胁迫(30分钟和1小时)诱导的M14叶片中蛋白质组/磷酸化蛋白质组的变化[3]。然而植物蛋白质组对盐胁迫的反应取决于盐胁迫的强度、持续时间和取样部位,同时近年来的研究指出盐处理可以分为渐进的(盐胁迫处理)或立即的(盐休克处理)[54],这些差异会引起植物不同的应答反应,并可能影响对最终实验结果的解释[8]。目前关于甜菜蛋白质组学的研究存在处理时间较短或处理低浓度较低等局限,因此,采用渐进式给盐方式,研究高浓度长时间处理对甜菜幼苗蛋白质组的变化有助于丰富甜菜蛋白水平盐胁迫应答的结果,为最终揭示甜菜盐胁迫应答分子机制提供基础。
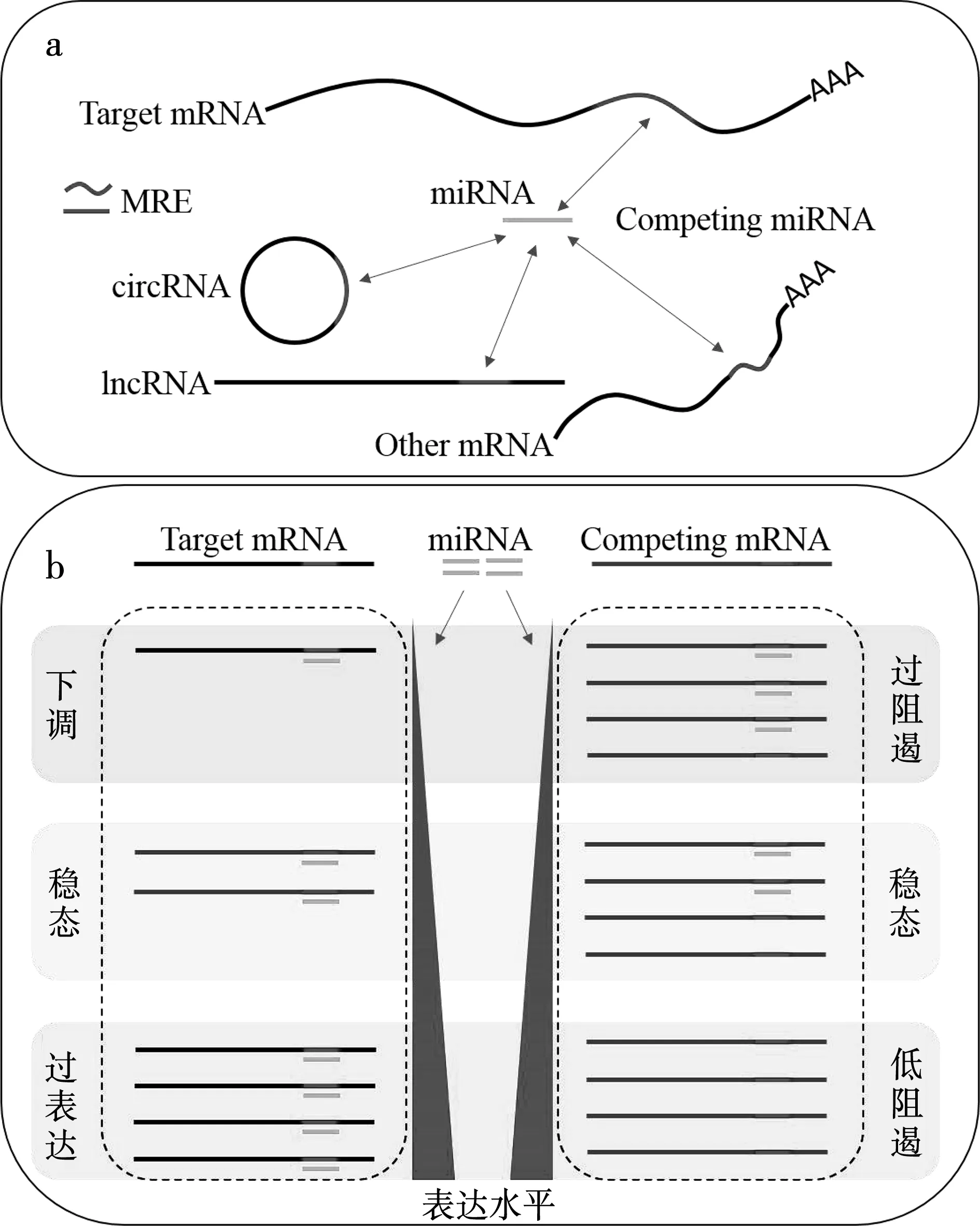
图3 ceRNA机制示意图(a)ceRNA竞争miRNA机制示意图,MRE:miRNA应答元件;(b)ceRNA表达水平关系示意图
4.3 代谢组学
代谢物既可以作为信号分子(如植物激素等)参与调控植物的信号转导,也可以直接作为效应物(如作为渗透调节剂的甜菜碱和自由基清除剂的生育酚等)参与植物的生物和非生物胁迫应答。与基因和蛋白质相比,代谢产物更接近于表型,可以更加准确地反映各种调控的综合结果。近年来随着新技术的不断涌现,各组学的研究迅速向高通量化和定量化发展。由于转录组学、蛋白质组学和代谢组学的研究目标共同处于一张代谢网络中,使得这些组学之间存在一定的关联性,基于此的多组学联合分析已成为探索生命化学物质基础和深入解析其分子机制的新方向。

