超高效液质联用技术分析黄芩-槐花药对活性成分及其治疗慢性肾脏病的网络药理学研究
管怡晴,郑鑫楠,颜梦秋,吴焕贤,张国华*,吕 琳*
超高效液质联用技术分析黄芩-槐花药对活性成分及其治疗慢性肾脏病的网络药理学研究
管怡晴1,郑鑫楠2,颜梦秋2,吴焕贤2,张国华1*,吕 琳2*
1. 南方医科大学中医药学院,广东 广州 510080 2. 南方医科大学药学院,广东 广州 510080
分析鉴定黄芩-槐花药对的活性成分,探究活性成分治疗慢性肾脏病(chronic kidney disease,CKD)的潜在作用机制。采用超高效液相色谱-质谱联用(UPLC-ESI-TOF/MS)技术,对黄芩-槐花有效成分进行分析,结合中药系统药理学数据库和分析平台查找黄芩-槐花中有效成分的作用靶点。分别在比较毒物基因组学数据库(comparative toxicogenomics database,CTD)、在线人类孟德尔遗传数据(online mendelian inheritance in man,OMIM)、GeneCards和DrugBank数据库中以“Chronic kidney disease,CKD”为关键词,查找疾病相关蛋白,用Venny图取交集筛选出二者共同作用靶点。利用Cytoscape 3.8.2软件构建“活性成分靶点-疾病”的调控网络,运用String数据库获取蛋白相互作用关系(Protein-protein interation,PPI),将疾病和有效成分的共同核心蛋白进行基因本体论(Gene ontology,GO)以及京都基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,并构建“核心靶点-通路”网络图。黄芩-槐花药对共鉴别出29种有效活性成分,其中槲皮素、染料木素、汉黄芩素、山柰酚等17种关键活性成分的作用靶点与疾病相关蛋白取交集,共筛选出包括白介素-6(interleukin-6,IL-6)、细胞信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、肿瘤坏死因子(tumor necrosis factor,TNF)、血管内皮生长因子(vascular endothelial growth factor-A,VEGFA)、趋化因子-8(chemokine factor-8,CXCL-8)等36个核心靶点。对关键作用靶点进行通路富集分析,黄芩-槐花药对中有效成分主要通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-丝氨酸/苏氨酸蛋白激酶 B(protein kinase,PKB,AKT)、Janus激酶(janus kinase,JAK)-信号传导和转录激活因子(signal transducer and activator of transcription,STAT)、白介素-17(interleukin-17,IL-17)、晚期糖基化终末化产物(advanced glycation end products,AGE)及晚期糖基化终末产物受体(receptor for dvanced glycation end products,RAGE)等信号通路对慢性肾脏病发挥治疗作用。确定了黄芩-槐花药对中含有的29种有效成分,分析出黄酮类、类黄酮类、黄酮醇类以及皂苷类4类化合物中主要成分汉黄芩苷、槲皮素、山柰酚和槐花皂苷III的质谱裂解规律;探究黄芩-槐花药对在治疗CKD中的潜在机制,为后续临床应用提供科学的理论基础。
黄芩;槐花;药对;UPLC-ESI-TOF/MS;慢性肾脏病;网络药理学;汉黄芩苷;槲皮素;山柰酚;槐花皂苷III
慢性肾脏病(chronic kidney disease,CKD)是因为肾脏功能或生理结构改变所导致的一种临床综合症,具有不可逆和缓慢进行的特点。根据2021年世界肾脏大会提出的最新报告,全球约有11.7%的人患有慢性肾脏病[1]。我国慢性肾脏病的患病率同样高达10.8%,且其发病率一直都在不断上升中。然而,由于CKD患者在早中期并不表现出明显的症状,直到晚期才会出现典型肾功能不全的并发症,因此慢性肾脏疾病已成为人类健康生活中不可忽视的潜在杀手。
目前,CKD的临床治疗手段分为保守治疗与替代治疗2种[2]。然而2种治疗方法均具有价格昂贵、患者耐受性差、治疗时间长的缺点。因此,寻找有效的辅助疗法就变得十分重要。中医药在CKD的临床治疗中有其独特的优势,某些单味中药及其提取物以及一些中药复方可以减轻炎症损伤,延缓CKD进展,且治疗具有不良反应较小、价格相对便宜的优势。
在我国,黄芩至少有两千年的药用历史,据中医四大经典著作之一的《神农本草经》记载,黄芩具有清热燥湿、泻火解毒、止血、安胎的作用,现已正式收录于《中国药典》2020年版、《欧洲药典》(EP 9.0版)和《英国药典》(BP 2018版)[3]。槐花出自《日华子本草》,具有一千多年的药用历史,其可清肝泻火、凉血止血。大量临床研究证明,黄芩与槐花中含有许多活性成分,且对慢性肾脏病具有独特的治疗作用。黄芩素、黄芩苷、芦丁、槲皮素、槐花皂苷等均具有抗炎效果[3-5]。黄芩苷、黄芩素等黄酮类提取物在小鼠体外关节炎中能缓解踝关节肿胀[6-7]。此外,汉黄芩苷可通过减少细胞产生的炎症介质一氧化氮(nitric oxide,NO)和前列腺素E2(prostaglandin E2,PGE2),抑制促炎细胞因子的释放[8-10]。同时有临床实验证明汉黄芩素通过抑制炎症因子进而对慢性肾脏病有较好的缓解作用。此外,槲皮素已被证明可用于治疗炎性肠病,其抗氧化剂作用与抑制促炎性介质的释放作用具有广阔的研究前景[11-13]。南方医科大学张国华教授首次提出利用黄芩-槐花辅助治疗慢性肾脏疾病,且疗效较为显著[14]。但现阶段对此药对的有效成分尚不清楚,且其具体作用机制仍需探究。本研究采用UPLC-ESI-TOF/MS技术对黄芩-槐花中的多种化学成分进行分析鉴定,并通过生物信息学分析手段,构建多成分、多靶点的相互作用网络图,探究黄芩-槐花中有效成分可能的调控机制,为此药对的临床运用提供充分的科学依据。
1 材料与仪器
1.1 仪器与设备
岛津LC-30A色谱仪,AB Sciex Triple TOF 5600+质谱仪,C18色谱柱(100 mm×2.1 mm,1.8 μm,Thermo Scientific,美国),Xcalibur 2.2.0化学工作站Centrifuge5702型离心机(Eppendorf),AL204型电子天平(梅特勒-托利多公司),KQ3200DE型超声超声清洗器(江苏省昆山市超声仪器有限公司),超纯水制备仪(Millipore),0.22 μm微孔滤膜(Pall Corporation 6229286)。
1.2 材料
黄芩(批号70704610)、槐花(批号7110901)免煎颗粒均购自南方医院,为广东一方制药有限公司生产。对照品汉黄芩苷(批号P09J8F28374)购自上海源叶生物科技有限公司、槲皮素(批号LP087-201408)、山柰酚(批号LP057-201406)购自沈阳泷浦科技有限公司,对照品质量分数均≥98%。甲醇(分析纯,天津大茂化学试剂厂),甲醇色谱纯(OCEANPAK ME-00040203),甲酸色谱纯(Aladdin K1414066),乙腈色谱纯(OCEANPAK 000406281/03),实验用水为超纯水。
2 方法
2.1 供试品溶液的制备
分别精密称取黄芩、槐花样品各0.3 g至10 mL EP管中,加入甲醇-水溶液8 mL,超声处理30 min,13 000 r/min,离心10 min,取上清,过0.22 μm微孔滤膜,装入1.5 mL自动进样瓶内,最终获得黄芩-槐花药对的样品提取液。空白对照样品也经相同条件与步骤处理。将处理好的提取物置于4 ℃的冷藏环境储存,在分析前取出,保存时间不能超过24 h。
2.2 对照品溶液的制备
分别精密称取汉黄芩苷、槲皮素、山柰酚对照品适量,用70%甲醇水溶液溶解,配制成质量浓度为1 mg/mL的对照品储备液,−20 ℃保存备用。精密量取1 mg/mL的各储备液用甲醇稀释后得到混合对照品溶液。
2.3 色谱条件
HALO C18色谱柱(100 mm×2.1 mm,2.7 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),柱温为40 ℃,体积流量0.3 mL/min,进样量为5 μL,检测波长为360 nm。梯度洗脱条件见表1。
2.4 质谱条件
电喷雾离子源(electronic spray ion,ESI)正负离子模式扫描,正离子电压为5500 V,离子源温度为 600 ℃,去簇电压(declustering power,DP)为100 V,碰撞能量(collision energy,CE)为35 V,碰撞能量扩展(collision energy expansion,CES)为15 V。负离子电压为−4500 V,离子源温度为500 ℃,DP分别为100 V,CE分别为−35 V,CES为15 V。雾化气体为氮气,GS1压强为413 kPa,GS2压强为344 kPa,辅助气为275 kPa。一级质谱母离子扫描范围为/50~1000,IDA设置响应值超过100 cps的6个最高峰进行二级质谱扫描,子离子扫描范围为/50~1000,开启动态背景扣除(dynamic background subtraction,DBS)。
表1 色谱洗脱梯度条件
Table 1 Gradient conditions of chromatographic elution
tR/minA/%B/% 0.01955 15.007030 30.00995 32.00595 35.000100
2.5 质谱分析
对样品溶液所得总离子流图进行分析,推测成分的分子式,并与中药系统药理学分析平台(traditional chinese medicine systems pharmacology database and analysis platform,TCMSP,http:// libts.hkbu.edu.hk lLSP/tcmsp.php)数据库[15]中收录的中药成分进行比对,初步确定各化合物类型后,将得到的化合物进行分类,根据各化合物所属大类的质谱裂解规律,质谱碎裂的分子离子峰与碎片离子峰同时参照相关文献推测化合物在负离子模式下的裂解路径,并与所得二级质谱图进行比对。
2.6 黄芩-槐花药对活性成分靶点筛选和疾病靶点汇集
借助TCMSP(http://libts.hkbu.edu.hk lLSP/ tcmsp.php)检索出黄芩槐花所含的29种有效成分,包括芦丁、汉黄芩苷、槲皮素、黄芩素、山柰酚、汉黄芩素等,同时汇集活性成分对应的有效靶点,将纳入的活性化合物和有效靶点进行删除重复值处理,最后以表格形式阐明化合物基本信息。
CTD数据库有助于了解影响疾病的分子机制以及基因和蛋白质之间复杂的相互作用网络。OMIM数据库侧重于呈现疾病表型与其致病基因的关联。GeneCards数据库可查询基因的基本功能,还可查询疾病相关的基因列表。DrugBank数据库是临床导向的药品百科全书,可提供药物靶目标、药物作用机制的详细信息。分别在CTD(http://lctdbase.org/)、OMIM(https://llomim.org/)、GeneCards(https://l/www.genecards.org/)和DrugBank(https://llgo.drugbank.com/)数据库中以“chronic kidney disease”为关键词进行查询,得到与CKD相关的基因,整合各数据库的结果,删除重复结果,得到疾病相关蛋白。
2.7 Venny分析共有靶点
为了进一步得到黄芩-槐花中29种有效成分治疗CKD的潜在靶点,将筛选得到的269个CKD相关蛋白与黄芩-槐花有效活性成分的246个治疗靶点信息分别导入Uniport(https://www.uniprot org/)网站进行Gene Symbol转换,利用Venny2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html)软件取交集筛选获得靶基因。
2.8 PPI网络构建
通过String 10.0软件(http://string db.org)分析黄芩-槐花治疗慢性肾脏病靶基因之间的相互作用,设定置信度阈值>0.7,得到相互作用关系,将其导入Cytoscape 3.8.2中,利用富集插件cytohubba筛选核心靶点,并构建PPI网络图,将结果可视化。
2.9 基因本体论(gene ontology,GO)以及京都基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
通过Cytoscape插件BiNGO3.0.3对目的基因进行GO以及KEGG分析,进一步了解靶基因的功能及在信号通路中的调节作用,设定<0.01筛选相应的GO条目,绘制功能富集图。应用Clue GO插件绘制信号通路图,选择前10条通路进行分析。
3 结果
3.1 黄芩-槐花药对的正、负离子流图
通过采用液质联用飞行时间质谱仪对黄芩-槐花提取物进行分析,得到该药对的正、负离子流图,如图1所示。
3.2 有效成分鉴定及分类
与TCMSP数据库中收录的中药成分进行比对,共检测到29种中药活性成分,根据化合物的母环以及取代基的结构特点,对以上活性成分进行分类以及对应离子碎片结果见表2。

图1 黄芩-槐花药对提取物(空白组背景扣除) 正 (A)、负(B) 离子模式下总离子流图
表2 UPLC-Q-TOF-MS黄芩槐花药对中含有的化合物
Table 2 Compounds ofSB-SJdrug pairby UPLC-Q-TOF-MSanalysis
序号tR/min分类名称MS (m/z)加合离子分子式 110.32查耳酮类2,6,2′,4′-四羟基-6′-甲氧基查耳酮301.072 [M+H]+C16H14O6 28.01类黄酮类芦丁609.145[M+H] +C27H30O16 38.90山柰酚-3-O-芸香糖苷593.151[M+H] +C27H30O15 48.53槲皮素301.035[M+H]+C15H10O7 512.73黄酮类汉黄芩苷459.092[M+H] +C22H20O11 610.73黄芩苷445.077[M+H]+C21H18O11 718.37黄芩新素II373.093[M+H]+C19H18O8 815.05黄芩素269.046[M+H]+C15H10O5 914.60去甲汉黄芩素269.046[M+H]+C15H10O5 1018.03汉黄芩素283.062[M+H]+C16H12O5 1111.06粘毛黄芩素III345.061[M+H]+C17H14O8 1218.23白杨素253.051[M+H]+C15H10O4 1319.14黄芩黄酮343.082[M+H]+C18H16O7 1418.62黄芩黄酮I313.072[M+H]+C17H14O6 1515.29粘毛黄芩素II329.066[M+H]+C17H14O7
续表2

序号tR/min分类名称MS (m/z)加合离子分子式 1617.33皂苷类(五环三萜)大豆皂苷Bb941.512[M+H]+C48H78O18 1717.93槐花皂苷III925.517[M+H]+C48H78O17 1811.39二氢黄芩素447.093[M+H]+C21H20O11 199.34二氢黄芩苷447.092[M+H]+C21H20O11 2011.585,7,2′,6′-四羟基二氢黄酮醇287.050[M+H]+C15H12O6 2113.41滇黄芩新苷301.720[M+H]+C16H14O6 2210.737,2′,6′-三羟基-5-甲氧基二氢黄酮297.040[M+H]+C16H10O6 2318.70二氢木蝴蝶素A285.077[M+H]+C16H14O5 2411.04二氢黄酮醇类左旋圣草素287.056[M+H]+C15H12O6 2510.73异黄酮类染料木素269.045[M+H]+C15H10O5 2610.322,6,2′,4′-四羟基-6′-甲氧基查耳酮301.072[M+H]+C16H14O6 2712.44黄酮醇类粘毛黄芩素I301.036[M+H]+C15H10O7 2814.57山柰酚285.041[M+H]+C15H10O6 2914.90异鼠李素315.051[M+H]+C16H12O7
3.3 有效成分分析
从29种化合物中,选取汉黄芩苷(黄酮类)、槲皮素(类黄酮类)、山柰酚(黄酮醇类)以及槐花皂苷III(皂苷类)4种代表性化合物进行波谱解析。
3.3.1 汉黄芩苷 负离子模式下,质谱图显示化合物相对分子质量为/459.092 9,见图2。在TCMSP中与黄芩-槐花有关的中药化合物成分进行比对,发现汉黄芩苷的相对分子质量与其相近,汉黄芩苷为黄酮类取代衍生化合物,其相对分子质量为459.092 9,在高能碰撞的正离子扫描模式下,此化合物往往先丢失1个电子,从而生成质量为459的碎片离子峰。在正离子扫描模式下,由于汉黄芩苷为葡萄糖醛酸取代的黄酮类衍生物,较易先脱去葡萄糖醛酸部分[M-193],即首先丢失1分子葡萄糖醛酸自由基,得到碎片离子/283。接下来,脱去母环上的甲基自由基,得到碎片离子/268。根据以上规律,将各个标志性碎片离子与得到的二级质谱图比对,发现主要碎片质量基本一致,结合以往文献报道[16]进一步可确定此化合物即为汉黄芩苷,汉黄芩苷的二级质谱以及可能的裂解途径如图2所示。

图2 汉黄芩苷的一级(A)、二级(B) 质谱图和可能的裂解途径 (C)
3.3.2 槲皮素 在负离子模式下,通过质谱图获得的化合物相对分子质量为/301.035 8,见图3,经比对,发现槲皮素与之相匹配,槲皮素的相对分子质量为302.238 7,其在高能碰撞的负离子的扫描模式下,此类化合物往往发生丢失1个氢离子,从而生成质量为301的碎片离子峰。在负离子扫描模式下它的准分子离子裂解规律为标志性的逆-迪尔斯-阿德裂解,即RDA裂解[17],从而分离出标志性的碎片离子/283、175、151。由于槲皮素易发生中性碎片丢失,脱去H2O,即脱去C环3位上的羟基与B环6′位氢,脱水后得到碎片离子/283。通过RDA反应,C环裂解,分别得到碎片离子/151和/175。根据以上规律,将各个标志性碎片离子与得到的碎片离子峰图对比,标志性碎片的相对分子质量相同,结合相关文献记载的裂分规律可进一步推断该化合物即为槲皮素,槲皮素可能的分子裂解途径见图3。
3.3.3 山柰酚 在负离子模式下,通过MS谱图获得的化合物相对分子质量为/285.041 4,见图4,与黄芩-槐花有关的中药化合物成分比对后,确定与之相对分子质量最相似的化合物为山柰酚,通过二级质谱,进一步确定山柰酚为黄酮醇类化合物,中间环被羟基取代导致其稳定性较弱,裂解规律为此环失去1个羰基和取代的羟基 [M-28-17],生成相对分子质量为239的标志性离子峰。然后,脱去母环上的3个小分子羟基[M-52],生成相对分子质量为187的标志性离子峰。黄酮醇类化合物由于羟基取代,因此较少发生RDA裂解[18],而是发生上述方式的裂解,见图4。根据此规律,将各个标志性碎片离子与得到的碎片离子峰图对比,标志性碎片的相对分子质量相当,确定此化合物为山柰酚。
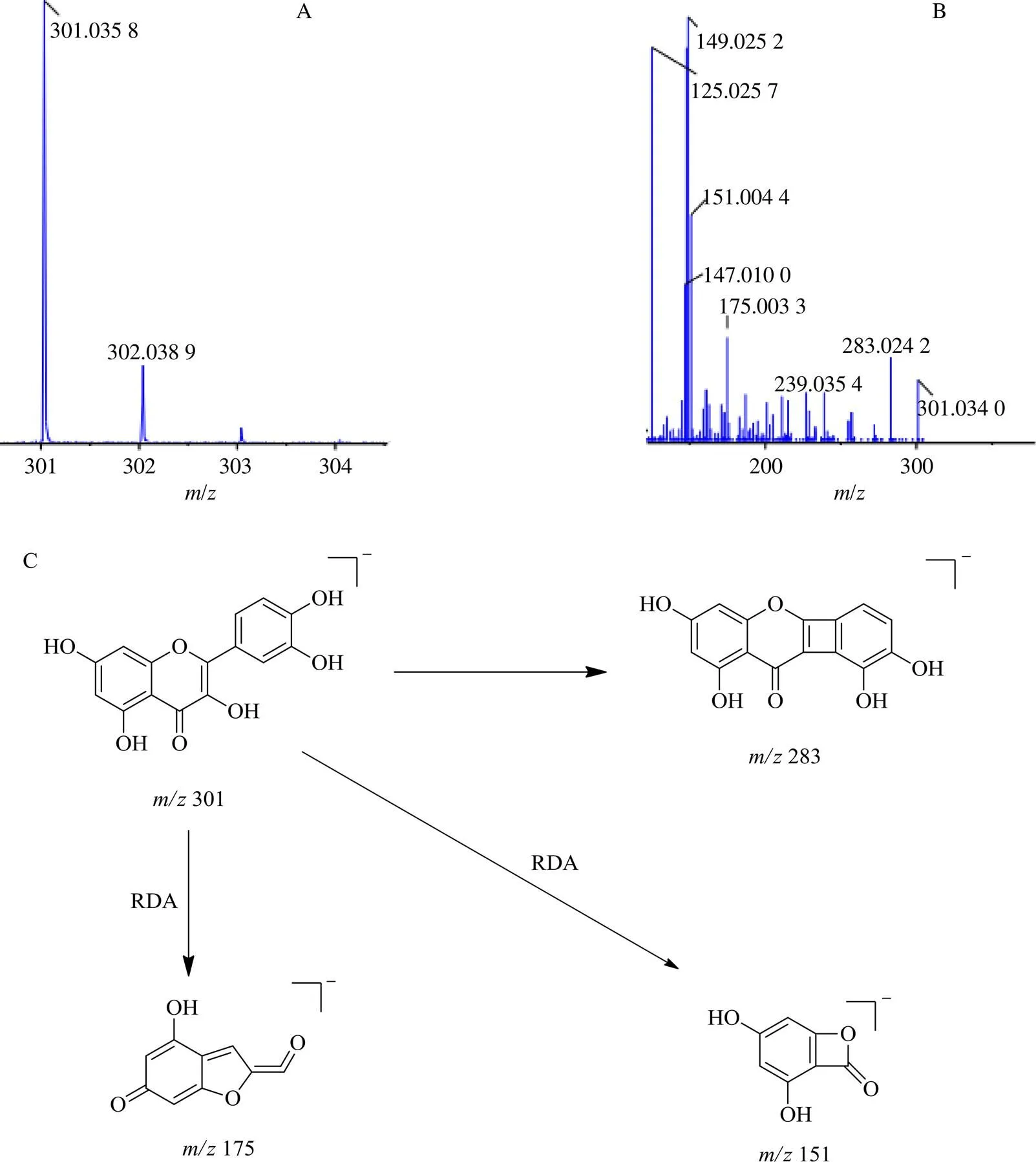
图3 槲皮素的一级(A)、二级(B) 质谱图和可能的裂解途径(C)

图4 山柰酚的一级(A)、二级(B) 质谱图和可能的裂解途径(C)
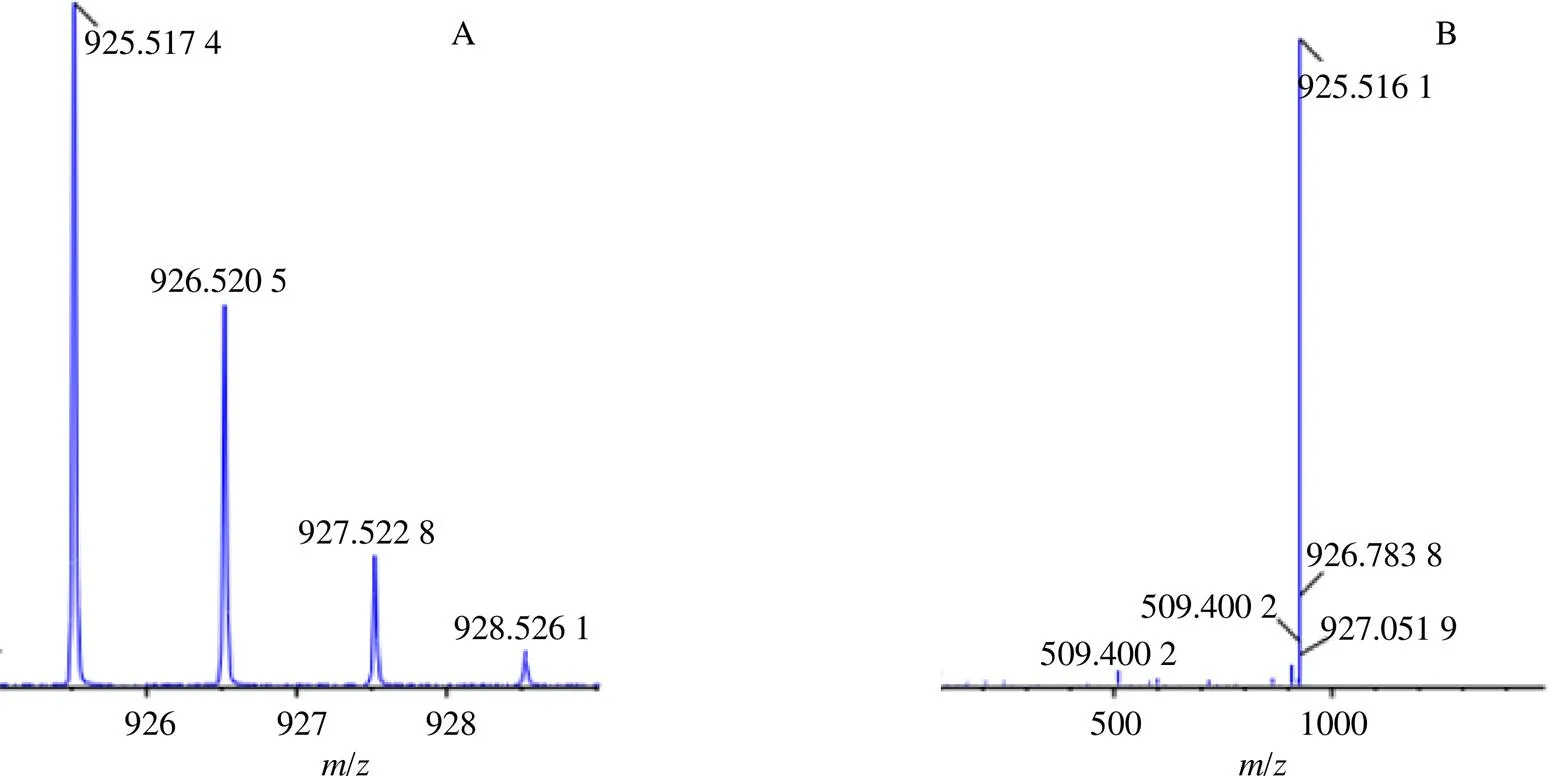
3.3.4 槐花皂苷III 如图5所示,在负离子模式下,通过MS谱图获得的化合物分子质量为/925.5174,在TCMSP数据库中寻找相关成分,发现槐花皂苷III质量与其相近,故初步确定其为槐花皂苷。接下来对其进行二级质谱分析。在其二级质谱图中可以观察到2个离子峰之间相差416,根据环三萜类皂苷裂解规律,此类化合物首先断开末端的鼠李糖[19],然后脱去小分子基团如羟基,羧基等相连的碎片峰,最后进行RDA裂解。此裂解方式为五环三萜类皂苷天然化合物的标志裂解,将各个标志性碎片离子与得到的碎片离子峰图对比,标志性碎片的相对分子质量相当,进一步确定此化合物为槐花皂苷III。槐花皂苷的二级质谱以及推测裂解途径如图5所示。
3.4 活性成分-靶点网络的建立和拓扑分析
借助TCMSP搜索质谱分析中检测出的29种活性成分,包括芦丁、汉黄芩苷、槲皮素、黄芩素、山奈酚、汉黄芩素等,删除重复并去除假阳性,整合得到17种有效成分及246个靶点。其中,槲皮素作用靶点最多,为127个,其次是染料木素75个,汉黄芩素72个(表3)。利用Cytoscape 3.8.2构建活性成分-靶点网络图(图6),该网络涉及266个节点和493条边,外围节点代表化合物,中央节点表示药物靶点,每条边代表化合物与靶点之间的互作关系。
3.5 潜在靶点预测
分别在CTD、OMIM、GeneCard和DrugBank 数据库中以“Chronic kidney disease,CKD”为关键词进行查询,整合各数据库的结果,去除重复结果,筛选出269个CKD相关靶点,应用Venny2.1.0软件获得40个药物与疾病的共有靶点(图7)。为了进一步探究黄芩-槐花的有效成分在治疗慢性肾脏病中的潜在靶点,运用Cytoscape 3.8.2软件绘制有效成分靶点与疾病靶点的作用关系(图8),蓝节点代表黄芩-槐花药对有效成分靶点,绿节点代表CKD疾病相关蛋白,连线表示两者的相互作用。
3.6 PPI网络构建与分析
基于String和Cytoscape3.8.2软件构建有效成分与疾病相关靶点的蛋白互作网络关系,并利用cytohubba 插件筛选核心靶点(图9)。该图由36个蛋白质节点和125条边组成,边代表蛋白间相互作用关系,线条越多表示关联度(degree)越大,节点的大小和颜色均代表degree值的大小。依据网络拓扑学性质可知,有较多节点的化合物或药物靶点在整个网络中可能起到核心作用,由此预测黄芩-槐花药对中的关键蛋白可直接干预CKD的作用机制,靶点及值排名见表4。
3.7 GO与KEGG通路分析
对核心靶点进行GO和KEGG富集分析,以<0.05为筛选阈值,选取前10的GO分析(图10),GO分析包括生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF);对前20的KEGG代谢通路绘制气泡图(图11),气泡面积代表通路富集基因数,面积越大,则参与该功能的靶基因越多,气泡颜色代表值大小,颜色越红,值越小。黄芩-槐花药对治疗CKD的GO分析中BP与上皮细胞增殖(epithellal cell prollferation)、氧化应激(response to oxidative stress)、活性氧代谢(reactive oxgen spocies metabolic process)、酪氨酸磷酸化(reguation of pepioyr tyrosine poshryatot)、JAK-STAT通路等相关。在CC中作用靶点主要富集在膜筏(membrane raft)、胞质囊腔(cytoplasmicvesicle lumen)、膜微区(membrane microdomain)、胞吞泡(endocytic vesiclet)、RNA聚合酶II转录因子调控(RNA polymerase II transcription factor complex)等。而MF方面靶点主要富集在细胞因子受体结合(cyokine receptor binding)、生长因子受体结合(growth factor receptor binding)、蛋白磷酸化(protein phosphatase binding)等。黄芩-槐花药对治疗CKD的KEGG代谢通路与动脉粥样硬化(lipid and atherosclerosis,degree 16)、PI3K-Akt(degree 15)、晚期糖基化(AGE-RAGE,degree 15)、JAK-STAT(degree 13)、流体剪切应力(fluid shear stress and atherosclerosis,degree 13)、缺氧诱导因子1(hypoxia inducible factor-1,HIF-1,degree 11)等密切相关。
表3 黄芩-槐花药对活性成分靶点预测基本信息预测
Table 3 Prediction potential targets of active ingredients of SB-SJdrug pair
MOL ID活性成分degree值MOL ID活性成分degree值 MOL000098槲皮素127MOL002560白杨素11 MOL000481染料木素75MOL002927黄芩新素II11 MOL000173汉黄芩素72MOL002932黄芩黄酮Ⅰ9 MOL000422山柰酚50MOL002919粘毛黄芩素III7 MOL002714黄芩素28MOL000525去甲汉黄芩素6 MOL012266黄芩黄酮22MOL005190左旋圣草素5 MOL003653槐花皂苷III19MOL002916粘毛黄芩素II4 MOL000415芦丁17MOL0029255,7,2′,6′-四羟基二氢黄酮醇3 MOL002917粘毛黄芩素II17
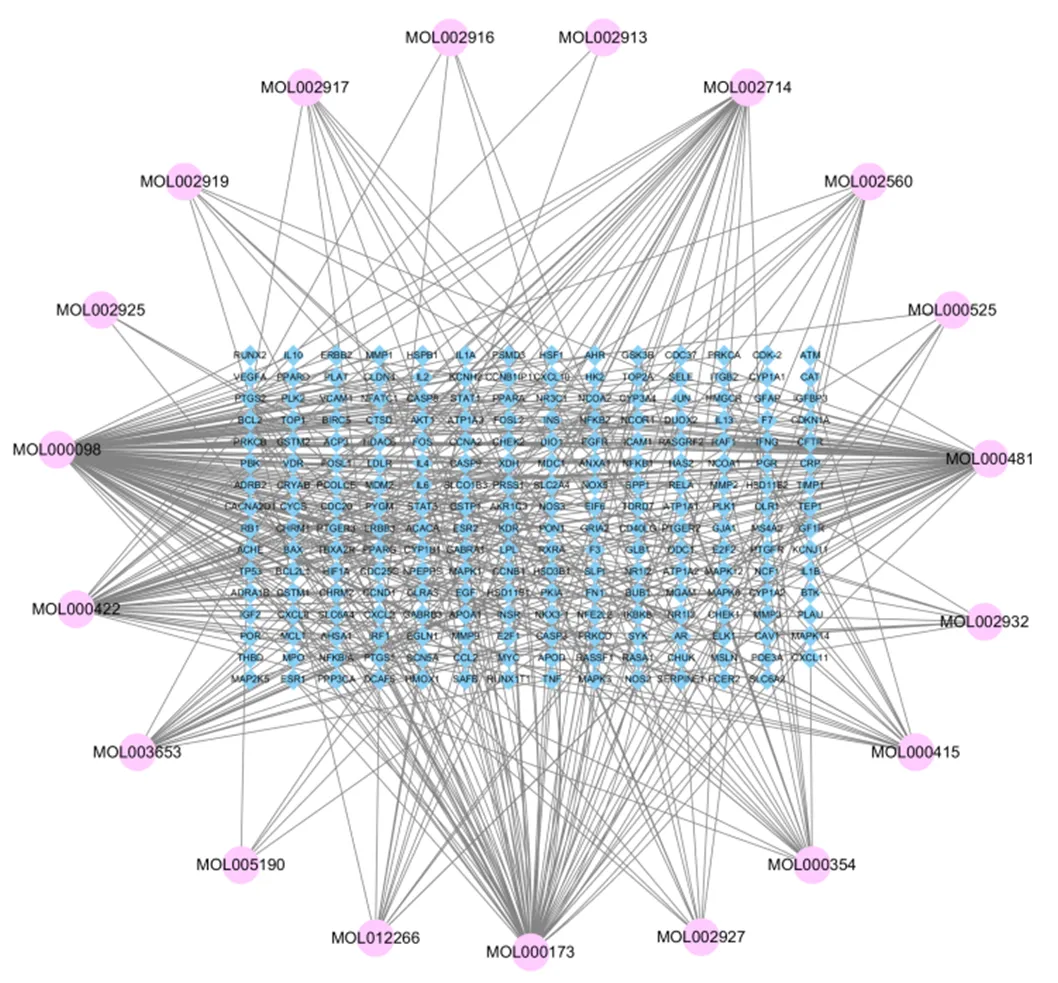
图6 黄芩-槐花药对活性成分-靶点网络图

图7 黄芩-槐花药对活性成分-慢性肾脏病靶基因韦恩图
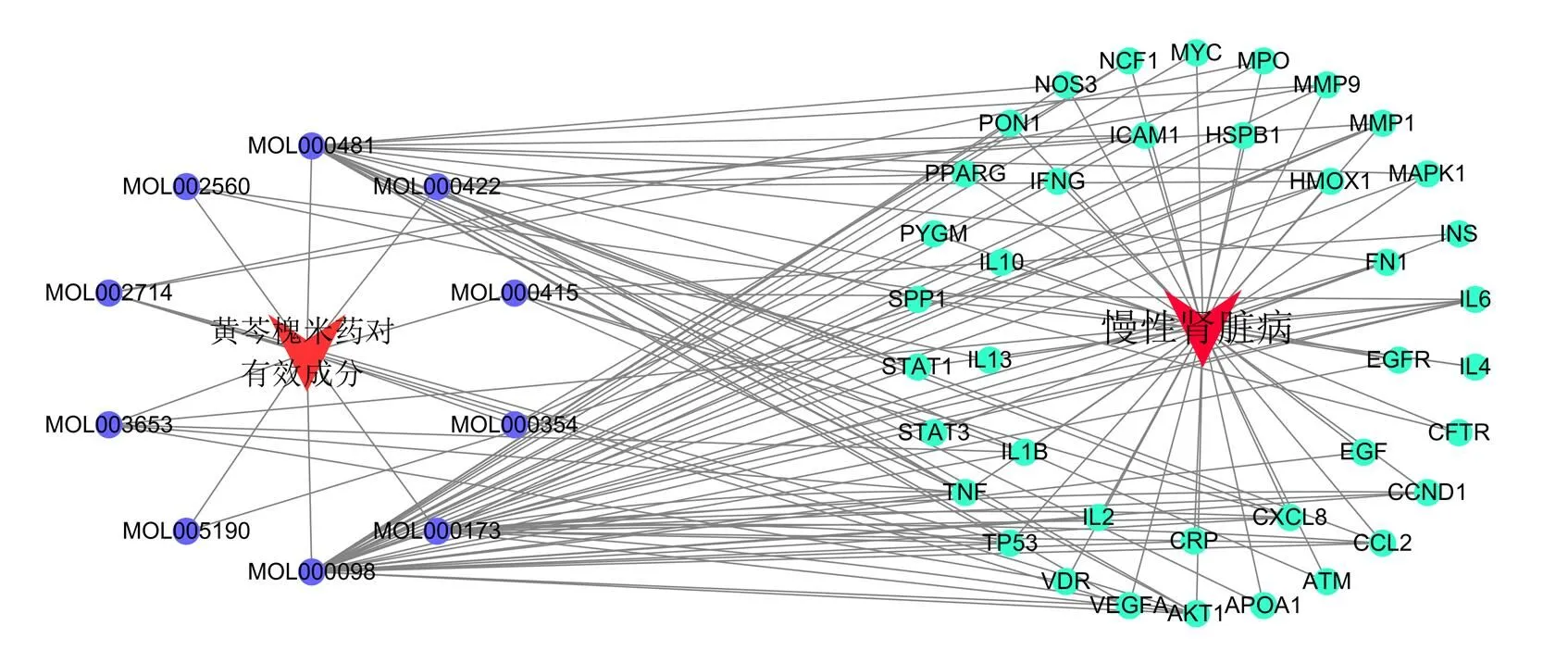
图8 药物活性成分-靶点-疾病网络图

图9 活性成分-疾病靶点互作网络图
表4 黄芩-槐花药对中的关键靶点预测及P值排序
Table 4 Prediction of key targets and ordering of P values of SB-SJdrug pair
核心靶点P值核心靶点P值核心靶点P值 IL-621CCL-210CCND15 STAT317MAPK110APOA14 TNF17TP5310CRP3 VEGFA13FN-19NOS33 CXCL-812INS9PPARG3 IL-1312STAT19SPP13 IL-1β12EGF8CFTR2 IL-412ICAM17HMOX12 AKT111IFNG7ATM1 EGFR11MMP67MPO1 IL-1011MYC6PON11 IL-211
3.8 有效成分-核心靶点-通路网络图的构建
根据蛋白靶点与信号通路之间的相互作用关系,选取关键的前20条可能与CKD相关的通路,同时与黄芩-槐花活性成分的作用靶点一一对应,构建活性成分-CKD核心靶点-通路多维网络图(图12)。节点的degree值代表网络中与该节点相连的边的数量。黄芩-槐花药对有效成分-靶点-通路网络图含有53个节点、32条通路、21个个靶点、以及446条边;最大degree值为16,最小为1,平均degree值8.4,其中13个靶点,18条通路在平均值以上。
4 讨论
现代研究表明,CKD的发生发展过程与氧化应激、炎症反应、血管硬化以及自身免疫等病理生理机制密切相关[20]。黄芩作为一种传统植物,在中国已有数千年的药用历史,多项研究表明黄芩通过抑制促炎因子IL-1β、IL-18、TNF-α的产生,发挥显著的免疫抑制作用,广泛应用于肝炎、肺炎、肠炎、过敏反应、痢疾、呼吸道感染等疾病的治疗[21]。同时课题组前期研究证明汉黄芩素可治疗慢性肾脏疾病,其通过抑制炎症因子的产生以及抑制氧化应激通路来达到调节肠道菌群,进而减轻肾脏损伤[14]。
本研究定性鉴别了黄芩-槐花药对中29种活性成分,如黄芩素、黄芩苷以及槐花中含有的芦丁、槲皮素、槐花皂苷等,这些活性成分都已证明具有抗炎效果。如黄芩苷可通过上调肠内NF-κB和p65蛋白水平,激活NF-κB信号通路,以提高下游抗炎细胞因子和IL-8、IL-6、IL-10、IFN-γ的蛋白表达水平,降低肠道炎症和氧化作用,从而治疗溃疡性肠道炎症[22-23]。此外,汉黄芩苷已被证明可通过减少巨噬细胞和中性粒细胞的肺浸润来改善脂多糖诱导的小鼠急性肺损伤[24]。姜红宝等[25]研究者证明芦丁可改善四氧嘧啶诱导的糖尿病肾病大鼠,其机制可能与抑制醛糖还原酶活性和消除氧自由基有关,阻止葡萄糖转变为山梨醇,减弱山梨醇通路对大鼠造成的损害。另外,芦丁可降低肾组织脂质过氧化物酶(lipid peroxidase,LPO)活性,延缓氧自由基对机体的进一步损伤。芦丁还可通过NO-鸟苷酸环化酶途径产生内皮依赖性的血管舒张作用[26]。有研究表明槲皮素与芦丁有相似的抗氧化以及血管舒张作用[27],同时,槲皮素还被证明对口腔癌、多发性骨髓癌、白血病等多种癌症具有化学治疗作用[28-30]。另外,槲皮素能够显著抑制急性痛风性关节炎模型大鼠的肿胀程度,降低炎症反应,减少炎症因子IL-1β、COX-2及NO水平,从而证实槲皮素有较强的抗炎作用[31-32]。本研究利用TCMSP数据库预测到黄芩-槐花中17种活性成分在治疗CKD过程中发挥作用的潜在靶标共36个,关键潜在靶点包括IL-6、MAPK1、AKT1、TNF、STAT3、IL-1β等,各靶点之间相互关联,具有协同治疗作用。活性成分-CKD靶标-KEGG通路网络结果显示,黄芩-槐花药对治疗CKD涉及多个信号通路。有研究表明黄芩苷能减轻HT-29细胞炎症反应,抑制P13K磷酸化,下调AKT的活化,抑制NF-κB的活化入核,从而抑制TNF-α、IL-6等炎症因子的分泌,发挥其抗炎效应[33]。黄芩苷还可通过抑制NLRP3炎性小体和TLR4/NF-κB信号通路,减轻认知障碍,保护神经元免受小胶质细胞介导的神经炎症[34]。黄芩苷还通过上调腺苷A2a受体、下调转化生长因子TGF-β1和磷酸化ERK1/2,抑制博来霉素诱导的肺纤维化[35-36]。
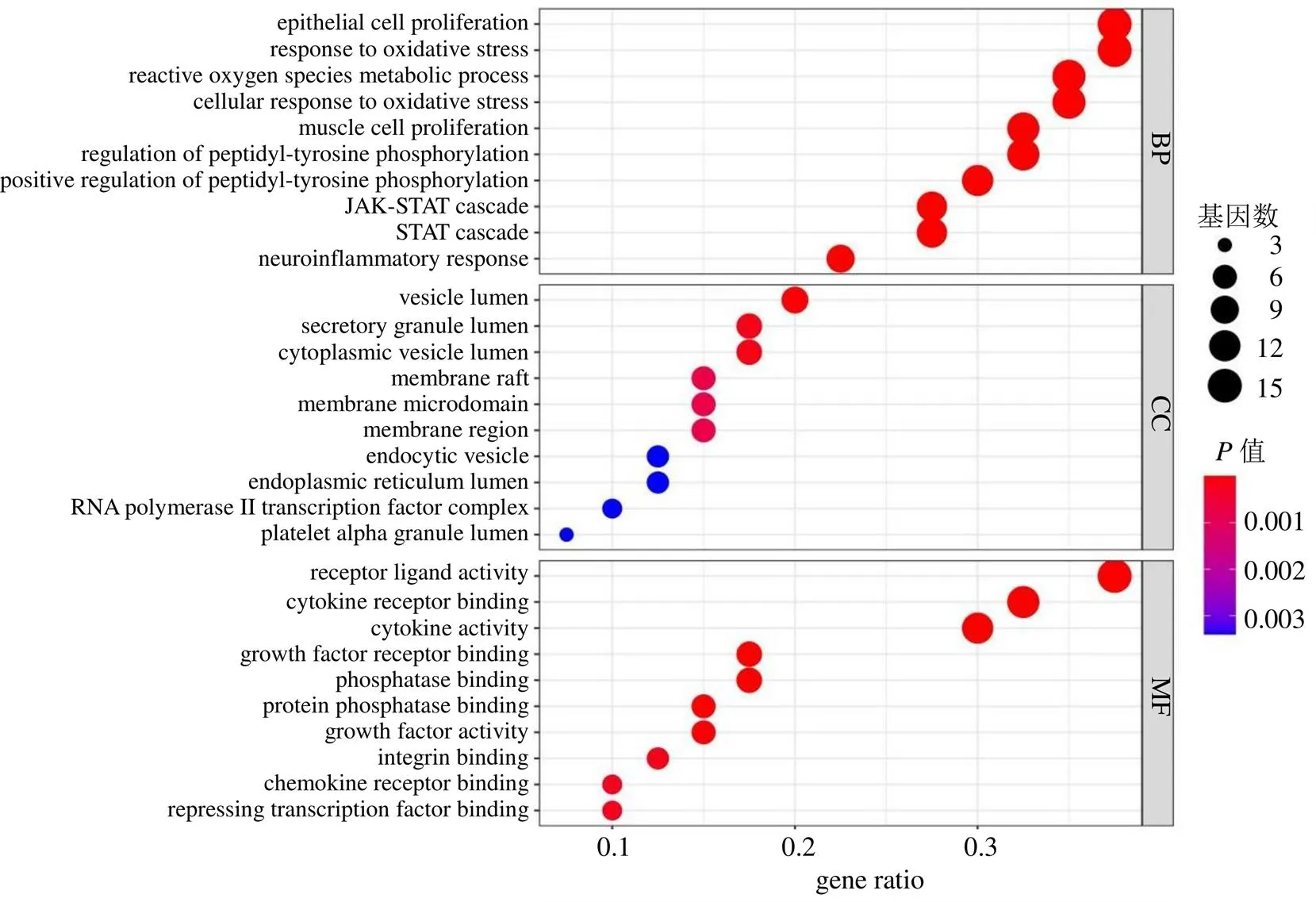
图10 GO-BP、GO-CC、GO-MF富集分析

图11 KEGG富集分析

图12 黄芩-槐花药对有效成分-靶点-通路网络
中药在治疗慢性肾脏病方面具有显著疗效,可通过调节一系列信号通路减轻肾组织的炎性损伤,延缓CKD进展[37],但是仍面临药物成分多,靶点不明确,作用机制复杂的困难。本研究通过高效液相色谱-飞行时间质谱联用技术分析有效成分,再结合网络药理学初步探究并推测黄芩-槐花药对主要通过影响HIF-1、TNF、NF-κB、MAPK、P13K-AKT等信号通路共同参与机体细胞凋亡调控、炎症反应、缺氧反应、血管生成、老化、血管内皮调控等生物过程以达到治疗CKD的目的,以期为后续研究提供思路与依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Ghorbani A. Mechanisms of antidiabetic effects of flavonoid rutin [J]., 2017, 96: 305-312.
[2] Ammirati A L. Chronic kidney disease [J]., 2020, 66 (Suppl 1): 3-9.
[3] Wang Z L, Wang S, Kuang Y,. A comprehensive review on phytochemistry, pharmacology, and flavonoid biosynthesis of[J]., 2018, 56(1): 465-484.
[4] 龙宇, 向燕, 谭裕君, 等. 黄芩苷药理作用及新剂型的研究进展[J]. 中草药, 2019, 50(24): 6142-6148.
[5] Han Y K, Kim H, Shin H,. Characterization of anti-inflammatory and antioxidant constituents fromusing LC-MS coupled with a bioassay method [J]., 2020, 25(16): 3617.
[6] Kim E H, Shim B, Kang S,. Anti-inflammatory effects of Scutellaria baicalensis extract via suppression of immune modulators and MAP kinase signaling molecules [J]., 2009, 126(2): 320-331.
[7] Yang X, Yang J, Zou H J. Baicalin inhibits IL-17-mediated joint inflammation in murine adjuvant-induced arthritis [J]., 2013, 2013: 268065.
[8] Wang G, Liang J X, Gao L R,. Baicalin administration attenuates hyperglycemia-induced malformation of cardiovascular system [J]., 2018, 9(2): 234.
[9] Wang J W, Li K X, Li Y P,. Mediating macrophage immunity with wogonin in mice with vascular inflammation [J]., 2017, 16(6): 8434-8440.
[10] Cui X, Qian D W, Jiang S,.andimprove glucose and lipid metabolism in T2DM rats via regulation of the metabolic profiling and MAPK/PI3K/Akt signaling pathway [J]., 2018, 19(11): 3634.
[11] Byun J H, Kim J S, Kang S S, et al. Triterpenoid saponins from the roots of Sophora koreensis [J]. Chem Pharm Bull (Tokyo), 2004, 52(7): 870-873.
[12] Tabrizi R, Tamtaji O R, Mirhosseini N, et al. The effects of quercetin supplementation on lipid profiles and inflammatory markers among patients with metabolic syndrome and related disorders: A systematic review and meta-analysis of randomized controlled trials [J]. Crit Rev Food Sci Nutr, 2020, 60(11): 1855-1868.
[13] Li Y, Yao J Y, Han C Y, et al. Quercetin, inflammation and immunity [J]. Nutrients, 2016, 8(3): 167.
[14] Guan Y Q, Chen K, Quan D L,. The combination ofGeorgi andL. ameliorate renal function by regulating gut microbiota in spontaneously hypertensive rats [J]., 2021, 11: 575294.
[15] 赵苗青, 李丰, 石彬彬, 等. 系统药理学 (VI): TCMSP数据库及其应用 [J]. 中医药信息, 2020, 37(3): 22-29.
[16] He L L, Zhang Z F, Lu L Y,. Rapid identification and quantitative analysis of the chemical constituents inL. by UHPLC-QTOF-MS and UHPLC-MS/MS [J]., 2016, 117: 125-139.
[17] Zhang B S, Li Y K, Zhang Z, et al. Synthesis of C4-aminated indoles via a catellani and retro-Diels-alder strategy [J]., 2019, 141(24): 9731-9738.
[18] Gharari Z, Bagheri K, Derakhshani B, et al. HPLC-DAD-ESI/MS n analysis of phenolic components of,and[J]., 2022, 36(9): 2440-2445.
[19] 贾瑶, 黄健, 吴斌. 知母皂苷类化合物的质谱裂解规律研究进展 [J]. 沈阳药科大学学报, 2013, 30(9): 740-748.
[20] 李佳霖, 王倩, 赵海玲, 等. 慢性肾脏病临床危险因素研究[J]. 世界中医药, 2020, 15(17): 2538-2543.
[21] Liao H F, Ye J, Gao L L,. The main bioactive compounds ofGeorgi. for alleviation of inflammatory cytokines: A comprehensive review [J]., 2021, 133: 110917.
[22] Liao P, Li Y H, Li M J,. Baicalin alleviates deoxynivalenol-induced intestinal inflammation and oxidative stress damage by inhibiting NF-κB and increasing mTOR signaling pathways in piglets [J]., 2020, 140: 111326.
[23] 王怡薇, 张会会, 王彦礼, 等. 黄芩汤对溃疡性结肠炎大鼠NF-κB p65调控作用研究 [J]. 药学学报, 2015, 50(1): 21-27.
[24] 张海丽, 游雷鸣, 刘慧, 等. 汉黄芩素对LPS和ATP联合诱导的巨噬细胞炎症反应的抑制作用 [J]. 中国免疫学杂志, 2019, 35(9): 1059-1063.
[25] 姜宝红, 苏环德, 徐峰, 等. 芦丁对糖尿病肾病的防治作用 [J]. 黑龙江医学, 2005, 29(12): 899-901.
[26] 周新妹, 姚慧, 夏满莉, 等. 槲皮素与芦丁对离体大鼠主动脉环的舒张作用及机制 [J]. 浙江大学学报: 医学版, 2006, 35(1): 29-33.
[27] 贾小燕, 闫素清, 柴保臣, 等. 槲皮素-钼配合物对超氧阴离子和羟自由基的清除作用 [J]. 华西药学杂志, 2008, 23(1): 40-42.
[28] 肖兰飞. 槲皮素及miR-181a-5p对口腔癌细胞体外协同抗肿瘤作用的研究 [D]. 太原: 山西医科大学, 2021.
[29] 徐亚文, 邹丽芳, 李菲. 槲皮素对多发性骨髓瘤的抗肿瘤作用及其相关机制 [J]. 中国实验血液学杂志, 2020, 28(4): 1234-1239.
[30] 张林, 欧祥琴, 张涛, 等. 基于加权基因共表达网络分析槲皮素抗胃癌的基因模块和分子标志物研究 [J]. 世界中医药, 2021, 16(4): 546-552.
[31] 黄敬群, 孙文娟, 朱妙章, 等. 槲皮素治疗大鼠急性痛风性关节炎的实验研究 [J]. 西北药学杂志, 2012, 27(2): 135-138.
[32] 黄敬群, 孙文娟, 王四旺, 等. 尿酸钠致急性痛风性关节炎模型大鼠与槲皮素的抗炎作用 [J]. 中国组织工程研究, 2012, 16(15): 2815-2819.
[33] 蒋寅. 黄芩苷对溃疡性结肠炎PI3K/Akt/NF-κB信号通路的影响及其机制研究 [D]. 南京: 南京中医药大学, 2016.
[34] Jin X, Liu M Y, Zhang D F,. Baicalin mitigates cognitive impairment and protects neurons from microglia-mediated neuroinflammation via suppressing NLRP3 inflammasomes and TLR4/NF-κB signaling pathway [J]., 2019, 25(5): 575-590.
[35] 张沂, 穆杰, 高伟华, 等. 基于网络药理学从系统层面探讨黄芩苷治疗肺纤维化的效应机制研究[J]. 世界中医药, 2020, 15(10): 1373-1380.
[36] Huang X Y, He Y C, Chen Y F,. Baicalin attenuates bleomycin-induced pulmonary fibrosis via adenosine A2a receptor related TGF-β1-induced ERK1/2 signaling pathway [J]., 2016, 16(1): 132.
[37] 刘红, 孙伟, 万毅刚, 等. 慢性肾脏病肾组织炎症信号通路NF-κB的调节机制及中药的干预作用[J]. 中国中药杂志, 2013, 38(24): 4246-4251.
Analysis of effective components of-drug pair by UPLC-ESI-TOF/MS and network pharmacology analysis of its effect on chronic kidney disease
GUAN Yi-qing1, ZHENG Xin-nan2, YAN Meng-qiu2, WU Huan-xian2, ZHANG Guo-hua1, LYU Lin2
1. School of Traditiongal Chinese Medicine, Southern Medicial University, Guangzhou 510080, China 2. School of Pharmaceutical Sciences, Southern Medicial University, Guangzhou 510080, China
To establish the identification and analysis method of effective ingredients of(SB-SJ) drug pair, and explore the potential mechanism in the treatment of chronic kidney disease (CKD) by network pharmacology analysis.Ultra Performance Liquid Chromatography Electrospray Ionization-ion Trap-time Of Flight mass spectrometry (UPLC-ESI-TOF/MS) was used to analyze the active components ofSB-SJ drug pair. Seeking the action targets of SB-SJ drug pair via the Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platfom (TCMSP), and the disease-related proteins were found by using the key words "Chronic kidney disease" in Comparative Toxicogenomics Database (CTD), Online Mendelian Inheritance in Man (OMIM), GeneCards and DrugBank databases, respectively. In addition, the interaction between the targets of active components and disease was analyzed on Venny platform, and the same targets of two were then screened. The regulatory network of "active component-disease targets" was constructed by Cytoscape 3.8.2 software. Moreover, the PPI was obtained by String software. The function and pathway enrichment analysis of core proteins were used GO and KEGG, and the "core target-pathway" network was further constructed.A total of 29 kinds of effect components were identified, including one chalcone, three flavonoids, eleven flavonoids, two saporins (pentacyclic titerpenes), seven dihydrofavonoids, one dihy doflavonol, one isoflavone and three flavonols. Among them, there were 17 active ingredients related to CKD, such as quercetin, genistein, wogonin and kaempferol, which were intersected with disease targets, and 36 core targets containing IL-6, STAT3, TNF, VEGFA and CXCL-8 were screened. According to the pathway enrichment analysis of the key targets, the active components of SB-SJ drug pairhave the therapeutic effect on CKD mainly through PI3K-AKT, JAK-STAI, IL-17, AGE-RAGE and other signal pathways.In this study, 29 active components in SB-SJ drug pairwere determined, and the mass spectrometric cleavage rules of wogonoside, quercetin, kaempferol and kaikasaponin III were analyzed. Based on network pharmacology, the mechanism of SB-SJ drug pair in the treatment of CKD was explored, which provides a scientific basis for future clinical application.
Georgi;L.; drug pair; UPLC-ESI-TOF/MS; chronic kidney disease; network pharmacology; wogonoside; quercetin; kaempferol; kaikasaponin III
R284.1
A
0253 - 2670(2022)20 - 6388 - 13
10.7501/j.issn.0253-2670.2022.20.011
2022-03-14
广东省自然科学基金项目(2019A1515011124);广东省自然科学基金项目(2021A1515011674)
管怡晴(1993—),女,硕士研究生,专业方向为中西医结合治疗心血管疾病。Tel: 13411214868 E-mail: 1040052@qq.com
张国华,男,教授,主任医师,博士,研究方向为中西医结合治疗心血管疾病。Tel: 13189098311 E-mail: zghgz@163.com
吕 琳,女,副教授,博士,研究方向为抗乳腺癌药物的药理学研究。Tel: 13560490259 E-mail: lynnlv@smu.edu.cn
[责任编辑 王文倩]