基于AHP-熵权法结合正交试验设计优选岭南特色饮片制枳壳的发酵工艺及发酵前后成分对比研究
杨 婷,黄莹莹,方杨冰,龙江玲,李沁如,徐启键,黄爱华,张 英,夏 荃
基于AHP-熵权法结合正交试验设计优选岭南特色饮片制枳壳的发酵工艺及发酵前后成分对比研究
杨 婷,黄莹莹,方杨冰,龙江玲,李沁如,徐启键,黄爱华,张 英,夏 荃*
广州中医药大学中药学院,广东 广州 510006
建立枳壳发酵品中多个成分的含量测定方法,优化岭南特色饮片制枳壳的发酵工艺,并比较枳壳发酵前后的成分变化。通过UHPLC测定枳壳发酵品中特征成分含量,在单因素实验的基础上,采用正交试验法考察发酵温度、发酵时间、发酵湿度等影响因素,以枳壳发酵品中的10种特征黄酮类成分(包括黄酮苷及苷元)的含量和发酵品的外观性状作为指标,采用层次分析法(analytic hierarchy process,AHP)结合熵权法对这些指标设置不同的权重,并计算复合评分来优选其发酵工艺。枳壳的最佳发酵工艺为浸泡时间4 h,发酵时间48 h,发酵温度37 ℃,发酵湿度90%;枳壳发酵后,黄酮苷类成分的含量下降,黄酮单糖苷和苷元类成分的含量均大幅度增加。建立的UHPLC多成分含量测定方法操作简单、准确,优选的枳壳发酵工艺简便、稳定可行,可规范枳壳的发酵工艺,为制枳壳的工业化生产奠定基础。
枳壳;制枳壳;中药发酵;工艺优化;圣草次苷;新北美圣草苷;芸香柚皮苷;柚皮苷;橙皮苷;新橙皮苷;橙皮素-7--葡萄糖苷;枸橘苷;柚皮素;橙皮素
枳壳为芸香科柑橘属植物酸橙L.及其栽培变种的干燥未成熟果实,性微寒,味苦、辛、酸,具有理气宽中、行滞消胀之功效,主治胸胁气滞、胀满疼痛、食积不化、痰饮内停等症[1]。枳壳生品作用峻烈,易伤正气,体虚者不宜长期服用[2-3],因此临床上多以炮制品入药,以达到缓和药性的目的[4-5]。麸炒枳壳是使用最多的炮制品种,并被《中国药典》2020年版[1]所收载。但在广东、香港等岭南地区,制枳壳为常用的地方特色炮制品种,因可缓和生枳壳峻烈之性,具有较好的行滞消胀作用,较麸炒枳壳的临床应用更为广泛。
制枳壳的炮制工艺依据现行的《广东省中药炮制规范》[6]来执行,包括发酵、蒸制、闷制等多个工艺步骤。其中,发酵是制枳壳炮制过程中的关键环节,对产品质量影响较大。目前,在生产中,枳壳的发酵采用自然发酵的方式,但是,发酵工艺较为粗放,生产过程受季节与环境因素以及人为经验的影响较大。由于温度、湿度等条件均不可控,导致生产周期不一,发酵程度不均匀,发酵品的质量亦不稳定。因此,对枳壳发酵的规范化工艺研究十分必要。
目前,对枳壳发酵品的质量控制仅凭借外观性状等进行评判,经验性判别方法存在一定的主观性,造成市场流通的制枳壳饮片质量参差不齐。而关于枳壳发酵工艺及其成分变化的研究较少,依据《中国药典》2020年版的含量测定方法,仅以柚皮苷、新橙皮苷含量等少数指标作为枳壳及其炮制品的质量控制指标,忽略了炮制过程中化学成分的变化。另外,工艺优化的研究仅以主观评价方法计算评分也不尽合理。因此,本实验基于前期研究结果[7-9],选择发酵前后变化较大及与制枳壳行滞消胀功效密切相关的10种黄酮类成分(圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮素-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素)作为枳壳发酵品的特征性成分,以特征成分的含量和发酵品的外观性状作为枳壳发酵品的质量评价指标,在单因素基础上,采用正交设计试验,并借助主、客观评价方法层次分析法(analytic hierarchy process,AHP)-熵权法对枳壳发酵品的质量进行综合打分,全面评判枳壳发酵品的质量,进而优选枳壳的自然发酵工艺,为进一步的制枳壳炮制规范化的工艺研究提供依据。同时对枳壳发酵后的7种黄酮双糖苷类成分、1种单糖苷类成分及2种黄酮苷元类成分的含量进行对比分析,以期获得枳壳发酵前后成分变化的规律,为制枳壳岭南特色炮制机理的研究奠定基础。
1 仪器与材料
1.1 仪器
岛津LC-30AD型超高效液相色谱仪,日本岛津科技公司;AUY120型万分之一天平,广州湘仪机电设备有限公司;BT125D型电子分析天平,德国赛多利斯公司;LHS-150HC-II型恒温恒湿培养箱,上海一恒科学仪器有限公司。
1.2 材料
枳壳原药材(批号190701)购自广州至信药业股份有限公司,经广州中医药大学中药鉴定教研室张丹雁教授鉴定,确认来源为芸香科柑橘属酸橙L.的干燥未成熟果实。枳壳发酵品为由同一批号的枳壳原药材在相应发酵条件下制备而成的样品。
对照品柚皮苷(批号YJ77D9F001)、橙皮苷(批号P06D9F77001)、新橙皮苷(批号C05F4Y2)、柚皮素(批号YJ0603HA13)、橙皮素(批号C03F6Y1)均购自上海源叶有限公司;对照品芸香柚皮苷(批号PS011543)、圣草次苷(批号PS010198)、新北美圣草苷(批号PS010420)、橙皮素-7--葡萄糖苷(批号PS020721)、枸橘苷(批号PS010580)均购自成都普思生物科技有限公司;以上对照品质量分数均大于98%;乙腈、甲醇、磷酸为色谱纯;其余试剂均为分析纯;水为超纯水。
2 方法与结果
2.1 枳壳发酵品质量评价指标的建立
2.1.1 对照品溶液的制备 分别取圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮素-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素对照品6.36、5.16、16.44、30.00、17.46、30.01、16.08、16.68、14.10、15.24 mg,精密称定,分别加甲醇适量定容至刻度,制得质量浓度分别为0.318、0.258、0.822、1.500、0.873、1.500、0.804、0.834、0.705、0.762 mg/mL的单一对照品储备液;分别精密吸取上述10个对照品储备液适量,混合,加入甲醇制成上述各成分质量浓度分别为5.3、4.3、13.7、75、14.55、75、13.4、13.9、11.75、12.68 μg/mL的混合对照品溶液。
2.1.2 供试品溶液的制备 取各样品粗粉约0.5 g,精密称定,置于圆底烧瓶中,加甲醇45 mL,称定质量,加热回流1.5 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,精密移取续滤液0.1 mL,置于2 mL量瓶中,加甲醇稀释至刻度,过0.22 μm微孔滤膜,即得相应供试品溶液。
2.1.3 色谱条件 Waters UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%磷酸水溶液-乙腈,梯度洗脱:0~2 min,5% 乙腈;2~26 min,5%~55%乙腈;26~28 min,55%~20%乙腈;28~30 min,20%~5%乙腈;体积流量0.3 mL/min;柱温35 ℃;检测波长283 nm;进样量2 μL;PDA检测器。
2.1.4 系统适应性试验 在“2.1.3”项色谱条件下,供试品溶液中圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮素-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素与其他成分均达到基线分离,分离度均大于1.5,理论板数均不低于5000。色谱图见图1。
2.1.5 线性关系的考察 依次量取“2.1.1”项下混合对照品溶液0.1、0.2、0.5、1.0、2.5、5.0 mL于5 mL量瓶内,加甲醇稀释至刻度,摇匀。精密移取不同体积“2.1.1”项下的混合对照品溶液,置于量瓶中,加甲醇定容至刻度,按“2.1.3”项下色谱条件进样测定,以对照品质量浓度为横坐标(),峰面积为纵坐标()进行线性回归,得到回归方程,结果分别为圣草次苷=137 686-10 600,=0.999 6,线性范围0.11~5.30 μg/mL;新北美圣草次苷=176 065-8 349.3,=0.999 7,线性范围0.09~4.30 μg/mL;芸香柚皮苷=110 887- 10 177,=0.999 6,线性范围0.27~13.70 μg/mL;柚皮苷=437 696+121 634,=0.999 6,线性范围1.00~75.00 μg/mL;橙皮苷=240 958- 25 845,=0.999 7,线性范围0.29~14.55 μg/mL;新橙皮苷=339 758-302 411,=0.999 6,线性范围1.00~75.00 μg/mL;橙皮苷-7--葡萄糖苷=161 389-12 967,=0.999 7,线性范围0.27~13.40 μg/mL;枸橘苷=123 841-6 892.8,=0.999 7,线性范围0.28~13.90 μg/mL;柚皮素=245 796-916.81,=0.999 7,线性范围0.24~11.75 μg/mL;橙皮素=212 382+8 594.4,=0.999 8,线性范围0.25~12.68 μg/mL;表明10个对照品在各自质量浓度范围内线性关系良好。

1-圣草次苷 2-新北美圣草苷 3-芸香柚皮苷 4-柚皮苷 5-橙皮苷 6-新橙皮苷 7-橙皮素-7-O-葡萄糖苷 8-枸橘苷 9-柚皮素 10-橙皮素
2.1.6 精密度试验 精密吸取“2.1.1”项下混合对照品2 μL,按“2.1.3”项下色谱条件,连续进样6次,计算得到混合对照品溶液中圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素峰面积的RSD值分别为0.21%、0.11%、0.14%、0.19%、0.26%、0.28%、0.33%、0.53%、0.29%、0.38%,表明仪器精密度良好。
2.1.7 重复性试验 精密称取枳壳发酵品(正交试验4号样品)样品6份,按“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下色谱条件进样,计算得到供试品溶液中圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素的平均质量分数分别为0.23%、0.15%、0.43%、1.79%、0.24%、3.25%、0.42%、0.26%、0.18%、0.16%,各成分质量分数的RSD分别为1.22%、1.27%、1.17%、2.11%、1.97%、1.03%、0.98%、1.42%、1.38%、1.25%,表明该方法重复性良好。
2.1.8 稳定性试验 精密称取枳壳发酵品(正交试验4号样品),按“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下色谱条件,分别在0、4、8、12、16、20、24 h时进样测定,计算得到供试品溶液中圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素峰面积的RSD值分别为0.73%、0.82%、0.90%、1.55%、1.26%、2.23%、1.71%、1.86%、1.19%、1.04%,表明供试品溶液在24 h内稳定性良好。
2.1.9 加样回收率试验 精密称取枳壳发酵品(正交试验4号样品)6份,每份0.25 g,分别精密加入与样品中各成分等量的各对照品溶液,按“2.1.2”项下方法制成供试品溶液,按照“2.1.3”项下色谱条件测定含量,计算各成分的加样回收率,圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素的平均加样回收率分别为101.60%、100.62%、101.01%、103.30%、101.63%、100.71%、101.65%、102.95%、103.47%、100.19%,RSD分别为1.64%、1.46%、0.06%、0.05%、1.66%、0.81%、1.71%、0.73%、0.48%、1.55%,表明加样回收率符合要求。
2.1.10 样品含量测定 按照“2.1.2”项下制备供试品溶液,按照“2.1.3”项下色谱条件进样2 μL,根据峰面积与对照品标准曲线计算各成分含量。
2.1.11 外观性状评分表的确定 枳壳发酵品的外观性状评分依据传统经验判别标准,通过直接观察样品霉变性状进行判断,以样品全部布满白色菌丝为最高分,再按发酵程度设定分值,具体评分见表1。
2.2 枳壳发酵品评价指标的确立
2.2.1 熵权法确定权重 熵权法根据各指标离散程度来衡量综合指标的影响程度,属于客观赋权法。信息量越大,熵越小[10],表明对评价的贡献越大,权重就越大。各项指标数据经标准化、归一化(Y)、信息熵(S)计算,最终计算得到指标权重(W)[11-12]。圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素、外观性状的权重分别为0.107、0.174、0.077、0.048、0.068、0.046、0.110、0.049、0.082、0.094、0.145。
表1 枳壳发酵品外观性状评分
Table 1 Scoring table of appearance properties of fermented Aurantii Fructus
外观性状分值 表面未见霉斑和菌丝或药材腐败变质0 表面长霉斑或菌丝的部分少于1/32.5 表面长霉斑或菌丝的部位为1/25.0 表面长霉斑或菌丝的部分大于2/37.5 表面均匀地布满白色菌丝10.0
指标标准化值=(实测值-最小值)/(最大值-最小值)
W=(1-S)/(-ΣS)(为指标个数)
2.2.2 AHP确定权重 层次分析法根据指标间的重要程度按一定标度构建条理分明的层次关系,并据此求得指标赋权值[10],属于主观赋权法。根据文献研究,将各指标进行重要性排序,建立的层次顺序为柚皮苷=新橙皮苷>柚皮素=橙皮素=橙皮苷-7--葡萄糖苷>圣草次苷=新北美圣草苷=芸香柚皮苷=橙皮苷=外观性状,采用和积法[13-14]计算得到圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素、外观性状的权重分别为0.050、0.050、0.050、0.200、0.050、0.200、0.100、0.050、0.100、0.100、0.050。一致性比值为0(<0.1),表明矩阵合理有效,权重系数可靠[13],一致性比值越大,表明矩阵一致性越差,一致性比值为0表明矩阵具有完全一致性。
r=1/(a/a),a/a为矩阵各列的归一化值a为判断矩阵中因素与因素的重要性之比
2.2.3 AHP-熵权法计算复合评分
(1)AHP-熵权法权重系数确定:熵值表现了指标的离散程度,离散程度大的指标具有较大的权重,因而仅凭借熵权法赋权可能使重要指标因离散程度小而权重较小;AHP法能够体现专家对不同指标重要性的经验,熵值法可以反映指标的信息特征,2者结合不仅可以减少AHP法赋权的主观性,也可减少数据变化导致的权重波动。按下式计算熵权法- AHP复合权重[12],w和r分别为熵权法及AHP法所得权重系数。圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷、橙皮苷-7--葡萄糖苷、枸橘苷、柚皮素、橙皮素、外观性状的复合权重分别为0.07、0.11、0.05、0.12、0.04、0.12、0.14、0.03、0.10、0.12、0.09。
(2)复合评分计算:按下式计算AHP-熵权法复合评分()[12]。
=0.07×100×(圣草次苷含量/圣草次苷含量最大值)+0.11×100×(新北美圣草苷含量/新北美圣草苷含量最大值)+0.05×100×(芸香柚皮苷含量/芸香柚皮苷含量最大值)+0.12×100×(柚皮苷含量/柚皮苷含量最大值)+0.04×100×(橙皮苷含量/橙皮苷含量最大值)+0.12×100×(新橙皮苷含量/新橙皮苷含量最大值)+0.14×100×(橙皮素-7--葡萄糖苷含量/橙皮素-7--葡萄糖苷含量最大值)+0.03×100×(枸橘苷含量/枸橘苷含量最大值)+0.10×100×(柚皮素含量/柚皮素含量最大值)+0.12×100×(橙皮素含量/橙皮素含量最大值)+0.09×100×(外观性状/外观性状最大值)
2.2.4 AHP-熵权法的可行性验证 将AHP、熵权法2种评分方法的指标赋权值导入SPSS 26.0软件进行Pearson相关性分析,其中=0.102(>0.05),表明采取AHP-熵权法计算复合评分的方法不具有相似性;将2种方法所得权重系数计算各自的复合评分,并将其按从大到小顺序排序,再进行Speraman等级相关性分析,结果显示AHP和熵权法呈极显著正相关,相关系数为0.950,值为 0.000 088(<0.001),表明2种方法可以相互借鉴,所得结果大体一致。
综上所述,AHP-熵权法运用于发酵枳壳综合质量评价具有良好的可行性。
2.3 枳壳发酵工艺的优选
取枳壳净药材,称定质量,约40 g,每个条件下平行2份,加水浸泡一定时间,将泡湿的枳壳装入透气漏水的容器,置恒温恒湿培养箱中,在设定的温度、湿度下发酵一定时间,清洗干净,切薄片、干燥,即得相应的枳壳发酵品。选取发酵时间、发酵温度、发酵湿度、浸泡时间为考察因素,以发酵中间品中10个特征成分的含量及发酵终点的外观性状为指标,采用AHP-熵权法计算复合评分,在单因素实验的基础上、通过正交试验优选枳壳的自然发酵工艺。
由单因素实验的结果可知,当发酵温度较低(22 ℃)或较高(42 ℃)、发酵湿度较低(50%,60%)时,枳壳药材表面菌丝极少,发酵情况不明显,说明温度过高或过低及湿度过低时可能会抑制微生物的生长,导致枳壳发酵程度低。在发酵湿度较高(湿度大于90%)、浸泡时间过长(超过6 h)、发酵时间过长(超过6 d)的环境下,均会出现药材腐败软烂甚至变质的情况;根据含量测定的结果可知,发酵湿度在70%~90%时,药材表面发酵程度明显,10个特征成分的总含量较高;另外,浸泡时间过长有效成分容易流失,导致含量较低;发酵时间超过4 d,药材中的有效成分会被微生物过度利用,导致总体含量下降,影响枳壳发酵品的质量。
2.3.1 正交试验 根据单因素实验中不同枳壳发酵品的外观性状筛选出部分适宜条件,发酵温度(A)取27、32、37 ℃3个水平,发酵湿度(B)取70%、80%、90% 3个水平,发酵时间(C)取48、72、96 h 3个水平,浸泡时间(D)取3、4、5 h 3个水平,进行4因素3水平的L9(34)正交试验。
根据表2试验安排,取同一批次的枳壳药材,按“2.2”项下方法制备正交试验样品。按“2.1.2”项下方法制备供试品溶液,各成分的含量测定按照“2.1.3”项下条件测定,试验安排及结果见表2、3。
由表2正交试验结果可知,选出的最佳工艺为A3B3C2D1,且表3中方差分析结果表明,A因素对复合评分有显著性影响,且各因素影响程度依次为A>B>D>C(即发酵温度>发酵湿度>发酵时 间>浸泡时间),综合直观分析与方差分析,最终确定最优的工艺为A3B3C2D1,即浸泡时间4 h,发酵温度37 ℃,发酵时间48 h,发酵湿度90%。
表2 枳壳发酵工艺正交试验结果及复合评分
Table 2 Orthogonal test results and comprehensive scores of Aurantii Fructus fermentation process
序号A/℃B/%C/hD/hAHP-熵权复合评分 127 (1)70 (1)3 (1)48 (1)37.35 227 (1)80 (2)4 (2)72 (2)48.76 327 (1)90 (3)5 (3)96 (3)54.45 432 (2)70 (1)4 (2)96 (3)58.01 532 (2)80 (2)5 (3)48 (1)56.31 632 (2)90 (3)3 (1)72 (2)60.12 737 (3)70 (1)5 (3)72 (2)59.44 837 (3)80 (2)3 (1)96 (3)65.12 937 (3)90 (3)4 (2)48 (1)84.03 K146.85351.60054.19759.230 K258.14756.73063.60056.107 K369.53066.20056.73359.193 R22.67714.6009.4033.123
表3 枳壳发酵工艺正交试验方差分析
Table 3 Analysis of variance of orthogonal test on Aurantii Fructus fermentation process
误差来源偏差平方和自由度F值显著性 A771.351240.000P<0.05 B329.158217.069 C142.00827.364 D19.28421.000 误差19.2842
0.05(2, 2)=19.000.01(2, 2)=99.00
2.3.2 验证试验 对“2.3.1”中选出的最优工艺进行3次验证试验,测得复合评分分别为83.74、84.22、84.35,RSD小于3%,试验接近预测值,进一步说明优化工艺的稳定、可行。
2.4 枳壳发酵前后成分变化
选取枳壳及上述最优工艺下炮制的枳壳发酵品各3份,每份0.5 g,精密称定,按“2.1.2”项下方法制备供试品溶液,在“2.1.3”项条件下测定2次,计算各成分含量。在本研究中,通过对照品指认了枳壳发酵前后的10种特征黄酮类成分,其中包括黄酮双糖苷、单糖苷及苷元类成分,并发现发酵后这些成分的含量会发生变化,因此分别探究这些成分的变化规律,来初步阐明枳壳发酵的化学机制。
通过对照品指认出10种黄酮类成分,其中包括7种黄酮苷(圣草次苷、新北美圣草苷、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷和枸橘苷),1种黄酮类单糖苷(橙皮素-7--葡萄糖苷),2种黄酮苷元(柚皮素和橙皮素),分别计算发酵前后这10种黄酮类成分的含量,结果见表4。枳壳发酵后,7种黄酮双糖苷的含量均有不同程度的下降,而单糖苷(橙皮素-7--葡萄糖苷)和2种黄酮苷元的含量大幅度增加,提示发酵这一过程可能会导致成分的转化。
表4 发酵前后10种黄酮类成分含量的变化
Table 4 Changes of contents of ten flavonoids before and after fermentation
样品圣草次苷/%新北美圣草苷/%芸香柚皮苷/%柚皮苷/%橙皮苷/%新橙皮苷/%枸橘苷/%橙皮素-7-O-葡萄糖苷/%柚皮素/%橙皮素/% 枳壳0.47±0.010.17±0.010.56±0.015.16±0.100.48±0.034.86±0.020.48±0.01−−− 枳壳发酵品0.40±0.010.12±0.010.50±0.002.78±0.010.33±0.014.57±0.000.32±0.001.35±0.010.38±0.000.35±0.00 含量变化/%−14.88−21.43−11.81−47.06−34.77−6.19−34.50
“−”表示化学成分含量极低,未检测出
“−”means that the content of chemical components is extremely low and not detected
黄酮类化合物是枳实、枳壳及其炮制品的主要活性成分[15]。在枳壳发酵的过程中,一些微生物可分泌胞内胞外酶(如柚皮苷酶和橙皮苷酶)使一些黄酮苷类成分降解为相应的苷元或单糖苷,实现在体外对黄酮苷类物质进行生物转化[16-17]。本研究发现,枳壳发酵后,柚皮苷等7种黄酮苷的含量减少,柚皮素、橙皮素和橙皮素-7--葡萄糖苷的平均含量增加。与黄酮苷类相比,单糖苷或苷元成分生物利用度较高,易入血吸收[18-19],也说明了这种炮制的有效性。
结合含量测定结果推测枳壳发酵过程中柚皮苷、橙皮苷等黄酮苷类成分有大致类似的转化规律,都可能是在相应酶的作用下,使7-鼠李糖苷键水解,生成鼠李糖和相应单糖苷,然后继续进行反应生成相应的苷元和葡萄糖,具体的转化规律如图2所示(因新橙皮苷与橙皮苷互为同分异构体,柚皮苷与芸香柚皮苷互为同分异构体,故其转化过程大致相同)。由表5可知,几个正交试验样品的单糖苷及苷元含量的变化趋势大致相似,提示其转化过程可能同时进行。单糖苷及苷元的含量会随着发酵温度的上升而增加,在37 ℃时(样品正交7~9)这些成分的含量较高;在此温度条件下,当发酵湿度为90%时,可能会达到一个加速发酵进程的效果,柚皮苷酶等生物酶有较强活力,单糖苷及苷元的含量明显升高。
综上所述,发酵温度、湿度等条件会对枳壳发酵品中的单糖苷和苷元的含量产生影响,在最佳的发酵条件下,产生的单糖苷和苷元的含量较高,发酵程度较高,同时可以缩短发酵的时间。
3 讨论
中药炮制是中医的用药特点,中药饮片的质量直接影响临床疗效。科学、规范的炮制工艺是中药饮片质量的重要保证。岭南地区有许多独特的炮制工艺和独具特色的饮片,但相关的炮制研究较少。很多炮制工艺较为传统、粗放,往往缺乏科学合理的技术参数,炮制火候标准亦多凭借人为经验判别,常常导致饮片质量的不稳定。因此,借助现代科学技术和手段,对炮制工艺进行不断改进与创新,促进科学、规范化的炮制工艺建立至关重要。
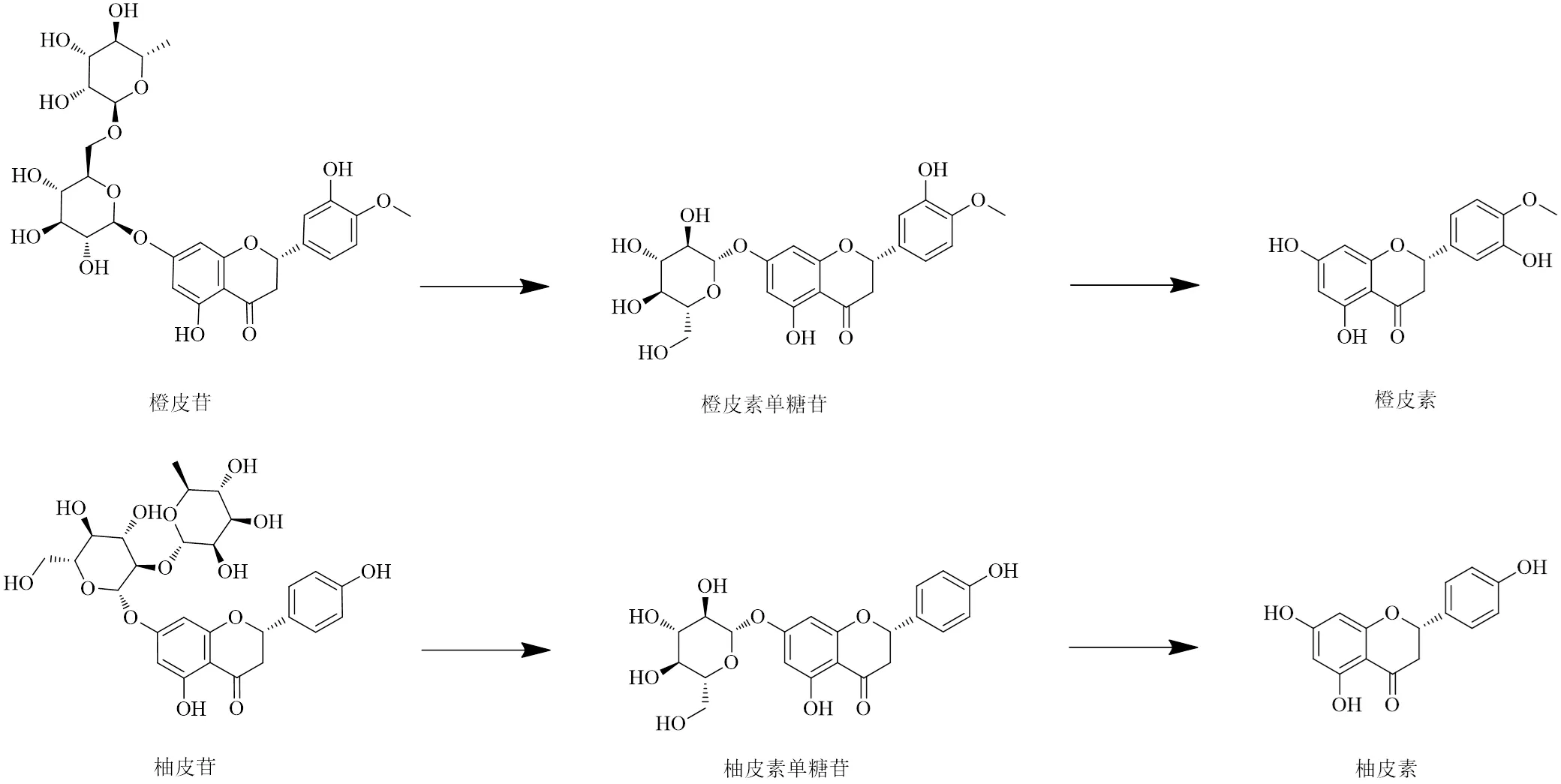
图2 枳壳发酵过程中主要成分的转化
表5 枳壳发酵正交试验样品中黄酮类单糖苷及苷元的含量
Table 5 Contents of flavonoid monoglycosides and aglycones in orthogonal test samples of Aurantii Fructus fermentation
正交试验样品黄酮单糖苷/%黄酮苷元/% 正交10.13±0.000.13±0.00 正交20.40±0.000.18±0.00 正交30.47±0.010.23±0.01 正交40.47±0.010.28±0.01 正交50.50±0.010.29±0.01 正交60.58±0.020.32±0.00 正交70.59±0.010.34±0.00 正交80.68±0.020.36±0.01 正交91.35±0.010.54±0.01
制枳壳为一岭南特色饮片,采用了先发酵后蒸制的独特炮制工艺,有较好的行滞消胀作用,在粤港澳地区被广泛使用。发酵是其炮制工艺中的关键环节,但在生产中缺乏规范化的炮制工艺参数,生产时间与产品质量受自然气候条件影响较大。另外,目前制枳壳的发酵中间品与成品的质量控制方法极为简单,仅凭借外观性状、色泽等经验鉴别手段来评判。因外观性状比较类似,一些生产企业擅自减少工艺流程,不发酵只蒸制,以清蒸枳壳代替发酵蒸制枳壳在市场流通,出现了产品质量参差不齐的乱象[20]。因此,质量控制中的含量测定是必不可少的。黄酮类成分为枳壳及其炮制品中的主要活性成分,炮制后也发生了较大的变化[21-22],故在本研究中,选择了发酵后变化较大且与制枳壳行滞消胀功效密切相关[8-9]的10种黄酮类成分进行含量测定。
在工艺研究中的综合评分方法有层次分析法、G1法、熵权法、主成分分析法等,其中,前两者属于主观评价法,后两者属于客观评价法,而主观与客观的组合评价方法更符合中药炮制工艺研究的特点[23]。因此,本研究利用UHPLC法同时测定枳壳发酵品中的多种黄酮类成分,以柚皮苷、柚皮素等10种黄酮苷及苷元类特征性成分的含量和发酵品的外观性状作为枳壳发酵品的质量评价指标,通过AHP-熵权法计算复合评分,对浸泡时间、发酵温度、发酵湿度及发酵时间等发酵工艺中的关键因素进行优选,确定了枳壳的最佳发酵工艺,为岭南特色饮片制枳壳的规范化炮制工艺研究及工业化大规模生产奠定了基础。同时对枳壳发酵前后的10种黄酮类成分含量变化的规律进行初步探讨,为制枳壳炮制机制的深入研究奠定基础。
尽管本研究对枳壳的发酵工艺环节进行了优化研究,但是依然存在发酵菌种不稳定、混杂有无效菌株等问题,影响枳壳发酵品的质量稳定。后续研究中可考虑采用更纯净、精准的定向发酵方式[24-27],筛选枳壳发酵的关键微生物菌群菌种,实现稳定菌种组合的混合固体发酵工艺。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 四部. 2020: 246.
[2] 李陈雪, 杨玉赫, 冷德生, 等. 枳壳化学成分及药理作用研究进展 [J]. 辽宁中医药大学学报, 2019, 21(2): 158-161.
[3] 何以蓓, 徐志瑛. 徐志瑛运用枳壳的经验 [J]. 浙江中医杂志, 2013, 48(10): 762-763.
[4] 徐欢, 陈海芳, 介磊, 等. 枳实、枳壳的化学成分及胃肠动力研究概述 [J]. 江西中医学院学报, 2009, 21(1): 42-44.
[5] 张金莲, 曾昭君, 李志强, 等. HPLC法测定枳壳不同炮制品中活性成分 [J]. 中成药, 2014, 36(11): 2355-2358.
[6] 广东省食品药品监督管理局. 广东省中药饮片炮制规范 [M]. 广州: 广东科技出版社, 1984: 192.
[7] 帅银花, 陈娟, 夏荃. 枳壳不同炮制品中柚皮苷的含量测定 [J]. 今日药学, 2010, 20(6): 42-44.
[8] 王红阳, 钟佩芸, 梁家怡, 等. 制枳壳HPLC指纹图谱与小肠推动作用的谱效关系 [J]. 中成药, 2021, 43(3): 750-754.
[9] 龙江玲, 黄莹莹, 杨婷, 等. 岭南饮片制枳壳不同化学部位对功能性消化不良大鼠的影响 [J]. 今日药学, 2021, 31(11): 839-843.
[10] 冯利梅, 陈艳琰, 乐世俊, 等. 基于层次分析-熵权法的中药质量标志物量化辨识方法研究: 以芍药甘草汤为例 [J]. 药学学报, 2021, 56(1): 296-305.
[11] 张景珍, 崔曰新, 王思雨, 等. 基于熵权法对千金子-甘草不同配伍比例的化学成分变化及体外肝毒性研究 [J]. 中国现代中药, 2020, 22(3): 433-440.
[12] 于亚田, 王智群, 冯建安, 等. 基于Box-Behnken及PCA-G1-熵权法优选青香乳康颗粒中挥发油的提取及包合工艺 [J]. 中草药, 2019, 50(15): 3631-3636.
[13] 刘杭. 层次分析中的两种近似计算方法 [J]. 南京邮电学院学报, 1987, 7(4): 135-139.
[14] 邓雪, 李家铭, 曾浩健, 等. 层次分析法权重计算方法分析及其应用研究 [J]. 数学的实践与认识, 2012, 42(7): 93-100.
[15] Li Y G, Wang X Y, Chen H F,. Comparison of the chemical constituents of rawandstir-baked with bran, and the biological effects of auraptene [J]., 2021, 269: 113721.
[16] 郑美瑜, 陆胜民, 陈剑兵, 等. 糖苷酶对橙皮苷和柚皮苷的酶解作用研究 [J]. 中国食品学报, 2010, 10(4): 141-146.
[17] 王幻, 王玉涛, 陈良, 等. 橙皮素单葡萄糖苷的酶法生物合成与定向调控 [J]. 食品与发酵工业, 2018, 44(10): 7-13.
[18] Shi S Q, Yan H, Chen Y,. Pharmacokinetic study of precisely representative antidepressant, prokinetic, anti-inflammatory and anti-oxidative compounds fromandBark [J]., 2020, 315: 108851.
[19] Yuan J B, Wei F T, Luo X Z,. Multi-component comparative pharmacokinetics in rats after oral administration ofextract, naringin, neohesperidin, and naringin-neohesperidin [J]., 2020, 11: 933.
[20] 夏荃, 鲍倩, 梁家怡, 等. 岭南特色炮制工艺对枳壳挥发油成分的影响 [J]. 中国实验方剂学杂志, 2018, 24(5): 13-19.
[21] 张栋健, 李薇, 何庆文, 等. UHPLC-Q-TOF-MS分析枳壳炮制前后成分变化 [J]. 中国中药杂志, 2016, 41(11): 2070-2080.
[22] 刘雅莉, 邓桂珠, 贤明华, 等. 枳壳炮制前后指纹图谱及主要黄酮类成分含量的变化 [J]. 中国实验方剂学杂志, 2020, 26(2): 113-118.
[23] 刘畅, 王潇, 刘芳, 等. 基于多指标质量差异关键属性优化厚朴产地加工“发汗”工艺 [J]. 中草药, 2021, 52(3): 677-684.
[24] 宋予震, 史洪涛, 范明夏, 等. 微生物发酵中药研究进展 [J]. 动物医学进展, 2021, 42(1): 105-109.
[25] 胡梦, 程玉冰, 张培燕, 等. 百药煎中转化鞣质生成没食子酸的最佳菌种组合筛选 [J]. 中国现代中药, 2018, 20(4): 453-457.
[26] 秦梦, 郭兰萍, 裴林, 等. 正交试验法优化中药废渣的最佳发酵工艺 [J]. 中华中医药学刊, 2020, 38(12): 31-34.
[27] Zhao C, Yang F, Lin F,. Process optimization in ginseng fermentation by Monascus ruber and study on bile acid-binding ability of fermentation products[J]., 2021, 51(2): 120-126.
Optimization of fermentation process of processedfrom Lingnan characteristic decoction pieces based on AHP-entropy weight method and orthogonal experimental design and comparison of components before and after fermentation
YANG Ting, HUANG Ying-ying, FANG Yang-bing, LONG Jiang-ling, LI Qin-ru, XU Qi-jian, HUANG Ai-hua, ZHANG Ying, XIA Quan
School of Pharmaceutical science, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
The content determination method of multiple characteristic peaks in fermentedwas established. The fermentation technological conditions of the characteristic processing product ofin Lingnan region were optimized, and the changes of components before and after fermentation were compared.The contents of characteristic peaks in the fermentedwere determined by UHPLC. Based on the single-factor test, the influencing factors such as fermentation temperature, fermentation time, and fermentation humidity were investigated by orthogonal test. The appearance properties of the fermentedand the contents of 10 characteristic flavonoids (including flavonoid glycosides and aglycones) in the fermentedwere used as evaluation indexes. The analytic hierarchy process (AHP) and entropy weight method were used to set different weights for these indexes, and the compound scores were calculated to optimize the fermentation process.The optimum fermentation technological conditions ofwere determined as follows: soaking time 4 h, fermentation time 48 h, fermentation temperature 37 ℃, fermentation humidity 90%; Fermentation considerably reduced the contents of flavonoid glycosides, while increasing hesperidin-7--glucoside and flavonoid aglycones.The established UHPLC multi-component content determination method is simple, accurate, reproducible, and reliable. The optimized fermentation process ofis simple, stable, and feasible. It standardizes the fermentation process ofand can provide experimental data for the industrial production of processed.
; processed; fermentation of traditional Chinese medicine; optimization of fermentation process; eriocitrin; neoeriocitrin; narirutin; naringin; hesperidin; neohesperidin; hesperidin-7--glucoside; poncirin; naringenin; hesperetin
R283.6
A
0253 - 2670(2022)20 - 6443 - 08
10.7501/j.issn.0253-2670.2022.20.016
2022-04-25
国家自然科学基金资助项目(81873003);广东省科技计划项目(2017A020213012);国家中医药管理局中药炮制技术传承基地项目(粤中医办函[2022]52号)
杨 婷(1998—),女,硕士研究生,研究方向为中药炮制工艺及炮制机制研究。Tel: 13687446034 E-mail: 1832603053@qq.com
夏 荃(1971—),女,硕士生导师,教授,主要从事中药炮制机制研究。Tel: (020)39358257 E-mail: xia@gzucm.edu.cn
[责任编辑 郑礼胜]