安徽通江湖泊4 种典型生境浮游植物群落结构特征及其影响因子
孟 诗,商乃萱,袁素强,周忠泽
(安徽大学资源与环境工程学院,合肥 230601)
浮游植物作为淡水水体中的主要初级生产者,构成了水生食物网的基础,由于浮游植物拥有独特的形态和生理适应性策略,其群落结构能对不同的生境变化做出直接且迅速地响应[1-2]。宋芳芳等[3]在探讨浮游植物群落对不同沉水植物生境的响应时,发现在4 种沉水植被生境中浮游植物的密度、生物量以及生物多样性均存在显著差异,优势种类从单一隐藻门转变成多门类物种同时占优势。王振方等[4]研究发现异龙湖3 个湖区的生境条件存在空间异质性,其浮游植物群落β多样性也存在显著差异。此外,浮游植物群落结构及其生物多样性对人工围隔和人工养鱼塘的建立也具有积极的响应[5]。全面了解不同生境下浮游植物群落结构动态及其驱动因子,解读其所响应的生境特征和变化,能为不同的水体环境生态保护提供依据。
水生植被具有复杂的生理结构,在不同水体中发挥多种生态作用,为浮游植物提供不同生境[6]。水生植被可以通过吸收营养物质[7],稳定底部沉积物减少沉积物再悬浮,提高水体透明度[8],释放溶解氧[9],竞争营养物质以及释放对浮游植物有毒的化感物质[10-12],为浮游动物提供避难所和繁殖场所[13-14]来直接或间接地影响浮游植物群落结构。代志刚等[15]在研究杭州西湖浮游植物群落对沉水植物恢复的响应时,发现在恢复示范工程实施后,水体中浮游植物的细胞密度逐渐减少,物种多样性有显著提升,水质得到一定程度的改善。Takamura 等[16]在日本3 个浅水湖泊中研究发现不同地点浮游植物群落结构的差异很大程度上是由水生植被造成的。
浮游植物群落结构的时空变化特征与环境因子关系密切,在不同生境中分布着不同群落结构的浮游植物[17-19]。邓建明等[18]在研究洪湖浮游植物群落结构及其与环境因子的关系时,发现浮游植物群落结构与水温、溶解氧及悬浮物浓度相关。张永红等[19]将滆湖控藻网围内、外及工程示范区浮游植物群落结构进行对比研究,结果显示水温、叶绿素a是影响滆湖浮游植物群落结构的主要环境因子。此外,渔业养殖[20-21]和水系连通[22-23]对浮游植物的影响也是现阶段水生生态学重要的研究热点之一。韩祥珍等[24]在研究围网养殖对水生植被和沉积物再悬浮的影响时,发现围网养殖破坏了水生植物资源,使沉积物再悬浮显著增强。刘丹等[25]在探讨水文连通性对湖泊生态环境影响的研究进展时,提出水文连通性会造成的营养物质和水体动力的改变进而对浮游植物群落结构产生重要影响。
在生态学研究中,生境是指生物个体、种群或群落生活的生态地理环境,包括生物必须的生存条件和其他对生物起作用的生态因素[26]。本研究按照水生植被类型、盖度以及水文连通性等生态因子的差异将安徽通江湖泊开阔水域、圩口及其邻近池塘水体分为4 种典型生境。研究4 种典型生境中浮游植物的群落结构特征,阐明影响因子,为探讨通江湖泊的浮游植物群落维持机理和生态管理提供科学依据。
1 材料与方法
1.1 研究区概况
升金湖,濒临长江,地表径流丰富,与长江具有很好的连通性;水生植被良好丰富,水质优良,生态系统多样,生态服务功能突出,是国家级湿地自然保护区。武昌湖,属皖河水系,由一系列串联湖泊组成,与自然河流和长江相连通;水生植被繁茂,生物资源丰富,沿湖没有工业污染,大力发展渔业养殖,是安徽省的重要渔场。升金湖和武昌湖均为重要的通江浅水湖泊,2000 年以来高密度的渔业围网养殖导致通江浅水湖泊水生植被严重退化,尤其是沉水植被几乎消失。2018 年在政府的大力支持下撤除渔业围网,水生植被得以快速恢复。升金湖、武昌湖周围间隔许多利用地形建成的圩口,金保圩、燕窝圩是通过围堤造田形成的典型圩口,通过闸门与自然湖泊相连,是升金湖流域的重要组成部分。自2008 年以来在圩口进行规模化渔业养殖后,水生植被逐渐减少,生境退化,为恢复圩口内的生态环境,在金保圩和燕窝圩构建水生植物群落,分别形成了浮游植物的沉水植被生境和挺水植被生境。随着经济压力的增加,水产养殖业发展迅速,武昌湖流域的圩口内改建了许多人工养鱼塘,人工养鱼塘为封闭的小水体,由于长期的渔业养殖,过量的饵料投喂,导致氮、磷含量过高。为此,本研究选取与人工养鱼塘相邻的鱼塘进行水生植被恢复,通过对比分析探究人工恢复的水生植被对人工养鱼塘浮游植物群落结构的影响。
将上述研究区分为4 种不同的典型生境:(1)自然湖泊生境。升金湖和武昌湖均为通江浅水湖泊,湖体水域开阔,水体与长江相连通,2018 年初渔业养殖围网撤除后水生植被在湖泊中自然恢复,平均盖度在夏季达到60%以上。(2)沉水植被生境。金保圩是一个大型圩口,通过闸口升金湖上湖连相通,在金保圩划分出面积为200 亩的水生植被恢复示范工程区,开展沉水植被恢复试验,通过人工种植沉水 植 被 苦 草(Vallisneria natans)、 黑 藻(Hydrilla verticillata)、金鱼藻(Ceratophyllum demersum)和小茨藻(Najas minor)形成了以沉水植被为主的生境,夏季时水生植被生长旺盛期,沉水植被平均盖度高达80%。(3)挺水植被生境。燕窝圩与升金湖下湖具有一定的连通性,在燕窝圩划分出面积为200 亩的水生植被恢复示范工程区,同时在与武昌湖下湖相连通的圩口选定一个面积为20 亩的小型池塘开展挺水植被恢复试验,在两个工程区内人工种植挺水植物菰(Zizania latifolia)和莲(Nelumbo nucifera),构建挺水植被恢复示范工程区,其植被盖度在夏季也达到80%。(4)人工养鱼塘生境。于武昌湖附近的圩区选定一个面积为20亩的人工养鱼塘作为一个特定研究生境,该鱼塘水体相对封闭,水生植被稀少。
1.2 样点设置与采样时间
本研究共设置24 个采样点,具体如图1 所示。24 个采样点位于以下4 种典型生境:(1)升金湖S1—S6 采样点和武昌湖W1—W6 采样点位于自然湖泊生境H1;(2)金保圩J1—J3 采样点位于沉水植被生境H2;(3)燕窝圩Y1—Y3 采样点和武昌湖水生植被恢复示范工程区W7—W9 采样点位于挺水植被生境H3;(4)武昌湖圩区鱼塘W10—W12采样点位于人工养鱼塘生境H4。根据安徽省通江浅水湖泊水体环境因子指标、水生植被生境参数以及浮游植物群落结构的特征,本研究于2018 年4 月至2019 年1 月每个季度采样 1 次,采样时间为每个季度首月上旬。为了分析影响浮游植物群落结构的环境因子,同时开展了水生植被生长状况调查和环境因子监测工作。
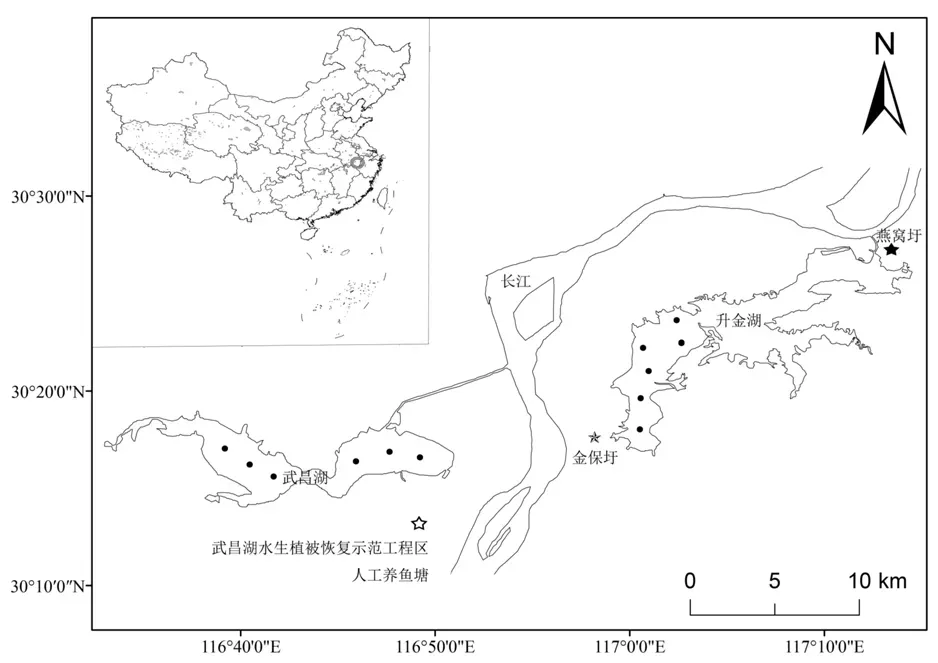
图1 安徽通江湖泊4 种典型生境采样点分布图Figure 1 Distribution of sampling points of four typical habitats in the lakes connected to the Yangtze River,Anhui Province
1.3 水生植被监测
采用样方法调查水生植被盖度,于采集浮游植物样品的样点处,布设 5 个大小为 5 m × 5 m 的样方,现场调查记录水生植被植物种类,估算其盖度。
1.4 浮游植物样品采集与计数
参考《淡水浮游生物研究方法》[27]采集浮游植物样品。采集浮游植物定性样品时使用25#浮游生物网,在表层水中做“∞”状的循回拖动富集,采集的样品浓缩至50 mL 注入样品瓶中,并立即固定。取定性样品制作临时装片于显微镜下进行拍照观察及种类鉴定,浮游植物分类鉴定方法参考经典文献[1,28]。采集浮游植物定量样品时使用采水器取1 L 水样装入聚乙烯瓶中,用10~15 mL 鲁哥试剂进行固定,运入实验室后静置沉淀48 h 以上,使用虹吸法浓缩至30 mL。定量计数前需将样品摇匀,取0.1 mL 样品注入计数框内,置400 倍的显微镜下按视野法计数,每一计数样品应取样和计数2 次(2 片),取其平均值。
1.5 环境因子的测定与分析
在采集浮游植物样品的同时于采样点处利用美国哈希 HQ40d 便携式多参数分析仪对溶解氧(DO)、pH 值、水温(WT)和电导率(COND)进行现场测定并记录数据,利用赛氏盘(Secchi Disk)测定水体透明度(SD)。采集1 L 水,用于实验室水化学分析,按照标准方法[29]分析总氮(TN)、总磷(TP)、硝态氮(NO3--N)、铵态氮(NH4+-N)和叶绿素a 含量。
1.6 数据整理与分析
浮游植物细胞密度的计算公式为:

式(1)中,N(cells·L-1)为水中浮游植物的总个体数;n(个)为计数所得到的细胞个体数量;Vs(mL)为沉淀体积;V(L)为采样体积;Va(mL)为计算体积。
浮游植物生物量计算。参照《淡水浮游生物研究方法》[27]中的方法,计算浮游植物生物量。测定方法如下:藻类的比重接近于1,故可以直接由藻类的体积换算为生物量(湿重),先根据藻类的形状按最近似的几何形状测量必要的量度,如长度、高度、直径等,然后按体积公式计算出体积。
浮游植物的优势度计算公式为:

式(2)中,ni:第i种的总个体数;fi:该物种在各样品中出现的频率;N:全部样品中的总个体数;以Y≥0.02 为界限,计算优势种。
浮游植物群落结构特征采用生物多样性指数进行分析,Shannon-Wiener 多样性指数(H′)、Pielou均匀度指数(J)和Margalef 丰富度指数(D)计算公式分别为:

式(3)中,S:浮游植物物种数;N:浮游植物个体总数;Ni:为i种的个体。
采用Arcgis 绘制采样点分布图,用Microsoft Excel 进行数据的图表制作,用 SPSS 19.0 进行单因素方差分析(One-Way ANOVA)和Pearson 相关性分析,用Canoco 4.5 软件对浮游植物生物量数据进行去趋势分析( DCA), 得出第1 轴长度(1.838)小于3,因此选择 RDA 分析。
2 结果与分析
2.1 环境因子
本研究对4 种典型生境的环境因子进行了单因素方差分析(One-way ANOVA),结果显示4 种生境的环境因子年平均值各不相同,但大多数变量在统计上存在显著差异(表1)。自然湖泊生境H1 的透明度为(49.44 ± 12.60)cm,显著高于人工养鱼塘生境H4 的(26.50 ± 3.89)cm,在4 种生境中最高。 4 种生境的浊度也存在显著差异,H4 的浊度最高为(60.28±1.89)NTU。H4 的总氮、总磷浓度具有最大值,显著高于其他3 种生境。挺水植被生境H3 的溶解氧浓度为(6.69±3.22)mg·L-1,在4种生境中最低。H4 叶绿素 a 浓度最高为(18.41±9.44)μg·L-1,H1 的叶绿素a 浓度最低为(4.95±2.66)μg·L-1。电导率的最小值出现在沉水植被生境H2,pH 值在H4 最大。4 种生境的水生植被盖度各不相同,H4 的水生植被盖度最低为(4.00±2.97)%,H2 和H3 的水生植被盖度分别为(48.08±34.48)%和(48.54±31.78)%,H1 的水生植被盖度为(36.22±25.39)%,略低于H2 和H3。

表1 4 种典型生境的环境因子及水生植被盖度(年平均值±标准差)Table 1 Environmental factors and aquatic vegetation coverage of 4 typical habitats (annual average ± standard deviation)
在4 种典型生境中总氮、总磷的浓度随季节改变发生明显变化(图2)。总体而言,H2、H3 季节变化趋势大致相同,夏季(7 月)总氮和总磷浓度最高,冬季(次年1 月)最低。H1 总氮没有明显的季节变化趋势,在夏季和冬季略有增加。H4 总氮、总磷浓度的季节变化趋势和其他生境均不相同,但在各季度都最高(图2)。水生植被盖度在4 种生境中的季节变化趋势大致相同,在7 月出现最大值,且H1、H2 和H3 的植被盖度均达到60%以上,1月出现最小值(图2)。4 种生境的叶绿素含量在秋季(10 月)出现最大值,夏季(7 月)高于冬季(1月)和春季(4 月)。各生境中透明度和溶解氧含量的季节变化各不相同,不具有相同的变化规律,但也随季节的变化而发生改变。
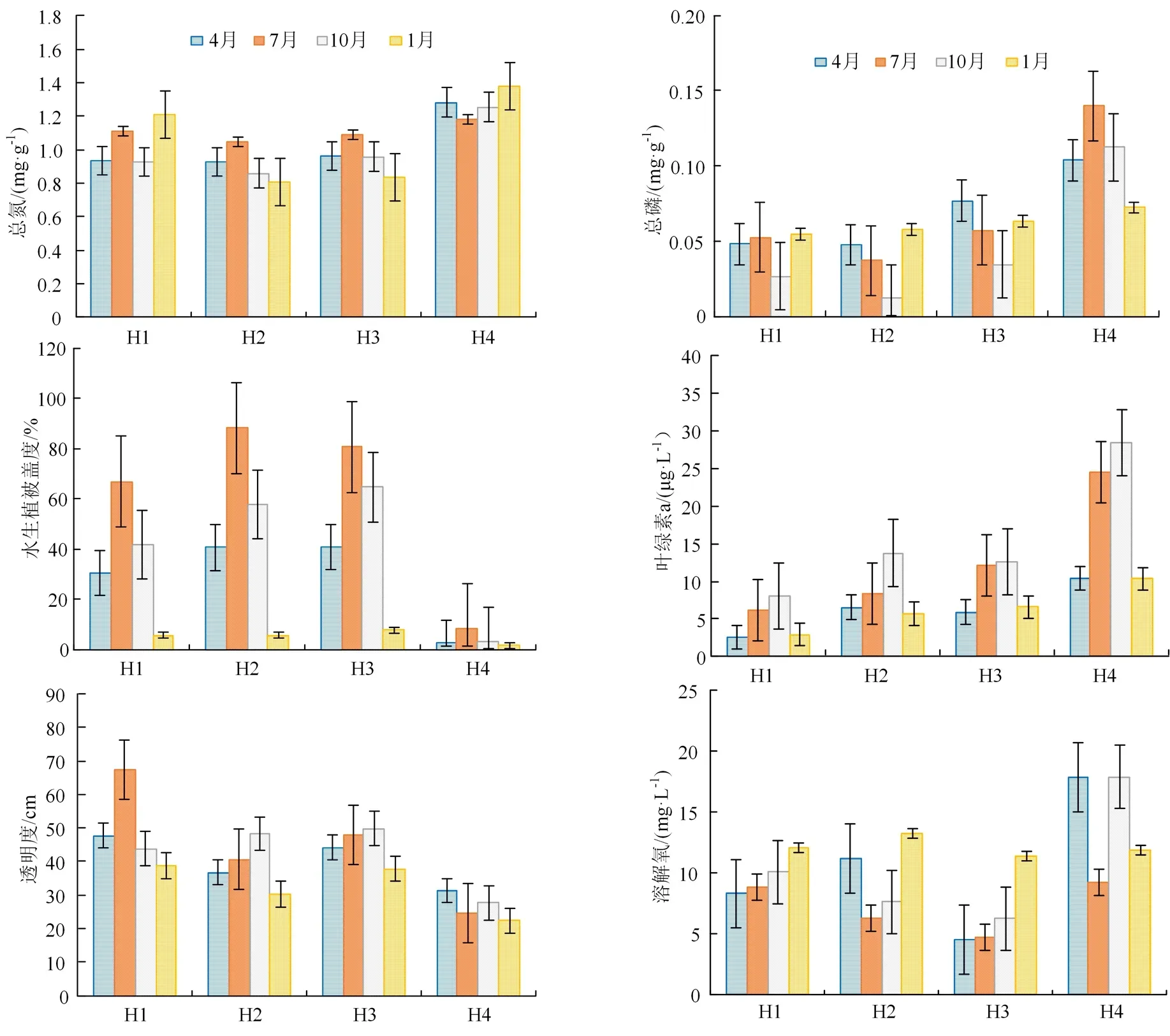
图2 4 种典型生境的环境因子Figure 2 Environmental factors of four typical habitats
2.2 浮游植物种类组成
在2018 年4 月至2019 年1 月对浮游植物的四季调查中,安徽省通江湖泊4 种生境共检出浮游植物235 种,隶属8 门94 属,其中绿藻门83 种、蓝藻门70 种、硅藻门45 种、裸藻门21 种、隐藻门7种、甲藻门6 种、黄藻门种2 和金藻门1 种。4 种生境间物种丰富度差异明显,H1 种数最高,为 233种,H2 和H3 物种数差异不明显,分别为162 种和154 种,物种数最少的是水生植被稀少的人工养鱼塘生境H4,仅有89 种。有水生植被分布的3 种生境浮游植物种类以绿藻为主分别是H1(83)种、H2(64)种和H3(58)种,而蓝藻门36 种是H4浮游植物物种组成的主要成分。此外,同一生境中各季节物种数差异明显,均在7 月份最高1 月份最低(图3)。

图3 4 种典型生境的物种组成Figure 3 Species composition of four typical habitats
2.3 浮游植物的优势种
根据物种优势度Y≥0.02 为优势种的原则,在4 种典型生境中,优势种共有29 种,其中硅藻门8种,蓝藻门11 种,绿藻门7 种隐藻门2 种,金藻门1 种(表2)。各生境优势种具有一定的差异,只有颗粒直链藻在4 种生境均占优势。H1 优势种共13种,其中硅藻门最多,有5 种,分别为梅尼小环藻(Cyclotella meneghiniana)、肘状针杆藻(Synedra ulna)、尖针杆藻、钝脆杆藻(Fragilaria capucina)和颗粒直链藻;蓝藻门3 种,分别为细鞘丝藻(Leptolyngbya foveolara)、纤细月牙藻(Selenastrum gracile)和铜绿微囊藻(Microcystis aeruginosa);绿藻门2 种,分别为肥壮蹄形藻(Kirchneriella obesa)和螺旋弓形藻(Schroederia spiralis);隐藻门2 种,分别为尖尾蓝隐藻(Chroomonas acuta)和啮蚀隐藻(Cryptomonas erosa);金藻门1 种,为长锥形锥囊藻(Dinobryon bavaricum)。H2 优势种共13 种,其中绿藻门最多有5 种,分别为螺旋弓形藻、蛋白核小球藻(Chlorella pyrenoidosa)、小球藻(Chlorella vulgaris)、小空星藻(Coelastrum microporum)和四尾栅藻(Scenedesmus quadricauda);硅藻门4 种,分别为梅尼小环藻、钝脆杆藻、岛直链藻(Melosira islandica)和颗粒直链藻;蓝藻门4种,分别为多变鱼腥藻(Anabaena variabilis)、狭形纤维藻(Ankistrodesmus angustus)、绿色颤藻(Oscillatoria chlorina) 和 细 小 平 裂 藻(Merismopedia minima)。H3 优势种共14 种,硅藻门5 种,分别为尖针杆藻、钝脆杆藻、颗粒直链藻、意大利直链藻(Melosira italica)和华丽星杆藻(Asterionella formosa);绿藻门4 种,分别为肥壮蹄形藻、蛋白核小球藻、拟新月藻(Closteriopsis longissima)和四尾栅藻;蓝藻门3 种,分别为多变鱼腥藻、铜绿微囊藻和细小平裂藻;隐藻门和金藻门各1 种,分别为尖尾蓝隐藻和长锥形锥囊藻。H4的优势种共11 种,主要集中在蓝藻门6 种,分别为固氮鱼腥藻(Anabaena azotica)、卷曲鱼腥藻(Anabaena circinalis)、铜绿微囊藻、水华微囊藻(Microcystis flos-aquae)、小席藻(Phormidium tenu)和绿色颤藻;硅藻门3 种,分别为梅尼小环藻、尖针杆藻和颗粒直链藻;绿藻门和隐藻门各1种,分别为蛋白核小球藻和啮蚀隐藻。

表2 4 种典型生境的浮游植物优势种及其优势度Table 2 Phytoplankton dominant species and their dominance in four typical habitats
2.4 浮游植物的生物量与细胞密度
采样期间,H1 浮游植物年平均生物量为8.19 mg·L-1,其中绿藻年平均生物量最高为2.34 mg·L-1,硅藻门、蓝藻门其次。H2 的年平均生物量最低为8.03 mg·L-1,其中蓝藻年平均生物量为1.78 mg·L-1,略大于硅藻年平均生物量1.74 mg·L-1。H3 的年平均生物量为8.88 mg·L-1,高于H1 和H2,其中绿藻年平均生物量最高,为2.83 mg·L-1。H4 的年平均生物量为14.03 mg·L-1,明显高于其他3 种生境,且蓝藻的年平均生物量为4.68 mg·L-1,在H4 的年平均生物量中占主要地位。总体上,4 种生境在各个季节的生物量差异明显,均在夏季达到最大值,在冬季达到最小值,且生物量与细胞密度的季节变化趋势基本上是一致的(图4(a))。
采样期间,H1 浮游植物年平均细胞密度为173.62×105cells·L-1,其中蓝藻年平均细胞密度最高为89.91×105cells·L-1。H2 的浮游植物年平均细胞密度为185.41×105cells·L-1,高于H1 和H3,蓝藻年平均细胞密度79.25×105cells·L-1。H3 浮游植物年平均细胞密度最低为158.60×105cells·L-1,蓝藻年平均细胞密度为73.76×105cells·L-1。H4 浮游植物年平均细胞密度最高为248.79×105cells·L-1,蓝藻年平均细胞密度为135.1×105cells·L-1。蓝藻在4 种生境的浮游植物年平均细胞密度均占绝对优势。总体上,浮游植物细胞密度呈现明显的季节变化,4 种生境均在夏季达到最大值,在冬季达到最小值(图4(b))。

图4 4 种生境中浮游植物的生物量和细胞密度Figure 4 Biomass and cell density of phytoplankton in four habitats
2.5 浮游植物多样性
调查期间,4种生境的浮游植物Shannon-Wiener多样性指数、Pielou 均匀度指数和Margalef 丰富度指数均在夏季达到最高值,在冬季达到最低值(图5)。H1 浮游植物的Shannon-Wiener 多样性指数平均值处于相对较高水平,为5.32(4.05~6.75),H2的平均值为4.87(3.81~5.89),H3 的平均值为3.95(2.76~5.11),低于H2,H4 的平均值,为2.88(2.25~3.51)(图5(a))。Pielou 均匀度指数H1浮游植物的平均值最高为0.54(0.41~0.66),H2的平均值为0.67(0.51~0.76),H3 的平均值为0.63(0.48~0.71)低于H2,H4 的平均值最低,为0.44(0.36~0.53)(图5(b))。H1 浮游植物的Margalef丰富度指数平均值为3.76(3.01~5.11),H2 的平均值最高为5.02(3.74~7.21),H3 的平均值为4.55(3.21~6.35),H4 的平均值最低,为2.80(2.21~3.53)(图5(c))。
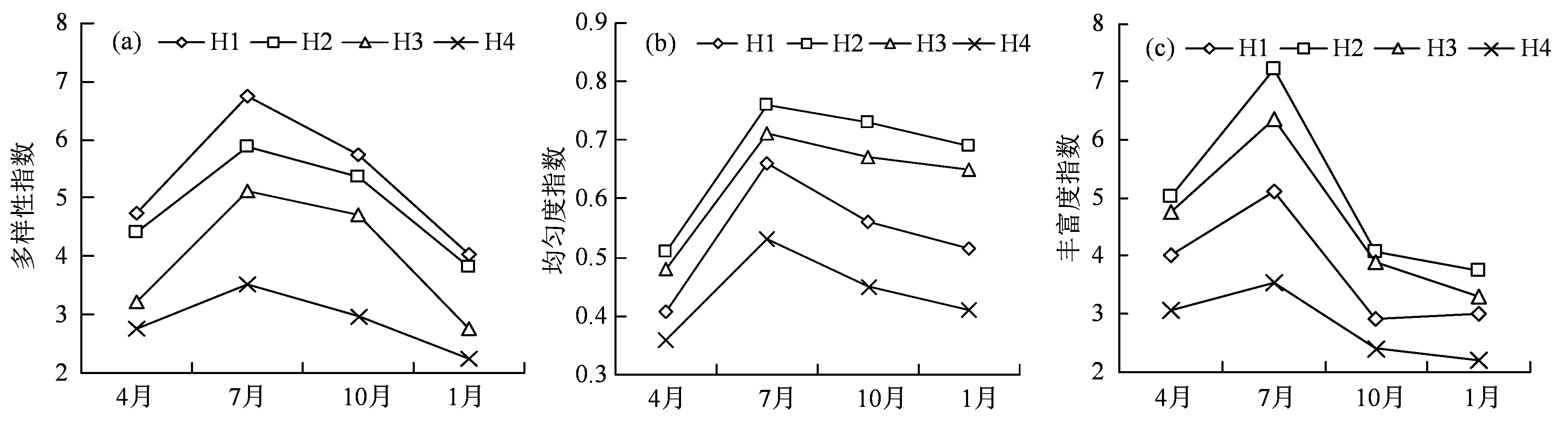
图5 4 种典型生境浮游植物的多样性指数Figure 5 Diversity index of phytoplankton in four typical habitats
2.6 浮游植物与环境因子的相关性分析
2.6.1 Pearson 相关分析 调查期间,对4 种生境浮游植物生物量和细胞密度与环境因子之间的Pearson相关分析结果显示,影响4 种生境浮游植物生物量、细胞密度的主要环境因子有水生植被盖度、总氮、总磷、浊度和透明度。水生植被盖度与浮游植物生物量、细胞密度均呈极显著负相关(P< 0.01),总氮与浮游植物细胞密度呈显著正相关(P< 0.05),总磷与浮游植物细胞生物量呈显著正相关(P< 0.05),且生物量与水体浊度呈极显著正相关(P< 0.05),溶解氧与生物量呈极显著负相关(P< 0.01),透明度与细胞密度呈极显著负相关(P< 0.01)(表3)。
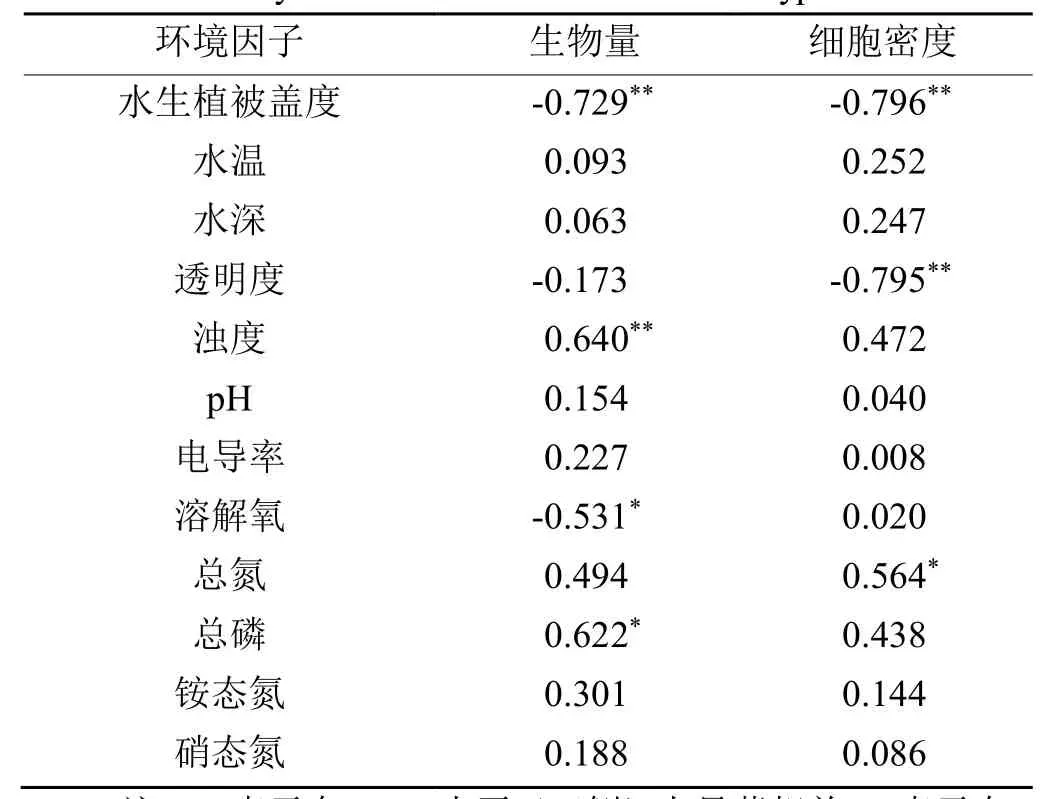
表3 4 种典型生境的浮游植物生物量、细胞密度与环境因子的Pearson 相关性分析Table 3 Pearson correlation analysis of phytoplankton biomass, cell density and environmental factors in four typical habitats
2.6.2 RDA 分析 选取13 个全年优势种的生物量与环境因子进行RDA 分析,通过RDA 前选和蒙特卡罗置换检验出水温(T)、水生植被盖度(MC)、透明度(SD)、浊度(TUR)、电导率(COND)、水深(WL)、氨氮(NH4+-N)、硝氮(NO3--N)、TP、叶绿素a(Chla)共10 个环境因子。由表4 和图6可知,水生植被盖度、水温、透明度、浊度、总磷、氨氮等与浮游植物群落结构密切相关。
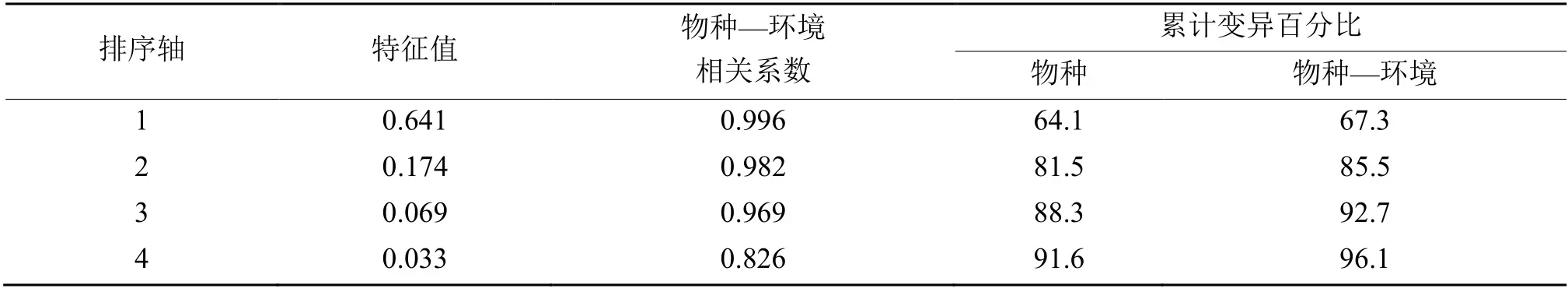
表4 4 种典型生境的浮游植物生物量与环境因子的RDA 分析Table 4 RDA analysis of phytoplankton biomass and environmental factors in four typical habitats
物种8、9、10 和11、12 与水生植被盖度和水温呈正相关,物种2、3 和4 与透明度和水深呈正相关,物种1 和13 与总磷、氨氮电导率呈正相关,物种5、6 与浊度呈正相关(图 6)。由此可知,影响4 种生境浮游植物群落结构的主要环境因子为水生植被盖度、透明度、浊度、总磷和氨氮。
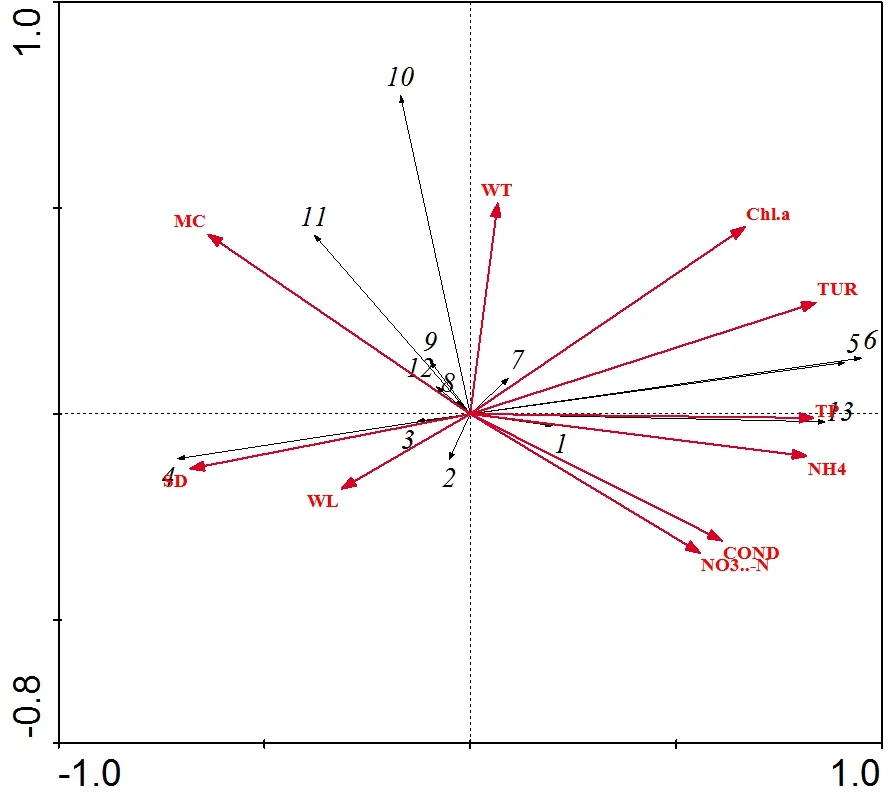
图6 4 种典型生境浮游植物生物量与环境因子RDA 分析Figure 6 RDA analysis of phytoplankton biomass and environmental factors in four typical habitats
3 讨论与结论
3.1 水生植被对浮游植物的影响
由于不同水生植被的器官构架和消长茎叶生命周期等生物学性状各异,必然会形成不同的水体生境[30]。不同水生植被为浮游植物提供了多样化的生境。在4 种不同的生境中,浮游植物群落的种类组成、生物量及优势种等均产生了较大差异,其中自然湖泊生境中,浮游植物现存量较低,但生物多样性最高,优势种类主要出现在硅藻门;沉水植被生境对浮游植物的生长抑制作用较强,小幅度提升了浮游植物群落结构的复杂性和生物多样性,绿藻门物种占优势;挺水植被生境的浮游植物群落的物种数及生物多样性指数略低于沉水植被生境,但生物量却更高,优势种类主要分布在硅藻门;人工养鱼塘生境中浮游植物的物种数及生物多样性指数均处于较低水平,但其生物量却最高,优势种类以蓝藻门为主。
许多研究表明,在水生植被存在时,浮游植物的细胞密度和生物量比不存在时要低,而物种多样性更高[15,31]。在4 种不同的典型生境中,浮游植物的细胞密度和生物量均在无水生植被的人工养鱼塘生境中出现最大值;研究中还发现在武昌湖圩口内的挺水植被恢复示范工程区的物种数为144 种,显著高于面积相同且相邻的无水生植被恢复的人工养鱼塘生境中的89 种。本研究中4 种典型生境水生植被盖度与浮游植物的生物量及细胞密度之间呈显著负相关(P< 0.05),表明水生植被能够抑制浮游植物过度生长,尤其对蓝藻门物种抑制作用最为明显。原因可能为:(1)水生植被特别是沉水植物由于特殊的叶形态结构,可以直接吸收水体中的营养盐,降低了水体中的营养盐含量,从而抑制浮游植物的过度生长[7],在4 种典型生境中沉水植被生境总氮、总磷含量最低,浮游植物的生物量也最低。(2)水生植被能通过稳定底层基质来减少水体中的营养负荷,从而减少沉积物中营养物质的释放,提高水体透明度[8]。本研究相关性分析表明,水体的透明度、浊度均对浮游植物的现存量呈显著负相关关系。(3)水生植被的化感作用也会直接抑制浮游植物的过度生长[11]。例如,沉水植被物种苦草、金鱼藻和狐尾藻等对浮游植物的强烈抑制[10];挺水植被莲、菰等对浮游植物也具有化感作用,且化感作用与其结构组织相关,挺水植物具有较高含量的木质化和纤维素组织,其有机渗出物富含腐殖质,可影响浮游植物酶的催化活性[12],沉水植被生境和挺水植被生境中浮游植物的生长均受到一定的抑制作用。(4)水生植被可以为大型浮游动物提供鱼类捕食的避难所,然后通过提高大型浮游动物的存活率,自上而下调节浮游植物的群落结构,导致浮游植物的细胞密度和生物量降低[32]。(5)水生植被与浮游植物同为水生生态系统的生产者,还会通过竞争光和营养盐来抑制浮游植物的过度增长[30]。
3.2 围网撤除对浮游植物的影响
对比吴芳仪等[33]于 2014 年围网养殖期间对升金湖浮游植物进行采样调查发现,升金湖浮游植物 年 平 均 生 物 量 由(10.72±8.89)mg·L-1降 至(7.03±3.15)mg·L-1,蓝藻门细胞密度由105. 51×105cells·L-1降为89.91×105cells·L-1,物种多样性指数由原来的5.21 增加至5.32。韩祥珍等[24]探讨了围网养殖对水生植被和沉积物再悬浮的影响,结果表明围网养殖破坏了水生植物资源,使沉积物再悬浮显著增强,促进了磷的释放,相比水生植被恢复区,在围网养殖区水生植被生物量显著降低,进而对浮游植物生物量产生影响。在围网撤除前,升金湖水生植被退化严重,尤其是沉水植被几乎消失,同时受渔网作业的影响,底泥扰动加速养分释放,船舶每天过湖也使沉积物不稳定,并促进其释放速度。然而,2018 年初渔业养殖围网撤除后水生植被快速恢复并发挥其生态作用,有效降低底泥搅动的影响,防止泥沙流失和沉积物再悬浮,促进泥沙淤积沉淀,降低营养物质的释放效果,并吸收水体中的氮、磷等营养物质,有效减少了湖泊水体中的限制性营养物质含量,使2018 年升金湖浮游植物年平均生物量降低。围网养殖对水质的污染还来自投放的饵料、肥料、药剂等几个方面[34]。研究表明,围网养殖对水环境的影响中,未食饵料的影响很大[35],投喂的饵料只有25%~35% 用于增加鱼类体重,65%~75%残留于养殖水域环境中,造成水质污染[36]。藏常娟等[37]在研究投饵养鱼对潘家口水库围隔中浮游植物及水质的影响时发现饵料投喂可显著促进浮游植物的生长。在本研究中,围网撤除后,残存饵料对浮游植物生长的促进作用逐渐减小,使浮游植物生物量和细胞密度显著降低。
3.3 水系连通对浮游植物的影响
水系连通是指湖泊及其他湿地圩口等水系的连通状况,反映水流的连续性和水系的连通性[38]。水文连通性对湖泊水文水动力条件和水质方面的影响,最终都会在生境格局、生物群落结构、生物丰度和生物多样性等方面表现出来[25]。本研究中自然湖泊生境的升金湖、武昌湖属通江湖泊,与自然河流和长江水系具有很好的连通性,沉水植被生境和挺水植被生境位于大型圩口,通过闸门与自然湖泊相连,而人工养鱼塘生境为封闭的小水体,水系不连通。在4 种典型生境中,自然湖泊生境浮游植物种类最多达233 种,其次是沉水植被生境和挺水植被生境,分别是162 种和154 种,物种数最少的是人工养鱼塘生境,仅89 种;4 种典型生境中浮游植物生物量和细胞密度均在水系不连通的人工养鱼塘生境出现最大值。水系连通主要通过改变浮游植物的生境,如悬浮物含量、水质指标、底层沉积物等理化指标,水位、水深、流速等水文条件,促进水生植被繁殖体扩散并改变水生植被格局,影响浮游植物定居、迁移扩散、繁殖行为等来改变其群落结构以及生物多样性[39]。

