BMSCs-Exosomes 携带miR-17-92 通过PTEN/PI3K/AKT/mTOR 通路促进缺氧后神经元轴突生长的机制研究
刘璐,郭玉莹,杨惠林,徐士欣*
(1.天津市滨海新区中医医院(暨天津中医药大学第四附属医院),天津 300451;2.天津中医药大学第一附属医院,天津 300112;3.周口市第二人民医院,河南 周口 466000)
0 引言
中风是世界范围内造成死亡和长期残疾的主要原因之一,其中缺血性脑卒中约80%[1-2]。组织纤溶酶原激活剂 (tPA)治疗中风的最佳时间窗为3-4.5h,只有少部分患者从中受益,同时因其增加了脑出血的风险,临床尚未广泛使用。脑特定区域短暂或永久的缺血和缺氧会导致神经元凋亡和死亡,导致局部脑损伤和功能缺陷。针对中风后神经损伤修复,目前临床仍然缺乏安全、高效的治疗方法。
间充质干细胞(MSCs)已成为改善中风恢复的重要途径[3]。研究表明,从骨髓和脂肪组织中获得的骨髓间充质干细胞(BMSCs)可促进大鼠脑卒中模型的功能恢复和神经再生[4-5]。干细胞主要通过旁分泌的功能发挥治疗作用,其中外泌体是细胞发挥旁分泌作用的关键载体[6]。外泌体具有穿过血脑屏障[7],低免疫原性[8],半衰期长等优点[9],可将囊泡内物质转移到靶细胞,从而介导神经细胞间信息交流和调节生命活动[10]。研究表明[11-13],MSCs生成的外泌体可以通过促进神经重塑以提高中风的恢复过程。
miR-17-92 基因簇是脊椎动物的一个保守miRNA基因簇,在细胞增殖、分化、凋亡及发育等多种生物学过程中起重要的调控作用。在小鼠大脑皮层发育过程中,miR17-92 簇通过抑制下游靶基因 PTEN 的表达可调节皮层中神经干细胞增殖及分化形成中间祖细胞[14]。PTEN 是具有双特异磷酸酶活性的重要抑癌基因,通过其脂质磷酸酶活性作用于下游 PI3K的下游靶分子 PIP3,从而使 PIP3 脱磷酸化生成 PIP2 阻断 AKT 及其下游激酶的活性。本研究转染miR17-92的骨髓间充质干细胞外泌体与缺氧损伤的神经元共培养,探讨其是否可以负调控PTEN表达促进轴突生长及其可能的作用机制。
1 材料和方法
1.1 材料
1.1.1 实验动物及细胞
健康4 周雄性清洁级S D 大鼠,体重在140~160 g;健康雌性SD大鼠,孕16d,以上均购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004;原代皮质神经元,骨髓间充质干细胞(Bone Mesenchymal stem cells,BMSCs)。
1.1.2 主要试剂
B27、Neurobasal-A 神经元培养基(Gibco公司),胎牛血清(以色列 BI 公司),免疫染色封闭液(上海碧云天科技有限公司,批号:P0260),MAP2、DAPI、DMEM基础培养基(上海碧云天科技有限公司),0.25%胰蛋白酶、多聚赖氨酸(北京索莱宝科技有限公司),Tublin(北京博奥森科技有限公司),青霉素及链霉素混合液美国,D-Hanks平衡盐溶液(北京索莱宝科技有限公司),CD90.1-PE(美天旎,批号:130-112-873)、CD29-APC(美天旎,批号:130-119-166)、CD31-VioBright FITC(美天旎,批号:130-105-938)、CD45-PerCP-Vio700(美天旎,批号:130-107-846)、REA control-PE(美天旎,批号:130-113-450)、REA control-APC(美天旎,批号:130-113-446)、REA control-VioBright FITC(美天旎,批号:130-113-455)、REA-control-PerCP-Vio700(美天旎,批号:130-113-453)、mimics(苏州吉玛基因股份有限公司)、PTEN(美国abcam公司,批号:ab32199)、PI3K(美国abcam公司,批号:ab86714)、p-PI3K(美国abcam公司,批号:ab182651)、AKT(美国abcam公司,批号:ab8805)、p-AKT(美国abcam公司,批号:ab38449、mTOR(美国abcam公司,批号:20657-1AP)、p-mTOR(美国abcam公司,批号:#5336)。
1.1.3 主要仪器
倒置荧光相差显微镜(DM3000,德国LEICA 公司);电子天平(AE100,瑞士METTLER TOLEDO公司);二氧化碳恒温孵育箱(Hera cell 150i型,德国Thermo公司);超净工作台(DL-CJ-2NDI型,北京东联哈尔仪器制造有限公司);多功能酶标仪(ThermoVarioskan™ LUX,德国Thermo公司);低速自动平衡离心机(LDZ5-2,北京医用离心机厂)。
1.2 方法
1.2.1 BMSCs培养及鉴定
脱颈法处死雄性SD大鼠,无菌操作分离大鼠股骨和后肢胫骨。用1mL注射器吸取适量DMEM培养基,反复冲洗骨髓腔。收集冲洗液于无菌培养皿中,使用200目筛网过滤冲洗液,将过滤后的细胞悬液收集于15mL无菌离心管,在4℃条件下以1000r/min离心10min。弃去上清,用含有10%胎牛血清和1%双抗的完全培养基重悬沉淀的细胞,按2×106个细胞接种到25cm²培养瓶中置于37℃、5%CO2的细胞培养箱中培养至第 3 代。细胞离心后弃去上清,留取细胞沉淀,加入800ulPBS重悬细胞,流式管各加200μL单细胞悬液,分别滴加荧光标记抗体CD90.1-PE,CD29-APC,CD31-VioBright FITC,CD45-PerCP-Vio700各10μL,室温下避光孵育30min,加入10g/L多聚甲醛(500 μL)重悬固定,在流式细胞仪上检测阳性细胞构成比,根据多数文献报道表现为 CD90阳性而同时具备CD31阴性的细胞为骨髓间充质干细胞。
1.2.2 原代皮质神经元的培养及鉴定
颈椎脱位法处死孕鼠,迅速解剖孕鼠腹部取出胎鼠,分离脑组织,将皮质剪碎放入盛有0.25%胰蛋白酶消化培养皿中至组织块拉丝成团。加入含10%FBS的DMEM 培养基终止消化,使用200目筛网过滤细胞悬液,将滤液在4℃条件下以1000r/min离心5min。弃去上清液,加入含10%FBS的DMEM培养基吹打均匀细胞沉淀,以2×105个/mL接种在提前包被过L-多聚赖氨酸的24孔板。置于37℃,5%CO2的恒温培养箱中培养4h后,换为Neurobasal-A(含2%B27)无血清培养基,每隔48 h半量换液。于第7d的神经元加入4%多聚甲醛,固定细胞30 min,使用PBS清洗3次。加入免疫染色封闭液,于4℃冰箱中避光静置30min,使用PBS清洗3遍。加入MAP2(1:100),Tublin3(1:400),用PBS稀释两种抗体混匀,100μL/孔,置于4℃冰箱中避光过夜。加入Ⅱ抗,100μL/孔,置于4℃冰箱中,避光1h。吸弃Ⅱ抗,每孔加入500μLPBS,清洗3次。加入DAPI(100ng/mL)对细胞核进行染色,用甘油对细胞爬片进行封片,置于荧光显微镜下,随机取6个视野,200倍镜下观察并拍照分析。
1.2.3 外泌体提取
在4℃的环境下,将收集的培养上清300g离心10min,2000g离心20min,然后弃沉淀,去除细胞,将上清转移至新的50mL离心管中。继续在4 ℃条件下,10 000g离心30min,弃沉淀,去除亚细胞成分,将上清转入超速离心管中。4℃条件下,100 000g离心60min,弃上清,所得沉淀即为exosome。使用PBS溶液重新悬浮沉淀物,混匀后再以100000g离心60min,弃上清液,沉淀物即为提纯的exosome,将沉淀用400μLPBS重悬,装入Ep管内,4℃保存1-7d,或者用含10%DMSO的PBS重悬置于-80℃冰箱内最多保存6个月。
1.2.4 BMSCs 细胞转染及分组
分别将miR-NCmimics、mi R17-92 mimics、anti-miR-NCmimics与anti-miR17-92mimics转染至 BMSCs 中,具体步骤参照转染试剂 Lipofectamine®2000 转染试剂说明书操作。
1.2.5 qRT-PCR检测各组神经元细胞miR-17-92簇与PTEN靶向关系
将胎鼠皮质神经元随机为正常组、缺氧模型组(缺氧2h)、缺氧模型组+miR-17-92簇过表达外泌体(共培养48h)、缺氧模型组+miR-17-92对照外泌体、缺氧模型组+miR-17-92簇inhibitor外泌体、缺氧模型组+miR-17-92inhibitor对照外泌体组。按照 TRIZOL 试剂盒说明书提取各组细胞总 RNA。Superscript Ⅲ逆转录酶用于合成cDNA模板。用SYBR ExScriptqPCR试剂盒在以下条件下进行:95℃预变性10min,95℃变性10s,56℃退火30s,在72℃延伸32s,进行40个循环,95度 10s,65度60s,97度1s,1个循环Cooling37度 30 s,1个循环。依据2-ΔΔCt法计算各样本相对表达量。RT-qPCR引物序列如下:

1.2.6 Western blotting 检测蛋白表达
取各组胎鼠皮质神经元,RIPA 裂解液提取总蛋白,采用Brad-ford法检测蛋白浓度,10%SDS-PAGE 分离蛋白,半干法转移至P V DF膜,5%脱脂奶粉封闭2 h,加入Cleavedcaspase-3(1∶1 000)、Bax(1∶1 000)一抗与β-actin(1∶3000) 抗体稀释液在4°C条件下孵育24h,室温条件下加入二抗稀释液(1:5000)孵育2h,滴加ECL显影液,将印迹膜置于凝胶成像系统中曝光显影,采用 ImageJ软件分析各条带灰度值。以待测蛋白与内参照β-actin的灰度值比值作为蛋白的相对表达量,灰度值越高,蛋白含量越高。
2 结果
2.1 BMSC培养、特征鉴定及BMSC-exo提取、鉴定
2.1.1 BMSC培养、特征鉴定
将全骨髓细胞液悬液接种于培养瓶中,24h可见部分原代细胞逐渐贴壁。BMSCs核居中,胞体较小,形状为均和的圆形或者梭形。BMSCs培养10d,细胞基本融合,可进行传代。BMSCs培养至第3代,可见细胞呈长梭形,细胞形态较一致。流式细胞仪结果显示BMSCs的CD90阳性表达率为98.8%,CD29阳性表达率为 96.7%,因此 CD90和CD29呈阳性表达。而CD31阳性表达率为 0.97%,CD45阳性表达率为1.37%,因此CD31和CD45呈阴性达。说明本试验提取的BMSCs纯度较高,可用于后续实验。见图1。
2.1.2 BMSC-exo鉴定
电子显微镜下exsomes双层脂膜结构,WB检测外泌体阳性标记物-CD63、TSG101,见图2。
2.2 神经元的培养、鉴定
原代皮质神经元接种4h后贴壁良好,细胞呈圆形,表面光滑,杂细胞较多;神经元培养24h后逐渐长出轴突与树突;神经元培养3d,可见轴突、树突相互交织形成神经网络。经染色发现神经元细胞形态完整,染色质均匀。微管相关蛋2(micotubule associated protein2,MAP2)集中表达在在神经元的胞体和树突上,Tubline-1主要在细胞轴突上高表达,根据多数文献报道二者是鉴定神经元细胞的重要标志,见图3。
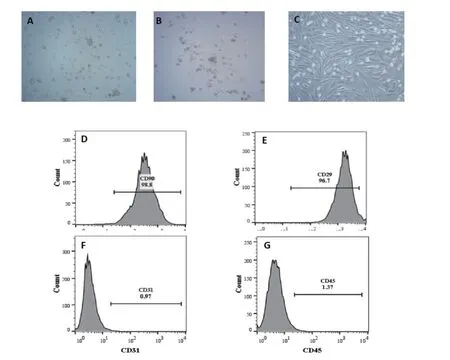
图1 骨髓间充质干细胞培养及鉴定
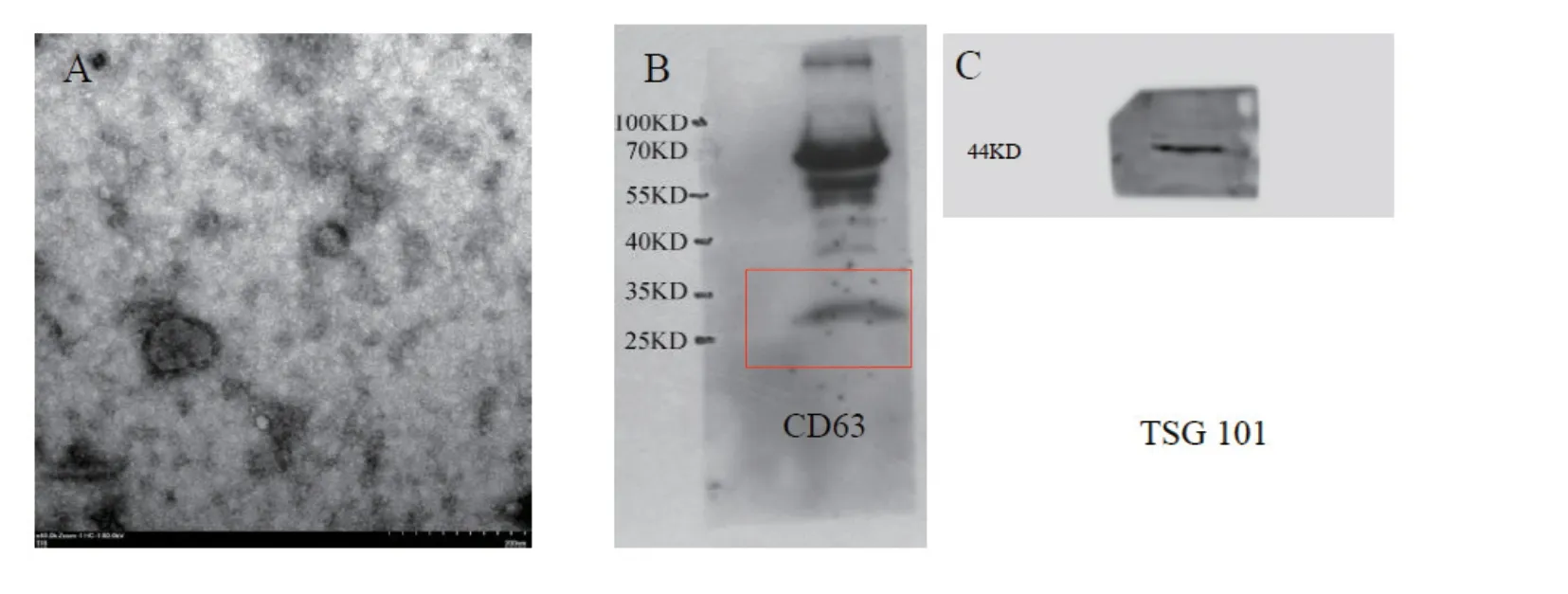
图2 外泌体鉴定
2.3 RT-PCR检测miR17-92簇转染至BMSC的水平表达
将miR-NC、miR17-92 mimics、antimiR-NC与anti-miR17-92转染至 BMSCs,与miR-NC组比较 miR17-5p,miR18a-5p,miR19a-3p,miR19b-3p,miR20a-5p,miR92a-3p基因高表达,差异有统计学意义(P <0.05),其中miR17-92 mimics组高表达最显著,见图4。

图3 原代皮质神经元形态学观察及鉴定

图4 RT-PCR 法检测miR-17-92 转染至BMSCs 情况(*P<0.05,**P<0.01)
2.4 RT-PCR法检测各组神经元miR-17-92簇的变化
各组 BMSCs-exosomes 干预神经元细胞后,与正常组比较,miR-17-92 簇在缺氧+mimics control exosomes组及缺氧+ASONC-e xosomes 组差异无统计学意义 (P >0.05),其余组差异有统计学意义(P <0.05),其中缺氧+miR-17-92 cluster exosome组表达最高,见图5。
2.5 检测各组神经元中PTEN(mRNA,Proten)表达
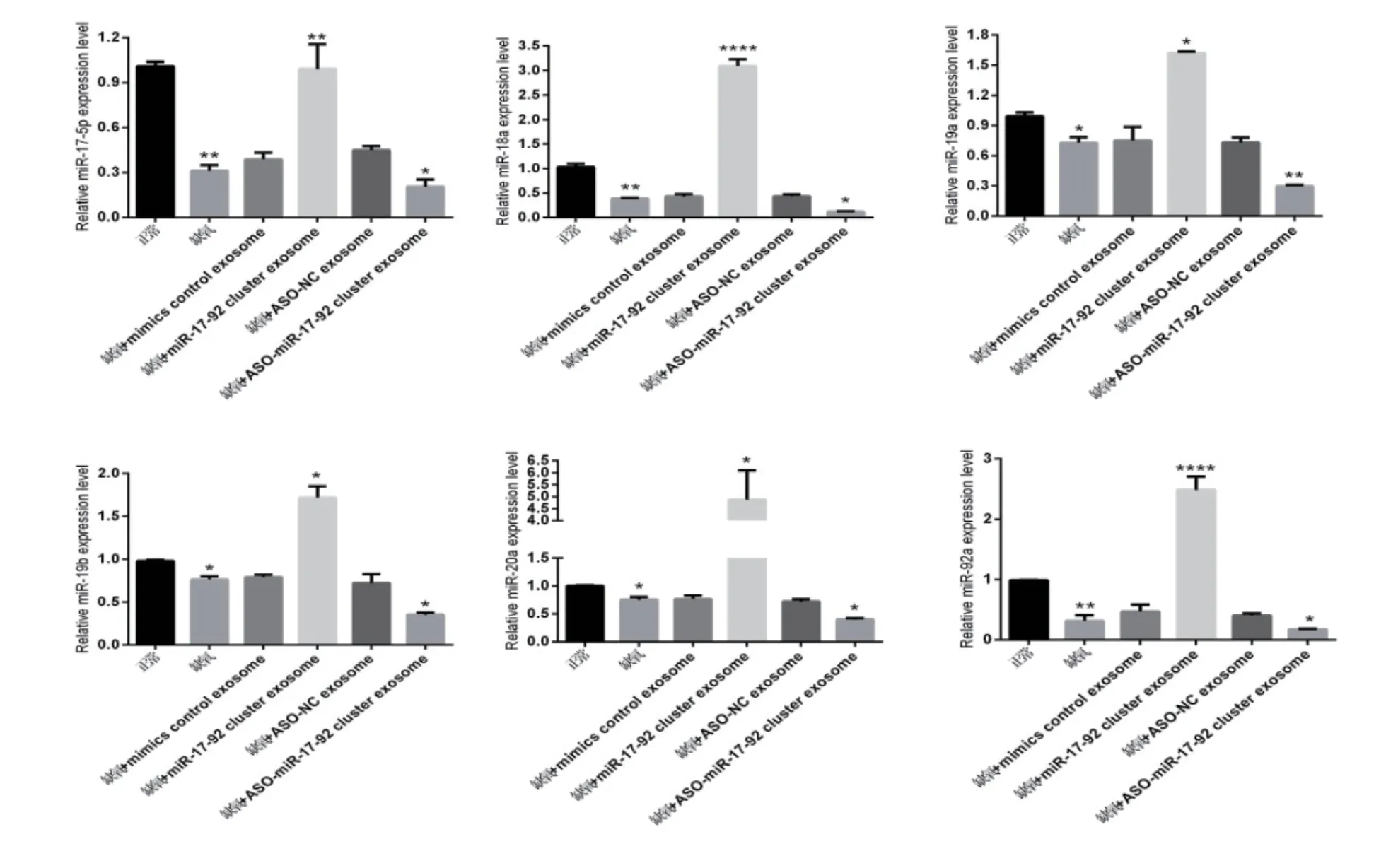
图5 RT-PCR 法检测各组神经元miR-17-92 簇的变化(*P<0.05,**P<0.01)
各组BMSCs-exosomes干预神经元细胞后,RT-PCR法检测各组神经元PTEN表达,与缺氧组对比,缺氧+miR17-92 cluster exosome组PTEN值最低(P <0.01),缺氧+ASO miR17-92exosomes组表达最高(P <0.01);WB法测各组神经元PTEN表达,与缺氧组对比,缺氧+miR17-92 cluster exosome组PTEN值最低(P <0.01),缺氧+ASO miR17-92exosomes组表达最高(P <0.01),说明 miR-17-92上调表达,PTEN下调表达,二者呈负相关,见图6。
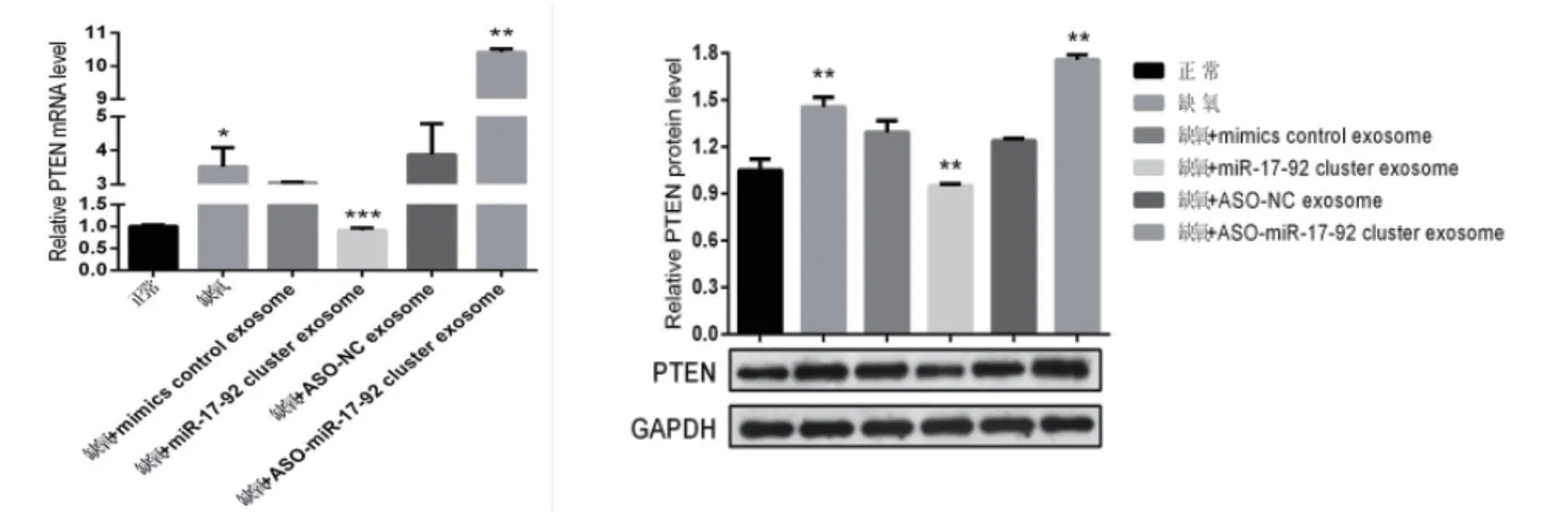
图6 检测各组神经元中PTEN(mRNA,Proten)表达
2.6 WB法检测各组神经元PI3K/AKT/mTOR的变化
与缺氧组对比,p-PI3K、p-AKT、p-mTOR在缺氧+miR17-92 cluster exosome组蛋白表达量最高(P <0.01),缺氧+ASO miR17-92 cluster exosome组蛋白表达最低(P <0.01),提示miR17-92可通过靶向PTEN调控PI3K/AKT/mTOR从而促进神经元轴突生长,见图7。
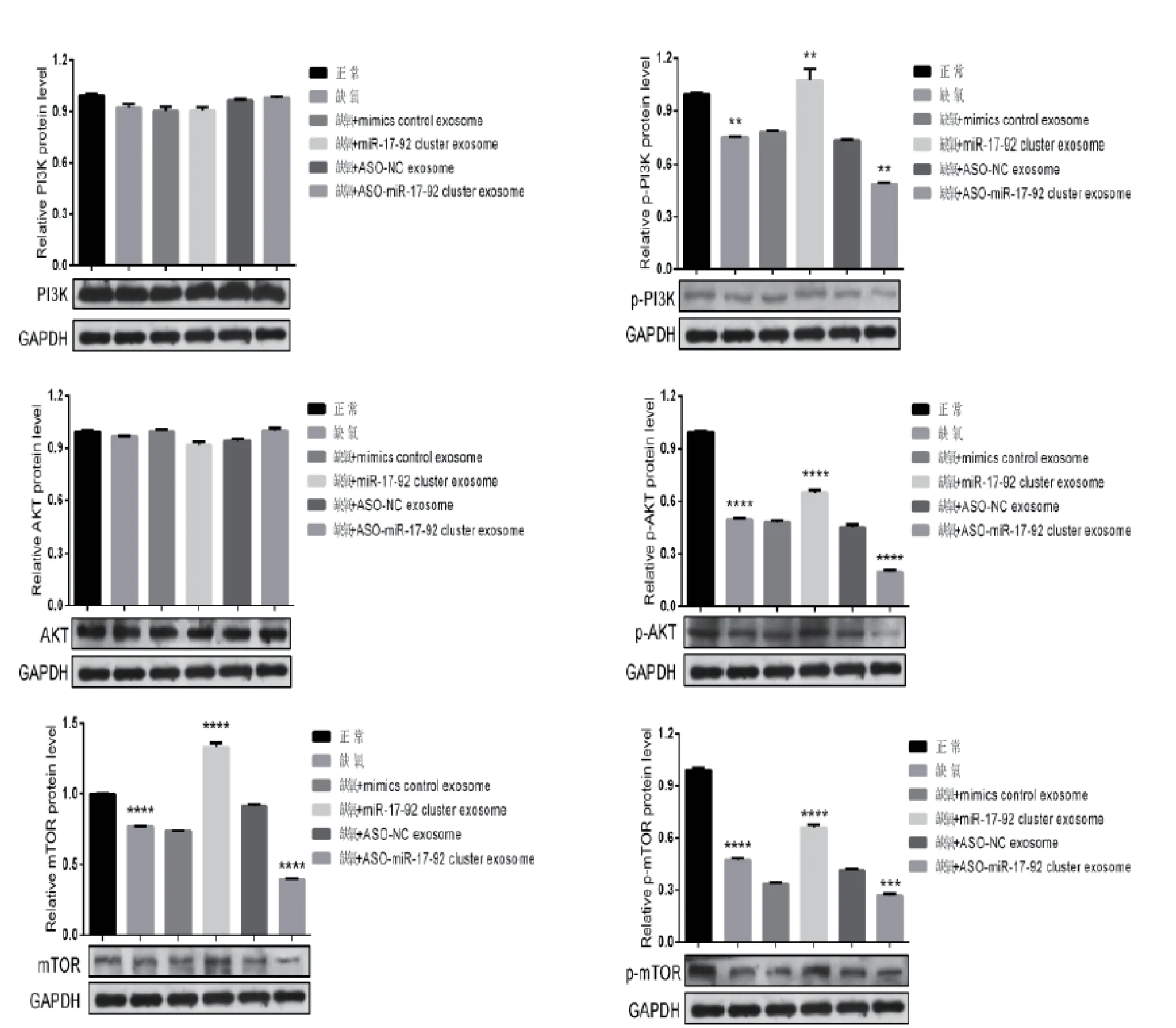
图7 WB 法检测各组神经元PTEN/PI3K/AKT/mTOR 的变化(*P<0.05,**P<0.01)
3 讨论
缺血性中风具有高死亡率和高致残率,目前的临床治疗方案仍不满意。缺血性脑卒中后的神经可塑性包括神经再生、突触发生、少突发育和轴突生长等,其主要病理事件是血管阻塞引起的脑缺血及随后出现的脑组织神经元损伤[15],因此神经元修复对脑卒中后期功能的恢复有着重要意义[16-17]。
研究表明,MSCs-exosomes介导了细胞间通讯,从而调节了脑组织损伤后的内源性修复[18-21]。miR17-92基因簇对于神经细胞的增殖和分化具有调控作用。永久梗塞的 MCAO模型小鼠室管膜下区(Subventricular zone,SVZ)神经前体细胞中 miR17-92 簇水平显著升高,提示miR17-92簇参与了神经前体细胞增殖的调节[22]。本研究表明,在BMSCs 中转染miR17-92mimics,使其分泌的exosomes过表达 miR17-92,可显著抑制 PTEN 表达。磷酸酶和张力蛋白同源物(PTEN)是癌症中最常见的突变或缺失的基因,存在于染色体10q23-24区域。PTEN 在神经系统中也有广泛表达。研究发现通过敲除 PTEN 能极大促进损伤视神经的轴突再生[23]。PTEN 对调节细胞增殖分化的经典 PI3K/Akt途径具有负调控作用[24]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是 PI3K/Akt信号通路下游的关键分子,可整合细胞内外信号,包括来自生长因子、营养、能量水平及细胞应激的信号,以调节细胞生长、存活、凋亡、自噬以及细胞周期进程、血管生成、代谢等过程。此外,mTOR是一种重要的神经元生长调节剂,包括轴突生长和引导和树突生长[25]。本研究证实,转染miR17-92的骨髓间充质干细胞外泌体与缺氧损伤的神经元共培养,可以通过负调控PTEN表达水平;当PTEN蛋白高表达时,p-PI3K、p-AKT、p-mTOR蛋白低表达,进而激活PI3K/AKT/mTOR这一轴突再生的关键通路。

