长链非编码RNA ANO1-AS1对食管鳞癌细胞增殖及凋亡的影响
邵生辉,张 健,彭雅琼,向 辉,赵 敏,谢元茂,郑 勇,陈卫刚
目前,我国仍是食管癌发病率最高的国家[1]。食管鳞癌(esophageal squamous cell carcinoma,ESCC)是食管癌最常见的组织学亚型[2]。由于ESCC起病晚,缺乏早期疾病标志物,通常被诊断已为晚期,其总的5年生存率仅有20%左右[3]。研究[4-5]显示,食管癌的发生发展与基因的表达失衡密切相关,因此,探寻与其相关的分子标志物,对食管癌的防治具有一定意义。长链非编码RNA(long non-coding RNA,LncRNA)因其转录本长度超过200个核苷酸且不编码蛋白质而得名[6]。近年来,大量LncRNA被发现并证实参与肿瘤的多项生理和病理过程[7]。课题组前期通过基因芯片技术,发现食管鳞癌组织中有大量LncRNAs存在异常表达,其中钙离子激活氯离子通道蛋白1反义RNA1 (anoctamin 1 antisense RNA-1,ANO1-AS1)在ESCC组织中表达上调[8]。目前ANO1-AS1在食管癌中的作用鲜有报道,为探究该基因在食管癌中所发挥的功能,该研究通过转染沉默慢病毒下调食管癌细胞TE-1和EC109中ANO1-AS1的表达,观察食管癌细胞增殖及凋亡等生物学功能的变化并探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1细胞株 人食管鳞状细胞癌细胞株(TE-1、EC109)由石河子大学医学院新疆地方与民族高发病重点实验室留存。
1.1.2主要试剂 沉默慢病毒由上海吉玛制药技术有限公司制备;胎牛血清购自以色列 BI公司;高糖DMEM培养基购自美国 Gibco公司;双抗及胰蛋白酶购自美国 Hyclone公司;二甲基亚砜(DMSO)购自上海生物工程技术有限公司;TRIzol试剂购自美国Invitrogen公司;反转录试剂盒购自美国Thermo公司;引物均购自上海生工生物工程股份有限公司;qRT-PCR试剂盒购自德国QIAGEN公司;CCK-8试剂盒购自日本东仁公司;Bcl-2和Bax兔抗人单克隆抗体购自英国Abcam公司;其他兔抗人多克隆抗体购自美国CST公司;小鼠抗人β-actin抗体、山羊抗兔IgG二抗、山羊抗小鼠IgG二抗购自北京中杉金桥生物技术有限公司。
1.1.3主要仪器 荧光倒置显微镜购自日本Olympus公司;酶联免疫检测仪、垂直电泳槽、电泳仪、电转印仪均购自美国Bio-Rad公司;全自动化学发光成像仪购自上海天能科技有限公司;梯度PCR仪器购自日本Takara公司;实时荧光定量PCR仪购自瑞士Roche公司。
1.2 细胞培养与转染筛选细胞用含10%胎牛血清和1%青链霉素混合液的高糖DMEM培养基在37 ℃、5%CO2、湿度95%的培养箱内进行培养。待细胞融合度达到80%~90%时进行传代、冻存或功能实验。细胞转染所用沉默ANO1-AS1慢病毒载体和空载体浓缩液由上海吉玛制药技术有限公司制备完成。其中sh-ANO1-AS1序列为5′-GGAACCGGAATCAATCATTAT-3′,sh-NC序列为5′- TTCTCCGAACGTGTCACGT-3′。参照吉玛基因慢病毒使用手册进行慢病毒转染,嘌呤霉素筛选后传代保存稳转株并进行下一步实验。分组情况:sh-ANO1-AS1(实验组)即转染沉默ANO1-AS1慢病毒载体;sh-NC(阴性对照组)即转染沉默慢病毒空载体;Blank(空白对照组)即未转染慢病毒。
1.3 总RNA提取及qRT-PCR用TRIzol试剂裂解各组细胞,提取细胞总RNA,参照反转录试剂盒说明书合成cDNA,按SYBR Green PCR试剂盒说明进行qRT-PCR检测。引物序列见表1,β-actin为内参。利用2-ΔΔCt方法计算相对表达量。

表1 引物序列
1.4 CCK-8法检测细胞增殖能力按分组消化收集细胞,计数按分组以2 000个/孔接种于96孔板,每组设置5个复孔。培养0、24、48、72、96 h时,在每孔中加入 10 μl CCK-8试剂,继续培养箱孵育2 h,用酶联免疫检测仪测量各孔450 nm处的吸光度(optical density, OD)值。
1.5 平板克隆形成实验按分组收集细胞并计数,接种于6孔板中(300个/孔),每2~3 d换液,培养12~14 d。当出现肉眼可见的克隆时,使用PBS洗涤细胞2~3次,用4%多聚甲醛固定45 min,结晶紫染色20 min,大于50个细胞为1个克隆,显微镜下计数克隆形成数并计算克隆形成率。
1.6 Western blot收集细胞并提取细胞总蛋白,加入上样缓冲液混匀,100 ℃煮10 min变性,取8~10 μl上样,根据目的蛋白制备适宜浓度SDS-PAGE胶进行电泳,转至PVDF膜上,5% BSA室温封闭3 h,加入一抗(1 ∶1 000稀释),4 ℃摇床过夜,洗膜后加入二抗(1 ∶20 000稀释),室温孵育1 h。洗膜后加入化学发光液使用化学发光成像仪进行曝光。β-actin蛋白条带作为内参对照。采用 Image J 软件测算各蛋白条带灰度值。
1.7 LinkedOmics数据库LinkedOmics数据库(www.linkedomics.org)是利用TCGA数据库进行在线分析的工具。具体步骤:① 肿瘤类型:TCGA_ESCA;② 数据类型:RNAseq;③ 目的基因名:ANO1;④ 靶标数据类型:RNAseq;⑤ 统计方法:Pearson相关性分析,即可获取ANO1正相关表达基因集,选择GSEA富集分析工具,对ANO1正相关基因进行KEGG pathway富集,FDR值小于0.05的纳入条件。

2 结果
2.1 转染沉默慢病毒后ANO1-AS1的表达降低在食管癌EC109和TE-1细胞株中转染ANO1-AS1沉默慢病毒后,通过qRT-PCR验证各组沉默效率。结果如图1所示,TE-1和EC109两组细胞中sh-ANO1-AS1组ANO1-AS1表达水平均低于sh-NC组及Blank组,差异有统计学意义(F=109.957,P<0.001;F=94.943,P<0.001)。
2.2 沉默ANO1-AS1可抑制食管癌细胞增殖和克隆形成能力CCK-8实验结果显示,转染沉默慢病毒后,TE-1细胞系sh-ANO1-AS1组从24 h开始OD值较sh-NC组及Blank组减小,差异有统计学意义(F=149.835,P<0.001);EC109细胞系sh-ANO1-AS1组OD值从24 h开始低于sh-NC组及Blank组,差异有统计学意义(F=26.584,P=0.001),见图2A、2B。
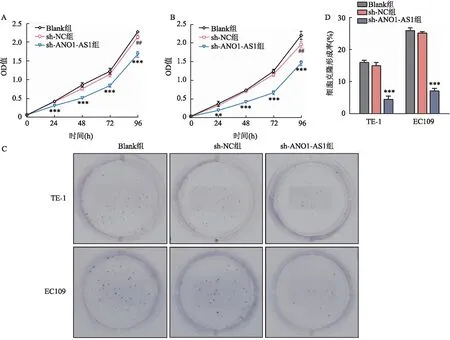
图2 敲低ANO1-AS1对食管癌细胞TE-1和EC109增殖的影响A:CCK-8法检测TE-1细胞系各组细胞增殖情况;B:CCK-8法检测EC109细胞系各组细胞增殖情况;C、D:TE-1及EC109两细胞系各组细胞克隆形成情况;与sh-NC组比较:**P<0.01,***P<0.001;与Blank组比较:#P<0.05,##P<0.01
平板克隆形成实验结果显示,沉默ANO1-AS1后,TE-1细胞系sh-ANO1-AS1组克隆形成率低于sh-NC组和Blank组,差异有统计学意义(F=211.858,P<0.001);同样,EC109细胞系sh-ANO1-AS1组克隆形成率低于sh-NC组及Blank组,差异有统计学意义(F=979.284,P<0.001),见图2C、2D。
2.3 敲低ANO1-AS1表达对PCNA及P53蛋白表达的影响Western blot检测沉默ANO1-AS1后,PCNA和P53蛋白的表达情况,结果显示,与sh-NC组及Blank组相比,TE-1和EC109两细胞系中sh-ANO1-AS1组PCNA的表达减少(F=241.638,P<0.001;F=500.044,P<0.001),P53的表达增加(F=141.118,P<0.001;F=205.268,P<0.001),sh-NC组及Blank组之间差异无统计学意义(P>0.05)。见图3。
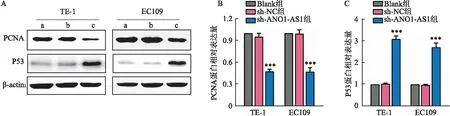
图3 下调ANO1-AS1对食管癌细胞TE-1和EC109中PCNA和P53蛋白表达的影响A:Western blot检测两细胞系各组PCNA和P53蛋白表达情况;B:PCNA蛋白相对表达量;C:P53蛋白相对表达量;a:Blank组;b:sh-NC组;c:sh-ANO1-AS1组;与sh-NC组比较:***P<0.001
2.4 下调ANO1-AS1对凋亡相关蛋白的影响Western blot检测沉默ANO1-AS1后细胞凋亡相关蛋白Bax、Bcl-2的表达变化,结果显示TE-1和EC109两细胞系中,与sh-NC组及Blank组相比,sh-ANO1-AS1组Bax表达增加,差异均有统计学意义(F=652.139,P<0.001;F=28.672,P=0.001);与sh-NC组及Blank组相比,两细胞系sh-ANO1-AS1组Bcl-2的表达均减少,差异有统计学意义(F=206.288,P<0.001;F=55.445,P<0.001),见图4。

图4 沉默ANO1-AS1对食管癌细胞TE-1和EC109凋亡相关蛋白表达的影响A:Western blot检测两细胞系各组细胞Bax和Bcl-2的表达;B:Bax蛋白相对表达量;C:Bcl-2蛋白相对表达量;a:Blank组;b:sh-NC组;c:sh-ANO1-AS1组;与sh-NC组比较:**P<0.01,***P<0.001
2.5 沉默ANO1-AS1后ANO1的表达降低qRT-PCR及Western blot结果均显示:沉默ANO1-AS1后,TE-1细胞系sh-ANO1-AS1组ANO1的mRNA及蛋白表达低于sh-NC组及Blank组,差异有统计学意义(F=55.766,P<0.001;F=1 183.685,P<0.001);同样,EC109细胞系sh-ANO1-AS1组ANO1的表达低于sh-NC组及Blank组,差异有统计学意义(F=170.199,P<0.001;F=191.339,P<0.001),见图5。

图5 沉默ANO1-AS1表达后ANO1表达降低A:qRT-PCR检测下调ANO1-AS1后TE-1和EC109细胞中ANO1 mRNA的表达;B:Western blot检测下调ANO1-AS1后TE-1和EC109细胞中ANO1蛋白的表达;C:ANO1蛋白相对表达量;a:Blank组;b:sh-NC组;c:sh-ANO1-AS1组;与sh-NC组比较:***P<0.001;与Blank组比较:#P<0.05
2.6 ANO1正相关基因及相关通路富集通过LinedOmics在线数据库,筛选到食管癌数据集中与ANO1表达正相关基因,并根据相关性由高到低进行排序并展示Pearson相关系数>0.5的基因(图6A)。通过GSEA富集分析工具,对ANO1正相关表达的基因可能调节的通路进行富集(图6B),并选择PI3K/Akt通路进行验证。
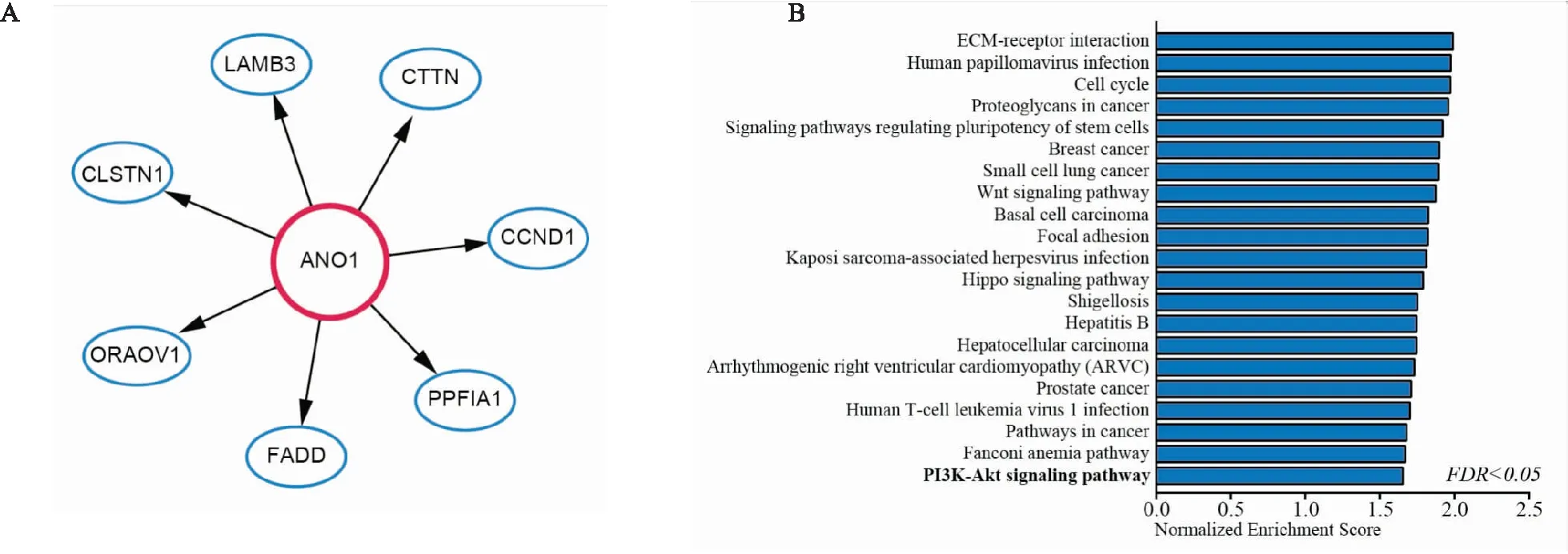
图6 LinedOmics在线数据库食管癌中ANO1正相关表达基因(A)和GSEA通路富集情况(B)
2.7 敲低ANO1-AS1可能影响PI3K/Akt通路蛋白的表达Western blot检测沉默ANO1-AS1后,PI3K/Akt通路蛋白的表达和磷酸化修饰情况,结果显示:下调ANO1-AS1后,TE-1及EC109两细胞系中均发现,与sh-NC组及Blank组相比,sh-ANO1-AS1组PI3K和Akt蛋白磷酸化水平均降低,差异有统计学意义(F=536.088,P<0.001;F=418.073,P<0.001),见图7。

图7 下调ANO1-AS1表达对PI3K/Akt通路相关蛋白表达的影响A:Western blot检测两细胞系各组细胞PI3K/Akt通路相关蛋白的表达;B:PI3K蛋白磷酸化水平(p-PI3K/PI3K);C:Akt蛋白磷酸化水平(p-Akt/Akt);a:Blank组;b:sh-NC组;c:sh-ANO1-AS1组;与sh-NC组比较:***P<0.001
3 讨论
近年来,大量研究证实,非编码RNA的异常表达与ESCC等消化道肿瘤的发生发展密切相关,并在其增殖、转移、凋亡等多种生物学过程中发挥重要作用[9-10],其中包括许多反义LncRNA[7],例如:KRüppel样因子3反义RNA 1(KLF3-AS1[11])在ESCC表达上调从而使其正义链KLF3发生激活,进而抑制食管癌细胞的迁移和侵袭。锌指蛋白667反义RNA 1 (ZNF667-AS1[12])与其正义链ZNF667在食管癌中均高表达,并抑制ESCC细胞的增殖、迁移和侵袭,ZNF667-AS1的过度表达增加了ZNF667的mRNA和蛋白表达水平。本课题组通过芯片筛选发现多个LncRNAs在ESCC中表达上调[8],其中高表达的ANO1-AS1在ESCC中发挥何种生物学功能尚无明确报道,故本研究通过体外实验进行了探究。
ANO1-AS1位于人类染色体11q13.3上,大小为722个碱基,由钙离子激活氯离子通道蛋白1 (anoctamin 1,ANO1)基因反义链转录,为ANO1的反义LncRNA。Yu et al[13]发现, ANO1在ESCC中表达上调。有研究[14]证实敲除ESCC细胞系中的ANO1可抑制细胞增殖、诱导凋亡和减少肿瘤生长。ANO1-AS1的异常表达,提示其可能在ESCC的发生发展中发挥重要作用。为了进一步探究其对ESCC细胞生物学功能的影响,本研究同时向ESCC细胞系TE-1和EC109中转染沉默ANO1-AS1慢病毒抑制其表达水平并在此基础上进行后续功能学实验。结果显示,下调ANO1-AS1后,TE-1及EC109ESCC细胞增殖能力及克隆形成能力降低。PCNA是肿瘤细胞异常增殖的标志性蛋白,可反映肿瘤细胞增殖情况;P53则为抑癌基因,其失活将导致细胞获得无限增殖能力,从而发生恶性癌变。本研究表明,沉默ANO1-AS1后,PCNA蛋白表达降低,同时抑癌基因P53蛋白表达升高,进一步证明敲除ANO1-AS1,ESCC细胞的增殖能力受到抑制。同时,下调ANO1-AS1后,ESCC细胞中促凋亡蛋白Bax表达增加,而抑凋亡蛋白Bcl-2表达降低,说明沉默ANO1-AS1可能促进食管癌细胞发生凋亡。本研究还发现,下调ANO1-AS1的表达,ANO1的mRNA和蛋白表达均降低。以上结果提示,ANO1-AS1可能发挥促癌基因作用,影响ESCC细胞的增殖和凋亡,且ANO1-AS1与ANO1存在正相关表达。
有研究[14]显示,高表达的ANO1通过激活EGF受体(EGFR)和钙调素依赖性蛋白激酶Ⅱ(CAMKⅡ),从而诱导Akt和丝裂原活化蛋白激酶1(MAPK)信号的激活,促进ESCC的发生。为进一步探究ANO1-AS1在ESCC细胞中发挥功能的可能机制,本研究通过对食管癌中与ANO1正相关表达的基因进行通路富集,结果提示可能影响PI3K/Akt信号通路。活化的PI3K通过刺激其下游因子Akt来调节细胞的存活、增殖及代谢等过程。通过体内外实验证实,该通路的PI3K、Akt及mTOR等关键分子在ESCC中均有高表达和激活[15]。本研究显示,沉默ANO1-AS1后,PI3K及Akt蛋白磷酸水平下降,提示PI3K/Akt信号通路活性降低。以上结果提示抑制ANO1-AS1表达可能影响PI3K/Akt通路的活化进而降低ESCC细胞增殖能力,促进其发生凋亡。结合以上结果,推测其作用机制有以下可能:① ANO1-AS1本身具有直接调控PI3K/Akt信号通路关键分子表达和磷酸化修饰的作用进而影响食管癌生物学行为;② ANO1-AS1与ANO1两者之间存在直接或间接调控作用进而调节通路活性影响食管癌进程。这为ANO1-AS1在ESCC中作用机制的进一步研究提供了方向。
综上所述,抑制 ANO1-AS1可能影响PI3K/Akt通路活性从而降低ESCC细胞增殖能力,诱导其发生细胞凋亡。提示ANO1-AS1可能通过影响ESCC的增殖及凋亡,发挥促癌基因作用,为ANO1-AS1的进一步研究及ESCC的早期诊治提供一定理论依据。

