藜麦种质资源对霜霉病的抗性鉴定与评价
王 昶, 杨发荣, 李敏权, 陆建英, 魏玉明, 赵桂琴
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2. 甘肃省农业科学院作物研究所,甘肃 兰州 730070; 3. 甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;4. 甘肃省农业科学院,甘肃 兰州 730070)
藜麦(Chenopodiumquinoa)原产于南美洲安第斯山区,距今已有7 000多年的栽培历史[1],是当地居民传统的食物和家畜饲料来源[2]。藜麦籽粒无麸质[3],蛋白质含量高,而且富含人体必需的9种氨基酸以及矿物质、维生素、抗氧化物质、膳食纤维等营养物质[4]。藜麦对生物和非生物胁迫均表现出优异的抗性[5],可在恶劣环境中生长,尤其是边缘贫瘠土壤中。藜麦全株均可作为优良饲草,叶片[6]、籽实[7]和麸皮[8]均是优质的高蛋白饲料,可改善饲草中氨基酸平衡,为家畜提供优质蛋白。藜麦秸秆的营养价值虽与其它部分相比较低,但其仍表现出与现有优良饲草料相当的饲用价值[9]。藜麦的营养价值高、抗逆性强,是全球理想的粮饲兼用型作物,深受欢迎,现已突破南美洲传统原产国,扩延至全球90多个国家[10]。目前,我国藜麦种植区主要分布在甘肃、山西、青海、内蒙古等省份,2020年仅甘肃省种植面积就达1万hm2左右,约占全国面积的一半。
藜麦的全球扩延,带来了病虫害种类和数量增加的问题[11]。病原菌PeronosporavariabilisGäum引起的(曾命名为P.farinosaf. sp.chenopodiiByford)[12]藜麦霜霉病(Downy mildew,DM)是藜麦生产中为害最严重的世界性病害[13],现已传播至全球所有藜麦种植区[14]。该病害主要为害叶片,最初在叶正面出现小而不规则的褪绿坏死斑,同时在叶背形成灰色霉层,随着病程的发展,这些斑点开始聚结,融合,叶片萎黄,最终导致叶片脱落。病害发生后叶片机体受损,光合面积减少,严重影响植株的生长发育。霜霉病可导致藜麦减产33%~99%[15],气候环境有利病害生长时,减产甚至可达100%[16]。藜麦霜霉病在我国普遍发生严重,在山西省静乐县发病率达95%,使藜麦减产40%左右[17]。笔者调查发现,甘肃省的甘南州、临夏州和武威市等藜麦种植区发病率普遍在40%以上,临夏州阴湿区最为严重,甚至高达95%,已严重威胁本地藜麦生产。
藜麦霜霉病的防治非常困难[18],喷施杀菌剂是其防治的传统方法[19]。藜麦霜霉病病原菌Peronosporavariabilis具有有性生殖,易变异[20],使其产生抗药性。利用抗病品种防治是最简单、经济和有效的措施,而种质资源抗病性评价是其实现的先决条件。国外学者开展了大量的抗性筛选和评价研究[14,21-22]。Mhada等[14]对77份藜麦种质资源和当地2份野生种(Chenopodiumalbum和Chenopodiumurale)在摩洛哥通过采取离体叶片接菌鉴定和田间自然感病鉴定的方法进行了霜霉病抗性鉴定,发现种质资源‘M2a’和‘S938/1’表现抗病,‘M24’表现高感,其余均感病。Nolen[18]对3个Chenopodiumberlandierivar.Macrocalycium(BVM)、2个BVM ×C.quinoa杂交种、1个藜(C.album)、4个藜麦(C.quinoa)等10个藜属植物进行了霜霉病抗性评价,未发现完全抗病或免疫材料。近年来,国内学者对藜麦的研究多集中在引种、栽培[23-24]、耐盐性[25-26]、抗旱性[27-28]、功能物质分析[29-30]及功能基因鉴定[31-32]等方面,鲜见有关藜麦霜霉病抗性评价的研究报道。基于此,我们开展本土环境条件下藜麦种质的霜霉病抗性筛选与评价试验,旨在为抗病基因的挖掘、藜麦遗传改良与霜霉病综合防控提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1藜麦种质资源 参试材料包括49份藜麦(C.quinoa)种质资源和1份‘台湾红藜’(Chenpodiumformosanum),均由甘肃省农业科学院畜草与绿色农业研究所从中国农业科学院国家作物种质资源库、山西稼祺藜麦公司、北京农品堂营养科技股份有限公司和甘肃条山集团农林科学研究所等机构引进和收集。
1.1.2供试病原菌 采集田间典型的藜麦病叶(为了与田间抗性鉴定病原菌保持一致,尽量采集田间试验区藜麦病叶),在低温冷藏条件下带回实验室,用无菌毛刷刷掉叶片老旧孢子和杂质,用无菌水冲洗干净,灭菌滤纸吸干表面水分,置于培养箱中,在20℃黑暗条件下保湿培养48 h,待叶片背面长出新鲜孢子囊后备用。
1.1.3孢子悬浮液的制备 将长出新鲜孢子囊的叶片置于20 mL无菌离心管中,加入5 mL无菌水,在涡旋仪上均匀震荡,使得孢子囊和叶片充分脱离,倒出悬浮液,4层无菌纱布过滤,取滤液在显微镜下用血球计数板计数,调至每毫升1×105个孢子囊,加入0.1%吐温20备用。
1.2 试验方法
1.2.1田间自然感病鉴定 试验于2020年在临夏州康乐县八松乡八松村进行,该地属阴湿区,霜霉病易发高发,平均海拔2 000 m,年均气温7.5℃,降雨量625 mm。选择地势平坦地块,人工开沟点播,每穴播种3粒种子,株距20 cm,行距50 cm。每品种播种2行,行长6 m,以高感材料‘QA065’作对照。4~6叶期间苗,每穴留苗1株。选择藜麦花芽分化期至盛花期(霜霉病盛发期)[33]调查发病率,分别采用“全叶法”(Total-leaf method)和“三叶法”[15](The three-leaf method)调查病害严重度,计算病情指数、评估抗性类型。“全叶法”调查时,每品种随机选取3株,从上而下调查每株全部叶片,病害严重度依据菌体覆盖单叶面积的比例确定;“三叶法”调查时,随机选取9株,把整个植株分为上、中、下三部分,在每部分中随机选取一叶调查。
采用Mhada等[14]的0~5级病害分级标准(略有改动)进行分级。0级:无病斑。1级:小而分散的病斑,病斑占叶片面积0~10%。2级:病斑数量和面积明显增加,病斑占叶片面积11%~25%。3级:病斑呈褐色,叶片背面开始形成孢子,病斑占叶片面积26%~50%。4级:病斑占叶片面积51%~90%。5级:病斑面积大于叶面积90%,叶片正面和背面形成大量孢子。
发病率和病情指数分别用以下公式计算:



根据病情指数对每个品种进行抗性分级,采用Staudt和Kassemeyer[34]分级标准(略有改动):0为免疫;0~5为高抗(HR);5.1~25为抗(R);25.1~50为中抗(MR);50.1~75为感病(S);>75为高感(HS)。
1.2.2室内离体叶片接菌鉴定 采用“叶盘法”测定。采集藜麦成株期相同部位健康叶片,70%的乙醇表面消毒30 s,无菌水冲洗干净,晾干,用打孔器避开主脉取直径10 mm的叶盘,置于铺有2层无菌滤纸,直径为90 mm的培养皿中,每皿放置12个叶盘,叶背朝上,每个叶盘中央滴20 μL的孢子悬浮液,加无菌水使滤纸湿润,保鲜膜封口。每品种3次重复,设置1个清水对照。将培养皿置于温度为20℃,相对湿度80%的人工气候培养箱中,黑暗培养24 h后,用无菌滤纸吸掉叶盘表面液滴,封口后12 h黑暗/12 h光照交替培养,接种5~7 d后调查发病情况。
1.3 数据统计
采用SPSS 18.0 软件对试验数据进行统计分析。用Duncan氏新复极差法进行差异显著性检验;组间连接法(Between-groups linkage)进行聚类分析。
2 结果与分析
2.1 田间抗性鉴定结果
分别采用“全叶法”和“三叶法”对50份藜麦材料进行田间发病率和病情指数的调查及抗性评价。结果如表1所示,不同材料发病率、“全叶法”病情指数、“三叶法”病情指数及抗性表现出显著差异水平(P<0.05)。参试材料全部发病,普遍严重,无免疫品种,基于“全叶法”病情指数的抗性评价结果显示(表1、图1),表现高抗的有‘台湾红藜’和‘QA064’,表现中抗的有‘陇藜2’号和‘HL-Q5’,占参试材料的8%,表现感病的有‘QA045’、‘QA050-2’和‘青海-02’等3份材料,占参试材料的6%,其余43材料均表现高感,占参试材料的86.00%;“三叶法”病情指数大于70.00 的有45个品种,占参试材料的90.00%,小于70.00的有5份材料,‘台湾红藜’病情指数最小,为2.67。基于“三叶法”病情指数的抗性评价结果显示(表1、图1),表现高抗的材料有‘台湾红藜’和‘QA064’,占比4%,表现中抗的有‘陇藜2号’和‘HL-Q5’,占比4%,表现感病的有‘高台02’和‘青海-02’,占比4%,其余44材料均表现高感,占比88.00%;参试材料的“全叶法”和“三叶法”病情指数非常接近,抗性鉴定中除‘QA050-2’、‘QA045’和‘高台02’等3份材料基于“全叶法”病指分别评价为感病、感病和高感,而基于“三叶法”分别评价为高感、高感和感病外,其余鉴定结果完全一致。
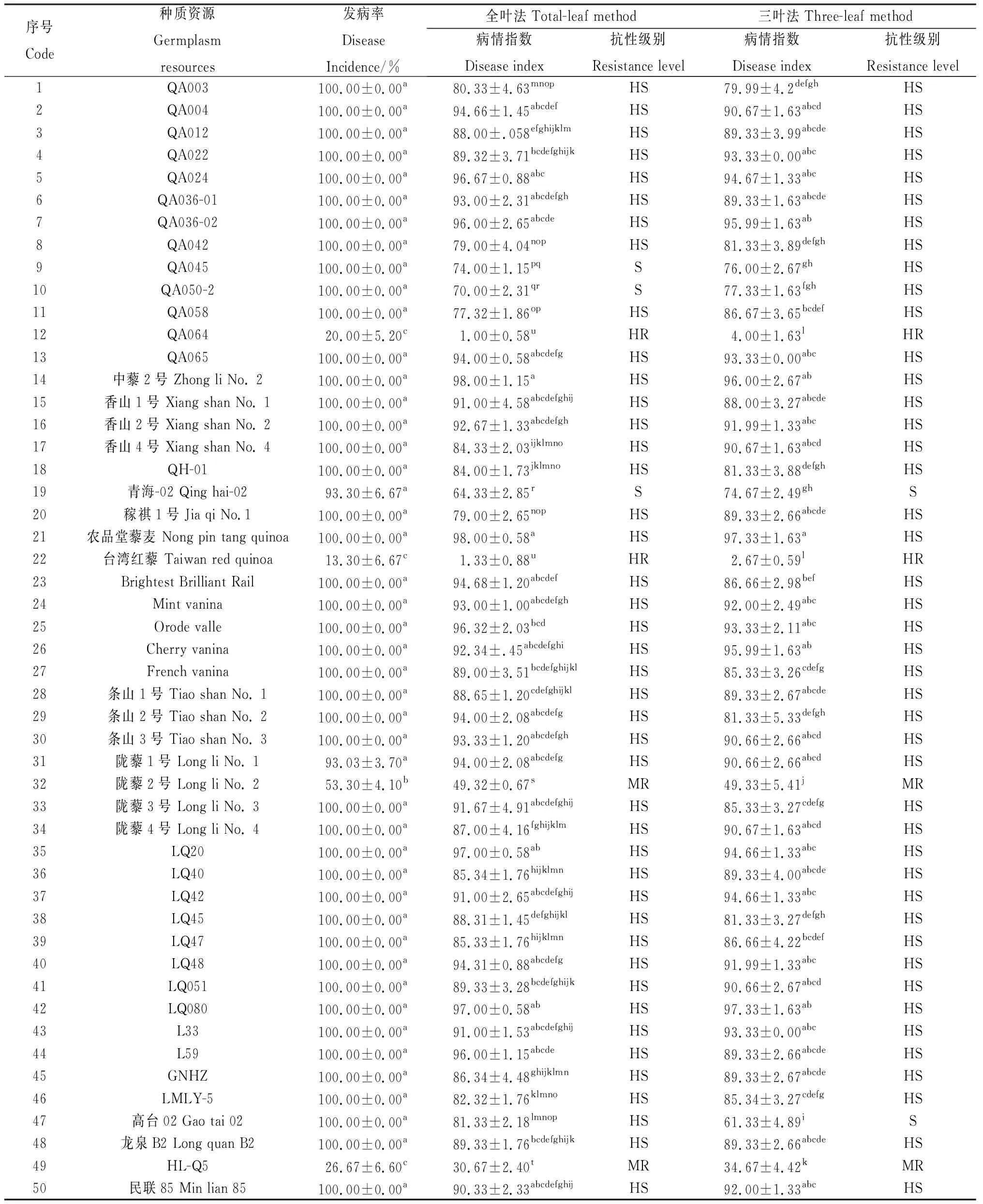
表1 藜麦种质资源对霜霉病抗性田间自然感病鉴定Table 1 Resistance identification of quinoa germplasm accessions against Peronospora variabilis by natural infection in the field

图1 不同藜麦抗性比例分布Fig.1 Resistance ratios distribution of the different quinoas
2.2 室内离体叶片抗性鉴定结果
采用叶盘法在室内对离体叶片人工接菌进行病叶率和病情指数的调查和抗性评价,结果如表2所示,不同藜麦材料之间病叶率和病情指数差异显著(P<0.05)。病叶率小于100.00%的有8份材料,占参试材料的16.00%,‘台湾红藜’最小,为19.45%,其余42份材料均为100.00%,占比84.00%;室内离体叶片抗性评价结果显示(表2、图1)90%的材料病情指数大于70.00,‘台湾红藜’表现高抗,病情指数最低,为4.44,占比2.00%,表现抗病的有‘QA064’,占比2.00%,表现中抗的有‘陇藜2号’和‘HL-Q5’,占比4.00%,表现感病有‘QA045’‘QA050-2’和‘青海-02’,占比6.00%;其余43份材料均表现高感,占比86.00%。

表2 藜麦种质资源霜霉病抗性室内离体叶片接种鉴定Table 2 Resistance identification of quinoa germplasm accessions against Peronospora variabilis by indoor artificial inoculation of the detached leaves
2.3 藜麦不同抗性的聚类分析
以田间全叶病情指数、三叶病情指数及室内离体叶片病情指数共同作为聚类分析的统计指标,采用组间连接法进行聚类分析,以平方欧式距离(Squared Eucideandistance)2.5为聚类分割点时(图2),50份藜麦材料聚为5类。第一类仅为‘台湾红藜’,第二类仅为‘QA064’,第三类包含‘陇藜2号’和‘HL-Q5’,第四类包括‘QA045’‘QA050-2’‘高台02’和‘青海-02’,其余42份材料为第5类。结合田间和室内抗性评价,聚类分析第一类可定为高抗材料,第二类为抗病材料,第三类为中抗材料,第四类为感病材料,第五类为高感材料。
2.4 植株发病率、病叶率和病情指数的相关性分析
植株发病率、病叶率和病情指数的皮尔逊相关系数(Pearson correlation coefficient)分析表明(表3),植株田间发病率、室内病叶率、全叶病情指数、三叶病情指数和室内病情指数相互之间呈极显著正相关关系(P<0.01),尤其是三叶法病情指数和全叶法病情指数、室内病情指数和全叶法病情指数以及室内病情指数和三叶法病情指数的相关性系数分别高达0.924,0.976和0.925,充分说明这几项指标能够相互印证,从一定程度上真实准确地反映出了病害发生的实际情况。

表3 发病率、病叶率和病情指数的皮尔逊(Pearson)相关性分析Table 3 Pearson correlation analysis of disease incidence,infection leaves rate and disease index
3 讨论
3.1 藜麦种质对霜霉病的抗性
藜麦遗传多样性高,生态类型多样,抗性变异大[35],这为抗病性评价提供了先天基础,国外的研究已得到证实。Kumar等[33]对引进的34份藜科种质资源,包括7个野生型和27个不同来源的藜麦种质资源在印度中东部田间自然感病条件下采用“两点法”(Two-point method)进行了霜霉病抗性评价和筛选,7个野生型和4份藜麦资源‘PI 510532’‘CHEN 67/78’‘Ames 22158’和‘CHEN 7/81’表现为免疫/高抗。Colque-Little等[36]在3个独立的温室中对132个藜麦基因型(5个对照、21个栽培种和106份种质)材料通过接种病原菌开展了霜霉病抗性评价和表型鉴定,结果显示对照品种C.album,Puno,基因库种质‘G41’‘G42’‘G76’‘G93’‘G96’和‘G112’抗性最高,而对照品种‘Vikinga’,栽培种‘CV13’和‘CV21’及种质‘G4’‘G9’‘G57’‘G67’‘G82’‘G91’最易感病。本研究首次在本土环境条件下,对来自国内外的50份藜麦种质资源分别通过田间自然感病和室内离体叶片接菌的方法进行了霜霉病抗性鉴定和评价,结果显示其发病率和病情指数表现出较大的变化(发病率13.30%~100.00%,病情指数1.00~100.00);50份材料中无免疫品种,绝大多数表现高感,‘台湾红藜’表现高抗,‘QA064’表现抗病,‘陇藜2号’和‘HL-Q5’表现中抗,这进一步证实藜麦霜霉菌侵染程度的高度变异和藜麦种质抗性存在明显差异[22,33,35]。藜麦霜霉病病原菌P.variabilis属卵菌(Oomycetes),有性生殖是卵配生殖(Oogamous),存在异宗配合(Heterothallic)现象[37],可促进菌群的进化和变异,产生许多新的毒力基因[38]。而在此试验中,我们尽量保持了相同单一菌株,然而,由于毒力基因的分化,同一藜麦材料可能对不同霜霉病菌株的抗性存在差异,在今后的研究中需要关注这一问题。
本研究中表现高抗的‘台湾红藜’(C.formosanum)是台湾土著假谷物作物[10],与藜麦(C.quinoa)同属苋科藜属,两者的生物学特性非常相似[39],其营养价值非常接近。我国藜麦产学研相关人员通常将台湾红藜列为藜麦的一个品种[32]。本研究首次发现了作为藜麦近缘种的‘台湾红藜’能够被P.variabilis侵染。‘台湾红藜’生育期长,植株高大,生物量多,是作为饲草型藜麦的首选。表现中抗的‘陇藜2号’是由甘肃省农业科学院畜草与绿色农业研究所选育的粮饲兼用型品种,可在生产中直接应用。该研究为藜麦霜霉病抗性基因的挖掘、利用及抗病机理的探究和防控奠定了基础。
3.2 霜霉病抗性鉴定时期
藜麦霜霉病抗性鉴定时期至关重要,若过早,则病害未充分发生,真实抗性容易被掩盖,若过迟,则病叶严重脱落,抗性不易观察,因此,恰当的时期能够充分体现病害侵染最严重程度和最真实抗性。本研究在前期调查的基础上发现藜麦霜霉病在盛花期发病最重,因此,选择盛花期作为抗性鉴定的时期。这与人们普遍认为花芽分化期是藜麦种质资源霜霉病抗性鉴定最重要和关键时期[33]基本吻合。藜麦的霜霉病抗性与其生育期密切相关,一般来说晚熟比早熟品种更具抗性[40]。通常情况下,早熟品种会在霜霉病肆虐前成熟,从而逃避了侵染,表现出“假抗性”[41]。高抗材料‘台湾红藜’属晚熟品种,生育期高达170 d,明显高于其他材料。Kumar等[33]筛选的免疫品种中,除‘CHEN 67/78’(119 d)外,其余‘PI 510532’(158 d)、‘CHEN 7/81’(134 d)和‘Ames 22158’(131 d)均是晚熟品种。
3.3 霜霉病抗性鉴定方法
目前,尚无统一有效和可重复的藜麦霜霉病严重度测定方法[20,33]。可靠的评价方法对病害流行病学研究、产量损失评估、致病性和毒力测定及种质资源抗性鉴定至关重要[20]。本研究采用田间和室内离体叶片鉴定相结合的方法进行评价,结果显示田间发病率和室内病叶率、田间病情指数(“全叶法”和“三叶法”)和室内病情指数非常接近,相关性系数分别为0.660,0.976和0.925,表现出极显著的正相关关系(P<0.01)(表3)。50份材料抗性鉴定结果基本一致,除‘QA064’田间鉴定为高抗,而室内鉴定为抗病,‘高台02’田间鉴定为感病,室内鉴定为高感,‘青海-02’田间鉴定为高感,室内鉴定为感病外,其余材料完全一致,这种差异可能是由于室内鉴定法接菌量大,材料离体抗病性弱[42]及田间自然感病鉴定受诸多因素影响[43]所致。一般而言,田间评价不会十分准确,因为寄主基因型×病原菌基因型×环境(G×G×E)的互作效应在大田中无法控制,包括田间条件、寄主、小气候温湿度、菌株毒力和孢子分布等因素都对抗性鉴定产生影响[41]。此外,病原菌侵染的症状受叶片组织的位置和叶龄的影响[44],可能产生诱导性抗性,这种抗性不仅发生在初始侵染位置,而且也发生在末梢和未侵染的部分[45]。而离体叶片鉴定技术的温湿度可控,接种量分布均匀,被认为是实验室评估霜霉病抗性最可靠的方法[20],总之,离体叶片鉴定法是一种霜霉病抗性评价的理想方法。
本研究采用了传统的“全叶法”和“三叶法”调查病害严重度,计算病情指数,结果显示两种测定方法的病情指数非常近似,且呈极显著性正相关(r=0.92)(P<0.01),这充分说明两种方法均可靠可行,但是,由于藜麦植株高大,叶片数量多,“全叶法”测定工作量大,尤其是在田间对大批量种质资源抗性的评价。而“三叶法”因只对单叶进行严重度评估而具有简便、快捷的优点,其结果的可比较性和重复性好,且其也是预测霜霉病产量损失的最佳方法[20]。由此可见,“三叶法”在霜霉病抗性鉴定和产量损失评价等方面具有简便、快捷和可靠的特点,应成为田间霜霉病抗性研究的首选方法。
4 结论
本研究表明藜麦种质对霜霉病的抗性存在明显差异,藜麦及其近缘种中存在丰富的抗性材料;首次发现‘台湾红藜’能被P.variabilis侵染,但其表现高抗,藜麦材料‘QA064’表现抗病,‘陇藜2号’和‘HL-Q5’表现中抗;进一步证实田间藜麦霜霉病抗性鉴定采用“三叶法”在藜麦盛花期进行效果较好,相比而言,室内离体叶片接菌鉴定技术更具优势。

