海南天然饲草青贮饲料中乳酸菌分离鉴定及优良菌株筛选
刘 悦, 字学娟*, 陈 婷, 孙 蓉, 李 茂, 汤 凯
(1. 海南大学林学院, 海南 儋州 571737; 2. 中国热带农业科学院热带作物品种资源研究所, 海南 儋州 571737; 3. 中国热带农业科学院湛江试验站, 海南 湛江 524000; 4.海南大学食品学院, 海南 海口 570228)
微生物活动是青贮发酵的本质,原料表面附着微生物多样性、菌种的生理生化特性以及外界环境等因素均能影响青贮发酵品质[1]。因此,调控微生物群落结构是保证青贮发酵品质的重要举措之一。一般来说,乳酸菌作为优势菌群的青贮发酵容易成功,通过产生乳酸和一些抗真菌代谢产物,可起到改善青贮饲料品质的作用[2]。
当前,研究人员发现通过筛选并添加不同种类的乳酸菌来可提高青贮成功率[3],韦庆旭等[4](陕西)从构树青贮饲料、玉米青贮饲料中分离出植物乳杆菌(Lactobacillusplantarum)、布氏乳杆菌(Lactobacillusbuchneri)、副干酪乳杆菌(Lactobacillusparacasei)、粪肠球菌(Enterococcusfaecalis)4种可饲用菌种;张玉琳等[5](新疆)从杂交构树(Broussonetiapapyrifera)青贮饲料中最终分离得到植物乳杆菌、短乳杆菌(Lactobacillusbrevis)、粪肠球菌和戊糖片球菌(Pediococcuspentosaceus),此外,李荣荣等[6](北京)从紫花苜蓿自然青贮饲料中筛选得到的植物乳杆菌,能够有效促进乳酸发酵、抑制梭菌生长、显著改善高水分苜蓿青贮品质。Peng等[7](贵州)收获包括紫罗兰、高粱、玉米等12种青贮原料进行青贮,筛选得到的优势菌株布氏乳杆菌(Lactobacillusbuchneri)添加到青贮饲料中有效地改善了温暖潮湿气候区紫花苜蓿青贮饲料的发酵质量;Wang等[8]从青藏高原普通野豌豆、高羊茅和多年生黑麦草中分离得到的植物乳杆菌和商业植物乳杆菌MTD—1对比,发现在10℃和15℃的低温环境下,3种菌均可不同程度的改善意大利黑麦草青贮发酵品质。此外,Liu等[9]研究发现与商用植物乳杆菌菌株相比,筛选得到的菌株戊糖片球菌在20℃下对改善柱花草青贮品质最为有效。因此,不同区域不同饲草附着乳酸菌种类和特性差异较大,从不同来源分离鉴定和筛选本土优良乳酸菌菌株具有重要意义。
在全球变暖的背景下,日均最高气温≥40℃的天数也在增加。高温是热带地区影响青贮品质的重要环境因素,高温会增加青贮饲料pH值和干物质损失,降低其乳酸含量和有氧稳定性,极大的影响饲用价值[10]。乳酸菌特性在热带和温带有明显差异[10],商品化乳酸菌制剂不能很好地适应热带的气候,发挥预期效果[11]。海南岛为热带季风气候,夏季长达6个月(月平均温度≥30℃)且无冬季,而天然饲草青贮饲料中乳酸菌的分离及鉴定鲜有报道,因此,本研究以分布广泛、可用作饲草为标准选取海南岛的野生草本植物斑茅(Saccharumarundinaceum)、蔓生莠竹(Microstegiumvagans)和木本植物银合欢(Leucaenaleucocephala)、构树(Broussonetiapapyrifera)为材料,并在5个气候区东部湿热区、西部干旱区、南部暖潮湿区、北部半湿热区、中部山地潮湿区采样对比,筛选高温条件下适合热带牧草的优良乳酸菌菌株,旨在丰富对我国热带地区乳酸菌菌群多样性认知和促进热带饲草青贮添加剂的研发。
1 材料与方法
1.1 试验材料、试剂及仪器
供青贮的原料为从海口(110°11′E,19°54′N,年均温24.1℃,年均降水量1 788 mm,海拔160 m)、琼中(109°34′E,19°1′N,年均温22.4℃,年均降水量2 350 mm,海拔560 m)、万宁(110°25′E,18°54′N,年均温23.9℃,年均降水量2 420 mm,海拔30 m)、三亚(109°34′ E,18°19′ N,年均温26.9℃,年均降水量1 716 mm,海拔40 m)、昌江(108°58′ E,19°19′ N,年均温24.6℃,年均降水量1 680 mm,海拔90 m)、儋州(109°30′ E,19°30′ N,年均温23.8℃,年均降水量1 870 mm,海拔160 m)野外采集的草本植物斑茅、蔓生莠竹和木本植物银合欢、构树。金黄色葡萄球菌(Staphylococcusaureus)、沙门氏菌(Salmonella)、大肠埃希氏菌(Es-cherichiacoli)、单核细胞增生李斯特氏菌(Listeriamonocytogenes)来自海南大学食品科学与工程学院实验室。
De Man,Rogosa,Sharpe(MRS)琼脂培养基、De Man,Rogosa,Sharpe(MRS)肉汤培养基:购自杭州百思生物技术有限责任公司;细菌微量生化反应管:购自杭州微生物试剂有限公司。
1.2 试验方法
1.2.1青贮制备 将采集得到的饲草切碎至2~3 cm,自然晾晒24 h后装入聚乙烯青贮袋中,每袋200 g,每个处理重复3次。用抽真空包装机抽真空后密封,于室内35℃~40℃环境下储存发酵60 d。
1.2.2菌体分离及菌种纯化 将青贮样品按草:水=1:10比例浸泡在锥形瓶中,然后进行梯度稀释,选取3个适宜梯度,各吸100 μL涂布于MRS固体培养基(含1.5% CaCO3)上,于37℃恒温培养箱下厌氧培养48 h后,观察菌落形态[12]等,挑取溶钙圈明显且较大的单菌落,于MRS固体培养基划线3~4次,保存于—80℃超低温冰箱,同时进行革兰氏染色、过氧化氢酶检验。
1.2.3优势菌MRS液体培养基初筛 将纯化后的乳酸菌菌液浓度调至108cfu·mL-1摇匀接100 uL至装有MRS液体培养基的离心管,放置在37℃恒温培养箱中培养8,16,36 h后测定发酵液的pH值。测600 nm处OD(Optical density,吸光度)值,选取pH≤4且OD≥2[13]的菌株为初筛代表菌株。
1.2.4高温条件下MRS液体培养基优势菌复筛及耐酸能力测定 按初筛同样的方法接100 ul至装有MRS液体培养基的离心管,分别置于40,45,50℃培养箱中培养72 h,测发酵液600 nm处OD值。同上述方法再将乳酸菌接入pH为3.0,3.5,4.0,6.0,8.0,9.0的MRS液体培养基中培养3天后,测发酵液600 nm处OD值。
1.2.5测序及系统发育树的构建 筛选所得优势菌株进行16S rDNA测序(华大基因),在NCBI数据库搜索并选择序列同源性较高菌株16S rRNA基因序列,采用MEGA7软件构建系统发育树,建树方法为邻接法(Neighbor-joining,NJ)[14]。
1.2.6生理生化试验 采用细菌微量生化反应管,严格按照说明书操作,接菌方法为从MRS平板挑取单菌落到生化管,封口,放置于恒温培养箱[15]。
1.2.7乳酸菌的生长曲线和产酸曲线的测定 将复筛后选出的优良乳酸菌稀释定菌数(按上述方法)并接种置于37℃恒温培养,在0—24 h每隔2 h取出1批样品于600 nm处分别测定MRS培养基的OD值,同时用pH测定仪测定MRS培养基的pH值[16],分别用来表征乳酸菌的生长速率和产酸速率。
1.2.8抑菌能力的测定 将指示菌株的活化划线于营养琼脂培养基,37℃恒温培养48 h。挑取单菌落接种于营养肉汤培养基中,37℃,180 r·min-1条件下培养24 h。调整菌体浓度为1×107cfu·mL-1作为指示菌悬液;以1%(V∶V)的接种量将乳酸菌种子液接种于MRS液体培养基中,37℃条件下静置培养12 h,10 000 r·min-1离心2 min后取上清液,4℃保存作为上清液备用;利用牛津杯法测定抑菌性能,首先倾注15 mL将2%营养琼脂培养基(灭菌)于培养皿,待水平静置凝固后,打入100 μL指示菌菌液,涂布均匀后备用,均匀放置牛津杯垂直于培养基表面,在其中加入乳酸菌上清液100 μL,4℃扩散2 h后再37℃培养24 h。根据抑菌圈直径大小来判断结果[17]。
1.2.9数据分析 基础数据用Excel 2019处理,用Oringin 2018软件作图,用MEGA 7绘制系统发育树。
2 结果与分析
2.1 乳酸菌的分离纯化
从青贮样品中分离得到127株乳酸菌,98株菌株革兰氏染色均为阳性,过氧化氢触酶试验均为阴性,初步鉴定为乳酸菌。
2.2 乳酸菌的产酸能力和生长能力初筛
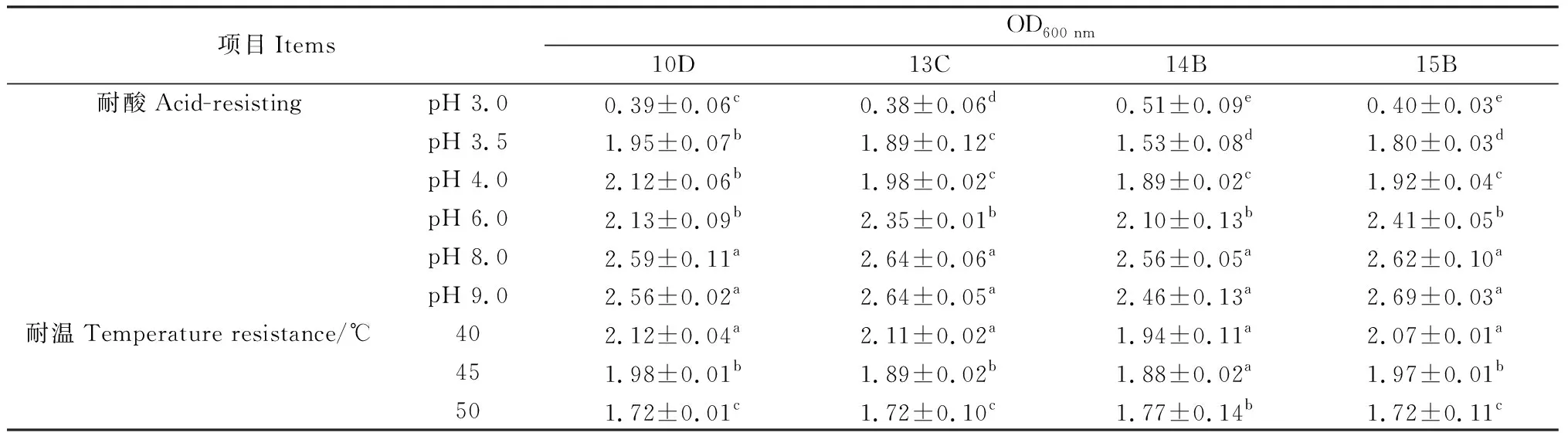
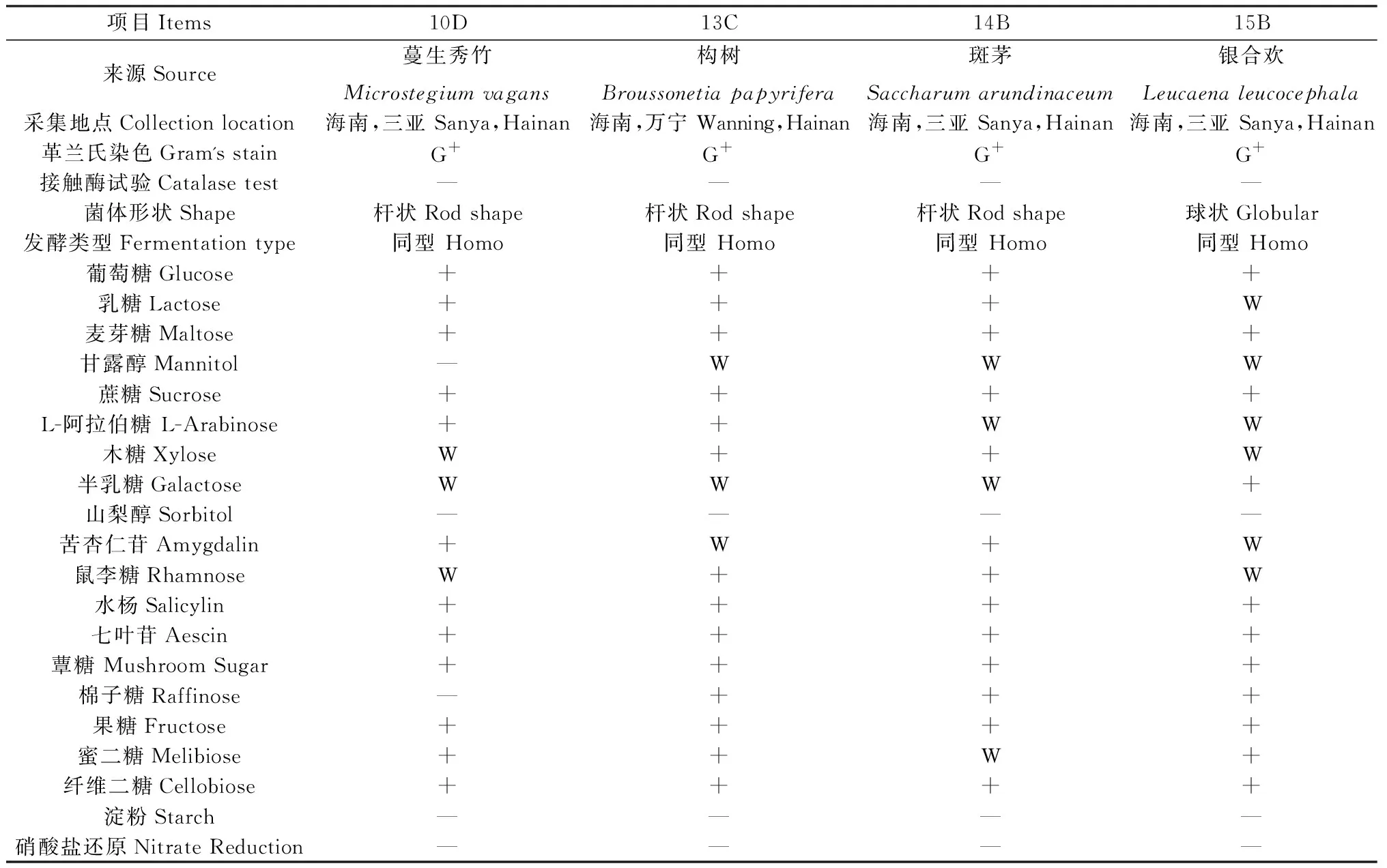
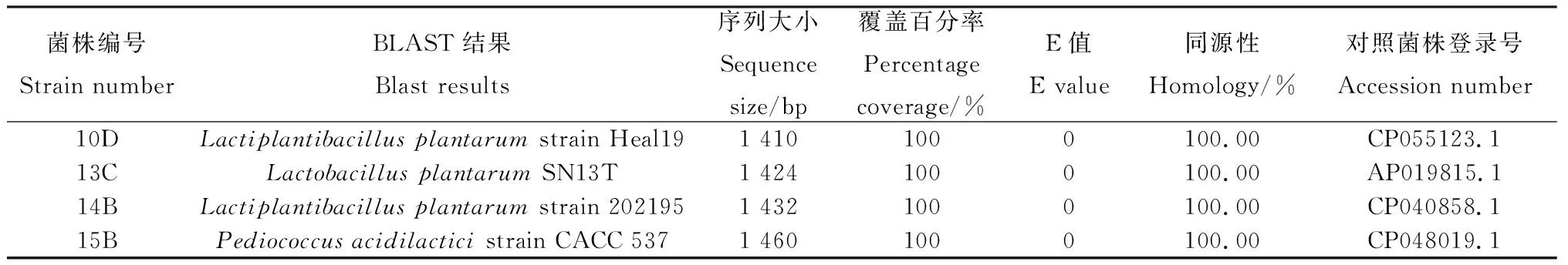
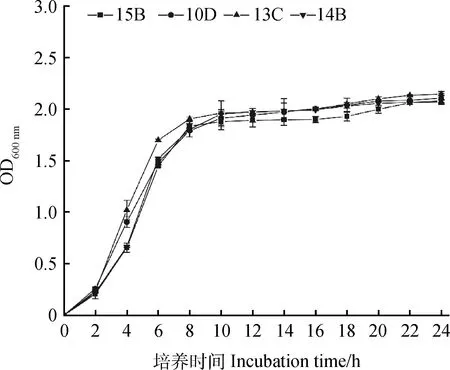
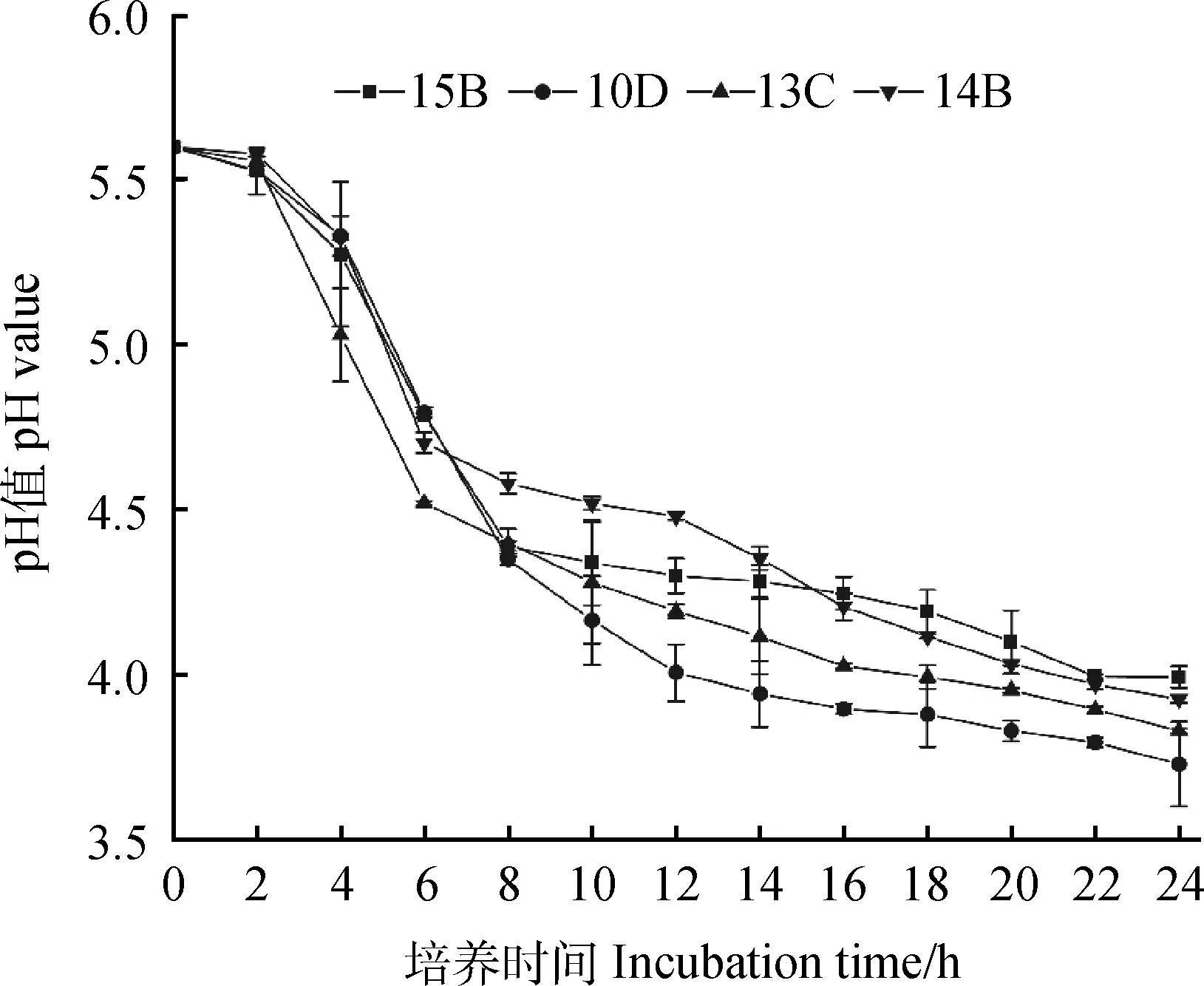
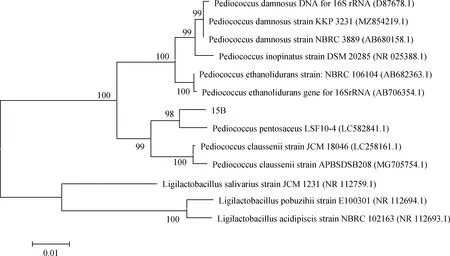
就产酸能力而言,发酵36 h后,98株菌株中,pH≤4的有39株,占比为39.8%,其中,产酸能力最强的1株菌pH为3.91,以上菌株在8 h和16 h时也表现较好,8 h时39株中有一半以上pH≤5,而16 h时pH又进一步下降,39株中有95%左右pH≤4.5;此外,发酵36 h时,4 在生长能力方面,30.77%的菌株8 h时OD≥2,所有菌株均OD≥0.5;发酵36 h时,pH≤4的菌株同时满足OD≥2。以36 h的pH≤4且OD≥2为条件,筛选得到39株优势菌,同时以8 h和16 h的结果为参考,发现所选菌株均满足生命力强且产酸能力强的要求。 对初筛优势菌39株进行耐高温能力和耐酸能力复筛,以T=50℃条件下的生长情况为依据,以T=40℃和T=45℃时的OD值为参考,选出OD值最大的15株为复筛优势菌,去掉测序结果中重复的菌种,最终得到4株优势菌,并对其进行耐酸能力的实验。随着温度的上升,所有菌株的OD值都呈现下降的趋势,在T=50℃时,菌株10D,13C,15B的OD值为1.72,菌株14B的OD值为1.77;以pH=6为界,pH值越小则越抑制乳酸菌的生长,这种抑制作用在pH=3时最为明显,仅14B的OD≥0.5,10D,13C,15B的OD分别为0.39,0.38,0.4。(表1)。 从表2中可以看出,所选菌株能利用广泛的糖源,但利用种类和能力有差别。所有的菌株七叶苷和苦杏仁苷生化管反应都呈阳性,七叶苷水解试验阳性说明该乳酸菌可将七叶苷分解成葡萄糖和七叶素;苦杏仁苷阳性则说明该该乳酸菌含β-葡萄糖苷酶可催化苦杏仁苷水解为两分子葡萄糖和1分子杏仁腈;另外,所有的菌株都能利用纤维二糖、葡萄糖、乳糖、果糖、半乳糖、麦芽糖、蕈糖、蔗糖、鼠李糖、木糖、蜜二糖、L-阿拉伯糖,但利用能力不一,其中,15B对乳糖的利用能力较弱;14B对蜜二糖的利用能力较弱;13C,14B,15B对甘露醇的利用能力较弱;14B,15B则对L-阿拉伯糖的利用能力较弱;10D,15B对木糖和属李糖的利用能力较弱;10D,13C,14B对半乳糖的利用能力较弱;然而,所有的菌株都不能利用山梨醇、淀粉且硝酸盐反应呈阴性,说明所选菌株不含硝酸还原酶和淀粉水解酶;10D不能利用棉子糖、甘露醇。 表1 4株优势菌株耐受性实验结果Table 1 Tolerance of four representative strains to acid and high temperature 表2 4株优势菌株生理生化实验结果Table 2 Physiological and biochemical characteristics of four representative strains 将代表菌株进行16S rDNA测序后,将序列结果提交至NCBI数据库对相似性进行比对,结果见表3。菌株10D和植物乳杆菌(Lactiplantibacillusplantarumstrain Heal19)同源性最高,菌株13C和植物乳杆菌(LactobacillusplantarumSN13T)同源性最高,菌株14B和植物乳杆(Lactiplantibacillusplantarumstrain 202195) 同源性最高,菌株15B和乳酸片球菌(Pediococcusacidilacticistrain CACC 537)同源性最高,所有菌种的同源性和标准菌株序列覆盖率均达到100%,E值都为0。E值代表在随机状态时,目标序列与其他序列的相似度大于本条序列的可能性。表中所列E值均为0,说明比对结果可靠。 表3 4株优势菌株的16S rDNA序列同源性比对结果Table 3 Homologous alignment analysis of 16S rDNA sequences from four typical isolates 表4可知,4株代表菌株抑菌效果均较明显,表现在其对所有致病菌抑菌圈的直径均大于10 mm。其中10D和13C对大肠杆菌的抑制作用更强;13C对金黄色葡萄球菌的抑制效果更好;10D对沙门氏菌的抑制作用较好;菌株10D,14B和15B对单核细胞增生李斯特氏菌的抑菌圈直径大小较为接近且数值较高,说明对该致病菌有更强的抑制能力。 表4 4株优势菌株的抑菌能力Table 4 Antibacterial activity of four representative strains 图1所示,4株优势菌株呈现出相似的生长情况,0~2 h菌株生长缓慢,处于迟滞期;2 h后迅速生长繁殖,进入对数生长期;到10 h后,生长速率减缓;22 h后趋于稳定,基本不再生长,曲线趋向“S”型。在对数期,相比其他菌种,菌株13C长势较快,菌株15B在2~4 h相对平缓;在稳定期,菌株13C生长情况最好,其余菌株长势相似。 图1 在MRS肉汤培养基中培养的4株乳酸菌于600 nm 处的光密度值Fig.1 The optical density values at 600 nm of four LAB strains in MRS broth with the process of incubation 图2所示,菌株10D培养2~12 h产酸速率较快,12~24 h产酸效率减小;菌株13C和14B在2~6 h时pH迅速下降,在6~24 h时pH有所下降但幅度变小;菌株15B在2~8 h时产酸速率较快,8~22 h产酸效率减小,22 h时趋于稳定期,pH值基本保持不变。在产酸速率上,菌株13C较其他菌株更快;在产酸能力上,菌株10D最强。 图2 4株乳酸菌于MRS肉汤培养基中培养的 pH值变化Fig.2 The pH values of four LAB strains in MRS broth with the process of incubation 由图3可知,菌株10D,13C,14B与植物乳杆菌(GenBank登录号:MT229370.1)和植物乳杆菌HBUAS52250(GenBank登录号MH472975.1)聚于一枝,亲缘关系最近,故将这3株菌株鉴定为植物乳杆菌。由图4可知,菌株15B与乳酸片球菌(GenBank登录号MW425291.1)聚于一枝,亲缘关系最近,因此,将其鉴定为乳酸片球菌(Pediococcusacidilactic)。 图3 利用16S rDNA序列对植物乳杆菌进行构建系统发育树Fig.3 Phylogenetic tree for Lactobacillus plantarum based on their 16S rDNA sequences 图4 利用16S rDNA序列对乳酸片球菌进行构建 系统发育树Fig.4 Phylogenetic tree for Pediococcus acidilactici based on its16S rDNA sequence 青贮发酵的微观层面是由饲草表面附着微生物的活动所主导的[18],其中,乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus)等在青贮饲料发酵中起关键作用[19]。乳酸菌的迅速繁殖会使得发酵体系中的pH值迅速下降,抑制大部分好氧细菌、大肠杆菌和霉菌等不利于青贮发酵的微生物繁殖[20],使得发酵品质更佳。因此,从青贮饲料中筛选优良乳酸菌对改善青贮发酵品质具有重要意义。 本研究以不同气候区以及草本、木本饲草为微生物富集材料,为分离纯化更丰富的菌株提供了基础。有学者总结,在青贮中若要作为添加剂使用,乳酸菌需具备两个条件1)耐酸能力强,活性高,生长迅速;同时大量产酸,迅速使得pH≤4,其它微生物的生长因此而受到抑制;2)除了乳糖外,可以利用蔗糖、果糖、葡萄糖等,最好可以发酵戊糖[21]。从初筛结果和生理生化实验结果来看,大部分乳酸菌在MRS液体培养基中培养36 h,培养液的pH≥4,这表明这些菌株的产酸能力较低,自然青贮难以取得良好效果,而优势菌10D,13C,14B和15B 在2 h即进入对数生长期,在36 h时pH降至4.0以下,且均可发酵多种糖源,因此,所选优势菌株都有潜力作为乳酸菌添加剂来改善青贮发酵品质。筛选到的优势菌10D,13C,14B和15B比付浩等[22]从玉米青贮饲料中筛选得到的短乳杆菌和戊糖片球菌(12~20 h为对数生长期)生长更快,但其优势菌株36 h左右pH达到3.6,最终的产酸能力较本实验所筛的优势菌稍强。 此外,青贮微生物受温度影响比较大,热带的高温环境会影响细菌细胞酶的活性,从而影响其生长代谢。而生活在这种环境中的菌株,会改变生理生化特性以达到适应环境的目的,形成特定的气候生态型。本研究旨在分离纯化出适应热带气候的优势乳酸菌,使本土优良菌种种质资源得以合理利用。因此在复筛时采用T=50℃下的生长情况较好(OD值高)为筛选原则,得到了4株耐高温同时耐酸能力良好的优势菌株,此前,研究人员从贵州省[7]青贮饲料中筛选得到的布氏乳杆菌(L.buchneri)和西南高温高湿地区[10]青贮饲料中筛选得到的植物乳杆菌(Lactobacillusplantarum)在pH=3.5和T=45℃的条件下均可生长,对高温和酸性环境具有良好的适应性。从兰州市[23]玉米秸秆和白菜尾菜混贮料中分离纯化得到的12株乳酸菌可以在pH=4.5和T=45℃条件下生长。而本实验分离纯化得到的乳酸菌对高温胁迫的耐受性更强,能在50℃的环境下生长繁殖。 对微生物的16S rDNA序列进行分析可以达到初步分类鉴定的目的,基于其构建的系统进化树可以确定菌种在进化中的位置。一般认为,在种分类水平上,2个分类单位间16S rDNA序列同源性高于97.5%则属于同一个种。经16S rDNA测序,结合糖发酵结果,10D,13C,14B为植物乳杆菌,15B为乳酸片球菌(Pediococcusacidilactic)。其中,植物乳杆菌被发现可以从多种饲草中筛选得到,新鲜仙人掌植物和青贮饲料中最常见的乳酸菌是植物乳杆菌(65%)[24];Li等[25]从玉米秸秆青贮饲料中分离出的植物乳杆菌ZZU 203和204具有抗菌活性,可用作青贮添加剂,以抑制青贮过程中不良微生物的增殖并保存青贮饲料的营养;袁洁等[26]从自然青贮多花黑麦草中筛选出的优质菌株中80%为植物乳杆菌。乳酸菌可以通过产生大量的有机酸、过氧化氢等物质来抑制致病菌的生长,是否具有抑菌作用和抑菌作用的强弱是评价乳酸菌的重要内容。结果显示4株菌株对大肠杆菌、金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌的抑菌圈直径均大于10 mm,具有很强的抑制作用,说明从青贮饲料分离的这4株乳酸菌对常见病原菌具有抑制作用。 本研究从海南岛不同地区不同植物样本中共分离到98株乳酸菌,经过初筛和复筛,得到4株优势菌株并进行16S rDNA测序。经鉴定,10D,13C,14B为植物乳杆菌,15B为乳酸片球菌(Pediococcusacidilactic),4株代表菌株中,菌株13C长势较好且产酸速率较快,菌株10D产酸能力较强。耐受性试验中,菌株14B在pH=3.0环境下生长较好,耐酸能力较好;所有菌株在50℃环境下生长良好,耐高温能力强,在抑菌试验中,所选优势菌株均可有效抑制致病菌的生长,其中,菌株10D可以有效的抑制大肠杆菌、沙门氏菌、单核细胞增生李斯特氏菌,菌株13C则对金黄色葡萄球菌有明显的抑菌作用。2.3 乳酸菌的耐高温能力和耐酸能力复筛
2.4 优良乳酸菌的生理生化、16S rDNA序列分析、系统发育树、生长速率及产酸速率和抑菌效果


3 讨论
4 结论

