基于HPLC-Q-Exactive液质联用技术与HPLC的通脉降糖胶囊成分分析及指纹图谱研究
武宇佳,万浩芳,李 畅,万海同,杨洁红
·药剂与工艺·
基于HPLC-Q-Exactive液质联用技术与HPLC的通脉降糖胶囊成分分析及指纹图谱研究
武宇佳,万浩芳,李 畅,万海同,杨洁红*
浙江中医药大学,浙江 杭州 310053
开发一种基于HPLC-Q-Exactive液质联用技术的通脉降糖胶囊(Tongmai Jiangtang Capsule,TJC)全局定性分析的检测方法,同时应用液相色谱建立TJC的HPLC指纹图谱,并对其主要成分进行定量分析,为TJC的全面质量评价及质量控制提供参考依据。利用Thermo Fisher Q-Exactive液质联用系统对TJC化学信息进行采集,结合数据库、文献检索及对照品比对等手段进行TJC成分鉴定。采用Capcell Pak C18色谱柱(150 mm×4.6 mm,3 μm),以0.5%甲酸水溶液-0.5%甲酸乙腈溶液为流动相进行梯度洗脱,柱温40 ℃,体积流量0.4 mL/min,对15批次TJC样品进行检测,同时建立指纹图谱,应用中药色谱指纹图谱相似度评价系统(2012版)进行相似度评价和共有峰指认,并对其中8个指标成分进行定量测定。利用高分辨液质联用技术共鉴定出TJC中150种化合物。15批TJC的指纹图谱相似度均在0.97以上,共标定25个共有峰,指认其中8个色谱峰(原儿茶酸、原儿茶醛、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B以及丹参酮IIA),对其进行HPLC定量分析,结果显示所有目标成分均线性良好(2>0.999),平均回收率均在95.30%~103.56%,质量分数分别为原儿茶酸0.204~0.482 mg/g、原儿茶醛0.345~0.516 mg/g、葛根素5.374~8.805 mg/g、3′-甲氧基葛根素1.148~2.075 mg/g、葛根素芹菜糖苷1.327~2.204 mg/g、大豆苷1.378~2.276 mg/g、丹酚酸B 3.065~4.918 mg/g以及丹参酮IIA0.412~0.594 mg/g。所建立的成分鉴定、指纹图谱和定量分析方法稳定可行、结果可靠,适用于TJC的综合质量评价,可为TJC产品的质量控制提供参考借鉴。
通脉降糖胶囊;HPLC;指纹图谱;质量控制;Q-Exactive;原儿茶酸;原儿茶醛;葛根素;3′-甲氧基葛根素;葛根素芹菜糖苷;大豆苷;丹酚酸B;丹参酮IIA
通脉降糖胶囊(Tongmai Jiangtang Capsule,TJC)收载于国家药品监督管理局国家药品标准[WS-11213(ZD-1213)-2002-2012Z][1],国药准字Z20026853。其以玄参、黄芪为君药,黄连、太子参、水蛭、苍术、葛根为臣药,丹参、山药、绞股蓝为佐药,冬葵果为使药,具有养阴清热、活血通络之功效,用于气阴两虚、脉络瘀阻所致的消渴病(糖尿病)[2]。方中君药玄参清热凉血、滋阴降火,具有抗炎、保肝、抗氧化、抗血小板聚集等作用[3-4];黄芪性温、味甘,可补气升阳、益卫固表、托毒升肌、利水退肿,具有保护心血管、抗肿瘤、调节免疫、抗炎、抗氧化、抗衰老等作用[5-6]。臣药黄连清热燥湿、泻火解毒,具有降血糖、抗菌、抗炎、抗肿瘤、调血脂等作用[7];苍术祛风散寒、健脾化湿,有抗炎症肿瘤、降血糖、抑菌[8]的功效;太子参可生津润肺、益气健脾,主要有心肌保护、免疫调节、抗氧化、降血糖、抗应激、抗疲劳、抗肿瘤、镇咳等药理作用[9];葛根生津止渴、升阳止泻,具有解热、抗炎、抗感染、降血压、降血糖、调血脂、改善生殖功能等功效[10];水蛭为动物类中药,咸、苦,性平,归肝经,可破血通经、逐瘀消癥,具有抗凝血、抗血栓、抗肿瘤、抗炎症、保护脑及细胞等功效[11]。全方共奏燥湿化痰、活血通络、益气降糖之功。
已有研究表明,TJC在改善糖尿病性周围神经病变的神经功能、神经组织结构方面,具有明显的优势,是防止糖尿病神经病变的有效药物[12]。例如,将TJC联合化学药应用于治疗2型糖尿病且处在脑梗死恢复期的患者,可改善患者糖脂代谢,下调炎性因子表达水平,改善患者神经功能及短期预后效果[13]。张爱旗等[14]观察了106例气阴两虚、脉络瘀阻所致的糖尿病周围神经病变患者,发现TJC能改善血液流变学、神经缺血缺氧,同时提高神经传导速度,改善肢体麻木疼痛、感觉减退等症状。徐静等[15]观察100例病例,发现TJC能通过调节患者的血脂水平,减少高脂血症对血管内皮的损坏,在保护血管的同时进一步改善周围血液循环,起到对糖尿病神经病变的防治作用。张斌等[16]利用糖基化终末产物诱导大鼠模型研究发现,TJC可作用于微循环系统及神经细胞,并可能通过抑制白细胞介素-6及肿瘤坏死因子-α的表达抑制雪旺细胞凋亡。但是目前关于TJC的研究大多集中于药理及临床疗效方面,对其药效物质基础相关研究较少,仅对方中黄连、黄芪以及太子参的部分成分进行评价,未见针对TJC全方的化学轮廓定性分析及指标成分的定量研究。且现行质量标准中,仅对TJC中的盐酸小檗碱(来源于黄连)进行评价(不少于1.25 mg/g)[1],尚缺乏其他主要成分的质控依据。鉴于此,本实验采用高分辨液质联用技术,结合数据库筛查、文献检索、对照品比对等方式,对TJC全方进行化学成分的定性表征,同时建立TJC指纹图谱及HPLC多成分含量测定方法,为TJC的全面质量评价和控制提供依据。
1 仪器与材料
1.1 仪器
Agilent 1260 Infinity II高效液相色谱仪,美国Agilent科技有限公司;Thermo Fisher Q-Exactive高分辨质谱仪,连接Ultimate 3000高效液相色谱仪,美国Thermo Fisher公司;FA2004型电子天平,上海舜宇恒平科学仪器有限公司;KQ-300DE型数控超声波清洗器,昆山市超声仪器有限公司;Heraeus Fresco 21离心机,美国Thermo Fisher公司;DLAB MX-F型固定式混匀仪,北京大龙兴创实验仪器股份公司;101-1AB型电热鼓风干燥箱,天津赛得利斯实验分析仪器制造厂。
1.2 药品与试剂
TJC,批号200803、200502、201002、210302、190301、210902、210502、210603、210401、210501、220502、220103、220701、220601、220702,分别编号为S1~S15,由保定天浩制药有限公司提供。对照品:原儿茶醛,批号L17A9D59027,质量分数≥98%,上海源叶生物科技有限公司;原儿茶酸(批号A2108151,质量分数≥97%)、丹参酮IIA(批号D1720010,质量分数≥98%),上海阿拉丁生物科技有限公司;葛根素,批号RH135778,质量分数≥98%,上海易恩化学技术有限公司;3′-甲氧基葛根素(批号AF20073104,质量分数≥98%)、葛根素芹菜糖苷(批号AF20073106,质量分数≥98%)、大豆苷(批号AF9091822,质量分数≥98%)、丹酚酸B(批号AF20092021,质量分数≥98%),成都埃法生物科技有限公司。甲酸,体积分数88%,购自上海阿拉丁生物科技有限公司;乙腈、甲醇均为色谱纯,购自美国天地试剂公司;实验用水取自Milli-Q纯水机,Millipore公司。
2 方法与结果
2.1 溶液的配制
2.1.1 混合对照品溶液的制备 分别取原儿茶酸、原儿茶醛、葛根素、葛根素芹菜糖苷、3′-甲氧基葛根素、大豆苷、丹酚酸B、丹参酮IIA对照品适量,精密称定,置于同一量瓶中,加甲醇溶解并定容至刻度,制成质量浓度分别为0.10、0.10、1.00、0.40、0.24、0.40、1.00、0.10 mg/mL的混合对照品储备液。精密吸取混合对照品储备液依次稀释成质量浓度为原儿茶酸0.100、0.090、0.080、0.070、0.060、0.050、0.040、0.030、0.020、0.010 mg/mL,原儿茶醛0.100、0.090、0.080、0.070、0.060、0.050、0.040、0.030、0.020、0.010 mg/mL,葛根素1.000、0.900、0.800、0.700、0.600、0.500、0.400、0.300、0.200、0.100 mg/mL,葛根素芹菜糖苷0.400、0.360、0.320、0.280、0.240、0.200、0.160、0.120、0.080、0.040 mg/mL,3′-甲氧基葛根素0.240、0.135、0.120、0.105、0.090、0.075、0.060、0.045、0.030、0.015 mg/mL,大豆苷0.400、0.360、0.280、0.240、0.200、0.160、0.120、0.080、0.040、0.015 mg/mL,丹酚酸B1.000、0.900、0.800、0.700、0.600、0.500、0.400、0.300、0.200、0.100 mg/mL,丹参酮IIA0.100、0.090、0.080、0.070、0.060、0.050、0.040、0.030、0.020、0.010 mg/mL的混合对照品溶液。
2.1.2 供试品溶液的制备 取TJC内容物适量,混匀,精密称取100.0 mg,加入70%甲醇1 mL,密塞,称定质量。50 ℃超声提取2次,每次30 min,用70%甲醇补足减失的质量,摇匀,在4 ℃下以13 800×离心10 min,离心3次,合并上清液,稀释至原来的70%,即得供试品溶液。
2.2 利用HPLC-Q-Exactive-MS对TJC成分进行定性分析
2.2.1 色谱条件 色谱柱为Capcell Pak C18(150 mm×4.6 mm,3 μm);流动相A为0.5%甲酸水溶液,B为0.5%甲酸乙腈溶液;梯度洗脱:0~18 min,5%~18% B;18~23 min,18%~20% B;23~25 min,20%~30% B;25~40 min,30% B;40~42 min,30%~95% B;42~52 min,95% B;52~53 min,95%~5% B;53~58 min,5% B;检测波长203、260、280、310 nm;柱温40 ℃;体积流量0.4 mL/min;进样量5 μL。
2.2.2 质谱条件 使用Thermo Fisher Q-Exactive高分辨质谱仪,离子源为HESI源。负离子检测模式:辅助气体积流量30 L/min,喷雾电压2.8 kV,离子传输管温度400 ℃,辅助气温度100 ℃,碰撞能量(CE)为30 eV。检测方式为Full MS/dd-MS2,分辨率分别为70 000和17 500,扫描范围/110~1500。数据采集使用Thermo Xcalibur软件实现。
2.2.3 TJC化学成分的定性分析 按照“2.1.2”项下方法制备TJC供试品溶液,以“2.2.1”和“2.2.2”项下的条件对TJC的化学信息谱进行采集。根据高分辨质谱提供的准分子离子及二级碎片信息,通过对照品比对、参考文献建立数据库并以Compound Discoverer软件进行检索比对等方式,对各色谱峰进行推测与鉴定。推测出TJC中150种化合物。TJC的基峰离子流图(base peak chromatogram,BPC)见图1,各成分质谱信息见表1。
根据鉴定结果,TJC中化合物类别主要包括有机酸类、黄酮类、糖苷类、环烯醚萜类等。其中有机酸类包括奎宁酸、柠檬酸、香草酸、没食子酸、原儿茶酸、4--阿魏酰奎尼酸、咖啡酸、迷迭香酸、壬二酸、阿魏酸、丹酚酸A、丹酚酸B等。黄酮类化合物包含3′-甲氧基葛根素、葛根素、3′-羟基葛根素、大豆苷、芹菜甙、芒柄花苷芒柄花素等。环烯醚萜类化合物有哈巴苷、哈巴俄苷等。
2.3 TJC指纹图谱的建立
2.3.1 精密度考察 将批号分别为190301、200502和210502的药品等质量混匀,用于方法学验证。
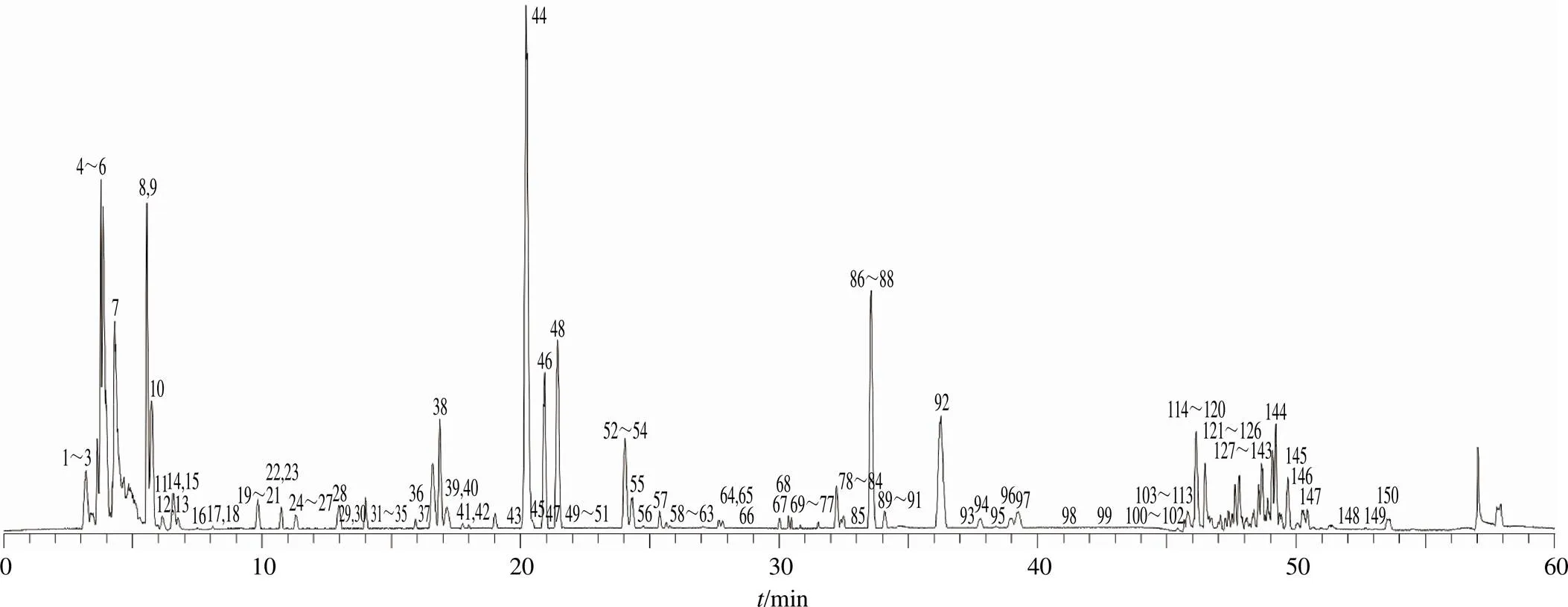
图1 TJC的BPC
表1 TJC中各成分的质谱信息
Table 1 Mass spectrometry information of components in TJC
峰号tR/min成分化学式母离子相对分子质量(m/z)主要碎片 (m/z) 理论值实测值偏差(×10−6) 13.37L-刀豆氨酸C5H12N4O3[M-H]−175.083 1 175.083 0 −0.57173.103 8, 146.960 4, 131.081 7 23.38L-组氨酸C6H9N3O2[M-H]−154.061 7 154.061 5 −1.30154.061 5, 137.034 9, 93.044 6 33.39L-精氨酸C6H14N4O2[M-H]−173.103 9 173.103 8 −0.58156.077 1, 146.960 4, 131.081 7 43.82麦芽糖C12H22O11[M-H]−341.108 4 341.109 0 1.76221.066 0, 179.055 7, 119.034 0, 89.023 3 53.83D-葡萄糖醛酸C6H10O7[M-H]−193.034 8 193.034 8 0.00191.055 7, 111.007 7, 103.002 6, 85.028 3 63.97奎宁酸C7H12O6[M-H]−191.055 6 191.055 5 −0.52111.007 7, 103.002 6, 85.028 3 74.26枸杞酸C12H18O11[M-H]−337.077 1 337.078 0 2.67277.056 7, 216.909 7, 174.016 3, 157.013 4 85.55柠檬酸C6H8O7[M-H]−191.019 2 191.019 1 −0.52173.008 9, 129.018 4, 111.077 6, 87.007 6 95.56尿苷C9H12N2O6[M-H]−243.061 7 243.062 2 2.06200.056 2, 152.034 6, 140.034 5, 110.023 7 105.772-哌啶甲酸C6H11NO2[M-H]−128.071 2 128.071 7 3.9082.028 6 115.97鸟苷C10H13N5O5[M-H]−282.083 8 282.084 9 3.90150.041 4, 133.014 6 126.27L-酪氨酸C9H11NO3[M-H]−180.066 1 180.066 2 0.56163.039 4, 152.916 9, 136.871 4, 119.049 2 136.29肌苷C10H12N4O5[M-H]−267.072 9 267.074 0 4.12230.940 8, 135.030 4, 129.018 4 146.40腺苷C10H13N5O4[M-H]−266.088 9 266.090 1 4.51150.041 4, 135.030 3, 129.018 3 156.75富马酸C4H4O4[2M-H]−231.014 1 231.014 7 2.60214.965 6, 188.926 8, 115.002 6, 96.958 9 167.58熊果苷C12H16O7[M-H]−271.081 8 271.082 9 4.06151.039 3, 123.044 3 178.01山栀苷C16H24O11[M-H]−391.124 0 391.125 5 3.84346.051 6, 237.206 0, 191.946 1, 183.066 0 188.10没食子酸C7H6O5[M-H]−169.013 7 169.013 6 −0.59126.026 9, 125.023 5 199.813,4-二氢甲基梓醇C16H26O10[M-H]−377.144 8 377.145 6 2.12310.870 9, 219.027 3, 174.955 5, 96.959 0 209.84丁香酸葡萄糖苷C15H20O10[M-H]−359.097 8 359.098 8 2.78197.045 2, 179.034 5, 72.991 9 219.99梓醇C15H22O10[M-H]−361.113 5 361.114 7 3.32/ 2210.73车叶草苷酸C18H24O12[M-H]−431.119 0 431.119 3 0.70385.098 1, 174.955 7, 137.023 6 2310.74哈巴苷C15H24O10[M+FA-H]−409.134 6 409.135 6 2.44294.030 2, 201.076 6, 183.065 9, 89.023 3 2411.16泛酸C9H17NO5[M-H]−218.102 8 218.103 3 2.29190.986 9, 146.081 5, 88.039 2 2511.29香草酸C8H8O4[M-H]−167.034 4 167.034 4 0.00149.023 6, 139.039 2, 123.044 3 2611.31丹参素C9H10O5[M-H]−197.045 0 197.045 1 0.51179.034 5, 135.044 3, 123.044 2, 72.991 9

续表1
续表1
峰号tR/min成分化学式母离子相对分子质量(m/z)主要碎片 (m/z) 理论值实测值偏差(×10−6) 6830.37毛蕊花糖苷C29H36O15[M-H]−623.197 6623.199 22.57 579.150 2, 461.168 0, 161.023 8 6930.65(S)-柚皮素C15H12O5[M-H]−271.060 6271.061 84.43 241.050 7, 201.022 6, 186.929 5 7030.66松脂醇葡萄糖苷C26H32O11[M-H]−519.186 6519.188 43.47 445.231 8, 357.134 9, 248.900 8, 151.039 4 7130.86柚皮苷C27H32O14[M-H]−579.171 4579.172 92.59 417.156 1, 402.132 7, 291.064 2, 181.050 1 7230.88异绿原酸AC25H24O12[M-H]−515.119 0515.120 32.52 253.050 6, 191.055 7, 174.955 6, 171.055 7 7331.14安格洛苷CC36H48O19[M-H]−783.271 2783.273 12.43 764.644 8, 461.167 8, 193.050 4, 175.039 6 7431.36ningposide AC18H22O9[M-H]−381.118 6381.119 83.15 362.933 6, 193.050 3, 174.955 4, 149.060 1, 134.036 5 7531.49柚皮素-7-O-葡萄糖苷C21H22O10[M-H]−433.113 5433.114 62.54 389.085 8, 311.056 2, 269.041 1, 178.998 2 7631.59肉苁蓉苷CC30H38O15[M-H]−637.213 2637.215 12.98 553.469 8, 304.914 8, 223.061 3, 161.023 8 7731.63丹酚酸EC36H30O16[M-H]−717.145 6717.147 83.07 339.051 5, 321.041 1, 295.061 8, 185.024 0 7832.03桂叶苷C29H36O13[M-H]−591.207 8591.209 73.21 473.125 4, 304.914 6, 174.955 6 7932.03scrophuloside A2C32H40O17[M-H]−695.218 7695.220 62.73 678.358 9, 599.312 1, 419.135 7, 145.028 8 8032.15ningposide CC17H20O8[M-H]−351.108 0351.109 33.70 328.062 2, 163.040 0, 145.028 8, 119.049 3 8132.23迷迭香酸C18H16O8[M-H]−359.076 7359.077 83.06 197.045 3, 179.034 6, 161.023 8, 135.044 4 8232.39丹酚酸AC26H22O10[M-H]−493.113 5493.114 82.64 295.061 7, 197.045 1, 185.024 0, 109.028 5 8332.39丹酚酸IC27H22O12[M-H]−537.103 3537.104 72.61 295.061 7, 185.024 0, 109.028 5, 61.987 2 8432.48壬二酸C9H16O4[M-H]−187.097 0187.097 00.00 169.086 5, 125.096 3, 97.064 8 8533.00二氢阿魏酸C10H12O4[M-H]−195.065 7195.066 54.10 182.022 0, 152.896 4, 128.034 6, 122.036 4 8633.46邻苯二甲酸C8H6O4[M-H]−165.018 8165.018 7−0.61 136.931 4, 121.028 6, 96.959 0 8733.55丹参酚酸BC36H30O16[M-H]−717.145 6717.146 91.81 339.051 5, 321.041 1, 295.061 6, 185.024 0 8833.60羟甲香豆素C10H8O3[M-H]−175.039 5175.039 1−2.29 160.016 1, 146.960 5, 118.965 3 8934.03阿魏酸C10H10O4[M-H]−193.050 1193.050 20.52 163.950 7, 134.036 6, 111.007 8, 61.987 2 9034.08黄芩苷C21H18O11[M-H]−445.077 1445.078 42.92 310.871 1, 269.046 2, 174.955 7 9134.08芒柄花苷C22H22O9[M+FA-H]−475.124 0475.125 02.10 267.066 8 9236.25白杨素C15H10O4[M-H]−253.050 1253.050 82.77 209.059 6, 149.144 5 9337.40甘草素C15H12O4[M-H]−255.065 7255.066 63.53 186.929 0, 153.018 6, 135.007 9, 119.049 2 9437.797,2′-二羟基-3′,4′-二甲氧基-C23H28O10[M-H]−463.160 4463.161 93.24 301.108 6, 287.088 8, 135.044 4, 121.028 5 异黄烷-7-O-β-D-葡萄糖苷 9538.40哈巴俄苷C24H30O11[M-H]−493.171 0493.172 32.64 165.055 2, 147.044 4, 89.023 3 9638.97槲皮素C15H10O7[M-H]−301.034 8301.035 83.32 273.040 8, 178.998 1, 151.002 9, 121.028 5 9739.25金合欢素C16H12O5[M-H]−283.060 6283.061 53.18 268.038 2 9841.54龍膽根素C14H10O5[M-H]−257.045 0257.045 72.72 221.842 2, 186.928 9, 163.003 1, 135.007 9 9942.70熊竹素C17H14O6[M-H]−313.071 2313.072 12.87 298.048 8, 283.025 6, 174.955 6, 146.960 2 10045.42黄芪皂苷VIC47H78O19[M-H]−945.505 9945.507 01.16 / 10145.49hareftoside EC47H76O18[M-H]−927.495 3927.498 33.23 777.428 3, 764.584 7, 678.328 6, 442.217 1 10245.49人参皂苷Rb1C54H92O23[M-H]−1 107.595 11 107.597 52.17 961.537 1, 799.488 8, 637.434 1, 475.379 6 10345.62地黄苷C31H40O15[M-H]−651.228 9651.231 43.84 562.208 1, 485.901 8, 329.235 4, 209.118 8 10445.637-O-methylisomucronulatolC18H20O5[M-H]−315.123 2315.124 43.81 297.114 1, 285.114 5, 211.134 5, 180.912 2, 112.984 7 10545.68芹菜素C15H10O5[M-H]−269.045 0269.046 24.46 225.149 5, 165.978 6, 151.003 0, 119.049 2 10645.69wistariasaponin B2C48H78O19[M-H]−957.505 9957.507 71.88 911.500 9, 764.678 4, 749.446 4, 667.407 3, 497.122 7 10745.80异丁香酚甲醚C11H14O2[M-H]−177.091 6177.091 5−0.56 150.030 3, 135.044 5, 123.018 8 10845.83垂崖豆藤异黄烷醌C17H16O6[M-H]−315.086 9315.087 82.86 285.082 7, 161.023 7, 109.028 5
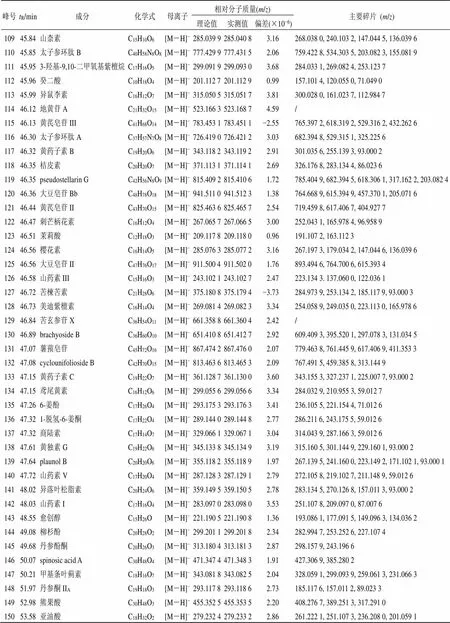
续表1
取混合TJC粉末制备的供试品溶液,按照“2.2.1”项下的色谱条件连续进样6次,以11号峰为参照峰(该色谱峰分离度较好,且有较大的峰面积),计算25个共有峰的相对保留时间以及相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于0.59%,相对峰面积的RSD均小于3.34%,表明该方法精密度良好。
2.3.2 中间精密度考察 将批号为210501、210502和220502的药品等质量混匀,按照“2.1.2”项下方法,在不同时期,由2名实验人员分别平行制备6份供试品溶液,各自制备TJC供试品溶液,按照“2.2.1”项下的色谱条件进样,以11号峰为参照峰计算25个共有峰的相对保留时间以及相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于1.46%,相对峰面积的RSD均小于4.89%,表明该方法中间精密度良好。
2.3.3 重复性考察 取“2.3.1”项所述混合TJC粉末,按照“2.1.2”项下方法平行制备6份供试品溶液。按照“2.2.1”项下色谱条件进样测定,以11号峰为参照峰,计算25个共有峰的相对保留时间以及相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于0.16%,相对峰面积的RSD均小于4.70%,表明该检测方法重复性良好。
2.3.4 稳定性考察 取“2.3.1”项所述混合TJC粉末,按照“2.1.2”项下方法制备供试品溶液,制备后样品置于4 ℃冰箱。分别于制备后0、2、4、6、10、12 h,按照“2.2.1”项色谱条件进样测定,以11号峰为参照峰,计算25个共有峰的相对保留时间以及相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于1.74%,相对峰面积的RSD均小于4.62%,表明12 h内供试品溶液的稳定性良好。
2.3.5 HPLC指纹图谱的采集 取15个不同批次的TJC,依照“2.1.2”项下方法分别制备15批TJC供试品溶液,按照“2.2.1”项下色谱条件进样,记录色谱图。用《中药色谱指纹图谱相似度评价系统(2012版本)》对所得15批样品的色谱图进行分析,以其中的S1图谱作为参照谱,采用多点校正后进行自动匹配(时间窗为0.1 min),用中位数法生成指纹图谱以及对照图谱(图2)。
2.3.6 共有峰的指认 根据指纹图谱结果,共标定25个色谱峰。通过与混合对照品(图3)进行比对,分别指认了8个色谱峰,其中6号峰为原儿茶酸、9号峰为原儿茶醛、11号峰为葛根素、12号峰为葛根素芹菜糖苷、13号峰为3′-甲氧基葛根素、15号峰为大豆苷、18号峰为丹酚酸B、25号峰为丹参酮IIA。由于11号峰面积最大、分离度良好、出峰时间适中,故选择此峰为参照峰。
2.3.7 相似度评价 用《中药色谱指纹图谱相似度评价系统(2012版本)》对所得15批TJC样品的指纹图谱以及其对照图谱进行相似度计算,结果见表2。15批次样品(S1~S15)的指纹图谱与对照图谱的相似度分别为0.981、0.985、0.987、0.992、0.991、0.990、0.992、0.989、0.988、0.984、0.973、0.982、0.990、0.987、0.979。结果显示,15批TJC与对照谱图的相似度均在0.97以上,这表明15批次TJC之间的差异较小,其质量的稳定性和均一性良好。

图2 15批TJC的指纹图谱 (S1~S15) 和对照图谱(R)

6-原儿茶酸 9-原儿茶醛 11-葛根素 12-葛根素芹菜糖苷 13-3′-甲氧基葛根素 15-大豆苷 18-丹酚酸B 25-丹参酮IIA
2.4 HPLC测定TJC中8种指标成分的含量
2.4.1 线性关系考察 将一系列混合对照品溶液按照“2.2.1”项下的色谱条件依次进样,以质量浓度为横坐标(),峰面积为纵坐标(),得到各成分的回归方程及线性范围,结果见表3。根据结果可知,在较宽的质量浓度范围内,所有校准曲线均表现出良好的线性(2>0.999),检测限和定量限分别在0.287~1.001 μg/mL和0.869~3.034 μg/mL。
2.4.2 精密度试验 取“2.3.1”项所述混合TJC粉末制备的供试品溶液,按照“2.2.1”项下色谱条件连续进样6次,得8种指标成分原儿茶酸、原儿茶醛、葛根素、葛根素芹菜糖苷、3′-甲氧基葛根素、大豆苷、丹酚酸B、丹参酮IIA的保留时间以及含量,计算其RSD分别为0.46%、0.61%、0.39%、0.33%、0.32%、0.25%、0.07%、0.02%和1.09%、0.24%、0.31%、0.43%、1.48%、0.85%、0.36%、0.70%。由结果可知,8种化合物保留时间的RSD均小于0.61%,含量的RSD均小于1.48%,表明该方法进样精密度良好。
2.4.3 中间精密度考察 取“2.3.2”项所述混合TJC粉末,按照“2.1.2”项下方法,在不同时期,由2名实验人员分别平行制备6份供试品溶液,各自制备TJC供试品溶液,按照“2.2.1”项下的色谱条件进样,得8种指标成分原儿茶酸、原儿茶醛、葛根素、葛根素芹菜糖苷、3′-甲氧基葛根素、大豆苷、丹酚酸B、丹参酮IIA的保留时间及含量,计算其RSD值分别为0.44%、0.48%、0.50%、0.63%、0.55%、0.72%、0.86%、0.35%和1.90%、3.99%、3.43%、2.37%、3.93%、2.95%、2.86%、1.28%。由结果可知,8种指标成分保留时间的RSD均小于0.86%,含量的RSD均小于3.99%,表明该方法中间精密度良好。
表2 15批次TJC相似度评价结果
Table 2 Similarities of 15 batches of TJC
样品相似度 S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15对照 S11.0000.9770.9690.9640.9600.9770.9790.9740.9640.9740.9490.9630.9620.9540.9590.981 S20.9771.0000.9610.9720.9700.9680.9700.9650.9720.9580.9690.9760.9690.9600.9730.985 S30.9690.9611.0000.9900.9900.9770.9870.9900.9850.9900.9330.9530.9720.9640.9560.987 S40.9640.9720.9901.0000.9900.9870.9860.9850.9860.9780.9560.9650.9760.9790.9630.992 S50.9600.9700.9900.9901.0000.9780.9810.9830.9860.9770.9540.9660.9840.9770.9670.991 S60.9770.9680.9770.9870.9781.0000.9840.9780.9740.9720.9660.9720.9770.9830.9580.990 S70.9790.9700.9870.9860.9810.9841.0000.9950.9870.9910.9490.9610.9780.9710.9610.992 S80.9740.9650.9900.9850.9830.9780.9951.0000.9870.9920.9370.9540.9770.9630.9610.989 S90.9640.9720.9850.9860.9860.9740.9870.9871.0000.9820.9440.9530.9750.9630.9610.988 S100.9740.9580.9900.9780.9770.9720.9910.9920.9821.0000.9260.9470.9700.9560.9530.984 S110.9490.9690.9330.9560.9540.9660.9490.9370.9440.9261.0000.9870.9650.9800.9570.973 S120.9630.9760.9530.9650.9660.9720.9610.9540.9530.9470.9871.0000.9710.9760.9630.982 S130.9620.9690.9720.9760.9840.9770.9780.9770.9750.9700.9650.9711.0000.9840.9790.990 S140.9540.9600.9640.9790.9770.9830.9710.9630.9630.9560.9800.9760.9841.0000.9650.987 S150.9590.9730.9560.9630.9670.9580.9610.9610.9610.9530.9570.9630.9790.9651.0000.979 对照0.9810.9850.9870.9920.9910.9900.9920.9890.9880.9840.9730.9820.9900.9870.9791.000
表3 HPLC测定TJC主要成分的标准曲线和范围
Table 3 Standard curves and ranges of main ingredients in TJC by HPLC determination
成分回归方程R2线性范围/(mg·mL−1)检测限/(μg·mL−1)定量限/(μg·mL−1) 原儿茶酸Y=19 147 X-1.462 30.999 00.010~0.0800.8922.704 原儿茶醛Y=60 924 X-125.30.999 00.020~0.0800.6301.909 葛根素Y=21 375 X-99.5860.999 30.100~0.9000.2870.869 葛根素芹菜糖苷Y=15 083 X-58.8780.999 10.040~0.4001.0013.034 3′-甲氧基葛根素Y=21 374 X-26.1050.999 60.030~0.2400.9102.757 大豆苷Y=23 127 X-124.840.999 50.015~0.2400.4401.333 丹酚酸BY=15 166 X-25.8890.999 10.100~0.8000.3290.996 丹参酮IIAY=32 880 X-79.70.999 30.020~0.0800.5721.733
2.4.4 重复性考察 取“2.3.1”项所述混合TJC粉末适量,按照“2.1.2”项下方法平行制备6份供试品溶液,按照“2.2.1”项下色谱条件依次进样,得8种指标成分原儿茶酸、原儿茶醛、葛根素、葛根素芹菜糖苷、3′-甲氧基葛根素、大豆苷、丹酚酸B、丹参酮IIA的保留时间以及含量,计算其RSD值分别为0.07%、0.05%、0.07%、0.05%、0.04%、0.04%、0.05%、0.01%和2.28%、2.47%、2.38%、4.50%、2.39%、2.31%、2.43%、1.57%。由结果可知,8种指标成分保留时间的RSD均小于0.07%,含量的RSD均小于4.50%,表明该方法重复性良好。
2.4.5 稳定性考察 取“2.3.1”项所述混合TJC粉末,按照“2.1.2”项下方法制备供试品溶液,制备后样品置于4 ℃冰箱。分别于制备后0、2、4、6、10、12 h,按照“2.2.1”项色谱条件进样,得8种指标成分原儿茶酸、原儿茶醛、葛根素、葛根素芹菜糖苷、3′-甲氧基葛根素、大豆苷、丹酚酸B、丹参酮IIA的保留时间及含量,计算其RSD值分别为0.66%、0.36%、0.33%、0.27%、0.24%、0.29%、0.16%、0.02%和4.46%、0.51%、0.17%、4.50%、1.97%、0.54%、0.60%、0.35%。结果显示,8种指标成分保留时间的RSD均小于0.66%,含量的RSD均小于4.50%,表明12 h内供试品溶液的稳定性良好。
2.4.6 加样回收率考察 取“2.3.1”项所述混合已知含量(原儿茶酸0.560 mg/g,原儿茶醛0.474 mg/g,葛根素7.210 mg/g,葛根素芹菜糖苷1.756 mg/g,3'-甲氧基葛根素1.860 mg/g,大豆苷1.778 mg/g,丹酚酸B 4.582 mg/g,丹参酮IIA0.496 mg/g)的TJC粉末,分别称取9份,每份约0.05 g,随机分成3组。采用标准添加法进行加样回收试验,每组样品中分别加入用70%甲醇水溶液配制的相当于原药中8种指标成分含量的80%、100%、120%的混合对照品溶液1 mL,密塞称定质量。50 ℃超声提取2次,每次30 min,用70%甲醇补足减失的质量,摇匀,在4 ℃下以13 800×离心10 min,离心3次,合并上清液,按照“2.2.1”项下色谱条件进样检测,记录8种指标成分的峰面积。根据标准曲线进行定量,最终质量浓度均在线性范围内。结果原儿茶酸、原儿茶醛、葛根素、葛根素芹菜糖苷、3′-甲氧基葛根素、大豆苷、丹酚酸B、丹参酮IIA的平均回收率分别为96.44%、98.39%、95.30%、102.15%、101.30%、103.56%、97.28%、96.19%,计算其RSD值分别为2.44%、4.12%、1.48%、4.15%、2.17%、3.92%、3.10%、4.43%。8种指标成分的平均回收率均在95.30%~103.56%,且RSD均小于4.43%,该方法的准确性良好。
2.4.7 含量测定 按照“2.1.2”项下方法制备15批不同批次(S1~S15)的TJC供试品溶液,按照“2.2.1”项下色谱条件进行检测,各批次重复进样3次。记录8种指标成分的峰面积,并根据标准曲线计算其含量,结果见表4。8种指标成分中,葛根素、丹酚酸B等含量较高且稳定,不同批次间含量差异较小。原儿茶酸的含量最低且不稳定,不同批次间含量差异较大。
表4 15批次TJC中8种指标成分含量测定结果 (n = 3)
Table4 Content determination results of eight components of 15 batches of TJC(n = 3)
批号质量分数/(mg∙g−1) 原儿茶酸原儿茶醛葛根素3′-甲氧基葛根素葛根素芹菜糖苷大豆苷丹酚酸B丹参酮IIA 2008030.3710.4645.3741.3921.327 1.5314.7260.560 2005020.2550.4086.9041.4071.931 1.6593.1870.526 2010020.2040.4425.9021.6081.663 1.5423.5700.519 2103020.2240.4006.4511.2961.826 1.6533.0650.555 1903010.2330.4157.0371.6921.876 1.5773.5230.594 2109020.4820.3896.3681.5051.685 1.5464.1490.452 2105020.3250.4886.1541.5161.715 1.8924.1680.482 2106030.3670.3655.6321.1611.423 1.5913.2260.514 2104010.2670.3455.7201.1481.671 1.5403.5070.548 2105010.2220.3595.7281.4691.597 1.3783.9340.470 2205020.3810.4518.1191.5562.102 1.9783.9710.466 2201030.4530.4787.1982.0752.111 1.7323.3770.412 2207010.3220.4927.1481.4391.915 1.6033.4620.531 2206010.2930.4918.8051.6262.204 2.2764.9180.558 2207020.2890.5167.7451.5401.985 1.9173.2930.558 RSD/%27.0912.6314.9815.0113.9413.5814.949.69
3 讨论
3.1 色谱条件的考察及提取方法的优化
3.1.1 色谱柱的优选 考察了Capcell Pak C18(150 mm×4.6 mm,3 μm)、Capcell Pak ADME(150 mm×4.6 mm,3 μm)、Agilent Poroshell 120 EC-C18(150 mm×3.0 mm,2.7 μm)3种不同型号的色谱柱,结果显示,经Capcell Pak C18(150 mm×4.6 mm,3 μm)色谱柱分离后,各色谱峰的分离效果最好,峰形尖锐,柱效最高,故选用Capcell Pak C18(150 mm×4.6 mm,3 μm)色谱柱进行本实验。
3.1.2 流动相条件的优选 分别考察了0.1%甲酸水溶液-乙腈、0.5%甲酸水溶液-乙腈、0.5%甲酸水溶液-0.5%甲酸乙腈溶液、0.1%甲酸水溶液-0.1%甲酸乙腈溶液等流动相体系。最终结果显示,使用0.5%甲酸水溶液-0.5%甲酸乙腈溶液作为流动相时,洗脱效果最好,出峰情况良好,色谱峰的分离度较高,故选择0.5%甲酸水溶液-0.5%甲酸乙腈溶液作为实验最终的流动相。
3.1.3 柱温的优选 分别考察了30、35、40 ℃柱温条件下色谱峰的分离情况,结果显示在40 ℃条件下峰形最好,基线平稳,噪音较低,因此,选择40 ℃为最终柱温。
3.1.4 提取方法的优化 对TJC提取工艺中的提取溶剂进行优化。考察了纯甲醇、50%甲醇、70%甲醇和纯水作为提取溶剂时,对TJC中主要成分提取效率的影响。结果显示,70%甲醇作为提取溶剂时提取率最高,且基线平稳、出峰多、响应值相对较高,故最终选用70%甲醇作为提取溶剂。
3.2 综合分析
本研究利用HPLC-Q-Exactive MS对TJC进行全局定性分析,采用Full MS/dd-MS2检测模式结合数据库分析筛查、对照品比对、人工解析等方法,鉴定出TJC中150种化合物,为后续TJC药效研究提供了物质基础。同时,本实验建立了TJC的HPLC指纹图谱,并对其中8种特征性指标成分(原儿茶醛、原儿茶酸、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、丹参酮IIA)进行定量分析,结果显示,葛根中的葛根素以及丹参中的丹酚酸B的含量相对较高且均高于现行质量标准所述小檗碱,可作为TJC中的质量标志物,为TJC的多指标质量控制提供参考依据。
《本草纲目》中记载:“葛根,性甘、辛、平、无毒,主治:消渴、身大热、呕吐、诸弊,起阴气,解诸毒”,葛根具有降血糖、延缓衰老、调节血脂、促进造血功能等方面的作用,并应用于临床。葛根提取物能有效降低I型糖尿病小鼠的空腹血糖值并减缓因糖尿病产生的体质量下降情况[17-18]。葛根素可通过降血糖、调血脂、保护血管、抗氧化应激、减轻炎性反应和改善胰岛素抵抗等机制来防治糖尿病, 并且可以改善微血管、大血管及神经系统并发症的发生发展[19]。丹参-葛根药对能有效降低II型糖尿病大鼠的空腹血糖、血脂水平及肝肾功能指标,有效改善肾脏、胰脏病变[20]。结合上述研究结果,我们推断TJC治疗糖尿病的药效作用可能与其中的葛根素、丹酚酸B等化学成分有关。
通过上述研究,共鉴定TJC中150种化合物,主要包括有机酸类、黄酮类、糖苷类、环烯醚萜类以及糖类等;在TJC指纹图谱中共标定25个共有峰,比较15批次样品,发现其相似度在0.97以上;建立的HPLC定量方法稳定可靠,对8种主要成分(原儿茶醛、原儿茶酸、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、丹参酮IIA)进行了定量分析。
综上,TJC主要含有机酸类、黄酮类等活性成分,其生产工艺稳定,质量可控。葛根素、丹酚酸B、3′-甲氧基葛根素等化合物含量较高且稳定,可作为TJC的主要质量标志物。同时,本研究建立的中成药成分定性、定量分析及指纹图谱建立方法可为中药复方研究和质量控制提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家药典委员会. 国家食品药品监督管理局国家药品标准: WS-11213(ZD-1213)-2002-2012Z [S]. 2002.
[2] 依丽米热·努尔麦麦提, 赵红梅, 热依汗尼沙·亚克亚.通脉降糖胶囊联合二甲双胍治疗2型糖尿病的临床研究 [J]. 现代药物与临床, 2019, 34(8): 2416-2419.
[3] 李翎熙, 陈迪路, 周小江. 玄参化学成分、药理活性研究进展及其质量标志物分析预测 [J]. 中成药, 2020, 42(9): 2417-2426.
[4] 陈向阳, 翟硕, 徐露露, 等. UPLC-LTQ-Orbitrap HRMS法结合特征裂解途径分析玄参水提物中化学成分 [J]. 中草药, 2019, 50(12): 2822-2829.
[5] 张瑞华, 张静文, 刘玲, 等. 黄芪及其有效组分药理作用与临床应用现状 [J]. 陕西中医, 2021, 42(8): 1138-1141.
[6] Yin F, Zhou H F, Fang Y C,. Astragaloside IV alleviates ischemia reperfusion-induced apoptosis by inhibiting the activation of key factors in death receptor pathway and mitochondrial pathway [J]., 2020, 248: 112319.
[7] 盖晓红, 刘素香, 任涛, 等. 黄连的化学成分及药理作用研究进展 [J]. 中草药, 2018, 49(20): 4919-4927.
[8] 邓爱平, 李颖, 吴志涛, 等. 苍术化学成分和药理的研究进展 [J]. 中国中药杂志, 2016, 41(21): 3904-3913.
[9] 傅兴圣, 刘训红, 许虎, 等. 太子参研究现状与研发趋势 [J]. 中国新药杂志, 2012, 21(7): 757-760.
[10] Huang Y, Yang J H, Zhao Y,. Screening, optimization, and bioavailability research of natural deep eutectic solvent extracts from[J]., 2021, 26(3): 729.
[11] 杨洪雁, 杜智恒, 白秀娟. 水蛭药理作用的研究进展[J]. 东北农业大学学报, 2012, 43(3): 6.
[12] 杨文强, 于炎冰, 徐晓利, 等. 通脉降糖胶囊对糖尿病性大鼠周围神经病变的影响[J]. 中国中西医结合杂志, 2016, 36(7): 831-834.
[13] 安先勇, 肖柏春. 通脉降糖胶囊对2型糖尿病并脑梗死恢复期患者预后的影响 [J]. 解放军医药杂志, 2018, 30(4): 83-87.
[14] 张爱旗, 王会芳, 李志茹. 通脉降糖胶囊治疗糖尿病周围神经病变临床观察 [J]. 现代中西医结合杂志, 2012, 21(10): 1077.
[15] 徐静, 陈朋. 通脉降糖胶囊治疗糖尿病神经病变疗效分析 [J]. 中医药临床杂志, 2013, 25(4): 313-314.
[16] 张斌, 张黎, 于炎冰, 等. 通脉降糖胶囊对AGEs诱导的雪旺细胞凋亡的影响及机制 [J]. 中华神经医学杂志, 2015, 14(11): 1089-1094.
[17] Prasain J K, Peng N, Rajbhandari R,. The Chineseroot extract () ameliorates impaired glucose and lipid metabolism in obese mice [J]., 2012, 20(1): 17-23.
[18] Wong K H, Li G Q, Li K M,. Kudzu root: Traditional uses and potential medicinal benefits in diabetes and cardiovascular diseases [J]., 2011, 134(3): 584-607.
[19] 曹盼, 张樱山, 魏学明, 等. 葛根素药理作用研究新进展 [J]. 中成药, 2021, 43(8): 2130-2134.
[20] 张娜, 李雪嘉, 江晓红, 等. 丹参葛根药对治疗2型糖尿病的药效学研究 [J]. 广东药科大学学报, 2020, 36(6): 797-802.
Composition analysis and fingerprint establishment of Tongmai Jiangtang Capsule based on HPLC-Q-Exactive-MS and HPLC
WU Yu-jia,WAN Hao-fang, LIChang,WANHai-tong, YANG Jie-hong
Zhejiang Chinese Medical University, Hangzhou 310053, China
To establish a set of analytical methods for global qualitative analysis, HPLC fingerprint, and main component quantification of Tongmai Jiangtang Capsule (通脉降糖胶囊, TJC) based on HPLC-Q-Exactive-MS, so as to provide scientific evidence for overall quality evaluation and control of TJC.In the present study, Thermo Fisher LC-Q-Exactive MS system was applied to collect MS information of the TJC components, which was further elucidated with the help of related databases, former publication and standard substances. HPLC analysis of TJC samples from 15 different batches was performed on a Capcell Pak C18column (150 mm × 4.6 mm, 3 μm) using 0.5% formic acid aqueous solution and 0.5% formic acid acetonitrile solution as mobile phases. The column temperature was 40 ℃, and the flow rate was 0.4 mL/min. Chromatographic fingerprint similarity evaluation system (2012 edition) was applied for similarity evaluation, common peak identification, and simultaneous determination of eight index components was carried out.As the result, a total of 150 compounds in TJC were identified with high resolution HPLC-MS. The fingerprint similarities of TJC samples from 15 batches were all above 0.97, and 25 shared peaks were calibrated. Eight chromatographic peaks (representing protocatechuic acid, protocatechualdehyde, puerarin, 3′-methoxypuerarin, puerarin apigenoside, daidzein, salvianolic acid B, and tanshinone IIA) were identified and quantitatively analyzed with HPLC. The results showed that all target components had good linearity (2> 0.999), and the average recoveries were in the range of 95.30%—103.56%. The contents of protocatechuic acid, protocatechualdehyde, puerarin, 3′-methoxy puerarin, puerarin apigenoside, daidzein, salvianolic acid B and tanshinone IIAwere 0.204—0.482 mg/g, 0.345—0.516 mg/g, 5.374—8.805 mg/g, 1.148—2.075 mg/g, 1.327—2.204 mg/g, 1.378—2.276 mg/g, 3.065—4.918 mg/g and 0.412—0.594 mg/g, respectively.The integrated method for the qualitative, quantitative and fingerprint analysis of TJC established in this study was proven stable, feasible and reliable. It would be suitable for the comprehensive quality evaluation and control of TJC.
Tongmai Jiangtang Capsule; HPLC; fingerprint; quality control; Q-Exactive; protocatechuic acid; protocatechualdehyde; puerarin; 3′-methoxy puerarin; puerarin apigenoside; daidzein; salvianolic acid B; tanshinone IIA
R283.6
A
0253 - 2670(2022)21 - 6686 - 12
10.7501/j.issn.0253-2670.2022.21.005
2022-05-17
国家重点研发计划项目(2018YFC1704200);国家重点研发计划项目(2018YFC1704204);浙江省中医药科技计划项目(2021ZQ025);浙江省自然科学基金项目(LR19H280001)
武宇佳,硕士研究生,主要从事中医方剂药效物质基础研究。E-mail: wuyujia1306859001@163.com
杨洁红,博士,教授,主要从事中医方剂学研究。E-mail: yjhong@zcmu.edu.cn
[责任编辑 郑礼胜]

