多药耐药相关蛋白2对汉黄芩素及其主要II相代谢产物药动学特征的影响
郑 蓉,张淇淞,胡雪黎,徐 睿,彭国爽,昌冰琳,胡泽华,胥鑫林,杨 宝, 4*
多药耐药相关蛋白2对汉黄芩素及其主要II相代谢产物药动学特征的影响
郑 蓉1, 2,张淇淞2, 3, 4,胡雪黎1, 2,徐 睿1, 2,彭国爽1, 2,昌冰琳1, 2,胡泽华1, 2,胥鑫林1, 2,杨 宝1, 2, 4*
1. 湖北民族大学医学部,湖北 恩施 445000 2. 湖北民族大学,风湿性疾病发生与干预湖北省重点实验室,湖北 恩施 445000 3. 广西大学医学院,广西 南宁 530004 4. 广州中医药大学中药学院,广东 广州 510006
研究多药耐药相关蛋白2(multidrug resistance protein 2,MRP2)对汉黄芩素及其主要II相代谢产物药动学特征的影响。FVB野生型和−/−小鼠ig汉黄芩素β-环糊精包合物后,于不同时间点眼眶取血。采用超高效液相色谱-质谱联用技术检测汉黄芩素、汉黄芩苷、汉黄芩素-7--硫酸酯的血药浓度,采用DAS 2.0软件以非房室模型计算药动学参数。3个成分的线性关系良好,准确度、精密度、稳定性、回收率等符合要求。汉黄芩素主要以II相代谢产物汉黄芩苷和汉黄芩素-7--硫酸酯存在,均在30 min内达到最大血药浓度。汉黄芩苷的达峰浓度(max)和药时曲线下面积(AUC0~t)最高,汉黄芩素-7--硫酸酯次之,汉黄芩素最低。与FVB野生型组比较,−/−组汉黄芩苷和汉黄芩素-7--硫酸酯的max和AUC0~t显著增加(<0.05、0.01)。MRP2介导了汉黄芩苷和汉黄芩素-7--硫酸酯的外排过程,显著影响汉黄芩素的体内处置过程。
汉黄芩素;汉黄芩苷;汉黄芩素-7--硫酸酯;药动学;多药耐药相关蛋白2;II相代谢产物
汉黄芩素因具有多种药理活性而受到广泛关注[1-3]。药动学研究是中药活性成分临床前研究的重要部分,对于评估成药性、揭示作用途径发挥着重要作用。汉黄芩素的口服生物利用度仅为1.1%[4],血药浓度远低于其体外活性的有效浓度。黄酮类化合物的口服生物利用度较低可能是由于其容易被肝、肠中的代谢酶代谢,发生葡萄糖醛酸化和磺酸化等II相代谢反应[5]。部分黄酮类化合物的II相代谢产物是肝脏和小肠外排转运蛋白(如多药耐药相关蛋白和乳腺癌耐药蛋白)的底物,能够被外排转运蛋白外排入胆汁或者肠腔,进而影响其体内过程[5-6]。因此,研究外排转运蛋白对黄酮类化合物的药动学行为的影响具有重要意义。
研究发现,汉黄芩素在体内主要发生葡萄糖醛酸化和磺酸化代谢,生成汉黄芩苷和汉黄芩素-7--硫酸酯,以汉黄芩苷的含量最高[4,7-8]。但是目前未见多药耐药相关蛋白2(multidrug resistance protein 2,MRP2)对汉黄芩素及其主要II相代谢产物的药动学行为影响的报道,尚不能全面地阐述其体内处置过程。另外,由于缺乏汉黄芩素-7--硫酸酯商业对照品,相关汉黄芩素的药动学研究也未准确定量其血药浓度。−/−小鼠是以野生型FVB小鼠为基因背景鼠,敲除基因建立的基因敲除小鼠模型,目前广泛应用于药物的摄取和消除机制研究。基于此,本研究拟采用酶催化法合成汉黄芩素-7--硫酸酯对照品,建立测定血浆中汉黄芩素、汉黄芩苷、汉黄芩素-7--硫酸酯的超高效液相色谱-质谱联用(UPLC-MS/MS)方法,并以FVB野生型和−/−小鼠为受试对象,研究MRP2对汉黄芩素及其主要II相代谢产物药动学行为的影响。
1 材料
1.1 动物
SPF级雄性−/−小鼠,体质量20~30 g,购自上海南方模式生物科技发展有限公司,合格证号312024300004357。SPF级雄性FVB野生型小鼠,体质量24~30 g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010。动物在恒温、自然光暗周期条件下饲养1周后进行实验。动物实验经湖北民族大学医学伦理委员会批准(批准号202148)。
1.2 药品与试剂
对照品汉黄芩素(批号RP200729,质量分数为98.0%)、汉黄芩苷(批号RP210215,质量分数为98.0%)购自成都麦德生科技有限公司;甘草苷对照品(批号wkq21021901,质量分数为98.0%)购自四川省维克奇生物科技有限公司;汉黄芩素-7--硫酸酯根据本课题组前期报道方法[6,9]采用酶催化法合成,质量分数大于98.0%;色谱乙腈、二甲基亚砜、β-环糊精购自默克公司;色谱级甲酸购自麦克林生化科技有限公司。
1.3 仪器
Xevo G2-XS Q/TOF质谱仪、UNIFI软件(美国Waters公司);Concentrator plus真空离心浓缩仪(德国Eppendoff公司);TGL-20M型高速冷冻离心机(湖南湘仪实验仪器有限公司);ME204型电子分析天平(梅特勒-托利多公司);Milli-Q超纯水系统(美国密理博公司)。
2 方法与结果
2.1 色谱条件
Waters HSS T3色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.05%甲酸乙腈(A)-0.05%甲酸水溶液(B),梯度洗脱:0~3.5 min,20%~58% A;3.5~5.0 min,58%~90% A;5.0~6.0 min,90%~100% A;6.0~6.5 min,100%~20% A;6.5~9.5 min,20% A。体积流量0.4 mL/min;柱温40 ℃;进样体积7 μL。
2.2 质谱条件
电喷雾电离源负离子模式;毛细管电压−3.0 kV;离子源温度130 ℃;脱溶剂气体积流量900 L/h,温度500 ℃;扫描范围/200~600。采用一级质谱定量,汉黄芩素(R=4.04 min,/284.068 5)、汉黄芩素-7--硫酸酯(R=3.12 min,/364.025 3)、汉黄芩苷(R=2.53 min,/460.100 6)、甘草苷(内标,R=1.77 min,/417.118 6)。
2.3 溶液的配制
精密称取汉黄芩苷、汉黄芩素-7--硫酸酯、汉黄芩素对照品适量,加甲醇溶解,配制成浓度分别为100.0、38.0、100.0 μmol/L的对照品储备液。精密移取各对照品储备液适量,配制成汉黄芩苷、汉黄芩素-7--硫酸酯、汉黄芩素浓度为8.0、1.0、1.0 μmol/L的混合对照品储备液,临用前稀释为系列浓度的混合对照品工作液。
精密称取甘草苷对照品适量,加甲醇溶解,配制成浓度为80 nmol/L的内标工作液。
2.4 血浆样品的处理
精密吸取10 μL血浆,加入10 μL内标溶液和80 μL甲醇后涡旋2 min,13 000 r/min离心15 min,吸取上清并真空干燥。用30 μL甲醇复溶,13 000 r/min离心15 min,吸取上清液待测。
2.5 汉黄芩素β-环糊精包合物混悬液的制备
参照本课题组前期报道的方法[6]制备汉黄芩素β-环糊精包合物混悬液,称取7.5 g β-环糊精,加入30 mL 0.9%氯化钠溶液,搅拌至溶解。分别精密称取10、5 mg汉黄芩素,用1.0 mL DMSO-EtOH混合溶剂按1∶1比例溶解,缓慢滴入9.0 mL 25% β-环糊精溶液,40 ℃恒温搅拌(350 r/min)2 h,即得质量浓度分别为1.0、0.5 mg/mL的汉黄芩素β-环糊精包合物混悬液。
2.6 方法学考察
2.6.1 专属性试验 空白血浆、空白血浆+混合对照品+内标、ig给药后血浆样品按“2.4”项下方法处理后进样检测,结果见图1。3个待测成分和内标的分离度和响应较好,无明显干扰。
2.6.2 线性关系与定量下限 在空白血浆中加入不同浓度的混合对照品工作液,配制成汉黄芩素和汉黄芩素-7--硫酸酯浓度为1.9、3.9、7.8、15.6、31.3、62.5、125.0、250.0、500.0 nmol/L,汉黄芩苷浓度为3.9、7.8、15.6、31.3、62.5、125.0、250.0、500.0、1 000.0、2 000.0、4 000.0 nmol/L的含药血浆样品,按“2.4”项下方法处理,进样检测。以待测成分和内标峰面积的比值()对浓度()进行线性回归,权重为1/2。根据信噪比/=10计算定量下限。汉黄芩苷的回归方程为=0.032+0.019,2=0.995 5,线性范围为1.5~4 000.0 nmol/L,定量下限为1.5 nmol/L;汉黄芩素-7--硫酸酯的回归方程为=0.075+0.001,2=0.996 5,线性范围为1.4~500.0 nmol/L,定量下限为1.4 nmol/L;汉黄芩素的回归方程为=0.026-0.004,2=0.996 0,线性范围为1.5~500.0 nmol/L,定量下限为1.5 nmol/L。各成分在相应范围内线性关系良好,灵敏度较高。
2.6.3 精密度与准确度试验 在空白血浆中加入不同浓度的混合对照品工作液,配制成汉黄芩苷浓度为3.9、500.0、4 000.0 nmol/L,汉黄芩素和汉黄芩素-7--硫酸酯浓度为3.9、31.3、500.0 nmol/L的含药血浆样品,按“2.4”项下方法处理,配制成低、中、高浓度的质控样品,连续测定3 d,计算准确度和精密度。结果见表1,日内和日间精密度的RSD均小于12.3%,准确度的RE为−10.9%~11.1%。
2.6.4 稳定性试验 低、中、高浓度的质控样品按25 ℃放置24 h、−20 ℃反复冻融3次、−80 ℃储存30 d考察稳定性,结果见表2,3个成分的RSD均小于13.0%,RE为−11.3%~8.7%。
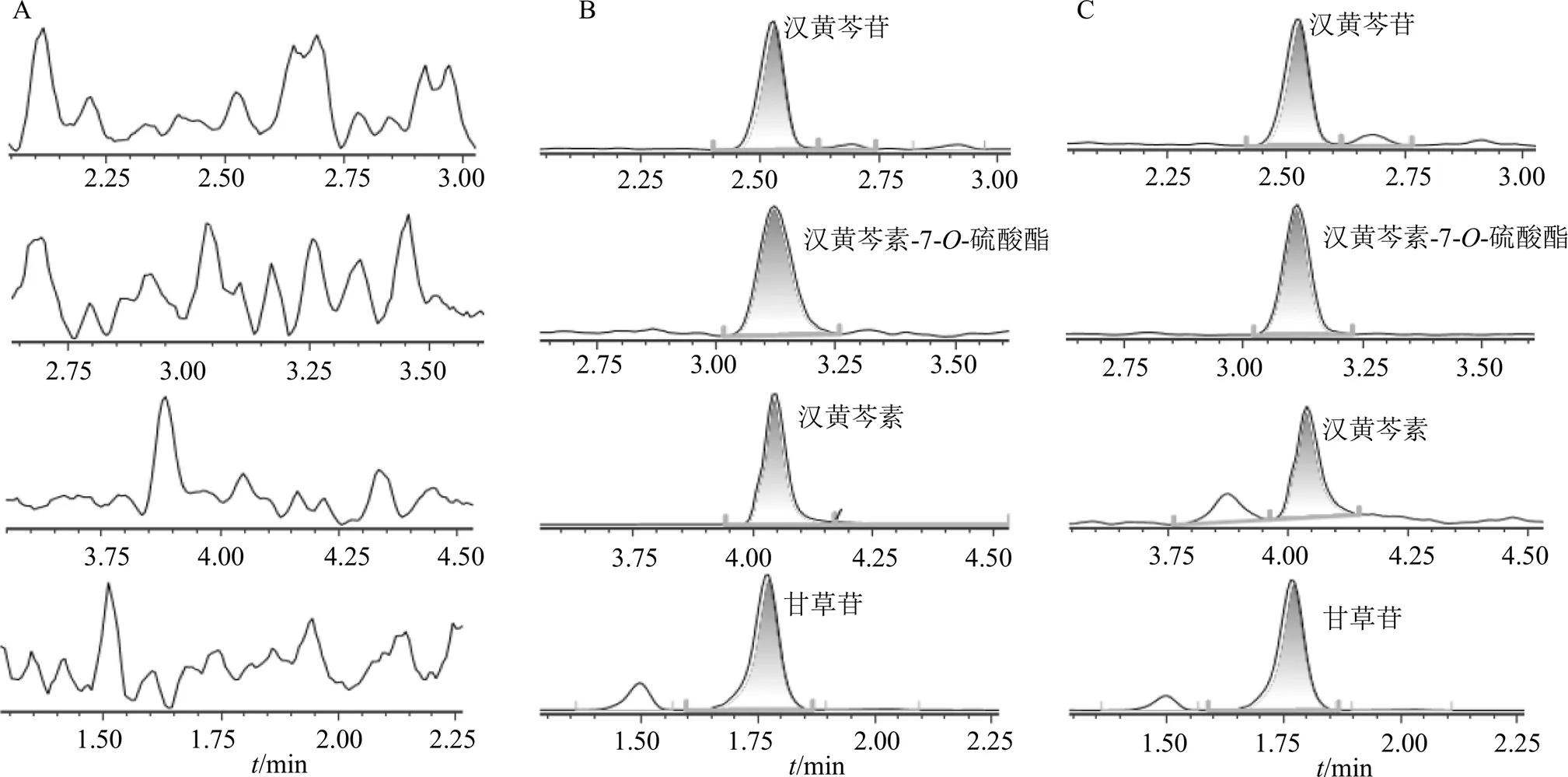
图1 空白血浆 (A)、空白血浆+对照品+内标(B)、给药后血浆样品(C) 中3个待测成分和内标的提取离子流图
表1 3个待测成分的精密度、准确度、基质效应和回收率试验结果 (n= 6)
Table 1 Precision, accuracy, matrix effect and recovery tests of three compounds (n= 6)
成分浓度/(nmol·L−1)精密度RSD/%准确度RE/%回收率/%基质效应/% 日内日间日内日间 汉黄芩苷4 000.04.33.9−4.1−3.592.8±5.593.8±6.7 500.07.36.8−2.8−4.191.0±6.991.6±4.9 3.96.18.5−1.9−6.689.6±10.391.1±8.0 汉黄芩素-7-O-硫酸酯500.04.24.9−1.6−3.4104.6±8.796.5±10.6 31.38.19.3−2.27.299.5±8.694.7±10.7 3.912.211.511.17.194.4±7.188.1±5.0 汉黄芩素500.04.14.2−3.5−3.998.0±4.998.5±3.1 31.33.03.6−2.6−3.4102.1±6.489.4±6.8 3.97.912.3−5.4−10.999.7±4.490.9±4.3
表2 3个待测成分的稳定性试验结果(n= 6)
Table 2 Stability test results of three compounds (n= 6)
成分浓度/(nmol·L−1)25 ℃放置4 h−80 ℃储存30 d冻融3次循环 精密度RSD/%准确度RE/%精密度RSD/%准确度RE/%精密度RSD/%准确度RE/% 汉黄芩苷4 000.02.61.63.94.97.5−2.7 500.02.9−5.23.4−0.17.0−5.3 3.97.4−8.38.91.113.0−11.3 汉黄芩素-7-O- 硫酸酯500.01.8−3.85.5−2.27.00.3 31.39.13.87.4−7.88.86.9 3.99.1−6.49.9−2.47.73.3 汉黄芩素500.04.20.72.8−3.53.9−6.6 31.32.4−3.04.5−3.29.0−2.9 3.98.28.77.0−7.46.17.8
2.6.5 基质效应和提取回收率试验 在空白血浆中加入不同浓度的混合对照品工作液,按“2.4”项下方法处理后配制成低、中、高浓度的质控样品(A);另取空白血浆(B)和超纯水(C)各6份,按“2.4”项下方法处理后取上清液,加入不同浓度的混合对照品工作液和内标,配制成相当于质控样本浓度的低、中、高浓度的含药样品。进样分析,记录样品与内标的峰面积。以A与B的比值计算提取回收率,以B与C的比值计算基质效应。结果见表1,3个待测成分的提取回收率为89.6%~104.6%,基质效应为88.1%~98.5%。
2.7 药动学研究
将10只−/−小鼠和10只FVB野生型小鼠随机分为高、低剂量(10、5 mg/kg)组,每组5只,ig汉黄芩素β-环糊精包合物混悬液(10 mL/kg),给药前禁食12 h,自由饮水。于给药前及给药后3、7、15、30、60、90、120、180、300、480、720 min眼眶取血约50 μL,4 ℃、4500 r/min离心10 min,取全部血浆保存。测定各时间点的血药浓度,采用DAS 2.0软件以非房室模型处理血药浓度-时间数据,并计算药动学参数,结果见表3和图2。FVB野生型和−/−小鼠的大多数时间点血浆样品中均能检测到3个待测成分。汉黄芩素在FVB野生型和−/−小鼠的胃肠道内吸收迅速,30 min内血药浓度达到峰值,但达峰血药浓度(max)较低,小于55.0 nmol/L,且消除速度较快。汉黄芩苷的max和药时曲线下面积(AUC0~t)最高,汉黄芩素-7--硫酸酯次之,汉黄芩素最低。另外,3个待测成分的max和AUC0~t呈剂量相关性增长。部分待测成分的药时曲线呈现了明显的双峰现象,可能是与肝肠循环有关。
3 讨论
血浆样品前处理是药动学研究中的关键环节,本研究选择了有机溶剂沉淀蛋白法,考察了甲醇和乙腈作为溶剂时对待测成分的选择性和回收率的影响,结果表明均满足生物样本分析要求。内标选择了二氢黄酮类成分甘草苷,其性质稳定,与汉黄芩素的理化性质相似,且对待测成分无干扰。
本研究首先采用超高效液相色谱-四极杆飞行时间质谱技术分析了小鼠ig汉黄芩素后血浆中的代谢产物,结合文献报道[4,7-8],发现主要是以II相代谢产物形式存在,含量最高的是汉黄芩苷,其次是汉黄芩素-7--硫酸酯,其他代谢物的含量非常低。与许多黄酮类成分一样,汉黄芩素的生物利用度较低,主要是与其在体内广泛存在的II相代谢反应有关[7]。由于缺乏汉黄芩素-7--硫酸酯商用对照品,目前对于汉黄芩素II相代谢产物的体内过程研究主要集中在汉黄芩苷,未见汉黄芩素-7--硫酸酯的研究报道。
表3 3个待测成分的主要药动学参数(, n = 5)
与相应剂量的FVB野生型小鼠比较:*<0.05**<0.01
*< 0.05**< 0.01corresponding dose of FVB wild-type mice
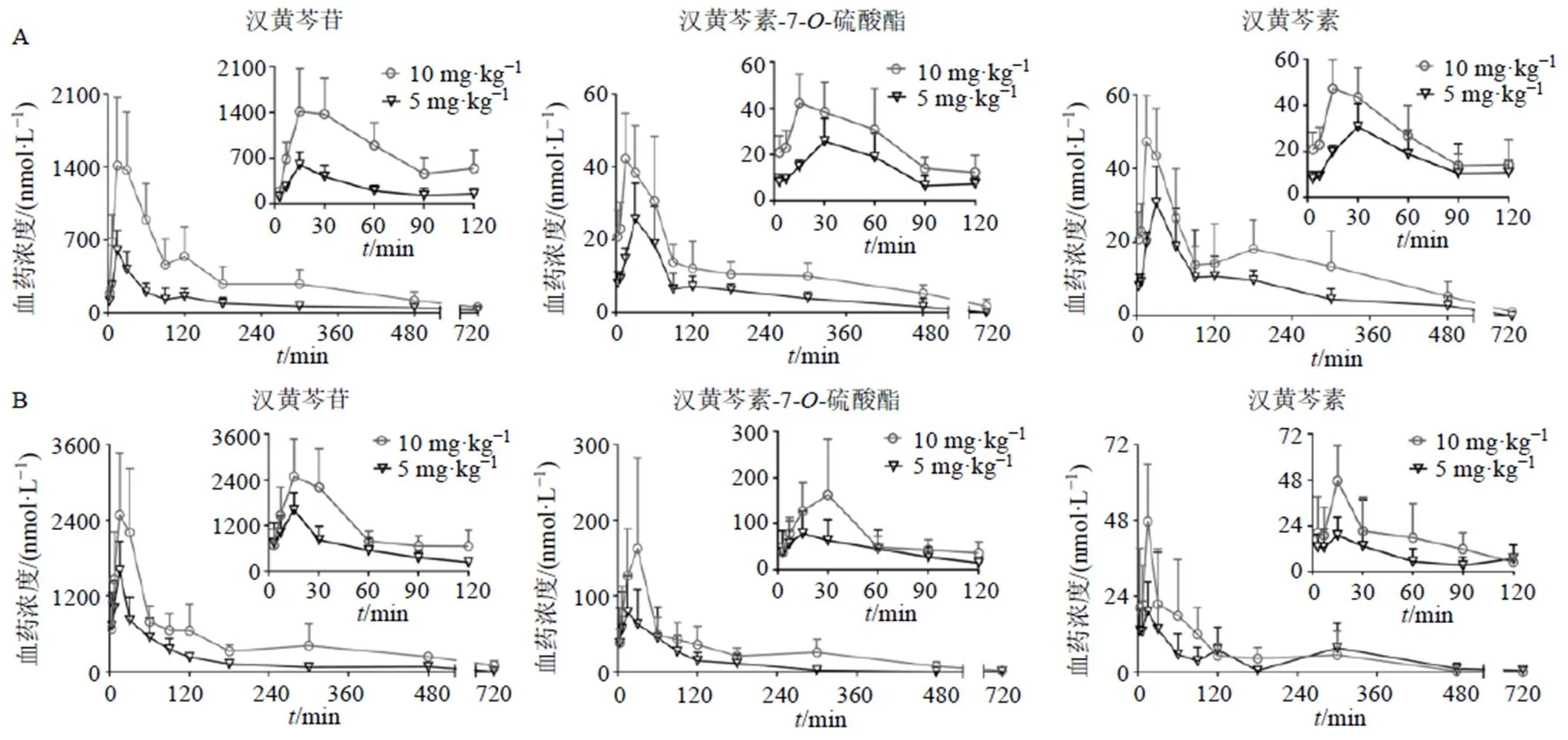
图2 FVB野生型小鼠(A) 和MRP2−/−小鼠(B) 血浆中3个待测成分的血药浓度-时间曲线图(, n = 5)
文献报道了多药耐药蛋白参与了黄酮类成分的体内过程,对其生物利用度有不同程度的影响,且部分黄酮类成分的葡萄糖醛酸化和磺酸化产物是外排转运蛋白的底物[5-6]。因此,多药耐药蛋白在黄酮类成分的体内过程中的作用受到了广泛的关注。金合欢素、槲皮素、毛蕊异黄酮等黄酮类成分的葡萄醛酸化和磺酸化代谢产物的外排过程受到多药耐药相关蛋白和乳腺癌耐药蛋白的调控[5-6,10-12],其中以多药耐药相关蛋白MRP1和MRP2为主。MRP2表达于肠道和肝脏细胞的顶膜侧,理论上会将汉黄芩苷和汉黄芩素-7--硫酸酯排入胆汁和肠腔,降低血药浓度。
本研究结果显示,ig低剂量(5 mg/kg)的汉黄芩素β-环糊精包合物混悬液后,汉黄芩苷在FVB野生型小鼠中的max和AUC0~t分别是汉黄芩素的18.1、15.4倍,是汉黄芩素-7--硫酸酯的21.5、22.0倍;汉黄芩苷在−/−小鼠中的max和AUC0~t是汉黄芩素的40.3、41.6倍,是汉黄芩素-7--硫酸酯的20.4、18.4倍。ig高剂量(10 mg/kg)的汉黄芩素β-环糊精包合物混悬液后,汉黄芩苷在FVB野生型小鼠中的max和AUC0~t分别是汉黄芩素的35.0、24.5倍,是汉黄芩素-7--硫酸酯的35.9、31.3倍;汉黄芩苷在−/−小鼠中的max和AUC0~t是汉黄芩素的54.3、100.7倍,是汉黄芩素-7--硫酸酯的15.3、18.6倍。提示汉黄芩素的生物利用度较低,在体内主要发生C-7位葡萄醛酸化反应,其次是C-7位磺酸化反应。
与FVB野生型小鼠比较,2个给药剂量下−/−组的汉黄芩苷和汉黄芩素-7--硫酸酯的max和AUC0~t均显著升高,与理论趋势相符[10]。其中低剂量下汉黄芩苷max和AUC0~t分别升高了1.7、0.8倍,高剂量下升高了0.4、0.5倍;低剂量下汉黄芩素-7--硫酸酯的max和AUC0~t分别升高了1.8、1.2倍,高剂量下升高了2.4、1.5倍。
与FVB野生型小鼠比较,−/−组汉黄芩素的max变化无统计学差异,AUC0~t有所降低。提示MRP2对汉黄芩素的体内过程有着重要影响,可能参与调控其II相代谢产物汉黄芩苷和汉黄芩素-7--硫酸酯的外排过程,其中对磺酸化代谢的影响更加明显。
本研究采用−/−小鼠研究了MRP2对汉黄芩素及其主要II相代谢产物汉黄芩苷和汉黄芩素-7--硫酸酯药动学行为的影响。结果显示汉黄芩素ig给药后主要以汉黄芩苷和汉黄芩素-7--硫酸酯存在,MRP2介导了汉黄芩苷和汉黄芩素-7--硫酸酯的外排过程,显著影响汉黄芩素的体内处置过程。
利益冲突 所有作者均声明不存在利益冲突
[1] 韦磊, 王绚, 陈雄, 等. 汉黄芩素缓解高脂饮食喂养−/−小鼠的动脉粥样硬化和NF-κB介导的动脉炎症反应 [J]. 天然产物研究与开发, 2021, 33(5): 750-757.
[2] Hong M, Almutairi M M, Li S Y,. Wogonin inhibits cell cycle progression by activating the glycogen synthase kinase-3 beta in hepatocellular carcinoma [J]., 2020, 68: 153174.
[3] Bei W, Jing L, Chen N. Cardio protective role of wogonin loaded nanoparticle against isoproterenol induced myocardial infarction by moderating oxidative stress and inflammation [J]., 2020, 185: 110635.
[4] Talbi A, Zhao D, Liu Q W,. Pharmacokinetics, tissue distribution, excretion and plasma protein binding studies of wogonin in rats [J]., 2014, 19(5): 5538-5549.
[5] Zheng L, Zhu L J, Zhao M,.exposure of kaempferol is driven by phase II metabolic enzymes and efflux transporters [J]., 2016, 18(5): 1289-1299.
[6] Zhang Q S, Zhu L J, Gong X,. Sulfonation disposition of acacetin:and[J]., 2017, 65(24): 4921-4931.
[7] 谢利霞, 周娟, 柳茜, 等. 汉黄芩素在FVB小鼠体内的磺酸化代谢特征研究 [J]. 世界临床药物, 2012, 33(7): 406-411.
[8] Liu W Y, Feng F. Metabolite identification and the development of a simultaneous quantification method for wogonin and wogonin-7--glucuronide: Application to a distribution study in mice liver [J]., 2011, 20(3): 282-289.
[9] Li Q, Wang L P, Dai P M,. A combined strategy of mass fragmentation, post-column cobalt complexation and shift in ultraviolet absorption spectra to determine the uridine 5′-diphospho-glucuronosyltransferase metabolism profiling of flavones after oral administration of a flavone mixture in rats [J]., 2015, 1395: 116-128.
[10] Yu J, Zhu L, Zheng H,. Sulfotransferases and breast cancer resistance protein determine the disposition of calycosinand[J]., 2017, 14(9): 2917-2929.
[11] Jiang H Y, Yu J, Zheng H H,. Breast cancer resistance protein and multidrug resistance protein 2 regulate the disposition of acacetin glucuronides [J]., 2017, 34(7): 1402-1415.
[12] Zhen Y, Wei Z, Song G,. Breast cancer resistance protein (ABCG2) determines distribution of genistein phase II metabolites: Reevaluation of the roles of ABCG2 in the disposition of genistein [J]., 2012, 40(10): 1883.
Effect of multidrug resistance protein 2 on pharmacokinetics of wogonin and its major phase Ⅱ metabolites
ZHENG Rong1, 2, ZHANG Qi-song2, 3, 4, HU Xue-li1, 2, XU Rui1, 2, PENG Guo-shuang1, 2, CHANG Bing-lin1, 2, HU Ze-hua1, 2, XU Xin-lin1, 2, YANG Bao1, 2, 4
1. Medical School, Hubei Minzu University, Enshi 445000, China 2. Hubei Provincial Key Laboratory of Occurrence and Intervention of Rheumatic Diseases, Hubei Minzu University, Enshi 445000, China 3. Medical College, Guangxi University, Nanning 530004, China 4. School of Pharmaceutical Sciences, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
To study the effect of multidrug resistance protein 2 (MRP2) on pharmacokinetic behaviors of wogonin and its major phase Ⅱ metabolites.FVB wild-type and−/−mice were taken blood from eye sockets at different time points after ig wogonin with β-cyclodextrin. The plasma concentrations of wogonin, wogonoside and wogonin-7--sulfate were determined by ultra-performance liquid chromatography coupled to mass spectrometry (UPLC-MS) method. The pharmacokinetic parameters were calculated by non-compartmental models with DAS 2.0 software.The linearity of three components was good, and accuracy, precision, stability and recovery rate met the requirements. Wogonin was mostly biotransformed to wogonoside and wogonin-7--sulfate and these analytes reached peak concentration (max) within 30 min. The plasmamaxandarea under the curve(AUC0~t) of wogonoside were the highest, followed by wogonin-7--sulfate, and wogonin was the lowest. Compared with FVB wild-type group,maxand AUC0~tof wogonoside and wogonin-7--sulfate in−/−group were significantly increased (< 0.05, 0.01).MRP2 mediated the efflux of wogonoside and wogonin-7--sulfate, significantly affected the disposal process of wogonin.
wogonin; wogonoside; wogonin-7--sulfate; pharmacokinetics; multidrug resistance protein 2; phase II metabolites
R285.61
A
0253 - 2670(2022)21 - 6779 - 06
10.7501/j.issn.0253-2670.2022.21.015
2022-07-31
国家自然科学基金资助项目(81560703);湖北民族大学大学生创新创业训练计划项目(S202110517027);广西大学高层次人才基金项目(A3370051006);风湿性疾病发生与干预湖北省重点实验室(湖北民族大学)项目(PT022202)
郑 蓉,女,本科,研究方向为中药药效物质基础。E-mail: 2219251481@qq.com。
杨 宝,博士,讲师,硕士生导师,研究方向为中药药效物质基础。E-mail: ybsept@qq.com
[责任编辑 李亚楠]

