白念珠菌定植对于免疫抑制宿主继发侵袭性感染的预测价值及免疫调控影响
朱 琤, 余跃天
作者单位:1. 上海交通大学医学院附属瑞金医院预防保健科,上海 200025;
2. 上海交通大学医学院附属仁济医院重症医学科。
侵袭性念珠菌病包括念珠菌血症和深部组织念珠菌感染,治疗时间长、费用高、预后差,因此引起广泛关注。目前易感人群已由恶性血液系统疾病患者转为免疫抑制宿主(immunocompromised host,ICH),而这其中念珠菌血症是近些年最常见的侵袭性念珠菌病。已有研究结果表明,白念珠菌血症归因死亡率为49%,全因死亡率高达60%[1]。目前对于ICH 在病程中发展为念珠菌血症的风险评估及准确预测仍不完善,但我们前期研究发现,此类患者在发生念珠菌血症前往往存在多部位的念珠菌定植[2]。当宿主免疫功能出现障碍时,假菌丝的组织侵袭能力得到进一步加强,进而使患者出现临床症状[3]。因此,念珠菌定植、念珠菌血症及宿主免疫状态三者之间的关系成为研究热点。虽然念珠菌定植指数及念珠菌评分等指标逐步应用于临床,但很少有与ICH 相关的研究。
定植是宿主机体对于病原微生物清除力与黏附力相互作用的结果,除皮肤黏膜屏障外,细胞介导的免疫反应是至关重要的抗真菌防御系统。由于白念珠菌细胞壁的组成部分 (1,3)-β-D 葡聚糖是一种促炎介质,会对宿主机体的免疫系统造成干扰,而我们的前期研究证实,对于白念珠菌气道定植患者抗真菌治疗可以使CD4 Th 淋巴细胞、白细胞介素(IL)-17A 等指标恢复得更快[4],但对于念珠菌血症发生后宿主机体的适应性免疫应答过程尚不了解。因此,我们设计此前瞻性观察性研究,试图进一步探索ICH 白念珠菌定植对于继发侵袭性感染的预测价值及侵袭性念珠菌感染发生后机体免疫调控与预后的关系。
1 材料与方法
1.1 研究对象
前瞻性观察性研究纳入2016 年1 月—2020 年12 月五年期间收治于仁济医院风湿免疫科及重症医学科ICH 合并白念珠菌血症患者。其中ICH 定义满足如下一项即可诊断:①长期(>3 个月)或大剂量口服泼尼松>0.5 mg·kg-1·d-1;②接受免疫抑制剂治疗;③存在原发性免疫缺陷疾病;④过去5 年由于实体肿瘤行化疗;⑤存在实体器官移植史;⑥存在血液系统恶性肿瘤病史[5]。若出现以下情况,则予以排除:①患者年龄<18 岁或>80 岁;②除白念珠菌外,存在其他引起血流感染的病原微生物。本研究由上海交通大学伦理委员会审核通过后准予执行,伦理审批号: No. 2016-Clinical-Res-083。
根据纳入ICH 合并白念珠菌血症患者的性别、年龄、基础疾病等指标,按1 ∶2 倾向匹配,无白念珠菌血症的ICH,其入选标准仍参考2013 年版美国感染病学会对于ICH 的定义[5]。
1.2 标本送检及菌株鉴定
疑似菌血症患者抽取2 个不同部位外周血标本,随即注入需氧及厌氧血培养瓶各2 套(法国生物梅里埃公司,需氧瓶259789 SA,厌氧瓶 259793 SN),置入全自动血培养仪(BacT/Alert24,法国生物梅里埃公司)。待仪器报阳后,进行涂片及革兰染色,同时接种于羊血哥伦比亚培养基及念珠菌科玛嘉培养基,待菌落生长完全后,用法国生物梅里埃公司全自动微生物分析系统VITEK-2 Compact 进行鉴定。
1.3 药敏试验
经血标本分离出的白念珠菌均使用比色微量稀释法进行药敏试验,其中所包含的药物为米卡芬净、卡泊芬净、阿尼芬净、伏立康唑、伊曲康唑、氟康唑、泊沙康唑、两性霉素B 及5-氟胞嘧啶共9 种,检测最低抑菌浓度(MIC)并将结果与美国临床和实验室标准化协会制定的M60 文件比对,判断抗真菌药物对于所分离出的白念珠菌抗菌活性。
1.4 数据收集及临床评估
纳入患者的临床资料主要包含以下5 方面内容:①年龄、性别及导致患者免疫抑制状态疾病的基本信息;②患者入院时Sevilla 评分、念珠菌评分、念珠菌定植指数及校正念珠菌定植指数;③患者抗念珠菌疗程及血培养转阴时间;④入院当日,确诊白念珠菌血症第1、3、5、7、10、14天(DA、D1、D3、D5、D7、D10、D14) 外 周血淋巴细胞绝对值、T 淋巴细胞绝对值、Th 淋巴细胞绝对值、CD4/CD8 比值、IL-1β、IL-4、IL-6、IL-10、IL-17A、(1,3)-β-D 葡 聚 糖、 肿 瘤 坏 死因子(TNF) -α 和干扰素(INF) -γ 等指标数值;⑤30 d 和60 d 全因死亡率。
主要研究终点为比较念珠菌定植指数及各项念珠菌评分对于ICH 白念珠菌血症的预测价值;次要研究终点为比较白念珠菌血症患者生存组及死亡组自确诊后各时间节点炎症及免疫指标的变化。
1.5 统计学分析
计数资料以频数及百分比表示,其可比性分析采用χ2或Fisher 检验。符合正态分布的计量资料以均数±标准差(x±SD)表示,两组之间的可比性分析采用独立样本t检验。绘制受试者工作特征(ROC)曲线,并根据曲线下面积(AUC)评估念珠菌定植指数及各项评分对于白念珠菌血症的诊断价值。绘制Kaplan-Meier 生存曲线比较白念珠菌血症患者30 d 和60 d 的生存率。应用SPSS 20.0 软件进行相关统计分析,以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 基线情况
五年研究期间共计42 例ICH 合并白念珠菌血症患者纳入研究,生存25 例,死亡17 例。患者平均年龄(42.6±12.4)岁,基础疾病以系统性红斑狼疮为主(26 例,61.9%),收治于ICU 患者为34 例(81.0%)。根据美国感染病协会指南推荐意见,念珠菌血症患者非连续2 次血培养阴性后,抗真菌药物仍需继续使用2 周[6]。因此,入组患者抗真菌疗程为(20.7±2.2)d,总住院时间(29.6±3.8)d。见表1。
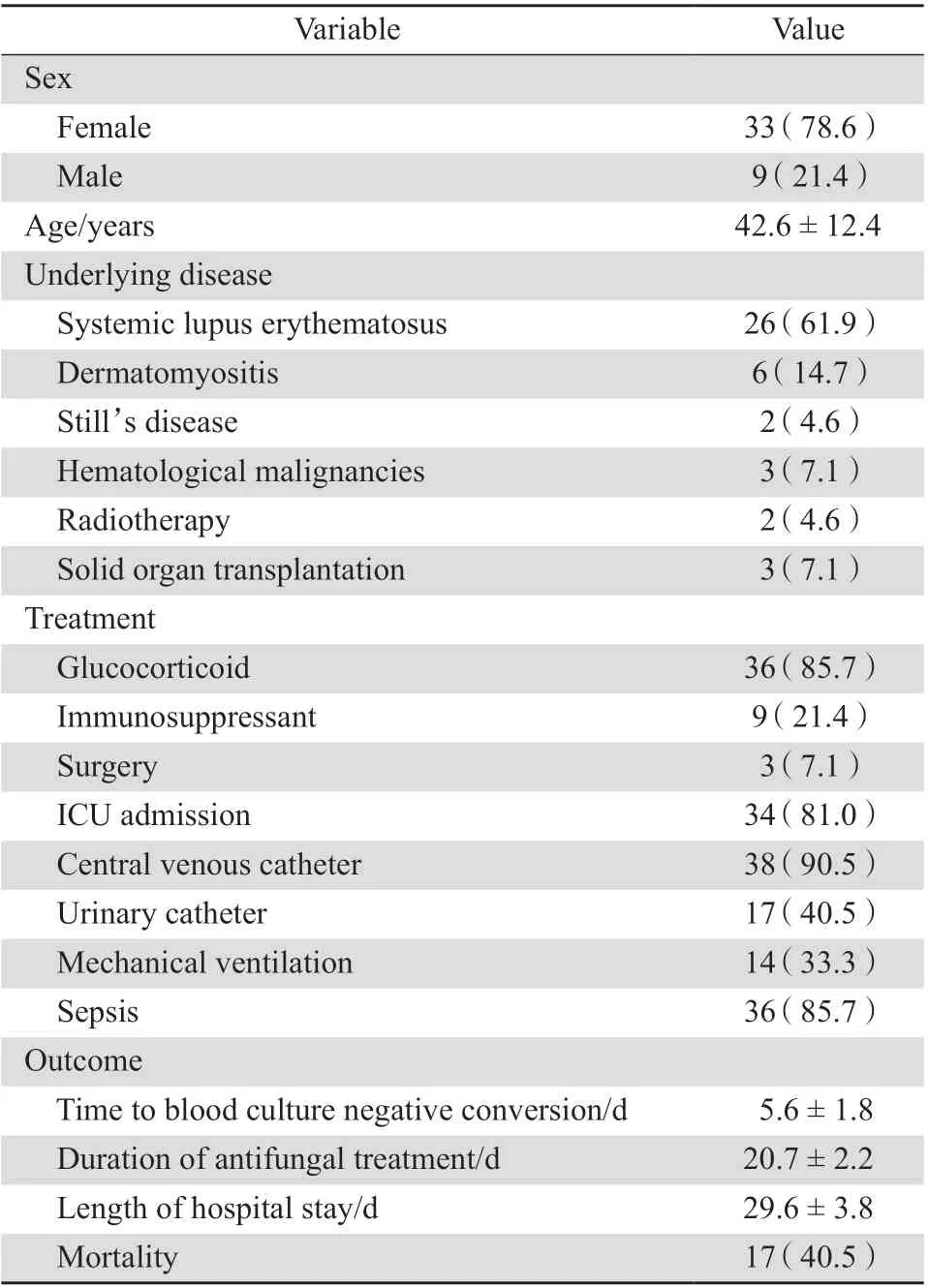
表1 白念珠菌血症患者基线情况Table 1 Demographic and clinical characteristics of the patients with Candida albicans bloodstream infection
2.2 白念珠菌对抗菌药物的敏感率
对42 例患者血标本中分离出的42 株白念珠菌行抗真菌药物敏感性试验,并将药敏结果与上海市细菌真菌耐药监测网和中国医院侵袭性真菌病监测网(CHIF-NET)数据[7-8]进行对比。患者血标本中分离出的白念珠菌对棘白菌素类抗真菌药物敏感率均为100%,对两性霉素B 也有极高的敏感率(98.3%),但对三唑类抗真菌药物的敏感率不佳,低于上海市细菌真菌耐药监测网数据及CHIF-NET 数据,尤其是对最常使用的抗真菌药物氟康唑,其敏感率仅为85.3%,对比上海市及全国耐药监测网数据,差异存在统计学意义(85.3%对94.2%对99.0%,P<0.05),提示将氟康唑作为临床抢先治疗的首选抗真菌药物时需慎重。见图1。
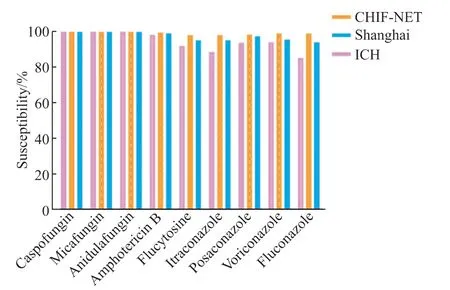
图1 血标本分离出的白念珠菌对抗真菌药物的敏感率Figure 1 Antifungal susceptibility of the Candida albicans strains isolated from blood
2.3 念珠菌定植相关指标与血培养转阴时间的相关性
分析纳入42 例患者的念珠菌定植指数、校正念珠菌定植指数、念珠菌评分及Sevilla 评分。念珠菌定植指数为(0.6±0.2)分,校正念珠菌定植指数为(0.5±0.1)分。将念珠菌定植相关指标与血培养转阴时间行相关性分析,提示Sevilla评分与血培养转阴时间呈正相关(R2=0.404,P<0.000 1),其他指标未提示相关性(P均>0.05),见图2。由于入组患者中全肠外营养患者及外科手术患者较少,因此念珠菌评分为(2.0±0.8)分,但Sevilla 评分为(11.1±2.4)分,提示入组对象均为高危患者。
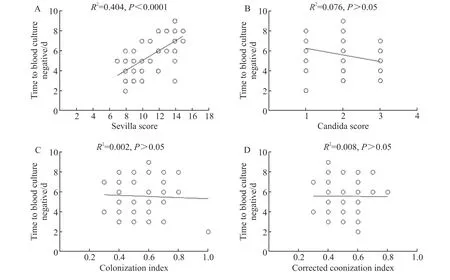
图2 念珠菌定植相关参数与血培养转阴时间的相关性分析Figure 2 The correlation between Candida colonization parameters and time to blood culture negative conversion
2.4 念珠菌定植相关指标对白念珠菌血症的诊断效能
根据纳入42 例ICH 合并白念珠菌血症患者的性别、年龄、基础疾病等指标,进行1 ∶2 倾向匹配,纳入84 例无白念珠菌血症的ICH 患者,其中女性患者66 例(78.6%),基础疾病仍以系统性红斑狼疮为主(52 例,61.9%)。收集126 例不同状况患者相对应的念珠菌定植指数、校正念珠菌定植指数、念珠菌评分及Sevilla 评分,绘制ROC 曲线(图3)。Sevilla 评分对于念珠菌血症的诊断价值较高,AUC为0.77,最佳截断点为11 分(P<0.001);校正念珠菌指数最佳截断点为0.4,同样具有较高的诊断价值,AUC为0.73(P<0.001)。念珠菌评分及念珠菌定植指数尚无法作为ICH 念珠菌血症较好的诊断判定指标(P>0.05),见表2。
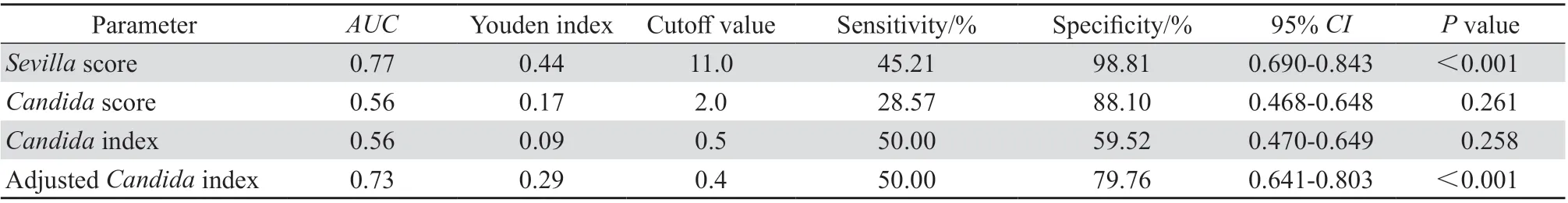
表2 念珠菌定植相关指标对于白念珠菌血症的诊断效能分析Table 2 The performance of Candida colonization parameters for diagnosing candidemia
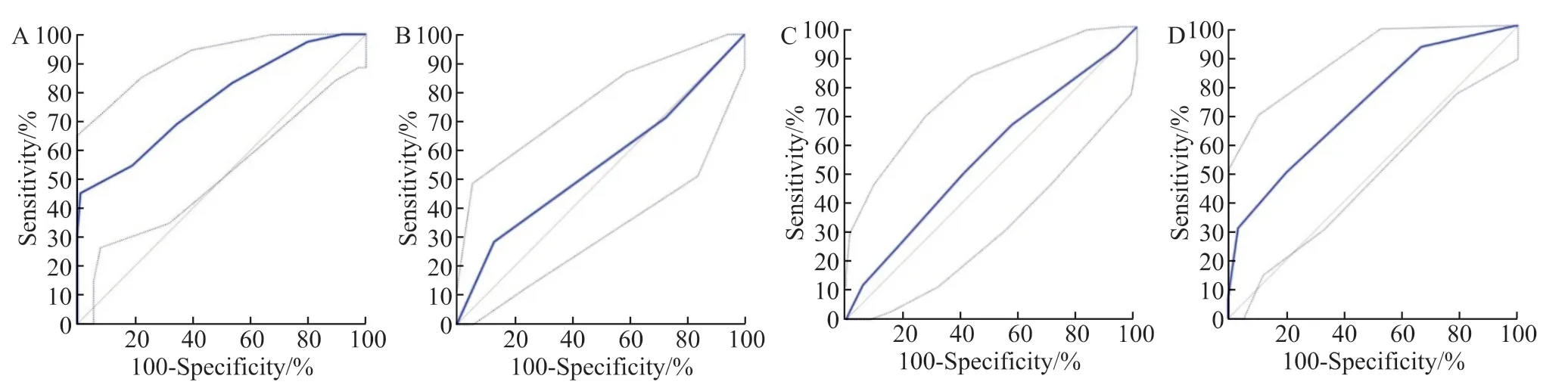
图3 念珠菌定植相关参数对于念珠菌血症的诊断效能分析Figure 3 The performance of Candida colonization parameters for diagnosing candidemia
2.5 白念珠菌血症患者免疫及炎性指标改变与预后分析
纳入42 例患者中最终死亡17 例,死亡率为40.5%,其中14 例患者于发病30 d 内死亡(图4)。比较生存组和死亡组患者入院当日、确诊白念珠菌血症第1、3、5、7、10、14 天(DA、D1、D3、D5、D7、D10、D14)外周血淋巴细胞绝对值、T 淋巴细胞绝对值、Th 淋巴细胞绝对值、CD4/CD8 比值、IL-1β、IL-4、IL-6、IL-10、IL-17A、TNF-α、INF-γ 及(1,3)-β-D 葡聚糖指标(图5)。两组患者在发生白念珠菌血症后相关炎性指标均出现上升趋势,且伴有淋巴细胞绝对值下降,在疾病确诊1 周后达到高峰。随着抗真菌药物治疗,生存组患者炎性及免疫指标逐渐趋于正常,而死亡组则进一步恶化。
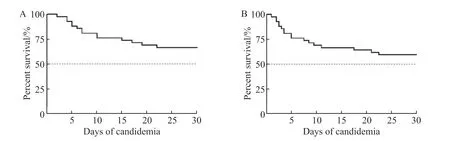
图4 免疫抑制宿主发生白念珠菌血症后的生存分析Figure 4 The survival rate of the immunocompromised hosts with candidemia
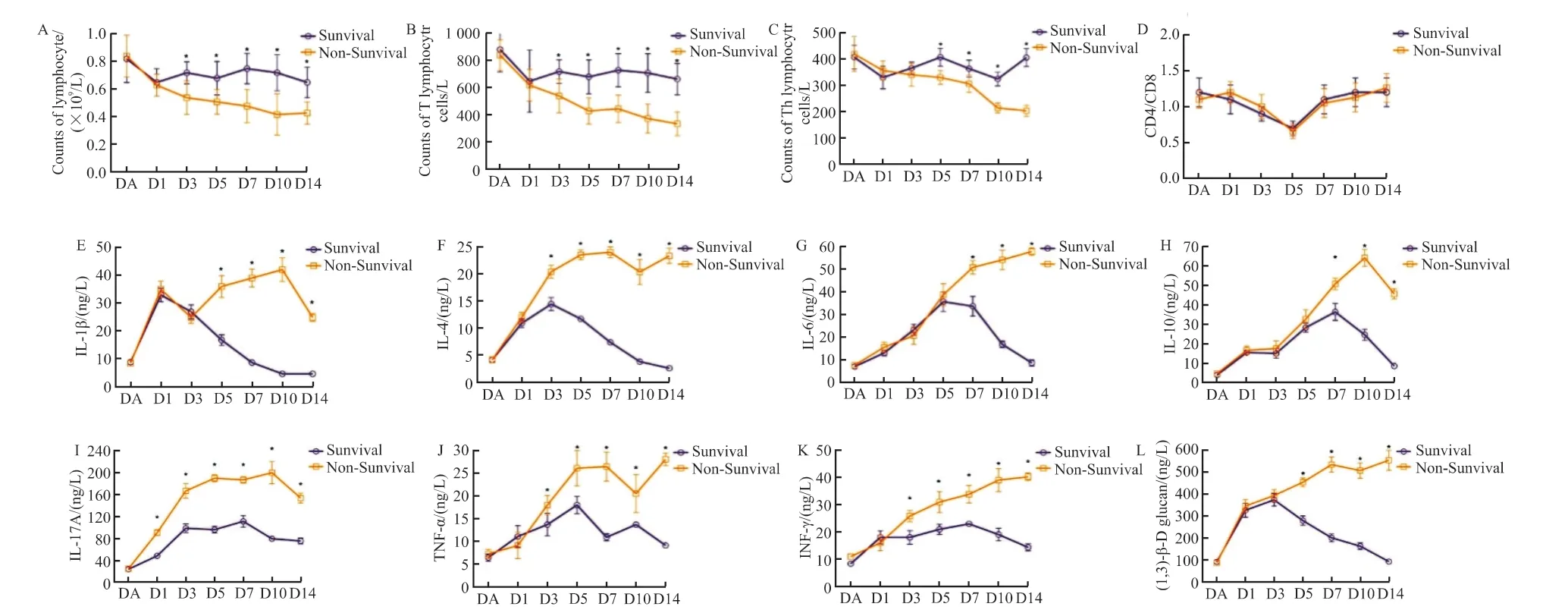
图5 生存组与死亡组各时间点免疫及炎性指标变化Figure 5 Changing patterns of relevant immune and inflammation biomarkers compared between survivors and deaths
3 讨论
本研究表明,ICH 发生白念珠菌血症后死亡率高,且此类患者血标本中分离出的白念珠菌对临床常用的三唑类抗真菌药物氟康唑耐药率较高。在各项与念珠菌定植相关的评估指标中,Sevilla评分与校正念珠菌定植指数对于念珠菌血症的发生具有较好的诊断价值。宿主发生白念珠菌血症后,其免疫功能受到极大的影响,生存组在抗真菌药物治疗下结合自身免疫功能调整,更容易在相对短的时间内恢复至基础稳态水平;而死亡组患者始终处于免疫与炎性反应失衡状态。此临床研究为下一步开展念珠菌血症宿主机体适应性免疫应答的调控机制奠定了部分基础。
念珠菌评分、Sevilla 评分、念珠菌定植指数及其校正指数目前仍是临床最常用的预测侵袭性念珠菌感染尤其是念珠菌血症的重要参考指标,但其使用时机及针对患者人群仍存在差异[9-10]。Sevilla 评分为三部分,除念珠菌定植水平以外,其对宿主从基础情况至入院治疗过程进行了整体评估。尤其对于患者是否入住ICU、留置导管情况、抗菌药物使用情况等作了进一步分析,且对于患者既往糖皮质激素累计用量(过去15 d 泼尼松累计用量>500 mg)进行了评估。最重要的是Sevilla 评分的17 项评分标准完全包括了念珠菌评分的4 项指标,因此对于ICH 的评估更为准确全面,不仅适用于外科手术患者,对于因内科疾病及收治于ICU 的患者同样适用。Sevilla 评分在评估宿主念珠菌定植强度的同时,也进一步评估了皮肤黏膜屏障的完整性(留置导管、腹部手术、血液透析等),同时评估了免疫功能,因此其对于念珠菌血症的诊断效能最高,AUC为0.77,且其评分高低与血培养转阴时间,即白念珠菌的清除时间呈正相关。
严重的感染在最初促炎阶段之后,将逐步过渡至抑炎阶段,导致免疫抑制阶段延长,称为侵袭性免疫抑制后阶段。这是由于循环中淋巴细胞重新定位至感染区域而导致其计数下降,以及脓毒症诱导的淋巴细胞凋亡发生[11]。我们的研究已经通过临床数据改变证实了这种继发性免疫反应受损与不良结局相关。如此严重、持续的低淋巴细胞计数也使患者容易继发感染,并导致恶性循环,这也从另外一个方面解释了相关的高死亡率。在念珠菌血症发生过程中,位于吞噬细胞表面的模式识别受体,特别是Dectin-1 受体,可以识别真菌细胞壁上的甘露聚糖和相关蛋白以及其他结构,如葡聚糖和甲壳素等。释放的细胞因子由于识别模式及受体的不同而存在差异。IL-1β 及IL-6的释放是通过多种途径刺激造成,而IL-17A 的分泌依赖于IL-23 的刺激,而不是通过凝集素受体。Th17 细胞分泌特异性细胞因子包括IL-17A、IL-21及IL-22。细胞因子IL-1β、IL-6 和转化生长因子-β诱导Th17 细胞的发育,而IL-23 是维持Th17 细胞的重要细胞因子[12]。因此,我们的研究表明,死亡组患者IL-17A 水平明显高于生存组水平。
综上,Sevilla 评分对于ICH 发生白念珠菌血症具有较高的诊断效能,且其评分高低与念珠菌血症培养转阴时间呈正相关。淋巴细胞绝对值下降及细胞因子水平,尤其是IL-17A 持续升高等是提示白念珠菌血症患者预后不良的重要因素。

