不同年龄段食蟹猴骨矿含量与骨密度测定分析
韦祝梅,申 果,李振明,曾 勇,季 风,杨继红
(1.广西华仁医学科技集团有限公司,南宁 530000;2.广西科学院医学与健康研究院,南宁 530000;3.广西玮美生物科技有限公司,南宁 530021)
食蟹猴是猕猴属动物之一,是人类的近属动物,在形态、生殖、代谢等方面与人类非常相似。食蟹猴在遗传物质上与人有75.0%~98.5%的同源性[1],并且它们经常性保持直立体位,生物力学与人类最为相近。食蟹猴体内器官系统包括消化系统、内分泌系统和生殖系统等,其饮食要求、组织器官、骨生物力学特性、雌性动物性周期与人类相似,骨代谢也与人类接近。因此作为非人灵长类动物的重要一员,食蟹猴是进行生物医学研究较为理想的实验动物[2]。目前,在骨质疏松症药物治疗评价中就有研究选择食蟹猴作为实验模 型 动 物[3],以 骨 矿 含 量(bone mineral content,BMC)和骨密度(bone mineral dendity,BMD)降低到一定的标准作为造模成功的依据。BMC是指骨骼中的矿物质含量,以克(g)表示;BMD是指单位面积的骨矿含量,以克每平方厘米(g/cm2)表示[4]。BMD和BMC的测定值是骨钙沉积状况的一种定量指标,能够比较精确地反映骨骼的发育及成熟状态,也是目前人类诊断骨质疏松的重要手段[5-6]。然而不同动物的骨骼发育情况不同,不同动物在不同年龄不同部位的BMD和BMC值差异大。食蟹猴作为理想的实验动物,在骨骼发育和骨质疏松的研究中具有巨大的价值,只有建立完整、准确的骨骼数据标准,掌握健康食蟹猴的正常BMD和BMC值,才能在评价食蟹猴骨质疏松症模型造模结果评价方面有更加确切的依据,这对于后续实验效果的评价也至关重要。
目前临床和科研常用的BMD测量方法有双能X线吸收检测法(dualenergy X-ray absorptiometry,DXA)、定量计算机断层摄影术(quantitative computed tomography,QCT)、外周QCT(peripheral quantitative computed tomography,pQCT)和定量超声(quantitative ultrasound,QUS)等多种方法,其中基于DXA测量结果是骨质疏松症诊断金标准[7]。判断人类及实验动物骨质健康状况均是基于DXA测量结果。因此,同性别、同品种健康食蟹猴骨峰值的准确数据是骨质疏松症模型研究所必需的基础数据。
本实验通过对健康雄性和雌性食蟹猴各个年龄阶段283只的大样本量DXA测量,获得1~15岁及15岁以上全年龄段、不同性别的健康食蟹猴BMD和BMC的标准数据和变化趋势,为食蟹猴骨骼生长发育特点提供数据支持,为以食蟹猴为模式动物的骨科疾病的研究提供可供参考的基础数据。
1 材料与方法
1.1 实验动物
283只普通级食蟹猴,年龄1~19岁,其中雄性187只,雌性96只。分为雄性和雌性不同年龄段:1岁≤年龄<3岁(1~2)组(雄性10只,雌性10只)、3岁≤年龄<5岁(3~4)组(雄性20只,雌性14只)、5岁≤年龄<7岁(5~6)组(雄性10只,雌性10只)、7岁≤年龄<9岁(7~8)(雄性16只,雌性11只)组、9岁≤年龄<11岁(9~10)(雄性28只,雌性12只)组、11岁≤年龄<13岁(11~12)组(雄性10只,雌性12只)、13岁≤年龄<15岁(13~14)组(雄性21只,雌性0只)、年龄≥15岁(≥15)组(雄性72只,雌性27只)。动物由广西玮美生物科技有限公司提供[SCXK(桂)2012-0004]。动物均饲养于普通级动物房内,检测血液学、血生化等指标未见异常,无运动障碍。环境温度:16~28℃,相对湿度:40%~80%,自然光照,大栏饲养,每天饲喂食蟹猴专用颗粒料2次,分别在7:30和17:00投喂专用饲料,自由饮水,每天14:00点投喂苹果约半个/只。项目在广西玮美生物科技有限公司实验部完成[SYXK(桂)2013-0008],本实验中动物饲养、麻醉及检测等操作均符合中华人民共和国《实验动物管理条例》和《关于善待实验动物指导性意见》的要求。
1.2 实验器材
TC30K电子天平(常熟市双杰测试仪器厂,中国);双能X线骨密度仪(DEXA)(Discovery Wi,美国)。
1.3 食蟹猴骨密度与骨矿含量的测量
(1)DEXA测量仪器:采用美国HOLOGIC生产的双能X线骨密度仪(DEXA)测量骨密度与骨矿含量。
(2)DEXA测量方法:动物于测量前一天晚17:00后禁食,自由饮水,次日早餐禁食。称量动物的体质量,测体温,查看粪便和精神状况,确保动物健康。使用麻醉药物前15 min核对确认动物ID牌,肌内注射硫酸阿托品剂量为0.01 mg/kg。肌内注射麻醉药舒泰50剂量为2.5 mg/kg。动物麻醉后根据仪器SOP进行扫描,见图1。结束确认动物的心跳、血压、体温生命体征恢复正常后放回原笼。

图1 双能X线骨密度仪测量食蟹猴的骨密度和骨矿含量Figure 1 Bone mineral density(BMD)and bone mineral content(BMC)of cynomolgus monkeys were measured by dual-energy X-ray absorptiometry
1.4 数据统计及分析
2 结果
2.1 食蟹猴BMC和BMD不同年龄段测量结果和变化
通过骨密度仪对283只动物进行全身扫描,得出不同年龄段雄性和雌性食蟹猴全身总和的BMC和BMD,如表1所示。
雄性食蟹猴在1~12岁时,BMC值随着年龄的增长而显著升高。BMC由1~2岁的67.38 g增长到12岁的399.15 g,增长了5.92倍,平均年增长30.16 g;其中增长幅度最大的年龄是3~6岁,平均增长率为45.15 g/年。13岁以后的老年雄性食蟹猴BMC值呈下降趋势,但下降不明显;13~14岁的BMC值为368.37 g,≥15岁时维持在(367.51±7.17)g。1~8岁BMD逐年增长,从0.32 g/m2增加到0.57 g/m2;8~15岁的BMD相对稳定,维持在(0.57±0.05)~(0.56±0.06)g/m2。
雌性食蟹猴在1~10岁时,BMC值随着年龄的增长而显著升高。BMC由1~2岁的58.84 g增长到10岁的233.29 g,增长了3.96倍,平均增长率为19.38 g/年;10岁后BMC值呈下降趋势,且下降显著。11~12岁BMC值为208.05 g,13~14岁缺乏数据(从表1判断,13~14岁BMC值大约为180 g左右),15岁后降到166.63 g,平均下降率为13.33 g/年,15岁后较10岁时的BMC下降了28.6%,平均每年下降5.72%。1~10岁BMD逐年增加,从0.31 g/m2增加到0.47 g/m2;10~15岁的BMD相对稳定,维持在(0.47±0.03)~(0.46±0.00)g/m2。
表1 雄性和雌性食蟹猴不同年龄的骨密度和骨矿含量Table 1 Bone mineral density(BMD)and bone mineral content(BMC)of male and female cynomolgus monkeys at different ages(±s)

表1 雄性和雌性食蟹猴不同年龄的骨密度和骨矿含量Table 1 Bone mineral density(BMD)and bone mineral content(BMC)of male and female cynomolgus monkeys at different ages(±s)
注:同性别与前一年龄段比较,★P<0.05,★★P<0.01;同年龄段不同性别之间的比较,△P<0.05,△△P<0.01。Note:Comparisons between same sex at different ages,★P<0.05,★★P<0.01.Comparisons between different sexes of the same age group,△P<0.05,△△P<0.01.BMC:Bone mineral content;BMD:Bone mineral density.
?
雄性食蟹猴和雌性食蟹猴的BMC在每个年龄段都有显著差异,在3岁后的每个年龄段都有极显著差异。雌性食蟹猴进入中青年期后BMC比雄性的低,在骨量峰期(9~10岁)时雄性食蟹猴的全身BMC总和是雌性食蟹猴BMC总和的1.93倍,10岁以后,雌性食蟹猴的BMC下降速度比雄性食蟹猴快,15岁后老年雄性食蟹猴的BMC是雌性的2.25倍。1~4岁雄性食蟹猴和雌性食蟹猴的BMD无明显差异,5岁后雄性食蟹猴每个年龄段的BMD都显著高于雌性食蟹猴。
2.2 不同年龄食蟹猴各部位BMD随年龄变化
2.2.1 雄性食蟹猴不同年龄不同部位BMD变化
雄性食蟹猴不同年龄不同部位BMD变化如表2所示。对不同年龄段各组雄性食蟹猴不同部位的BMD结果进行统计学分析,1~2岁组与3~4岁组间,3~4岁和5~6岁组间各部位BMD差异显著(P<0.01),即在1~6岁雄性食蟹猴全身各部位BMD均随年龄增长而显著增加,之后BMD变化不明显。从不同部位的数据比较来看,BMD最高的是头部,最低的是手臂:头部>脊柱>骨盆>手臂≈双腿。
2.2.2 雌性食蟹猴不同年龄不同部位BMD变化
对不同年龄段各组雌性食蟹猴不同部位的BMD结果(暂缺13~14岁数据)进行统计学分析,1~2岁组与3~4岁组间各部位BMD差异显著(P<0.01),即在1~4岁雄性食蟹猴全身各部位BMD均随年龄增长而显著增加,之后BMD变化不明显。从不同部位的数据比较来看,BMD最高的也是头部,最低的也是手臂,头部>脊柱>骨盆>手臂≈双腿。雌性食蟹猴不同年龄不同部位BMD变化详见表2。
2.2.3 雄性和雌性食蟹猴不同部位BMD变化比较
在脊柱BMD方面,雄性和雌性食蟹猴脊柱BMD在5岁之前差异不显著,在1~2岁的测量值都在0.39 g/cm2左右,在3~4岁的测量值都在0.52 g/cm2左右,从5岁开始,脊柱BMD在雄性和雌性之间开始有显著差异,5~6岁雄性值在0.71 g/cm2左右,雌性值在0.55 g/cm2左右,雄性BMD显著大于雌性,并在之后一直保持着显著性差异(P<0.01),详见表2。
骨盆BMD的变化规律和脊柱BMD一致,雄性和雌性食蟹猴骨盆BMD在5岁之前差异不显著,在1~2岁的测量值都在0.35 g/cm2左右,在3~4岁的测量值都在0.44 g/cm2左右,从5岁开始,骨盆BMD在雄性和雌性之间开始有显著差异,5~6岁雄性值在0.53 g/cm2左右,雌性值在0.46 g/cm2左右,雄性BMD显著大于雌性,并在之后一直保持着显著性差异(P<0.01),详见表2。
表2 雄性和雌性食蟹猴不同年龄不同部位的骨密度变化Table 2 Changes in bone mineral density of different body parts in male and female cynomolgus monkeys at different ages(±s)
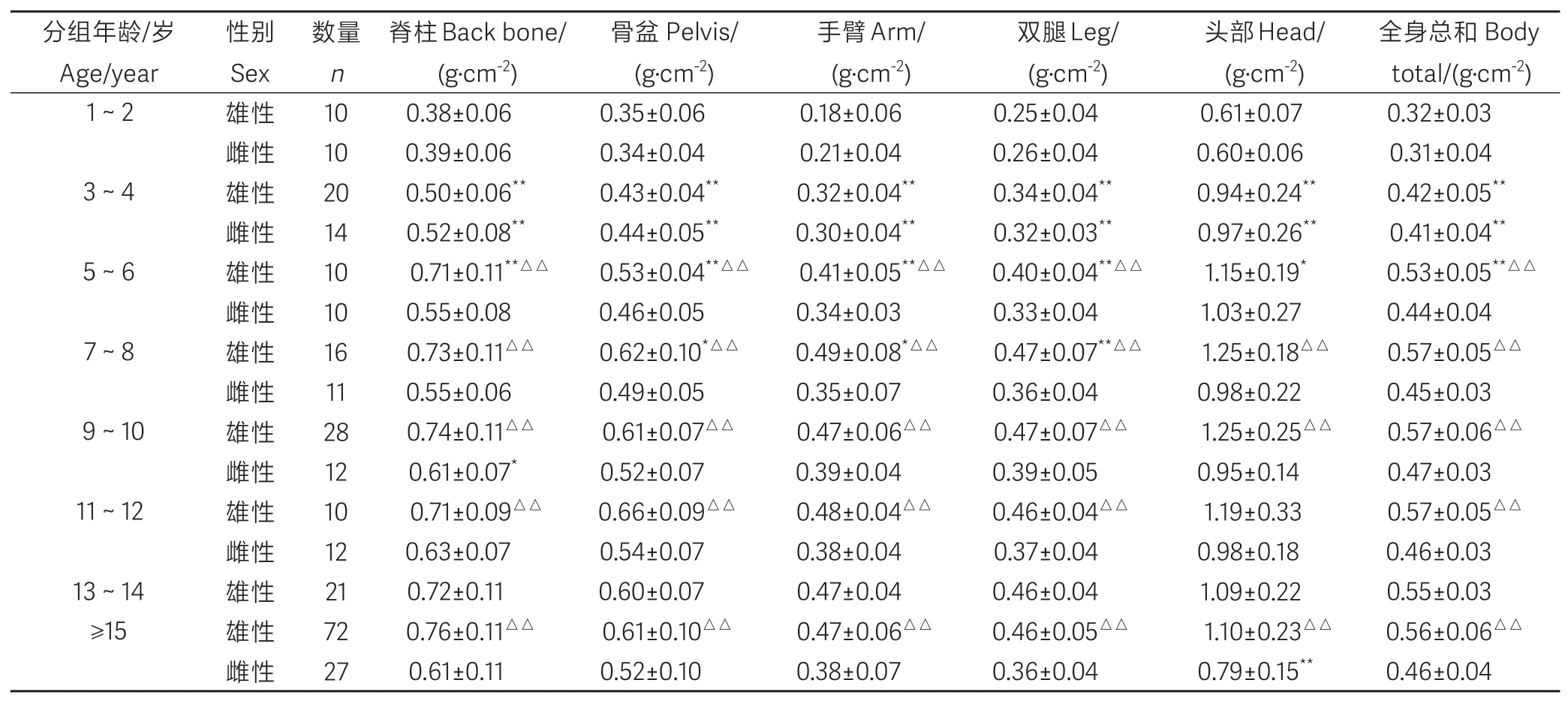
表2 雄性和雌性食蟹猴不同年龄不同部位的骨密度变化Table 2 Changes in bone mineral density of different body parts in male and female cynomolgus monkeys at different ages(±s)
注:同性别与前一年龄段比较,★P<0.05,★★P<0.01;同年龄段不同性别之间的比较,△P<0.05,△△P<0.01。Note:Comparisons between same sex at different ages,★P<0.05,★★P<0.01.Comparisons between different sexes of the same age group,△P<0.05,△△P<0.01.
?
手臂BMD在5岁之前性别差异不显著,在1~2岁的测量值都在0.2 g/cm2左右,在3~4岁的测量值都在0.3 g/cm2左右,5岁以后,雄性食蟹猴各年龄段手臂BMD都比雌性食蟹猴大(除雌性食蟹猴13~14岁数据缺乏外),差异显著(P<0.01),详见表2。
双腿BMD在5岁之前性别差异不显著,在1~2岁的测量值都在0.26 g/cm2左右,在3~4岁的测量值都在0.34 g/cm2左右,5岁以后,雄性食蟹猴各年龄段双腿BMD都比雌性食蟹猴大,差异显著(P<0.01),详见表2。
头骨BMD在7岁之前性别差异不显著,在1~2岁的测量值都在0.61 g/cm2左右,在3~4岁的测量值都在0.97 g/cm2左右,在5~6岁的测量值都在1.15 g/cm2左右。6岁以后,雄性食蟹猴的各年龄段头骨BMD都比雌性食蟹猴大,差异显著(P<0.01),详见表2。
全身骨BMD变化和脊柱BMD、盆骨BMD值变化规律一致。雄性和雌性食蟹猴全身平均BMD在5岁之前差异不显著,在1~2岁的平均值都在0.32 g/cm2左右,在3~4岁的测量值都在0.42 g/cm2左右,从5岁开始,骨盆BMD在雄性和雌性之间开始有显著差异,5~6岁雄性值在0.53 g/cm2左右,雌性值在0.44 g/cm2左右,雄性BMD显著大于雌性,并在之后一直保持着显著性差异(P<0.01),详见表2。
3 讨论
本实验主要研究健康食蟹猴不同年龄段、不同性别骨骼发育特点。食蟹猴的寿命约30岁,4岁性成熟,绝经期一般在15岁后。根据食蟹猴的生理发育情况,为观察未成年、成年后以及老年食蟹猴BMC和BMD的变化,本研究将不同性别的食蟹猴按不同年龄分组。实验结果表明,雄性食蟹猴1~12岁是骨骼发育期,雌性食蟹猴1~10岁是骨骼发育期,其中1~6岁时的骨骼发育是以快速生长为主,这个时期是食蟹猴的成长期。之后骨骼继续发育成熟,雄性食蟹猴BMC和BMD峰值出现在11~12岁,12~15岁骨吸收大于骨形成,骨量逐渐丢失。而雌性食蟹猴BMC和BMD峰值出现在9~10岁,10岁后BMC开始显著下降。此结论与蔡敏的研究结果相似:小于10岁的雌性食蟹猴BMC和BMD与年龄呈正相关,大于10岁则呈负相关[8]。雌性食蟹猴的BMC峰值比雄性低很多,仅相当于雄性食蟹猴的58%,BMD峰值相当于雄性食蟹猴BMD峰值的80%,这与人类男性BMD高于女性BMD的现象一致。雌性食蟹猴BMC丢失要开始得更早,从10岁起雌性食蟹猴BMC开始显著下降,之后每个年龄段BMC都显著下降,这可能是因为进入衰老期的雌性食蟹猴BMC受雌激素降低的影响较大[9-10]。对比人体骨骼发育,有研究[11]表明人类BMC和BMD值在30岁以前呈增加趋势,30~40岁的BMC和BMD达到一生的峰值期,此后随年龄增加,骨量逐渐丢失,BMC和BMD呈现下降趋势。BMD峰值期过后,破骨细胞相对活跃,开始出现生理性的骨量减少,骨质总量以每年0.2%~0.5%的速度递减。和人类相比,食蟹猴的10岁骨骼状态相当于人类的30岁骨骼状态,10岁之后食蟹猴每年骨量丢失的速度约为人骨量丢失速度的10倍。
食蟹猴身体不同部位的BMD数值从大到小依次为头部>脊柱>骨盆>手臂≈双腿,雄性和雌性规律一致,即头部BMD最大,四肢最小,且雄性猴各部位的BMD均比雌性的高。Black等[12]研究发现不同年龄段雄性食蟹猴的BMD高于雌性。Cerroni等[13]对不同年龄段恒河猴的骨密度研究表明雄性的BMD高于雌性。本研究得到了相似的结果,即各年龄段的雄性食蟹猴的BMD高于雌性。本研究中年龄区间分得更小,对食蟹猴的BMD变化体现得更详细。在不同部位的BMD中,头骨的BMD随着年龄的变化最明显,这与王晓达等[14]的研究结果一致。其他部位的BMD在食蟹猴6岁后相对稳定,10岁左右进入衰老期后也未出现明显下降,这和人类老年阶段BMD自然减少的规律不一致,原因可能是头骨面积比较稳定,当进入衰老期时,BMD随着骨量丢失而降低,而其他部位虽然骨量丢失,但是骨面积也变小,表现为衰老期猴的体长变小等,所以BMD变化不大;或者可能与头骨松质骨相对较多有关,因为松质骨积累和丢失的速度均快于皮质骨,具体原因需要改进方案延长选用猴的年龄段,测量其骨密度,更加完整地监测食蟹猴BMD的变化规律。
随着年龄增长骨密度降低可能会导致骨质疏松症的发生,食蟹猴BMC及BMD随着年龄增长的变化和达到峰值骨量后的变化与人类的生理过程十分相似,因此食蟹猴是研究人类BMD、骨质疏松和骨质减少的良好模型。本研究测量的不同性别、不同年龄段的BMC和BMD变化,为以食蟹猴为模式动物的骨科疾病的研究提供了可供参考的基础数据。
[医学伦理声明Medical Ethics Statement]
所有实验操作均在广西玮美生物科技有限公司(拥有AAALAC完全认证)实验部完成,实验过程遵照中国实验动物相关法律法规条例要求进行,包括《实验动物管理条例》(2017年3月1日)和《关于善待实验动物指导性意见》(2006年9月30日)。
All experimental operations were completed in the Experimental Department of Guangxi Weimei Bio-tech Co.,Ltd,which has been certified by AAALAC.All experimental procedures were performed in accordance with the requirements of laws and regulations in China related to experimental animals,includingAnimal Management Regulations(01/03/2017),Laboratory Animal:Guidance on the Treatment of Experimental Animals(30/09/2006),and so on.
[作者贡献Author Contribution]
韦祝梅负责文章的材料收集和整理,并结合实践进行文章撰写;申果负责文章摘要的翻译以及材料整理;李振明、曾勇、季风对全文的数据准确性进行确认,并提出修改建议;杨继红对全文内容提供指导。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。

