贵州半细毛羊线粒体D-loop区母系遗传结构分析
张 继,吴 雪,刘若余
(1.贵州省草地技术试验推广站,贵州 贵阳 550025;2.贵阳市乌当区农业农村局,贵州 贵阳 550018;3.贵州大学 动物科学学院/高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025)
丰富的遗传多样性是畜牧业生产的基础。在动物遗传科学界对很多家养动物的进化历程有双起源和三起源等多种观点[1]。贵州半细毛羊于20世纪80年代从中国陕西、甘肃、山东等地引进考力代绵羊[2],再由贵州粗毛羊与新疆细毛公羊的杂交二代与考力代羊进行级进杂交,并从子代(考细杂,罗考细杂,罗细杂)当中选取的理想型个体进行横交固定,培育成贵州独有的半细毛羊品种[3]。贵州半细毛羊体质壮实,肉质鲜美细腻,膻味不明显,体躯为丰满的圆桶状,全身毛色为白色,是同时符合毛用市场要求和肉用市场需求的毛肉兼用性品种。
线粒体(mitochondria)是生物能量代谢的重要细胞器[4]。线粒体DNA(Mitochondrial DNA,mtDNA)是共价闭合的环状双链DNA 分子,相对于核DNA 来说其分子量较小(15.7~19.5 kb);在单个动物体内具有高度的均一性,在生物体组织中无特异性[5];线粒体DNA 的进化速度一般是细胞核遗传物质变异速度的5~10 倍,因此线粒体DNA在不同的物种、种内不同群体间变异程度大,与核DNA 相比,线粒体DNA 具有更为丰富的多态性,对于种内和近缘种间的遗传解析保持着很高灵敏度[6]。此外,线粒体DNA 的遗传方式是母系遗传,独特的遗传方式避免了父系个体对遗传的影响,单个个体就能作为整个母系集团的代表,因此对于试验材料的需求相对较少[7]。通过对已受到驯化的畜禽体内线粒体DNA 的类型研究,能够重新展示其野生先祖的DNA 类型,这得益于线粒体DNA 在世代传递过程中保持着相当的稳定性,同时也因为其严格的母系遗传而使畜禽品种的母系集团特征得以反映,因此线粒体DNA 成为归类和探索动物物种进化历程的重要工具[8],也为各个地方品种的遗传多样性研究以及保种育种工作提供了有力支持。
通常线粒体的控制区也被称为D-loop区,其大约占据线粒体DNA 总量的6%[9],广泛存在于线粒体DNA 的识入Apbe 和tRNApo 之间,腺嘌呤的含量相对比较丰富。在中国有关绵羊线粒体DNA 遗传多样性的探究方法较少,RFLP 方法[10]是最先采用的方法之一。目前对于线粒体DNA-RFLP 技术大多被运用于牛、猪和鸡等畜禽动物的起源进化和品种间亲缘关系的研究中。尽管已有绵羊起源和品种分化方面的研究,但鲜见对贵州绵羊与山羊遗传学研究的相关报道。因此,选取20只家养贵州半细毛羊个体,对其进行线粒体DNA 的D-loop 区的序列测定,分析贵州半细毛羊的遗传多样性,为贵州绵羊的遗传多样性研究以及育种保种和开发利用提供科学依据。
1 材料与方法
1.1 材料
试验羊,选自贵州省毕节市威宁县威宁种羊场,其品种名称及产地信息等见表1。
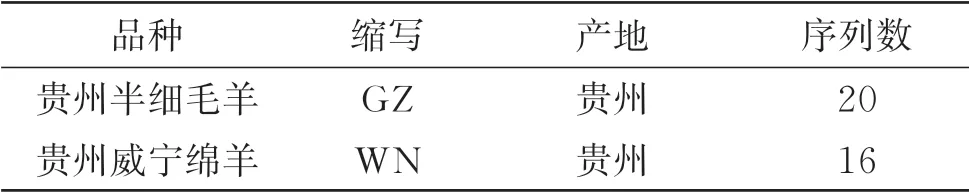
表1 试验绵羊品种信息
试验样本:选用20 只饲养管理条件相同且成年健康的贵州半细毛羊,将采集的血样放在冰盒中短暂保存,回到实验室转入-40℃低温冰箱保存。
试剂:ezup 柱式血液基因组DNA 提取试剂盒[生工生物工程(上海)股份有限公司];琼脂糖(BIOWEST)、DNA Marker(DL 2000)(康为世纪)、10×DNA loading buffer(康为世纪)、Goldenview Ⅰ型核酸染料(康为世纪)。
仪器设备:试验主要仪器设备信息见表2。分析软件:MEGA 5.0、CLUSTALX、DNAStar、BIOEDIT。

表2 试验主要仪器设备信息
1.2 贵州半细毛羊线粒体DNA 的提取及检测
利用试剂盒提取贵州半细毛羊血样DNA,进行PCR 扩增后,用1%琼脂糖凝胶电泳检测。用紫外分光光度计进行DNA 浓度和纯度检测,取每个DNA样品5 μL进行混合,构建DNA池。
1.3 线粒体DNA D-loop 区的引物设计及目的片段扩增与测序
引物设计:从NCBI 数据库中查询绵羊mtDNA的序列(GenBank登录号:AF010406),使用生物软件Primer 5.0设计1对D-loop区引物并送到北京诺赛生物公司进行合成。上游引物:AGAACAACCAACCTCCCTA;下游引物:TGCTTGATACCTGCTCCTT,扩增片段1 456 bp。
反应体系:PCR 反应体系(30 μL):2×Taq PCR Master Mix 15 μL,浓 度 为10 pmol/μL 的上、下游引物各1.5 μL,DNA池模板3 μL,最后加ddH2O补足30 μL。
PCR 扩增条件:95℃预变性5 min;95℃变性30 s,61.5℃退火30 s,72℃延伸1 min,35个循环,72℃终延伸5 min,4℃保存。
将扩增出的PCR 产物用1%琼脂糖凝胶电泳检测,待结果与目的片段相一致之后送北京诺赛生物公司进行测序。
1.4 数据处理
利用DNAstar 软件对试验结果进行比对,利用SeqMan 软件将20 条贵州半细毛羊线粒体DNA D-loop 区序列与NCBI 上查找到的绵羊线粒体DNA D-loop 区序列进行比对,用MEGA 5.0 软件将比对结果进行分析并构建贵州半细毛羊遗传发育树。
1.5 贵州半细毛羊与威宁绵羊的比对
将试验测序出的20条贵州半细毛羊线粒体DNA D-loop 区序列与试验组前期试验所得16 条贵州威宁绵羊线粒体DNA D-loop区序列和5 条NCBI 下载序列进行比对。在Kimura 2-parameter 模型下用MEGA 5.0软件选用邻接法(Neighbor-jioning mehod,NJ)用MEGA 5.0 进行遗传发育树构建。分析贵州半细毛羊与威宁绵羊的母系遗传结构差异。
2 结果与分析
2.1 PCR扩增及测序结果
将扩增出的PCR 产物用1%琼脂糖凝胶电泳进行检测。从图1可知,电泳条带清晰明亮、无杂带、无弥散和拖尾,说明PCR 扩增条件合适,引物特异性好。扩增所得片段大小与预期目的片段大小一致,说明扩增得到的是试验所需mtDNA 片段。将扩增得到的mtDNA 片段进行双向测序,从图2 可知,测序峰图均呈单一峰,无杂峰,表明测序结果良好。
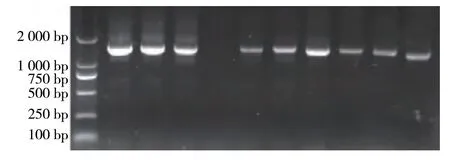
图1 贵州半细毛羊mtDNA D-loop区的特异性扩增产物
图2 贵州半细毛羊mtDNA D-loop区的测序峰
2.2 贵州半细毛羊线粒体DNA D-loop 区的核苷酸变异及碱基组成
经试验检测,20 只贵州半细毛羊个体mtDNA D-loop 区的长度为1 106.0~1 182.0 bp,其中长度为1 181 bp个体数量为16,长度为1 180.0 bp 个体数量为1,长度为1 178.0 bp 个体数量为1,长度为1 176.0 bp个体数量为1(表3),长度为1 106.0 bp 个体数量为1,由此推测贵州半细毛羊线粒体DNA D-loop 区的长度为1 181.0 bp。其中个体GZ1 在长度146 bp 处缺失4 个碱基TCCA(图3)。个体GZ10 在长度205 bp 处缺失74 个碱基(图4)。20 只贵州半细毛羊个体的A、G、C、T 平均含量分别为33.1%、14.4%、22.9%、29.7%,其中 A+T 为62.8%,G+C 为37.3%,A+T 含量明显高于G+C 含量。20 条序列中共发现多态位点84个,其中转换83个,颠换1个。所发现的84个多态位点共确定17个单倍型。
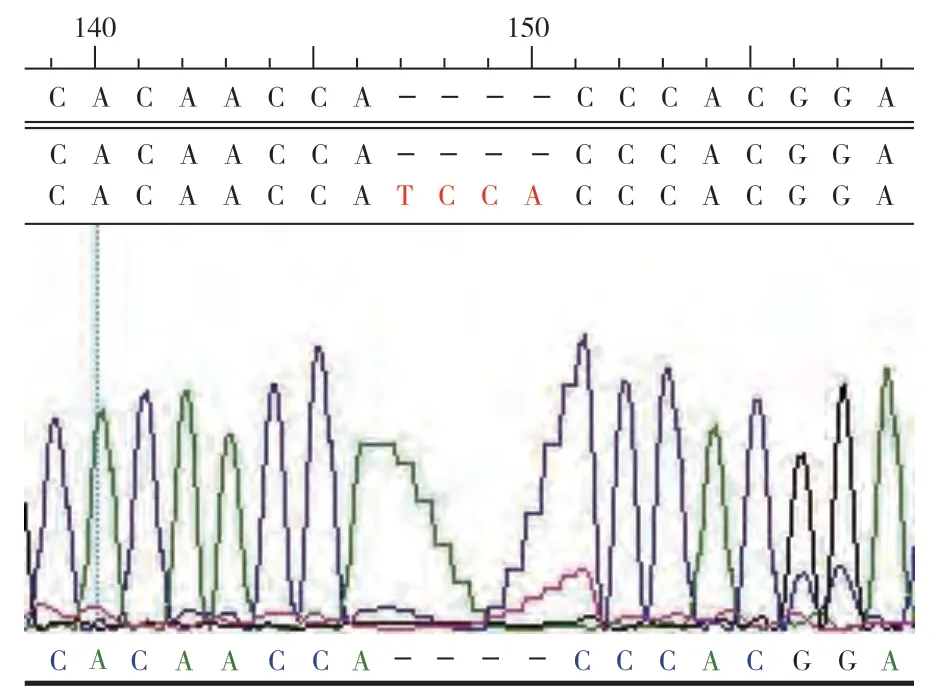
图3 贵州半细毛羊GZ1的mtDNA D-loop区碱基缺失

图4 贵州半细毛羊GZ10的mtDNA D-loop区碱基缺失
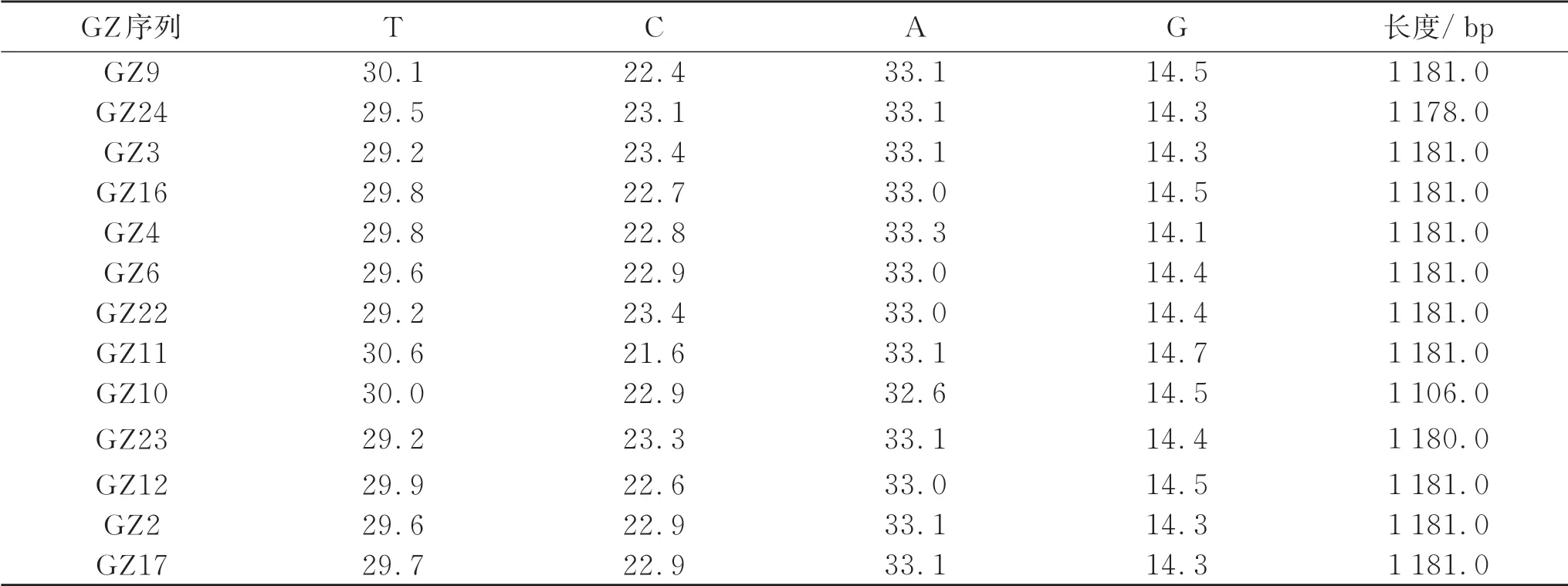
表3 贵州半细毛羊线粒体DNA D-loop区的核苷酸组成与长度
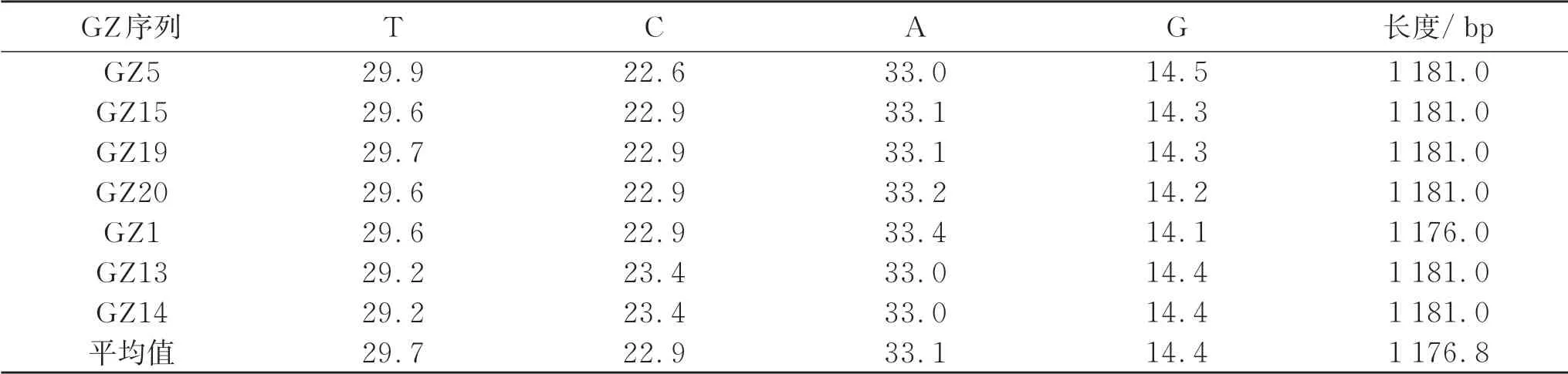
续表3
2.3 贵州半细毛羊群体的起源与进化分析
在Kimura 2-parameter模型下选用邻接法(NJ)和未加权配对算术平均法(UPGMA)通过MEGA 5.0软件构建了20只贵州半细毛羊个体和5 条NCBI 下载序列的遗传发育树,5 条NCBI 下载序列分别是1 条亚洲A 型序列(AL:AF039578)、1条欧洲B型序列(BL:AF039577)、1条羱羊序列(AJ238300)、1条摩弗伦羊序列(AY091487)、1条赤羊序列(AY091490)。从图5可知,不同方法构建的系统发育树均将贵州半细毛羊分为2个支系,且不同方法构建的系统发育树结果相似,25条序列构建的遗传发育树明显分为3个分支,第1支系为16只贵州半细毛羊个体和亚洲A型;第2支系包括4只贵州半细毛羊绵羊个体、欧洲B型与摩弗伦羊序列;第3支系中未见贵州半细毛羊的个体。
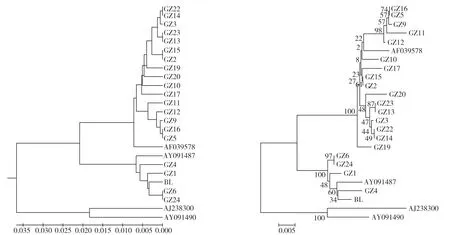
图5 贵州半细毛羊UPGMA(左)和NJ(右)遗传发育树
2.4 贵州半细毛羊与威宁绵羊的母系遗传结构差异
从图6可看出,遗传发育树同样明显分为3 个分支,第1 支系16 只贵州半细毛羊个体、12 只威宁绵羊和亚洲A 型;第2 支系包括4 只贵州半细毛羊绵羊个体、4只威宁绵羊、欧洲B型与摩弗伦羊序列;第3支系中同样未见贵州半细毛羊的个体。说明贵州半细毛羊与威宁绵羊的遗传结构相近,均有亚洲型和欧洲型2个母系起源。
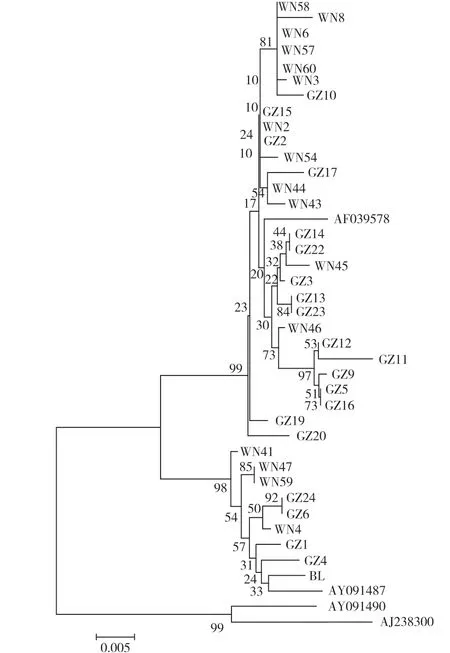
图6 贵州半细毛羊与威宁绵羊的NJ遗传发育树
3 讨论
作为生物多样性的重要参考指标,家畜的遗传多样性有着极其重要的地位[11]。家养绵羊是许多农业国家的主要家畜品种,中国有着悠久的的绵羊饲养历史以及相当丰富的种质资源。以摩佛伦羊(Ovis musimonorO.orientalis)、盘羊(O.vignei)和羱羊(O.ammon)等为代表的许多野生羊品种都曾经被认定为家养绵羊的祖先,对于部分绵羊品种的育成有着一定的贡献[1]。试验对20只贵州半细毛羊个体线粒体DNA D-loop 区的探究表明,D-loop序列长度为1 181.0 bp,与NCBI 上绵羊线粒体DNA D-loop 区序列长度一致。从贵州半细毛羊线粒体DNA D-loop 区序列的碱基组成来看,A+T为62.8%,G+C为37.3%,A+T含量明显高于G+C 含量,同样与mtDNA D-loop 区的结构特点一致。在20 条序列当中,发现多态位点84个,其中转换83个,颠换1个。所发现的84 个多态位点共确定了17 个单倍型。说明贵州半细毛羊mtDNA D-loop区序列具有转换偏倚性。通过构建遗传发育树发现,贵州半细毛羊20只个体遗传发育树主要分为两支,个体GZ1、GZ4、GZ6和GZ24遗传结构与欧洲B 型相近,其余16 只个体遗传结构与亚洲A 型相近,由此推测贵州半细毛羊至少有2个母系起源,根据相关文献发现贵州半细毛羊的育种方式为三元杂交类型[12],首先由新疆细毛羊作为父本与贵州当地威宁绵羊作为母本进行杂交出子代,再由子代与新西兰系考力代羊进行杂交,从而培育出贵州半细毛羊品种。
因贵州半细毛羊的培育是由贵州当地威宁绵羊、新疆细毛羊和新西兰系考力代羊为父母本进行的,因此与16 只威宁绵羊个体线粒体DNA D-loop 区序列进行对比,研究其遗传结构。通过对比分析发现,贵州半细毛羊与威宁绵羊的遗传结构相近,但又不完全相同。通过构建遗传发育树发现贵州半细毛羊与威宁绵羊都被分为两支系(欧洲B型与亚洲A 型),这与贵州威宁绵羊的遗传结构相符合,说明威宁绵羊在贵州半细毛羊的培育过程中作为母本之一产生了影响作用。但通过对多态位点的对比,发现贵州半细毛羊的D-loop 序列多态性更强,威宁绵羊16 条序列发现多态位点数为52 个,其中转换52 个,无颠换。而贵州半细毛羊20条序列所测多态位点为84个,其中转换83个,颠换1个。相比于威宁绵羊有所增加,说明贵州半细毛羊在培育过程中在其他品种羊的影响下,遗传结构有所改变。这或许是因为贵州半细毛羊的育种过程中,威宁绵羊作为母本只参与了与新疆细毛羊的杂交组合出子代,而贵州半细毛羊的培育过程还有新西兰系考力代羊,是三元杂交所培育出的品种,也就造成贵州半细毛羊的碱基序列与只占有父母本三分之一的威宁绵羊碱基序列有所不同,D-loop 区的多态性也有所增加。
在碱基组成方面,威宁绵羊D-loop 区的长度为1 181.0 bp,其碱基组成A+T 为62.7%,G+C 为37.4%,A+T 含量明显高于G+C 含量,与试验所测贵州半细毛羊D-loop序列结果相符。
试验构建的遗传发育树表明,贵州半细毛羊至少有2个母系起源,即亚洲A 型和欧洲B型,其中亚洲A型在贵州半细毛羊群体中占优势,因贵州半细毛羊的育种过程有贵州威宁绵羊品种的参与,故其母系起源和贵州威宁绵羊相近。
4 结论
20 只贵州半细毛羊个体线粒体DNA D-loop 区的长度为 1 106.0~1 181.0 bp,由于1 181.0 bp 长度占绝大多数,故贵州半细毛羊线粒体DNA D-loop 区的长度为1 181.0 bp。除少数插入/缺失外,少数个体长度变异为串联重复序列的重复次数不同造成。在20只贵州半细毛羊个体线粒体DNA D-loop 序列中共发现多态位点84 个,其中转换83 个,颠换1 个,这些多态位点共确定17个单倍型。不同方法构建的系统发育树均将贵州半细毛羊分为2个支系,根据NCBI 上查找的序列特征确定为支系A(亚洲A 型)和支系B(欧洲B 型),支系A 包括16 只贵州半细毛羊个体,支系B 包括4 只贵州半细毛羊个体。说明贵州半细毛羊mtDNA D-loop 区遗传多样性比较丰富,贵州半细毛羊至少存在2个独立的母系起源。

