纳米抗体分子影像探针的研究进展
张友 黄钢 魏伟军 刘建军
上海交通大学医学院附属仁济医院核医学科,上海交通大学医学院临床核医学研究所,上海 200127
大多数哺乳动物体内的单克隆抗体由2 条重链和2 条轻链组成,分子量约150 kDa。1993 年,比利时科学家Hamers-Casterman 等[1]在鲨鱼和骆驼中发现了没有轻链、只有重链的免疫球蛋白(immunoglobulin,Ig)G,并基于此IgG 进一步开发了单域抗体(single domain antibody,sdAb),也称之为纳米抗体(nanobody)[2]。纳米抗体相较于单克隆抗体,具有分子量小(约15 kDa)、溶解性好、稳定性高、组织穿透能力强且可快速从血液中清除并经肾脏排泄等诸多优点。此外,纳米抗体可通过生物工程技术在细菌、酵母或哺乳动物细胞中大规模生产,制备成本较低,从而有效促进其临床应用。纳米抗体作为构筑分子影像探针的新型靶向分子,经放射性核素标记后,具有短期内获取高质量图像、对疾病进行全面评估及指导个体化精准治疗等优势[3]。迄今为止,已经涌现出多种针对不同分子靶标的纳米抗体分子影像探针(简称纳米抗体探针)[4],并在肿瘤早期靶点特异性诊断方面发挥了重要作用。我们旨在综述纳米抗体探针领域的最新研究进展,并对该领域的未来发展作相应的展望。
1 纳米抗体探针在肿瘤中的应用
纳米抗体可应用于多种分子影像学成像技术,如PET/CT、SPECT/CT、光学成像和超声成像等。目前纳米抗体探针的主要靶点包括肿瘤膜抗原及肿瘤微环境中的靶点等,主要包括但不限于表皮生长因子受体(epidermal growth factor receptor,EGFR)、人表皮生长因子受体(human epidermal growth factor receptor,HER)2、血管内皮生长因子受体(VEGFR)、细胞分化抗原(cell differentiation,CD)、程序性细胞死亡蛋白-1(PD-1)、程序性细胞死亡配体-1(programmed cell death ligand 1,PD-L1)、淋巴细胞激活基因-3(lymphocyte activation gene-3,LAG-3)等。表1 中列举了部分已应用于临床试验的纳米抗体探针。
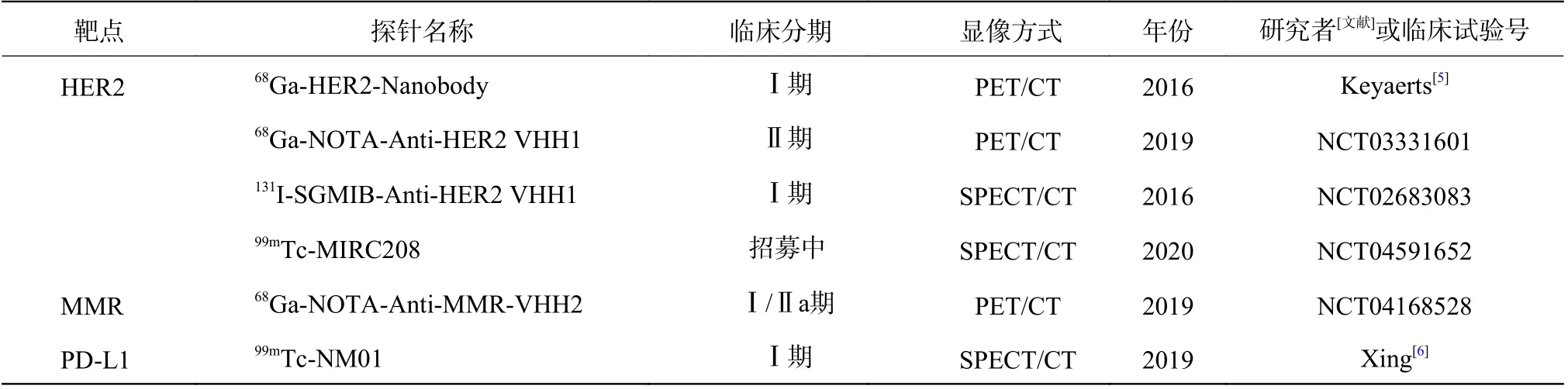
表1 临床级别的纳米抗体分子影像探针及其靶点Table1 Clinical-grade nanobody-based molecular imaging probes and their targets
1.1 PET/CT 显像纳米抗体探针
使用放射性核素68Ga、18F 等标记纳米抗体,可制备短半衰期PET/CT 分子影像探针。目前,PET/CT 显像纳米抗体探针的靶点主要包括HER2 和CD38 等。
1.1.1 HER2
HER2 是乳腺癌经典的生物标志物之一。抗HER2 治疗可显著延长HER2 阳性乳腺癌患者的生存期。基于纳米抗体的免疫PET 显像(immunoPET)有望实现HER2 异质性表达的无创可视化。Vaidyanathan 等[7]构建了靶向HER2 的纳米抗体探针18F-RL-I-5F7,证明了该探针可有效评估体内HER2 的表达情况。2016 年Keyaerts 等[5]制备了68Ga-HER2-Nanobody,并在一项纳入了20 例乳腺癌患者的临床试验中评估了该探针的诊断效能,结果显示,与周围正常组织相比,HER2 阳性乳腺癌病灶中的示踪剂摄取明显增高,这充分证实了68Ga-HER2-Nanobody 是一种极具临床应用价值的探针。目前该团队正在开展另一项临床试验,研究该探针对于乳腺癌脑转移灶的检出能力(NCT03331601)。
1.1.2 CD38
CD38 是一种在多发性骨髓瘤(multiple myeloma,MM)、非霍奇金淋巴瘤(NHL)及多种实体瘤细胞中显著高表达的跨膜蛋白。靶向CD38 的抗体达雷木单抗(daratumumab)已获批临床,用于MM 的治疗。最近,我们团队开发了首个靶向CD38 的纳米抗体探针68Ga[Ga]-NOTA-Nb1053(NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸,1,4,7-triacyclononane-1,4,7-tracetic acid),研究结果显示,该探针可特异性可视化皮下及原位骨髓瘤模型中浆细胞表面CD38 的表达水平,进而实现MM 的无创、靶点特异性精准诊断[8]。该探针的临床转化应用将有望为MM 的早期诊断、靶向治疗患者的筛选及治疗后疗效评价提供全新的路径。关于该探针的临床转化前景,可见最新的述评[9]。
1.1.3 肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)
TAM 是肿瘤微环境的重要组成部分,具有多种促肿瘤活性。在肿瘤缺氧部位,具有较强促血管生成作用的TAM 高度表达巨噬细胞甘露糖受体(macrophage mannose receptor,MMR)[10]。Blykers 等[11]制备了纳米抗体探针18F-anti-MMR sdAb,基于该探针的免疫PET 显像成功实现了肿瘤基质中促癌巨噬细胞亚群的无创可视化。Xavier 等[12]利用68Ga 标记的靶向MMR 的纳米抗体探针进一步实现了其临床转化。目前一项临床实验(NCT04168528)的研究者正在研究68Ga-NOTA-Anti-MMR-VHH2(VHH: 重链抗体可变区,variable domains of heavy chain-only antibodies)免疫PET 显像在乳腺癌、头颈部恶性肿瘤或黑色素瘤中的诊断价值。
1.1.4 PD-L1
靶向免疫检查点的免疫治疗正在逐渐改变肿瘤治疗的现状,PD-L1 是经典的免疫检查点之一[13]。然而,病灶内PD-L1 是否表达及表达程度将直接影响免疫治疗的效果。Nature Medicine杂志刊登的一项临床试验初步报道了PD-L1特异性单克隆抗体免疫PET 显像探针可视化PD-L1 异质性表达、预测PD-L1 特异性免疫治疗疗效的价值[14]。近期,国内研究者构建了一种靶向PD-L1 的纳米抗体探针68Ga-NOTA-Nb109,该探针可以利用PET/CT 显像无创显示肿瘤PD-L1 的表达情况并且及时准确评估免疫检查点靶向治疗的效果[15-16]。
1.1.5 细胞外基质(extracellular matrix,ECM)
ECM 对于促进肿瘤细胞的发生发展、增殖及迁移等具有重要的影响[17]。纤维连接蛋白(fibronectin)是一种糖蛋白,是构成肿瘤细胞外基质和新生血管的主要成分。Jailkhani等[18]从靶向ECM 蛋白的纳米抗体文库中筛选出了一种靶向纤维连接蛋白剪接体EIIIB 的纳米抗体NJB2,通过64Cu标记构建了64Cu-labeled-NJB2,最后通过免疫PET 显像证明了该探针在检测肿瘤原发灶、肿瘤转移灶、纤维化病变及以ECM 沉积为特征的疾病中具有良好的特异度和灵敏度。
1.1.6 免疫细胞
肿瘤浸润的CD8 阳性(CD8+)T 淋巴细胞在抗肿瘤免疫应答中起着重要作用。目前多项临床试验正在评估靶向CD8+T 淋巴细胞分子探针(89Zr-Df-IAB22M2C)的临床应用价值[19-21]。Rashidian 等[22]及我们团队[23]分别构建了靶向CD8+T 细 胞 的 纳 米 抗 体 探 针89Zr-PEGylated-VHH-X118 及68Ga-NOTA-SNA006a,上述探针在CD8+T 细胞的可视化及免疫治疗疗效的监测方面展现出了一定的价值,其临床应用价值有待进一步研究。
1.1.7 其他靶点特异性纳米抗体探针
除了上述的靶点之外,还有多种针对其他不同靶点的纳米抗体探针处于临床前研究阶段,如前列腺特异性膜抗原(PSMA)[24-25]、MM 细胞的表面标志物M 蛋白[26]和癌胚抗原(CEA)[27]等。
1.2 SPECT/CT 显像纳米抗体探针
使用发射γ 射线的放射性同位素(如99Tcm、111In 等)标记纳米抗体可进行SPECT/CT 显像。EGFR 是酪氨酸激酶受体家族的跨膜蛋白,其过度表达与多种恶性肿瘤的总体生存率和复发率相关。7D12 是第1 个被应用于分子影像的靶向EGFR 的纳米抗体[28]。Renard 等[29]合成了111In-labeled DTPA-IRDye700DX-7D12 ,该探针可进行SPECT/CT 及荧光双模态显像,准确可视化肿瘤细胞EGFR 的表达情况,有望筛选可从EGFR 靶向治疗中获益的患者。赵晋华团队首次将99Tcm标记的抗PD-L1 纳米抗体(NM-01)探针应用于非小细胞肺癌患者的SPECT/CT 显像,研究结果显示,99Tcm-NM-01 SPECT/CT 显像安全无不良反应,且在注射后2 h 显示出良好的T、NT,肿瘤的摄取水平与组织活检所示PD-L1 的表达情况具有良好的一致性[6]。近期,Lecocq 等[30]报道了一种靶向免疫检查点LAG-3 的纳米抗体探针99Tcmlabeled nanobody 3132,利用SPECT/CT 显像可以无创监测肿瘤浸润淋巴细胞(TILs)表面LAG-3 的动态演变,从而有望预测肿瘤患者的免疫治疗效果及远期预后。
1.3 光学成像纳米抗体探针
活体光学成像包括生物发光技术和荧光技术。生物发光技术是采用荧光素酶基因(luciferase)转染细胞,培养出能稳定表达荧光素酶的细胞株,进而通过光学成像进行生物发光;而荧光技术则采用荧光报告基团标记相应靶点进行显像。近期,Nix 等[31]通过细胞表面蛋白质组学揭示了CD72 是预后不良的KMT2A/MLL1(赖氨酸甲基轻移酶2A基因易位的混合谱系白血病,Lysine methyltransferase 2A translocations of the mixed lineage leukemia)重组急性B 淋巴细胞白血病的潜在靶标,并构建了靶向CD72 的纳米抗体NbD4,制备了基于NbD4 主动靶向的嵌合抗原受体T 细胞NbD4-CAR-T,进一步通过生物发光显像技术无创评估了NbD4-CAR-T 对于KMT2A/MLL1 重组急性B 淋巴细胞白血病的治疗效果。其研究结果显示, CD72-CAR-T 可延长CD19-CAR-T 治疗失败的KMT2A/MLL1 重组急性B 淋巴细胞白血病患者的生存期;此外,将靶向HER2 的纳米抗体11A4 与近红外荧光团IRDye 800CW 偶联后可特异性地定位于HER2 阳性异种移植小鼠的肿瘤部位。因此,利用近红外荧光成像进行图像引导手术,可精准切除HER2 阳性肿瘤[32]。
1.4 超声分子成像纳米抗体探针
超声分子成像是一种新颖的肿瘤诊断方法,将携带靶向特异性的抗体或配体的超声造影剂注射入体内,通过血液循环聚集于肿瘤部位,进而进行超声分子成像。碳酸酐酶Ⅸ(CAⅨ)在包括肾细胞肾癌在内的多种恶性实体瘤细胞膜高度表达,是构建分子影像探针的良好靶标。Zhu 等[33]构建了一种带有CAⅨ多肽的靶向纳米气泡,体内外研究结果显示,该气泡具有良好的穿透能力和特异性,可进行多种肿瘤的超声分子成像。
2 提高显像质量及促进临床转化
纳米抗体探针由于分子量小、循环时间短,导致其在体内迅速经过肾脏代谢并在肾脏内滞留。尽管在短时间内高亲和力的纳米抗体探针在肿瘤部位已有较高摄取,可勉强满足肿瘤诊断的需求,但是仍需对其药代动力学性质进一步优化,从而提高T、NT,促进其临床转化。此外,肾脏的持久高摄取及体内较短的循环时间还阻碍了纳米抗体探针在肿瘤治疗方面的应用。以下就目前推动纳米抗体探针临床转化所采取的相应策略展开简要介绍。
2.1 提高靶向亲和力
Rashidian 等[34]通过对纳米抗体的位点特异性修饰,合成了双特异性纳米抗体探针,其在荷瘤小鼠中显示了更强的亲和力。相较于单靶点纳米抗体探针,双特异性纳米抗体探针不仅增强了靶向特异性,还提高了靶向亲和力,实现了“1+1>2”的效果。双特异性纳米抗体探针已在多项动物实验中应用于放射性核素标记的显像、荧光成像和MRI 等[35]。HuNb1-IgG4 是一种新型的抗CD47 纳米抗体,具有较高的靶向亲和力和特异性。Ⅱ期临床试验(NCT02216409)证实了其在体内较强的抗卵巢癌和抗淋巴瘤活性[36]。在此基础上,Ma 等[37]合成了一种由HuNb1-IgG4 和利妥昔单抗(Rituximab)组成的抗CD47/CD20 双特异性抗体(BsAb),结果表明,其具有更强的选择性结合及抗肿瘤活性。此外,通过在纳米抗体末端引入特定标签,从而实现核素的定点标记,避免了随机标记破坏纳米抗体抗原结合位点的可能,这同样可提高纳米抗体探针的靶向亲和力[38]。
2.2 降低肾脏摄取
纳米抗体探针在肾脏摄取较高主要是由放射性核素标记的探针经肾小球滤过、近曲小管重吸收后被溶酶体降解所产生的放射性代谢产物在肾脏内长时间滞留所致。因此,降低肾脏摄取的主要方法可分为三个方面,一是减少肾小球滤过;二是抑制肾小管重吸收;三是在放射性核素标记的纳米抗体探针中引入代谢键来改变其在体内的代谢途径[39]。最近,Zhou 等[40-41]利用点击化学在纳米抗体探针中引入连接子GK,其可被肾近曲小管中的肾刷状缘酶选择性剪切,从而使放射性核素标记的基团随尿液排出,结果显示,在注射该探针3 h 后,几乎无法检测到肾脏摄取。此外,Wang 等[8]的研究结果表明, 在注射探针前5 min 注射马来酸钠或果糖,可通过抑制肾近曲小管细胞产生ATP 的方式,显著降低纳米抗体探针在肾脏的滞留。降低纳米抗体探针在肾脏的滞留不仅有助于提高图像质量,还可为纳米抗体介导的核素治疗及抗体偶联药物的发展提供可能。
2.3 延长体内循环时间
Hong 等[42]利用分选酶技术在靶向人EGFR 的纳米抗体7D12 的羧基末端引入二硝基苯基半抗原(DNP),修饰后的抗体可与内源性抗体结合形成原位免疫复合物,从而减慢其在肾脏的代谢,显著延长了其在小鼠体内的循环时间。Xenaki 等[43]将白蛋白结合域(ABD)引入纳米抗体,构建纳米抗体融合蛋白,其可与体内白蛋白结合从而不再经过肾小球滤过,体内外实验结果表明,其循环时间较纳米抗体延长了14.8 倍。此外,还可通过在纳米抗体中引入聚乙二醇链[44]、富含脯氨酸/丙氨酸的序列(PASylation)[45]等方式延长纳米抗体在体内的循环时间,增加肿瘤部位的摄取,从而提高显像质量,进一步协助对肿瘤的诊断及治疗。
3 小结与展望
随着免疫PET 显像技术的逐步兴起[46],纳米抗体探针也以其独特的优势迅速发展。除上述的靶点外,尚有其他靶点特异性纳米抗体探针在多项临床前研究中展现出了较好的诊断效果。随着分子生物学技术的不断迭代和对肿瘤病理生理过程的不断深入认知,越来越多的关键靶点将可用于纳米抗体探针的研发。为进一步有效推进纳米抗体探针的临床转化与应用,我们强调必须首先在符合药品生产质量管理规范(GMP)的条件下生产纳米抗体,并用于探针的构建,从而有效减轻药物所致的不良反应,保障患者的安全。我们认为,肿瘤靶点特异性诊断应服务于肿瘤靶点特异性治疗。虽然小分子药物、抗体类药物及细胞治疗等均可实现肿瘤的靶向治疗,但发展靶点特异性纳米抗体放射免疫治疗药物,优化其药代动力学和药效动力学性质,或将进一步助力实现肿瘤的精准诊疗[43,47-48]。
利益冲突所有作者声明无利益冲突
作者贡献声明张友负责综述的撰写与修改;黄钢、魏伟军、刘建军负责综述的审阅与最终版本的修订

