覆盆子苷-F3 抗血管生成作用的研究
周年,周萍,任琦,赵敏敏,2,刘宁,付辉政
1.江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029;2.江西中医药大学,江西 南昌 330004
覆盆子是蔷薇科悬钩子属植物华东覆盆子Rubus chingii Hu 的干燥未成熟果实,具有补肾、固精、明目之功效。作为江西省道地药材,覆盆子在江西省德兴市进行了规模化栽培,其中德兴覆盆子已登记为全国农产品地理标志。现代药理研究表明覆盆子具有显著的抗肿瘤作用,但作用机制仅局限于体外抑制肿瘤细胞增殖[1-2]。中药作为我国独特的天然药物宝库,国内已有许多文献报道如薏苡仁、姜黄等具有抗血管生成作用[3-4],而覆盆子分离的化合物抗血管生成的作用尚未见文献报道。抗血管生成可切断肿瘤恶性生长的供养途径,并阻断肿瘤侵袭转移的血行通道,有效遏制肿瘤的恶性发展[5]。肿瘤与血管形成有着密切的关系,其中血管内皮细胞的迁移和增殖是血管形成的关键步骤。本课题组前期采用MTT 法对覆盆子分离的化合物体外抗肿瘤的活性进行评价,筛选出抗肿瘤活性较强的化合物覆盆子苷-F3。在此基础上,以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)作为研究对象,采用MTT 法筛选出具有明显差异细胞毒性的活性化合物,并进一步通过细胞划痕、体外血管生成实验考察其对HUVECs 迁移能力和血管生成能力的影响。
1 材料与方法
1.1 材料
RPMI1640 完全培养基(批号WH01112202SP15,上海语纯生物科技有限公司);噻唑蓝(MTT)(批号723A051,上海语纯生物科技有限公司);二甲基亚砜(DMSO)(批号BCBN0845V,美国Sigma 公司);ECM 专用完全培养基(批号34356,Sciencell);重组人源血管内皮生产因子(rh-VEGF165)(批号B211228,北京博尔西科技有限公司);基质胶(批号BP2107002Z220224,Biozellen);肝素钠(批号605K021,北京索莱宝科技有限公司);紫杉醇(批号1534-200001,中国药品生物制品检定所);康莱特注射液(批号2110247-2,浙江康莱特药业有限公司)。
1.2 细胞株
Bel-7402 细胞来源于上海语纯生物科技有限公司,置RPMI1640 完全培养基(89%RPMI1640 培养基+10%胎牛血清+1%双抗),37 ℃恒温、5% CO2饱和湿度培养箱中生长;HUVECs 来源于上海语纯生物科技有限公司,于ECM 专用完全培养基(88%基础培养基+10%胎牛血清+1%内皮细胞生长添加剂+1%双抗),37 ℃恒温、5% CO2饱和湿度培养箱中生长。分别取处于对数生长期的Bel-7402 细胞,第二代至第五代之间的HUVECs 用于后续实验。
1.3 仪器
Multiskan go 酶标仪(赛默飞世尔科技有限公司);IC1000 细胞计数仪(上海睿钰生物科技有限公司);XDS-1 倒置显微镜(重庆光电仪器有限公司);BS224S 电子天平(赛多利斯科学仪器北京有限公司);311 型CO2培养箱(赛默飞世尔科技有限公司)。
1.4 MTT 法对覆盆子分离的化合物体外抗肿瘤活性的筛选
本次研究取华东覆盆子,利用各种色谱方法进行分离纯化,经鉴定后共分离得到17 个化合物[6]。经前期药效初筛选取覆盆子苷-F3 化合物,经连续2 倍稀释成6 个稀释浓度后备用。以紫杉醇作为阳性药,用培养基配制成0.03 μg/mL。将Bel-7402 细胞以5×103/孔接种于96 孔板中,每孔100 μL,培养24 h 后,依次吸弃上清液,更换为上述配制的覆盆子苷-F3 化合物溶液,设6 个复孔,24 h 后吸弃上清液,每孔加入含MTT(终浓度为0.5 mg/mL)的培养基100 μL,继续于CO2培养箱培养4 h 后,吸弃孔内液体,加入150 μL DMSO,孵育1 min,震荡5 min,在酶标仪上测定波长490 nm 处的吸光度值,计算细胞相对存活率(细胞存活率=给药组A490nm值/对照组A490nm值的均值×100%)。
1.5 覆盆子苷-F3 化合物对HUVECs 生物学行为的影响
1.5.1 细胞活性实验实验分为经rh-VEGF165(+)处理和无rh-VEGF165(-)处理两类,前者以rh-VEGF165(4 ng/mL)与覆盆子苷-F3 同时加入HUVECs 培养24 h,以rh-VEGF165(4 ng/mL)与ECM 专用完全培养基同时加入HUVECs 培养24 h作为对照组;后者除不添加rh-VEGF165 外与前者相同操作分组。覆盆子苷-F3 用ECM 专用完全培养基依次经连续2 倍稀释成6 个稀释浓度。以康莱特注射液作为阳性药,用ECM 专用完全培养基稀释成10 μg/mL 按照上述操作。将HUVECs 以5×103/孔接种于96 孔板中,每孔100 μL,培养24 h 后,依次吸弃上清液,更换为上述配制的含rh-VEGF165+覆盆子苷-F3 化合物溶液或不含rh-VEGF165+覆盆子苷-F3 化合物溶液进行干预,每个浓度设4 个复孔,24 h 后吸弃上清液,每孔加入含MTT(终浓度为0.5 mg/mL)的ECM 专用培养基100 μL,继续于CO2培养箱培养4 h 后,吸弃孔内液体,加入150 μL DMSO,孵育1 min,震荡5 min,在酶标仪上测定波长490 nm 处的吸光度值,计算细胞相对存活率(细胞存活率=给药组A490nm 值/对照组A490nm 值的均值×100%)。
1.5.2 细胞迁移实验将HUVECs 以5×104/孔接种于24 孔板上培养,每孔1 mL,待细胞贴壁融合后吸弃上清液,用200 µL 的枪头在孔板底部划出边缘整齐的“一”字划痕,然后用磷酸盐缓冲液清洗1 次后,设对照组、低剂量、高剂量组,每组依次加入经rh-VEGF165(+)处理的覆盆子苷-F3 化合物溶液(0、5 和 40 μg/mL),并设置一组阳性对照组(10 μg/mL),分别于0 h 和24 h 用倒置显微镜对细胞向创面边缘迁移的情况进行拍照。
1.5.3 体外血管生成实验实验所用枪头和96 孔板进行-20 ℃提前预冷,将96 孔细胞培养板放置冰上,每孔加入50 µL A 胶后继续置于冰上10 min,从冰盒中取出后每孔加入100 µL 冰的C 缓冲溶液,盖过之前加入的A 胶,在冰上继续反应15 min 后,小心吸弃C 缓冲溶液,加入100 µL 含5 μg/mL 的rh-VEGF165 及0.25 mM肝素的HUVECs悬浮液,使得细胞浓度为2.5×105个/mL,每孔依次加入覆盆子苷-F3 化合物溶液(0、10 和80 μg/mL),并设置一组阳性对照组(20 μg/mL),使得每孔内液体终体积控制在200 μL 左右,放置CO2培养箱继续孵育6 h 之后,取出放置于倒置显微镜下观察血管样结构的形成状况,拍照并以血管结节为量化指标,应用Image J软件血管生成插件对图片进行量化。
1.6 统计学方法
实验所有数据结果均用GraphPad Prism8 进行分析及绘图,采用单因素方差分析(One-way ANOVA)的方法对多样本间的均数进行比较,所有的统计结果均以P<0.05 为差异有统计学意义。
2 结果
2.1 覆盆子苷-F3 对Bel-7402 细胞活力的影响
覆盆子苷-F3 化合物对Bel-7402 细胞活力有明显的抑制作用(P<0.01),并且具有剂量效应,其对Bel-7402 细胞半数抑制浓度(IC50)值为(158.9±20.2)μg/mL。结果见图1。
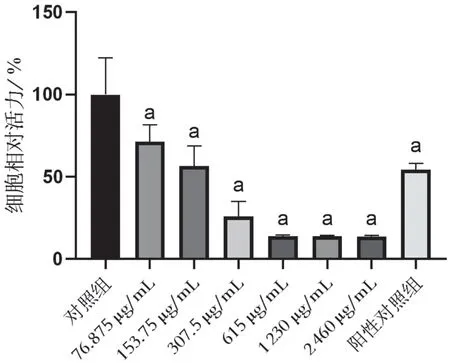
图1 覆盆子苷-F3对Bel-7402细胞活力的影响
2.2 覆盆子苷-F3 对HUVECs 活力的影响
覆盆子苷-F3 对经rh-VEGF165 处理的HUVECs活力有明显的抑制作用,其中抑制效果均强于不经rh-VEGF165 处理的HUVECs。此外,阳性药康莱特注射液对经rh-VEGF165 处理的HUVECs 和未经rh-VEGF165 处理的HUVECs 活力同样差异显著,反映出中药对血管内皮细胞活力的双向调节作用。结果见图2。

图2 覆盆子苷-F3对经rh-VEGF165(+)/rh-VEGF165(-)处理的HUVECs活力的影响
2.3 差异细胞毒性
覆盆子苷-F3 对Bel-7402 细胞和HUVECs 有明显的差异细胞毒性作用。即在对肿瘤细胞亚细胞毒性浓度下作用于HUVECs 有明显的增殖抑制作用(P<0.01)。图1 数据结果表明:当覆盆子苷-F3浓度为76.875 μg/mL 时,对Bel-7402 细胞的活力抑制率为28.73 %。选取对Bel-7402 细胞抑制率在20%以下的作用浓度[5,7],同时结合覆盆子苷-F3对HUVECs 的IC50值,选择高浓度40 μg/mL 与低浓度5 μg/mL 进行后续实验。
2.4 覆盆子苷-F3 对HUVECs 细胞迁移的影响
根据图3 细胞划痕实验图片可见,24 h 后对照组在rh-VEGF165 作用下,创面边缘明显消失,并长满了HUVECs,而覆盆子苷-F3 明显对细胞迁移起到抑制作用,其中40 μg/mL 组倒置显微镜下可见细胞形态发生了改变。

图3 覆盆子苷-F3的细胞划痕图片(×40)
2.5 覆盆子苷-F3 对HUVECs 抗血管生成的影响
据图4、图5 可知,6 h 后的对照组与0 h 相比,倒置显微镜下形成了密切交联的网状结构,可见明显的血管样,且交联比较致密,血管结节数明显增多(P<0.01),证实成功建立了血管生成体外模型。而覆盆子苷-F3 化合物5 μg/mL 组虽网状结构还有少许存在,但可见少部分结构呈现断裂式,交联不够致密,40 μg/mL 组基本没有血管样结构,血管结节数明显降低(P<0.01),其中HUVECs 主要呈单一分散排布的状态。该结果表明覆盆子苷-F3 以剂量依赖的方式抑制HUVECs血管生成。

图4 倒置显微镜下观察覆盆子苷-F3对HUVECs的抗血管生成作用(×100)
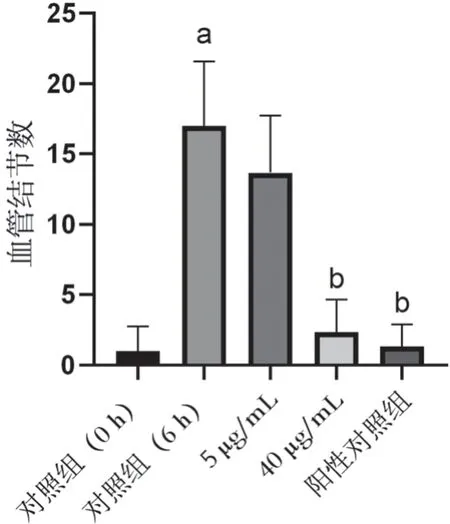
图5 覆盆子苷-F3处理后的血管结节数统计
3 讨论
文献对覆盆子的抗肿瘤作用报道较多集中在对肝癌的研究[8-9],本研究以人肝癌细胞株(Bel-7402细胞)作为研究对象,采用MTT 法考察覆盆子分离的化合物覆盆子苷-F3 体外抗肿瘤的活性。从结果可以看出,经浓度为76.875~2 460 μg/mL 的覆盆子苷-F3 处理24 h 后,Bel-7402 细胞的增殖抑制率显著上升,并且呈现浓度依赖性,表明覆盆子苷-F3 对人肝癌细胞株Bel-7402 细胞有明显的抑制作用。
依据Miller[10]提出的四项抗血管生成药物筛选标准之一“差异毒性”(即抗血管生成药物应该是其杀伤或抑制内皮细胞的药物剂量低于对肿瘤细胞的毒性剂量),本研究首先采用MTT 法筛选覆盆子分离的化合物中具有明显差异细胞毒性的化合物,然后通过细胞划痕、体外血管生成实验考察其对HUVECs 迁移能力和血管生成能力的影响。结果发现:覆盆子苷-F3 对Bel-7402 细胞的IC50值为(158.9±20.2 )μg/mL,而覆盆子苷-F3 对HUVECs的IC50值为(34.5±3.6)μg/mL,表明覆盆子苷-F3对Bel-7402 细胞和HUVECs 有明显的差异性细胞毒性作用。此外在筛选实验过程中发现覆盆子苷-F3化合物对经rh-VEGF165 处理的HUVECs 增殖抑制效果均强于不经rh-VEGF165 处理的HUVECs。VEGF 被认为是作用最直接、特异性最高的一种血管化生长因子,其中VEGF 165 在体内含量最为丰富,促血管化作用最强,这种差异性可能与HUVECs 经rh-VEGF165 处理后一定程度上模拟了体内肿瘤组织通过分泌大量VEGF 刺激血管内皮细胞增殖,促进血管生成的状态有关[11],也反映出中药对血管内皮细胞活力的双向调节作用[12]。同时,细胞迁移实验方面发现覆盆子苷-F3 可明显抑制内皮细胞的迁移。
尽管血管形成是一个复杂的过程,但是将HUVECs 在含有特定营养物质的基质胶上进行培养,细胞会快速迁移并排列形成复杂的网格状血管结构,可初步模拟体外血管生成。本研究通过体外血管生成实验发现:覆盆子苷-F3 可以以剂量依赖的方式抑制HUVECs 血管生成。血管的生成是一个涉及内皮细胞增殖、凋亡及细胞外基质降解和重塑的复杂过程,其中血管内皮细胞的迁移和增殖是血管形成的关键步骤。因此我们推测覆盆子苷-F3 在体外能有效抑制血管生成,其作用机理可能与抑制血管内皮细胞的增殖和迁移,从而达到抑制血管新生有关。本研究因覆盆子苷-F3 药量较少,采用的肿瘤细胞种类较为单一,有待采用较多的肿瘤细胞株进行全面的研究;同时抗血管生成作用还需建立体内肿瘤血管动物实验模型,观察覆盆子苷-F3 对体内肿瘤血管的抑制作用,为临床抗肿瘤血管生成的应用提供参考价值。

