设疑激趣 破迷开悟 实践应用
——实践型科学中考复习课研究
浙江慈溪市宗汉锦纶初级中学(315301)罗小飞
初中科学知识包罗万象,不仅包括生命科学和物质科学,还包括地球宇宙空间科学,且大多源自实际生活。通过观察、实验等实践活动,学生可认识科学规律,理解科学本质,并学会运用科学知识解决实际问题,更好地服务社会生活。因此教师可从实践活动入手开展实践型科学中考复习。下面笔者以市级公开课“水复习”一课为例来详细阐述是如何开展实践型科学中考复习的。
一、设疑激趣
初中科学一线教师都熟知“水”的中考核心考点有三个,分别是“溶液、悬浊液和乳浊液”“饱和溶液与不饱和溶液、溶解度”“溶质质量分数”。为了在复习课中激起学生强烈的好奇心和求知欲,笔者借助实践活动巧妙地将这三个核心考点融入实际情境并设疑激趣。
疑问1:怎么不会溶?
笔者展示“盐水”“白酒”“汽水”三瓶溶液,然后提问:生活中这些溶液由什么组成?它们有什么样的特征?接着让学生进行分组实验:将一小包未知的盐(一般用CaCO3粉末)慢慢倒入盛水的烧杯中,并用玻璃棒不断搅拌。继续提问:你们最感兴趣的问题是什么?多次磨课后笔者发现学生最感兴趣的问题是“这包盐怎么不会溶?”。像这样让学生通过实践后提出自己想要研究的问题,可以更好地激发学生的好奇心和求知欲,使后续的探究更加有的放矢。
疑问2:怎么不溶了?
笔者进行演示实验:取两个相同的烧杯,倒入等质量的水,再分别加入等质量的硝酸钾和蔗糖,结果发现蔗糖全部溶解,而硝酸钾却有部分未溶解。针对实验现象,笔者提问:硝酸钾怎么不溶了?该问题很好地激发了学生对“饱和溶液与不饱和溶液、溶解度”进行深入探究的欲望。
疑问3:怎么溶才好?
笔者展示图片“生理盐水”“医用酒精”“抗菌洗剂”,学生观察发现它们都有明确的溶质质量分数。对此,笔者提问:为了选种需要,要配制50 g溶质质量分数为16%的氯化钠溶液,怎么溶才好?这样为学生创设生活化问题情境,可促使学生探寻多种途径解决实际问题。
二、破迷开悟
针对“设疑激趣”环节提出的三个疑问“怎么不会溶?”“怎么不溶了?”“怎么溶才好?”,笔者巧妙设计了观察、实验等实践活动,抽丝剥茧、循序渐进地揭示科学规律,揭露科学本质。
(一)破“怎么不会溶”之迷,悟“溶液、悬浊液和乳浊液”之秘
为了破解学生的疑问“这包盐怎么不会溶?”,笔者先出示静置时间不同的三杯泥水(如图1)以及现场演示油滴入水中先摇匀后静置的实验(如图2),随即请学生思考讨论两者的异同。学生基本能通过求同思维得出:两者都不均一、不稳定,静置后会分层,它们都属于浊液。有的学生通过对比求异得出:泥水是固体小颗粒悬浮在液体中形成的混合物——悬浊液,油水是液体小颗粒分散在液体中形成的混合物——乳浊液。

图1

图2
在实物观察、实验操作、思考讨论的基础上,笔者进行层层追问:这包盐与水构成的混合物是悬浊液还是乳浊液?(悬浊液)这包盐可能是KNO3吗?请阐述理由。如果不是,你觉得它是什么?(不可能是KNO3,因为KNO3可溶,会得到溶液,猜测该盐可能为CaCO3、BaCO3等)你能从微观角度分析这包盐为什么不会溶吗?(该盐在水中颗粒依然较大)浊液和溶液的本质区别是什么?(师生共同归纳:浊液中物质的颗粒远大于溶液中溶质的颗粒,分散得不均一、不稳定)。由实物、实验刺激感官,由思考、讨论问题链助推思维,引导学生深入剖析浊液的概念、特征、分类以及悬浊液和乳浊液的区别与联系,并提炼归纳溶液与浊液的本质区别,牢固掌握“溶液、悬浮液和乳浊液”这一中考核心考点。
(二)破“怎么不溶了”之迷,悟“饱和溶液与不饱和溶液、溶解度”之秘
1.厘清概念
结合“设疑激趣”环节中的演示实验,笔者一只手举起一杯完全溶解的蔗糖溶液,另一只手举起一杯底部有晶体的硝酸钾溶液,提问:哪杯是饱和溶液?请阐述理由。(那杯底部有晶体的硝酸钾溶液是饱和溶液,不能再溶解某种溶质的溶液称为饱和溶液)实验中是什么因素影响溶解能力?(溶质)然后加热那杯底部有晶体的硝酸钾溶液,发现晶体全部溶解,继续提问:这又是什么因素影响溶解能力?(温度)紧接着,笔者取等质量的水和酒精,放入等质量的蔗糖,结果蔗糖在水中全部溶解,但在酒精中几乎不溶,提问:由此可见什么因素也会影响溶解能力?(溶剂)。综上所述,溶解能力的大小与溶质、温度和溶剂三个因素都有关,那么溶解度(定量表示溶解能力的大小)也应该与这三个因素有关,因此,物质的溶解度必须限定温度、溶剂的种类和质量,测出最多能溶解某种溶质的质量,即在一定温度下,某固体物质在100 g 溶剂(水)中达到饱和状态时所溶解的质量——溶解度。这样,通过实践来深入解读溶解度,不仅学生印象深刻、理解到位,还能为后续溶解度表格和图像的剖析以及饱和溶液与不饱和溶液的相互转化做好铺垫。
2.探索规律
[初探规律]让学生观察硝酸钾溶液的溶解度表(如表1),提问:从表1中你能获得哪些信息?

表1 硝酸钾溶液的溶解度
互动交流后,师生共同归纳出了某一温度下硝酸钾的溶解度,溶解度随温度变化的大致规律,以及根据表格数据判断某硝酸钾溶液是不是饱和溶液。
[再探规律]笔者利用自制的动画短片呈现将表1中对应的点转化为直角坐标系上的点的过程,然后将多个点用光滑的曲线连接,这样就得到了硝酸钾溶解度的图像(如图3),最后请学生思考讨论并完成表2 的填写,以便学生探知溶解度图像中各点所表示的含义和点与点之间转化的本质含义。

图3

表2 硝酸钾溶解度图像对应点及其含义
[深探规律]笔者将几种不同物质的溶解度呈现在一张图上(如图4-1),并单独呈现氢氧化钙的溶解度曲线(如图4-2),然后让学生小组合作找出物质溶解度的变化规律以及饱和溶液与不饱和溶液相互转化的规律,并填写表3。

图4-1 几种物质的溶解度曲线

图4-2 氢氧化钙的溶解度曲线

表3 溶解度与温度的关系及饱和溶液与不饱和溶液相互转化的规律
像这样以溶解度表格和溶解度图像为载体,引导学生由浅入深地探索相关规律,可以帮助学生成功突破学习难点,同时顺利揭示“饱和溶液与不饱和溶液、溶解度”的奥秘。
(三)破“怎么溶才好”之迷,悟“溶质质量分数”之秘
[夯实基础]围绕“要配制50 g溶质质量分数为16%的氯化钠溶液,怎么溶才好?”这个问题,笔者边实验边引导学生回顾重点内容“配制溶液的步骤和注意事项”。例如,配制溶液的基本步骤为计算、称量、溶解,注意事项为正确使用天平、量筒等,以及如果没有规范操作就容易导致溶质质量分数偏大或偏小等。
[挑战难度]笔者拿出一瓶密度为1.2 g/mL,质量分数为20%的氯化钠溶液,一瓶密度为1.1 g/mL,质量分数为10%的氯化钠溶液,以及食盐固体、纯净水等,引导学生发散思维,设计出尽可能多的实验方案并填入表4。
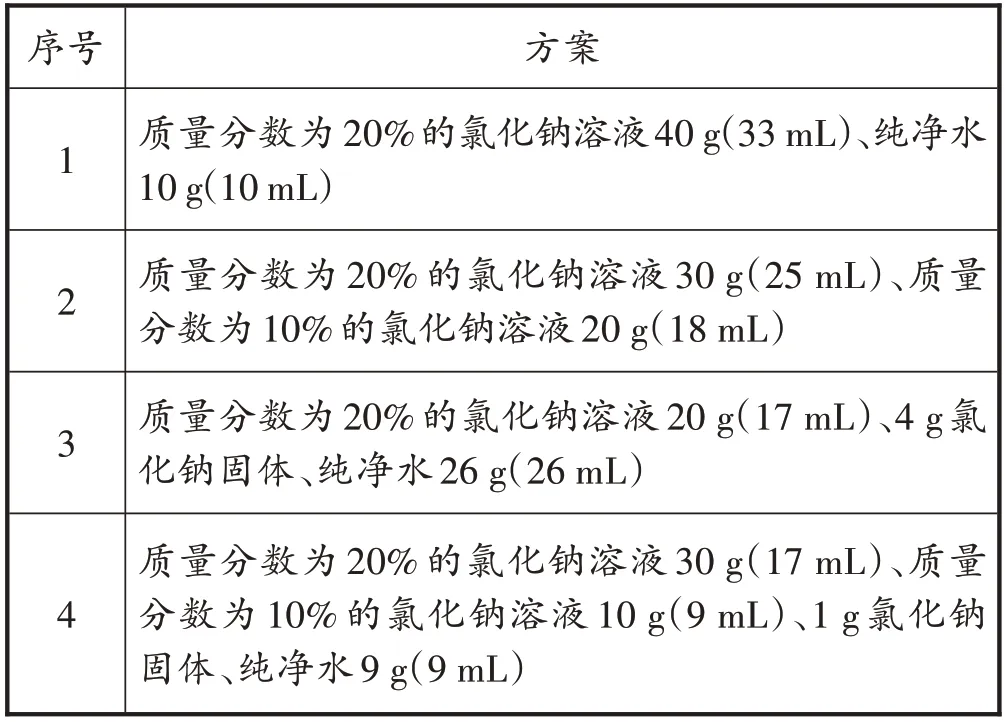
表4 配制50 g溶质质量为16%的氯化钠溶液的部分方案
像这样通过实验演示、根据实物设计实验方案等实践活动,让学生真切体验、深入思考、尽情表达,进而彻底领悟“溶质质量分数”的科学本质。
三、实践应用
学习科学的真正目的是将科学概念、规律、原理等应用到生活实践中,去解决问题、服务社会。通过实践增进体验,通过追问引发深思,通过剖析领悟科学本质,即“破迷开悟”是重中之重,但“实践应用”是价值体现。
(一)应用“溶液、悬浊液和乳浊液”解决实际问题
针对溶液、悬浊液和乳浊液在生活中非常常见,但又较难区分的特点,笔者设计“说说对错,举举实例”判断题(如表5)引导学生实践应用。

表5 “说说对错,举举实例”判断题内容
(二)应用“饱和溶液与不饱和溶液、溶解度”解决实际问题
针对“饱和溶液与不饱和溶液、溶解度”这一中考核心考点,笔者以溶解度图像(如图5)为载体设计了“提提问题,讲讲解释”的实践应用活动。活动中,学生提出了以下问题:P点的意义是什么?t2℃时,若用50 g水配制溶质是a,b,c的饱和溶液,需溶质最多的是哪个?溶剂质量相同的a,b,c三种物质的饱和溶液从t2℃降到t1℃时,析出晶体最多的是哪个?c物质的不饱和溶液变成饱和溶液的方法是什么?从混有少量b的a混合物中提纯a,可采用什么方法?

图5 溶解度图像
(三)应用“溶质质量分数”解决实际问题
针对“溶质质量分数”这一中考核心考点,笔者引导学生开展“想想办法,做做实验”实践应用活动,具体如下:有100 g 10%的食盐溶液,要使其质量分数变为20%,如何实现?学生通过思考、讨论得出了如表6的方法。

表6 提高溶质质量分数的方法
综上所述,实践型科学中考复习课从始至终都带着浓重的实践色彩,从实践中设疑激趣,到实践中破迷开悟,再到实践中应用自如,通过三环节成功打造趣味盎然、认识到位、理解深刻、效果良好的中考复习课。

