辣木籽多糖的超高压辅助提取工艺及其抗氧化活性分析
王标诗,黄澔杨,谭文慧,刘淑敏,张世奇,韩志萍,彭元怀
辣木籽多糖的超高压辅助提取工艺及其抗氧化活性分析
王标诗1,2,黄澔杨1,谭文慧1,刘淑敏1,2,张世奇1,2,韩志萍1,2,彭元怀1,2
1. 岭南师范学院食品科学与工程学院,广东湛江 524048;2. 广东省辣木资源开发与利用工程技术研究中心,广东湛江 524048
超高压辅助提取技术是一种天然产物新型绿色高效提取技术,在保证提取效率的同时能最大限度保持天然产物的生物活性。为探究超高压辅助提取技术对辣木籽多糖的提取效果及其抗氧化活性的影响,本研究以辣木籽为原料,通过超高压辅助提取技术提取辣木籽中的水溶性多糖,以多糖得率为考察指标,以提取压力、提取时间、料液比、粉碎度作为单因素,在单因素试验基础上,采用正交试验设计方法优化辣木籽多糖的超高压辅助提取工艺,并通过测定总抗氧化能力、清除DPPH自由基(DPPH•)和羟自由基(•OH)的能力来分析辣木籽水溶性多糖的抗氧化活性。结果表明,辣木籽多糖最佳的超高压辅助提取工艺条件为:提取压力100 MPa、保压时间6 min、料液比(g/mL)1∶15、粉碎度100目筛,在最佳提取工艺条件下辣木籽多糖最大提取得率为0.346%;在测试范围内辣木籽多糖清除DPPH自由基能力随多糖浓度的增加而增加,并有较好的线性关系,清除率达到50%时对应的浓度(IC50)为0.0439 g/L,但是其抗氧化能力低于相同浓度的Vc,在测试范围内清除羟自由基能力也随辣木籽多糖浓度的增加而增加,也有较好的线性关系,IC50为0.1666 g/L,其抗氧化能力与同浓度的Vc较接近,辣木籽多糖的总抗氧化能力为0.0482 mmol/L(以硫酸亚铁的当量浓度表示)。与热水提取方法相比,超高压辅助提取方法能够缩短提取时间,提取温度大大降低,提取效率显著提高;而且提取的辣木籽水溶性多糖具有较好的抗氧化能力,可以作为天然抗氧化剂进行开发利用。本研究结果可为天然抗氧化剂的开发、辣木资源的综合开发及高值化利用提供技术支持和参考。
辣木籽;水溶性多糖;超高压辅助提取;抗氧化活性
辣木()属被子门辣木科辣木属植物,起源于印度,目前,辣木树在非洲及世界热带、亚热带地区均有种植,被称为“穷人的牛奶树”“奇迹之树”[1-2]。辣木树浑身是宝,其叶子、花、嫩豆荚、籽均可直接食用。辣木被誉为植物中的“钻石”,与西洋参、灵芝合称为“世界三宝”,受到了医学界、食品界以及营养学界的高度重视。与普通的食品相比,辣木中蛋白质、膳食纤维及钙等矿物质元素含量较高,营养成分丰富[3]。辣木的种子即为辣木籽,辣木籽中除了含有丰富的蛋白质、油脂及矿物元素,还有多糖等活性物质[3-4],可用于食品、医药等方面,具有良好的开发价值和应用前景。
近年来,从天然植物中开发利用活性多糖成为新的研究热点,常见的多糖提取方法有很多种,如醇提法、热水浸提法、酶提法、微波法和超声波法等,但是大多存在提取率低、耗时较长和对多糖结构和功能造成破坏等缺点[5]。而超高压提取技术具有效率高、用时短和破坏性低等优点。目前关于超高压辅助提取多糖的研究比较少[6]。从天然产物中提取的多糖,在抗氧化、抗肿瘤、降血糖、降血脂等方面均有较好的效果[5]。
对辣木叶和辣木籽中多糖的提取已有相关报道,如陈瑞娇[7]和孙鸣燕[8]分别研究了辣木叶多糖的提取工艺条件;董成国[9]研究了热水提取辣木籽多糖的工艺条件及其抗氧化活性;CHEN等[10]研究了微波辅助提取辣木叶水溶性多糖的工艺条件及其降糖活性,而利用超高压辅助提取辣木籽多糖的研究尚无报道。
本文以辣木籽为原料,对辣木籽多糖的超高压辅助提取工艺进行优化,并研究辣木籽多糖的抗氧化活性。可为辣木资源的综合开发和高值化利用提供技术支持。
1 材料与方法
1.1 材料
1.1.1 植物材料 辣木籽购于湛江市旭昇南药种植专业合作社。
1.1.2 主要试剂 1,1-二苯基苦基苯肼(DPPH自由基)分装产品购自Sigma公司;总抗氧化能力(T-AOC)测试盒购自南京建成生物工程研究所;其他化学试剂均为分析纯。
1.1.3 主要设备 DFY-800摇摆式高速万能粉碎机,购自温岭市林大机械有限公司;FA1004N电子天平,购自上海精密科学仪器有限公司;W1-400/1.0型超高压试验杀菌机,购自天津华泰森淼生物工程技术股份有限公司;TU-1810DASPC紫外可见分光光度计,购自北京普析通用仪器有限公司;TGL16M高速冷冻离心机,购自盐城市凯特实验仪器有限公司;RE-2000B旋转蒸发仪,购自上海亚荣生化仪器厂;DHG-9240A电热恒温鼓风干燥箱,购自上海精宏实验设备有限公司;SHZ-D3循环水式真空泵,购自巩义市英峪仪器厂;HZS-HA水浴振荡器,购自哈尔滨东联电子技术开发有限公司;ELX808IU酶标仪,购自美国Bio-Tek公司。
1.2 方法
1.2.1 原料预处理 选择色泽均匀、无虫蛀、无霉变的辣木籽,置于55℃干燥箱中烘72 h,冷却后用高速万能粉碎机进行破碎;然后把辣木籽粉置于55℃的干燥箱中烘2 h,冷却后用索氏抽提器脱脂处理,残留物干燥过筛备用。
1.2.2 辣木籽多糖测定 参考梁琰等[11]的方法。分别取0.1 g/L葡萄糖溶液0、0.20、0.40、0.60、0.80、1.00 mL,用蒸馏水补足至1.00 mL,分别加入5.00 mL浓硫酸及1.00 mL 5%苯酚,每根试管加完后一起放置在90℃热水中水浴15 min,然后取出冷却至室温,于490 nm测吸光度。多糖得率的计算公式如下:
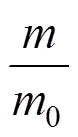
式中,表示从标准曲线中求出的辣木籽多糖质量(g),0表示辣木籽粉总质量(g)。
1.2.3 辣木籽多糖超高压辅助提取工艺 参考奚灏锵等[12]的方法。称取预处理后的脱脂辣木籽粉3 g,按不同料液比加入一定体积的水,装袋封口(尽量排出空气),放入超高压设备,按照不同压力和保压时间进行超高压处理。处理后进行抽滤,取上清液与Sevage试剂混合(脱蛋白),振摇30 min后离心:3500 r/min离心15 min,取上清液在低温下醇沉24 h,于20℃ 9000 r/min条件下离心10 min,沉淀物为辣木籽多糖,然后加蒸馏水溶解再定容至100 mL。
单因素试验分别探讨料液比、压力、保压时间和粉碎度对辣木籽多糖提取率的影响。料液比(g/mL)分别选取1∶15、1∶20、1∶25、1∶30、1∶35、1∶40;保压时间分别选取0、2、4、6、8、10 min;压力分别选取50、100、150、200、250、300、350、400 MPa;粉碎度分别选取过筛20、40、60、80、100目。
在单因素试验结果的基础上,选取对辣木籽多糖得率影响比较大的3个因素(料液比、提取压力和保压时间)作为考察因素,每个因素选取3个水平设计正交试验,以多糖得率为试验指标,优化提取工艺。正交试验设计因素与水平如表1所示。
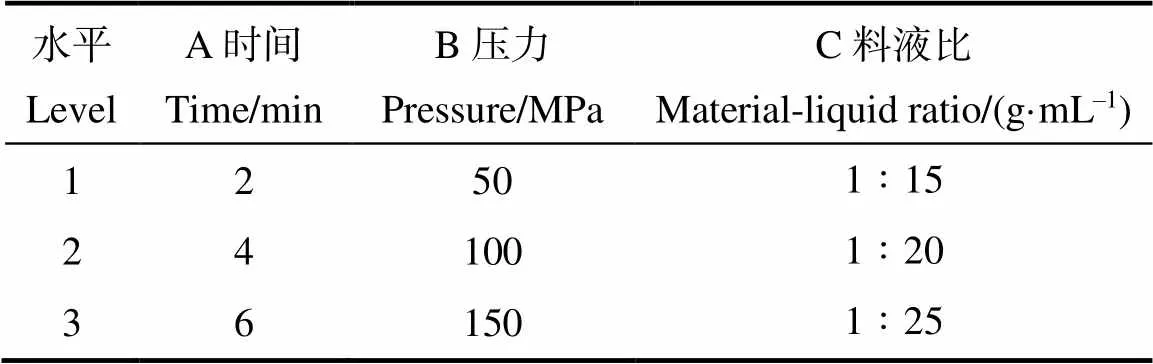
表1 正交试验因素与水平
1.2.4 辣木籽多糖热水提取工艺 参考王丽波等[13]的方法,略有修改。称取3 g辣木籽粉(精确到0.0001 g),量取45 mL水,在温度为90℃下提取4 h;趁热抽滤,取上清液与Sevage试剂混合(脱蛋白),振摇30 min后离心:3500 r/min离心15 min,取上清液醇沉24 h,于20℃ 9000 r/min离心10 min,弃上清液,取沉淀加蒸馏水定容至100 mL,以苯酚硫酸法测吸光度,根据标准曲线计算多糖得率。
1.2.5 辣木籽多糖清除DPPH自由基的测定 参考王丽波等[13]的方法。取多糖溶液2 mL于试管中,加入2 mL 0.3 mol/L DPPH,于暗处反应30 min,在517 nm波长处测定吸光度(i);再取上述2 mL多糖液,加入无水乙醇2 mL,反应30 min,在517 nm 波长处测定吸光度(j);取DPPH 2 mL,加入无水乙醇2 mL,反应30 min测定吸光度(0)。每个浓度的样品测定3次,然后取平均值。以VC作阳性对照。DPPH自由基清除率计算公式如下:

1.2.6 辣木籽多糖清除羟自由基的测定 参考WANG等[14]的方法。根据邻二氮菲-铁离子-过氧化氢体系,取2.0 mL pH为7.4的0.05 mol/L磷酸缓冲盐溶液(PBS)于试管中,加1.5 mL 0.005 mol/L邻二氮菲溶液后充分混合均匀,加1.0 mL 0.0075 mol/L硫酸亚铁溶液,立刻混合均匀,再加1.0 mL 0.1%过氧化氢,最后用蒸馏水补定容至10 mL,反应液置于37℃的水浴锅中保温1 h,于536 nm处测吸光度,按1.2.5方法,分别加入不同浓度多糖溶液,37℃水浴锅中保温1 h,测吸光度。羟自由基清除率计算公式如下:

式中,损伤为加过氧化氢未加样品所测得的吸光度,加样为加过氧化氢和样品所测得的吸光度,未损伤为未加过氧化氢和样品所测得的吸光度。
1.2.7 辣木籽多糖总抗氧化性(T-AOC)的测定 参照试剂盒说明书及相关操作测定。FRAP法测定辣木籽水溶性多糖的总抗氧化能力的原理是在酸性条件下抗氧化物质可以还原Fe3+-TPTZ产生蓝色的Fe2+-TPTZ,在593 nm处读取吸光度可以计算出样品中的总抗氧化能力。首先把试剂1、试剂2、试剂3按10∶1∶1比例配成FRAP工作液,避光37℃保温,现配现用。称取27.8 mg的FeSO4·7H2O,溶解后定容至1 mL,此时浓度为100 mmol/L。取上述配好的FeSO4·7H2O溶液稀释至0.15、0.30、0.60、0.90、1.20 mmol/L。最后按照说明书添加试剂到96孔板,在37℃下孵育5 min,最后置于酶标仪测定各孔值(即吸光度)。
1.3 数据处理
试验数据重复测定3次,结果以平均值±标准偏差表示。采用Excel软件等对实验数据进行处理与分析。
2 结果与分析
2.1 多糖标准曲线的制作
以吸光度为纵坐标,标准葡萄糖溶液浓度为横坐标,所得其线性回归方程为=0.9221– 0.0029,相关系数为0.9992(图1),说明在测定的浓度范围内,标准曲线线性关系较好、准确度高,可以用于辣木籽多糖含量的测定。
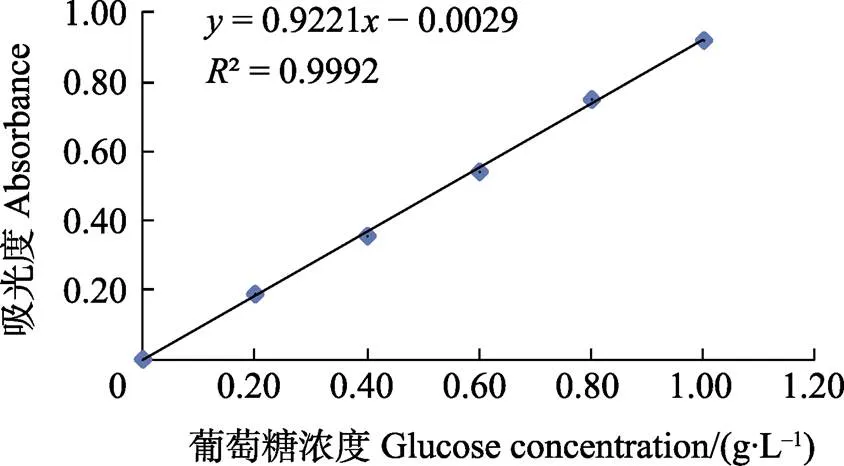
图1 葡萄糖标准曲线
2.2 辣木籽多糖超高压辅助提取单因素试验
2.2.1 压力对辣木籽多糖超高压辅助提取的影响 由图2可知,多糖提取得率在处理压力为100 MPa时达到最高,在50~100 MPa时提取得率随压力的增大而增大;在100~400 MPa时提取得率随压力的增大而减小。基于超高压提取原理,在小于100 MPa时,压力越大,超高压提取的效果越显著(<0.05);在大于100 MPa时,由于压力过大,辣木籽细胞膜结构有所损坏,再增加压力,反而有部分水溶性杂质被释放出来,同时,辣木籽多糖黏度也会提高,从而使扩散速率降低,在卸压的时候无法随着渗透压将细胞内的多糖物质输送出去,因此多糖得率有所下降。

图2 提取压力对辣木籽多糖得率的影响
2.2.2 时间对辣木籽多糖超高压辅助提取的影响 由图3可知,在前2 min内随着保压时间的增加,辣木籽水溶性多糖的提取得率逐渐增加,2 min后随时间的增加辣木籽多糖得率呈缓慢下降趋势,下降幅度不大,在2 min时提取得率最大,其余时间均高于保压0 min(升压后立即泄压)的结果。其原因可能是随着保压时间的增加,在长时间的超高压处理下,辣木籽细胞膜通透性变差,影响了卸压时多糖的渗透速度。
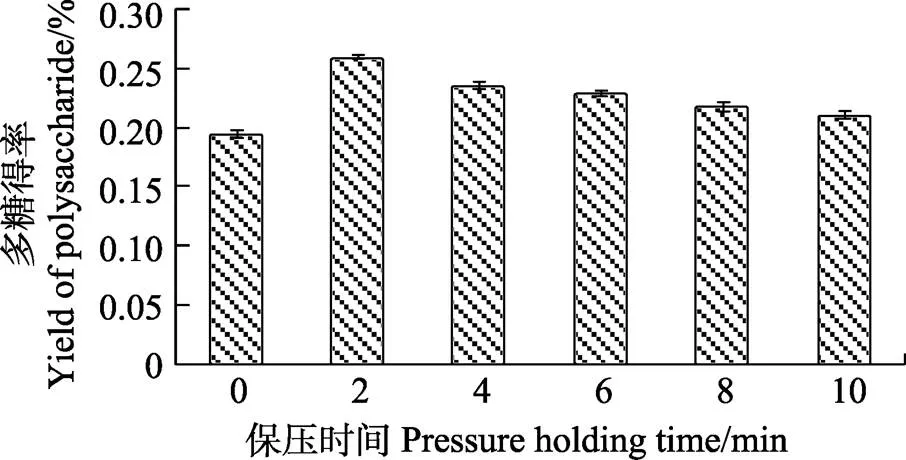
图3 时间对辣木籽多糖得率的影响
2.2.3 料液比对辣木籽多糖超高压辅助提取的影响 由图4可知,辣木籽水溶性多糖的提取得率随着料液比的增加呈先轻微增加而后逐渐降低的趋势,在1∶20时达到最高得率;而1∶20和1∶15两个条件下的多糖得率相差不大,无明显差异(<0.05),可能是在此范围内能提取到的多糖量基本上达到最大,多糖得率无明显变化。料液比在1∶20~1∶40之间,随着溶剂量的减少,卸压时所提供的渗透压增大,同时,水溶性多糖基本完全溶出,如再继续增加溶剂量,多糖量不变,而溶剂会增加,故其浓度反而会降低。

图4 料液比对辣木籽多糖得率的影响
2.2.4 粉碎度对辣木籽多糖超高压辅助提取的影响 由图5可知,粉碎度在20~80目筛之间,超高压提取辣木籽水溶性多糖得率基本无变化,100目筛粉碎度时辣木籽多糖得率最高,可能是由于在一定范围内,高压对多糖的溶出影响不大,超出范围后样品经过过细粉碎后,增大了与溶剂的接触面积,更有利于多糖的提取和溶出。
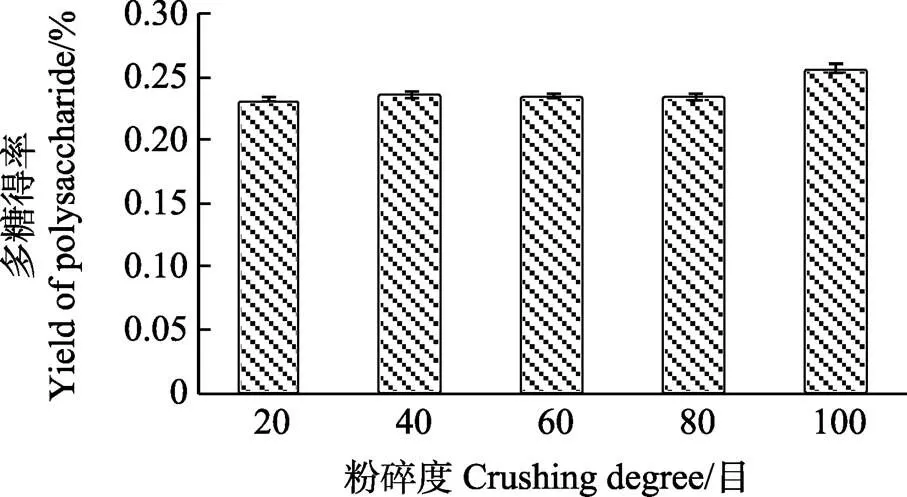
图5 粉碎度对辣木籽多糖得率的影响
2.3 超高压辅助提取辣木籽多糖工艺优化
单因素试验结果表明,粉碎度对超高压提取辣木籽水溶性多糖的得率影响变化不大,基于单因素试验结果,采用三因素三水平L9(34)正交表设计实验优化方案,考察压力、保压时间和料液比对辣木籽多糖提取得率的影响,结果如表2所示。从表2的极差分析可知,影响辣木籽多糖提取率的因素主次顺序为料液比(C)>保压时间(A)>压力(B),即对辣木多糖提取得率影响因素最大的是料液比,其次是时间,最后是压力,根据正交试验结果得出最优提取工艺参数组合为A3B2C1,即保压时间6 min,料液比1∶15,提取压力100 MPa。
优化后的最优组合存在于正交试验组中,最优条件下辣木籽多糖的得率为0.345%,在上述最优工艺条件下经验证得到辣木籽多糖得率为0.346%±0.005%,与正交试验方案的结果基本一致,所以可认为该工艺条件为最优工艺条件。
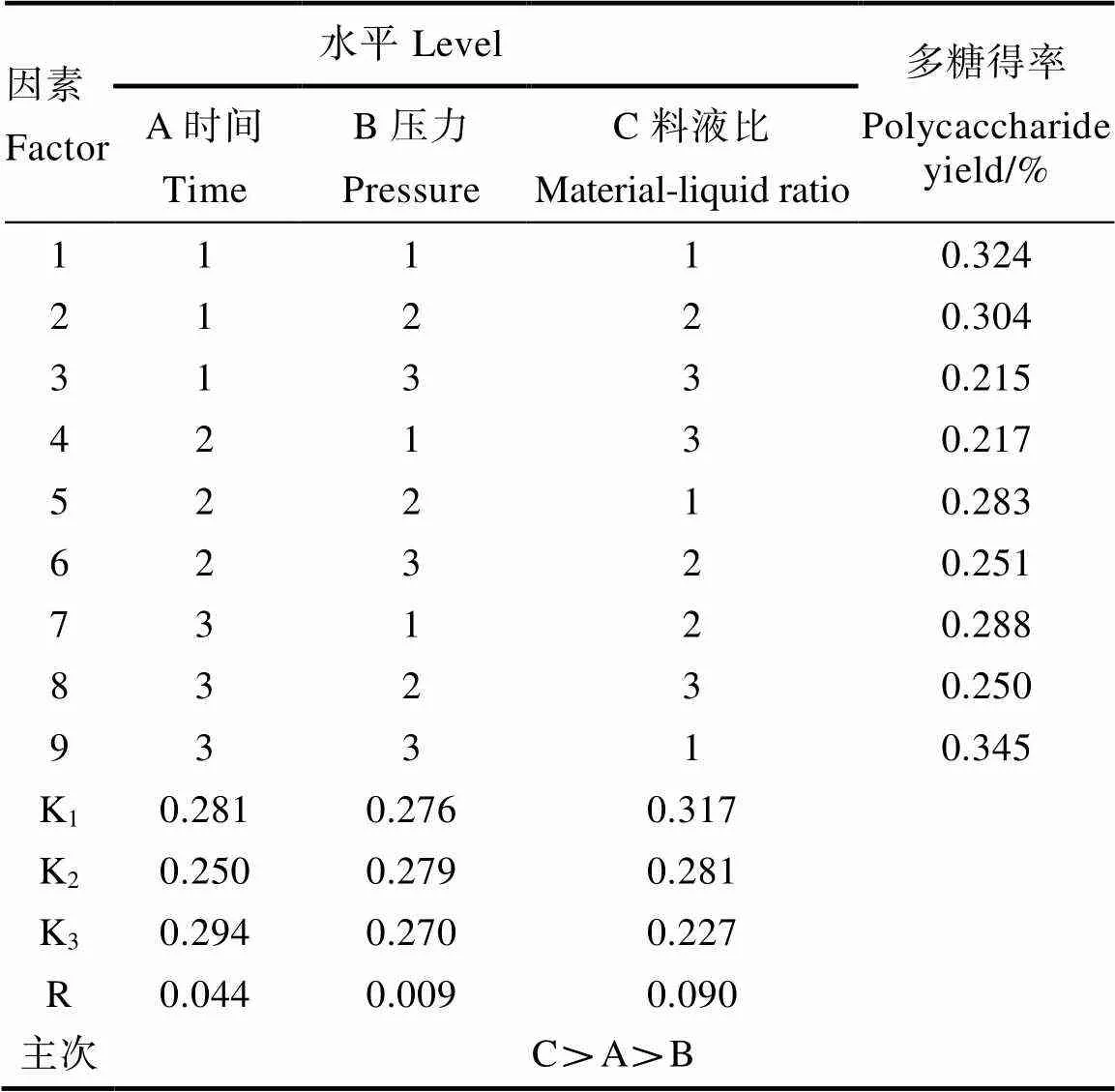
表2 正交试验方案及结果
2.4 辣木籽多糖超高压辅助提取与热水提取比较分析
由图6可知,辣木籽多糖通过热水提取(料液比1∶15,90℃下提取4 h)得率为0.296%± 0.006%,而超高压辅助提取在最优条件下(料液比1∶15,保压时间6 min,提取压力100 MPa)的辣木籽多糖得率为0.345%±0.005%。通过比较可知,在相同的料液比下,超高压辅助提取用时仅需6 min,提取结果明显高于热水提取4 h的结果(<0.05),可见,超高压辅助提取与热水提取相比可大大缩短提取时间、提高提取效率,而且在常温下提取对辣木籽多糖的结构和性质影响相对较小。
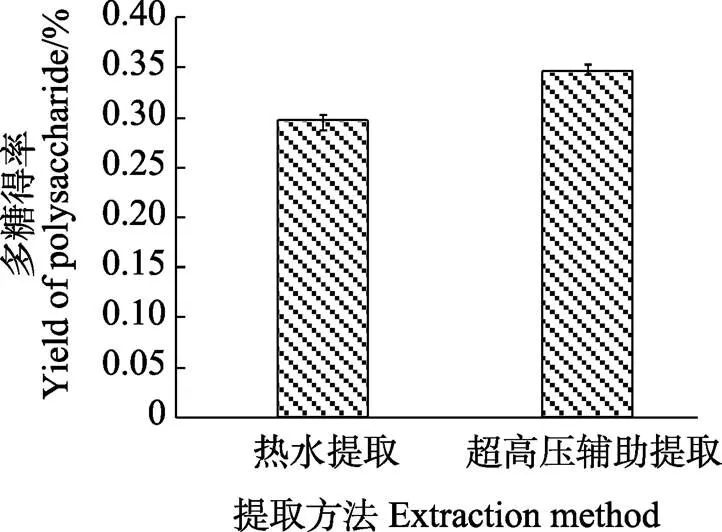
图6 提取方法对辣木籽多糖的提取效果的影响
2.5 辣木籽多糖的抗氧化活性测定
2.5.1 辣木籽多糖清除DPPH自由基能力 辣木籽多糖对DPPH自由基的清除能力如图7所示。由图7可知,在0.02~1.00 g/L多糖浓度范围内,辣木籽多糖对DPPH自由基的清除效果与浓度有较好的量效关系,多糖浓度()与清除率()的回归线性方程为=748+16.566,相关系数为0.962。测得辣木籽多糖清除DPPH自由基的IC50值为0.0439 g/L,在相同浓度情况下,Vc对DPPH自由基的清除率均高于辣木籽多糖,VC清除DPPH自由基的IC50值为0.0088 g/L。以上结果表明,辣木籽多糖具备一定的DPPH自由基清除能力,但是低于相同浓度下VC对DPPH自由基的清除能力。
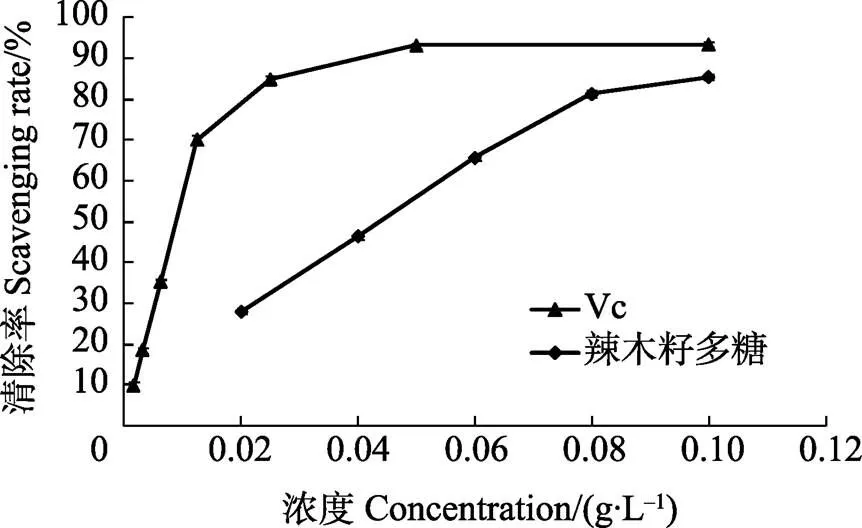
图7 辣木籽多糖对DPPH自由基的清除结果
2.5.2 辣木籽多糖清除羟自由基能力 辣木籽多糖对羟自由基清除能力如图8所示。由图8可知,辣木籽多糖的清除率与浓度成正比,多糖浓度()与清除率()的回归线性方程为=215.66+ 14.071,相关系数为0.9946。根据数据测得辣木籽多糖清除羟自由基的IC50约为0.1666 g/L,VC清除羟自由基的IC50约为0.1873 g/L,在低浓度条件下(<0.045 g/L),辣木籽多糖清除羟自由基能力高于同浓度的VC,高浓度条件下(>0.045 g/L),辣木籽多糖清除羟自由基能力低于同浓度的VC。
2.5.3 辣木籽多糖总抗氧化能力 由图9可知,标准曲线的线性关系较好,其线性回归方程为=0.1349+0.0805,相关系数为0.9983,说明在测定的浓度范围内,标准曲线线性关系较好。
相同条件下测3次辣木籽多糖样品,其吸光度为0.087,由公式求得,其值对应的硫酸亚铁标准溶液浓度为0.0482 mmol/L,即辣木籽多糖溶液的总抗氧化能力为0.0482 mmol/L(以硫酸亚铁的当量浓度表示)。
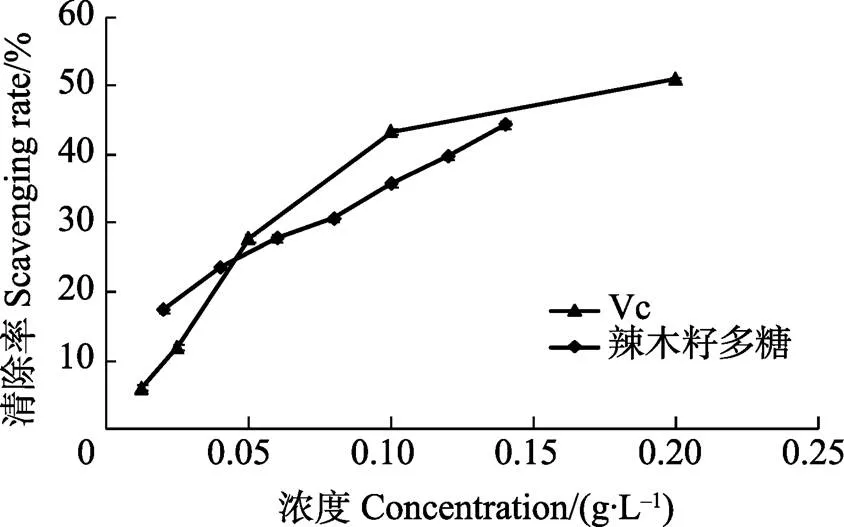
图8 辣木籽多糖对DPPH自由基的清除结果
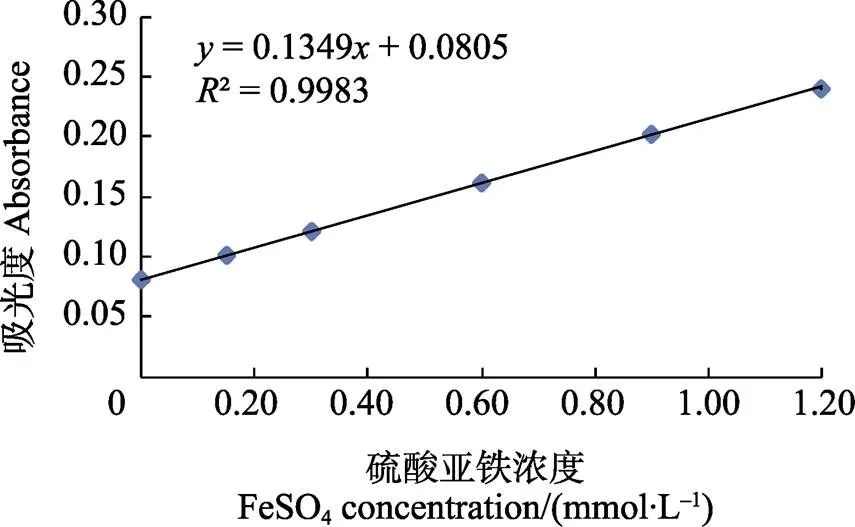
图9 试剂盒测定用硫酸亚铁的标准曲线
3 讨论
辣木多糖为辣木中重要的有效成分之一,目前,对辣木多糖的提取、分离和功能研究的相关报道较少,孙鸣燕[8]研究了辣木叶多糖的提取工艺条件,不同方法的辣木叶多糖提取率在17.10%~20.17%之间,其中超声波提取法的多糖得率最高,水提法的多糖得率最低,5种方法提取的多糖量差异均达到极显著水平;CHEN等[10]研究了微波辅助提取辣木籽叶多糖的工艺条件,该工艺条件下多糖提取率仅有2.96%。可见,不同提取方法对辣木叶中的多糖提取效果差别较大。董成国[9]研究了辣木籽水溶性多糖的热水提取工艺,其提取率比本研究结果高,可能与原料预处理方法及不同产地原料有关。
辣木多糖具有较好的抗氧化活性,董成国[9]对提取的辣木籽多糖进行纯化后再测定其抗氧化活性,分离得到的3种多糖组分抗氧化活性(清除羟自由基IC50均大于10 g/L)低于本研究结果,可见,超高压辅助提取的辣木多糖抗氧化活性更高,超高压技术对多糖活性影响较小,可以更好地保持多糖的抗氧化活性。本研究首次通过超高压提取技术提取辣木籽多糖并对其抗氧化活性进行分析,与热水提取法相比,超高压辅助提取的辣木籽多糖的得率更高,且具有较好的抗氧化活性,本研究为进一步开发利用辣木资源奠定基础,同时为辣木资源的高值化利用提供参考。
[1] GOPALAKRISHNAN L, DORIYA K, UMARK D S.: a review on nutritive importance and its medicinal application[J]. Food Science and Human Wellness, 2016, 5(2): 49-56.
[2] 虎虓真, 陶宁萍, 许长华. 基于食药价值的辣木籽研究进展[J]. 食品科学, 2018, 39(15): 302-309.
HU X Z, TAO N P, XU C H. Research advances inseedsbased on the food-drug values[J]. Food Science, 2018, 39(15): 302-309. (in Chinese)
[3] 樊建麟, 邵金良, 叶艳萍, 杨东顺. 辣木籽营养成分含量测定[J]. 中国食物与营养, 2016, 22(5): 69-72.
FAN J L, SHAO J L, YE Y P, YANG D S. Determination of nutritional content ofseeds[J]. China Food Nutrition, 2016, 22(5): 69-72. (in Chinese)
[4] BARAKAT H, GHAZAL G A. Physicochemical properties ofseeds and their edible oil cultivated at different regions in Egypt[J]. Food and Nutrition Sciences, 2016, 7(6): 472-484.
[5] AL-DHABI N A, PONMURUGAN K. Microwave assisted extraction and characterization of polysaccharide from waste jamun fruit seeds[J]. International Journal of Biological Macromolecules, 2020, 152(1): 1157-1163.
[6] 郭 淼, 宋江峰, 王传凯. 火龙果茎多糖的超高压提取及抗氧化活性研究[J]. 热带作物学报, 2017, 38(7): 1371-1376.
GUO M, SONG J F, WANG C K. Study on ultrahigh pressure extraction and antioxidant activity of polysaccharide from stem of[J]. China Journal of Trop Crops, 2017, 38(7): 1371-1376. (in Chinese)
[7] 陈瑞娇. 辣木叶多糖的提取及分离纯化[J]. 中药材, 2006, 29(12): 1358-1360.
CHEN R J. Extraction, separation and purification of polysaccharide fromleaf[J]. Journal of Chinese Medicinal Materials, 2006, 29(12): 1358-1360. (in Chinese)
[8] 孙鸣燕. 辣木黄酮和多糖提取方法及其含量影响因素的初步研究[D]. 呼和浩特: 内蒙古农业大学, 2008.
SUN M Y. Preliminary study on extraction methods and content influencing factors of flavone and polysaccharide from[D]. Huhehaote: Inner Mongolia Agricultural University, 2008. (in Chinese)
[9] 董成国. 辣木籽水溶性多糖的分离纯化、结构表征及其抗氧化活性研究[D]. 哈尔滨: 哈尔滨工业大学, 2016.
DONG C G. Purification, structure characterization and antioxidant activity of water-soluble polysaccharides fromseeds[D]. Haerbin: Harbin Institute of Technology, 2016. (in Chinese)
[10] CHEN C, ZHANG B, HUANG Q, FU X, LIU R H. Microwave-assisted extraction of polysaccharides fromLamleaves: characterization and hypoglycemic activity[J]. Industrial Crops and Products, 2017, 100: 1-11.
[11] 梁 琰, 赵志国, 张敏敏, 刘 倩, 程素盼, 耿岩玲, 王 晓, 赵恒强. 超声辅助提取苯酚-硫酸法测定野生平盖灵芝多糖含量[J]. 食品研究与开发, 2018, 39(16): 125-129.
LIANG Y, ZHAO Z G, ZHANG M M, LIU Q, CHENG S P, GENG Y L, WANG X, ZHAO H Q. Ultrasonic-assisted extraction of polysaccharide fromby phenol-sulfuric acid method[J]. Food Research and Development, 2018, 39(16): 125-129. (in Chinese)
[12] 奚灏锵, 袁根良, 杜 冰, 杨公明. 超高压提取香菇多糖的研究[J]. 现代食品科技, 2010, 26(9): 991-993.
XI H Q, YUAN G L, DU B, YANG G M. Study on extraction of polysaccharide from lentinan by ultra-high pressure[J]. Modern Food Science and Technology, 2010, 26(9): 991-993. (in Chinese)
[13] 王丽波, 程 龙, 徐雅琴, 王泰恒, 李鲁滨, 王瀚嵩. 南瓜籽多糖热水提取工艺优化及其抗氧化活性[J]. 农业工程学报, 2016, 32(9): 284-290.
WANG L B, CHENG L, XU Y Q, WANG T H, LI L B, WANG H S. Extraction technology optimization and antioxidant activity of polysaccharides from pumpkin seeds[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(9): 284-290. (in Chinese)
[14] WANG B S, LI B S, ZENG Q X LIU H X. Antioxidant and free radical scavenging activities of pigments extracted from molasses alcohol wastewater[J]. Food Chemistry, 2008, 107(3): 1198-1204.
Ultra-high Pressure Assisted Extraction and Antioxidant Activity of Polysaccharide fromSeeds
WANG Biaoshi1,2, HUANG Haoyang1, TAN Wenhui1, LIU Shumin1,2, ZHANG Shiqi1,2, HAN Zhiping1,2, PENG Yuanhuai1,2
1. School of Food Science and Engineering, Lingnan Normal University, Zhanjiang, Guangdong 524048, China; 2. Guangdong Engineering and Technology Research Center of Development and Utilization of,Zhanjiang, Guangdong 524048, China
Ultra-high pressure assisted extraction (UHP) is a new green and high efficient extraction technology for natural products, and the biological activity of the natural products can be kept as much as possible. Withseeds powder as the experimental material, the water-soluble polysaccharide was extracted by a new ultra-high pressure assisted extraction technology. The antioxidant activities of the water-soluble polysaccharide fromseed were evaluated by the total antioxidant capacity and DPPH and hydroxyl radicals scavenging ability. Taking the yield of polysaccharide as an evaluation index, the effects of pulverization degree, pressure, pressure holding time and ratio of material to liquid on the yield of water-soluble polysaccharide fromseed were investigated by the single factor experiment method. The orthogonal experiment design method was used to get the optimum ultra-high pressure assisted extraction conditions of polysaccharide fromseed. The experiment results showed that the optimum technological conditions of the polysaccharide fromseed were determined as follows: holding pressure of 6 min, solid-liquid ratio of 1∶15 (g/mL), extraction pressure of 100 MPa and degree of pulverization of 100 mesh. The yield of the polysaccharide fromseed under this optimum condition was 0.346%. The experiment results also showed that the scavenging abilities for DPPH and hydroxyl radicals increased with the increase of concentration of the polysaccharide fromseed and there was a good linear relationship between concentration of the polysaccharide fromseed and the radical scavenging ability. The IC50(the concentration when the radical scavenging rate is 50%) of the polysaccharide fromseed for DPPH and hydroxyl radicals was 0.0439 g/L and 0.1666 g/L respectively, and the antioxidant ability was lower than that of Vc at the same concentration, which indicated that the water-soluble polysaccharide fromseed had certain antioxidant capacity within a certain concentration range. The total antioxidant capacity of the water-soluble polysaccharide fromseed was 0.0482 mmol/L (Expressed as the equivalent concentration of FeSO4). The water-soluble polysaccharide fromseedcan be extracted effectively in lower temperature and shorter time by ultra-high pressure assisted extraction technology compared with hot-water extraction method and the water-soluble polysaccharide fromseedhas good antioxidant activities and can be exploited and used as a natural antioxidant. The results of this study could provide technical support and reference for the exploration of natural antioxidant and the development and high value comprehensive utilization of.
seeds; polysaccharide; ultrahigh pressure assisted extraction; antioxidant activity
S202.1
A
10.3969/j.issn.1000-2561.2022.10.020
2022-02-15;
2022-03-12
广东省自然科学基金项目(No. 2022A1515010360);中央财政支持地方高校发展专项资金项目(No. 0003018015);岭南师范学院自然科学基金项目(No. ZL1817)。
王标诗(1980—),男,博士,副教授,研究方向:农副产品深加工及综合利用。E-mail:hang_kong2002@163.com。

