植物固醇的功能研究进展
任慧文,王 雪,门淑珍
(南开大学 生命科学学院,天津 南开 300071)
1 植物固醇及其合成途径
固醇(又称甾醇)是异戊二烯衍生的脂类分子,以环戊烷多氢菲为基本骨架,并且含有醇基[1]。固醇是真核生物细胞膜的重要组成成分,不仅影响膜的稳定性、流动性和通透性,还影响胞吞和胞吐等囊泡运输过程以及膜蛋白的分布和活性[2-4]。此外,固醇还是甾醇类激素合成的前体,如哺乳动物中的性激素和植物中的油菜素甾醇(Brassinosteroid,BR)。因此,固醇在细胞的生命活动和个体的生长发育中具有重要的作用。哺乳动物细胞膜的固醇成分主要是胆固醇(cholesterol),真菌中主要是麦角固醇(ergosterol),而植物的固醇成分则相对复杂,能检测到60多种植物固醇,其中含量比较高的固醇成分是谷甾醇(sitosterol)、豆甾醇(stigmasterol)和菜油甾醇(campesterol)等[5,6]。这些固醇分子的区别在于双键的位置和数量以及侧链的结构,例如谷甾醇是C-24-乙基甾醇,菜油甾醇是C-24-甲基甾醇,而豆甾醇的结构与谷甾醇相同,只是其在C-22位是一个双键(图1)。
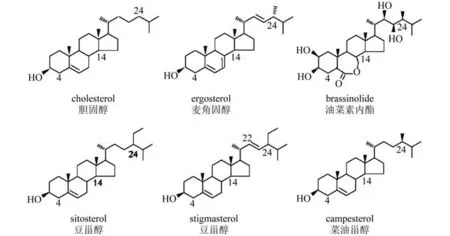
图1 固醇和油菜素甾醇分子的化学结构。
植物固醇合成途径的起始与动物和酵母中的相同,都是由乙酰辅酶A起始,经甲羟戊酸,通过一系列酶促反应生成2,3-环氧鲨烯(图2)[5,6]。但是,在随后2,3-环氧鲨烯的环化步骤,植物与动物和真菌存在明显的不同。动物和真菌中,2,3-环氧鲨烯在羊毛脂甾醇合酶(lanosterol synthase,LAS)的催化下生成羊毛脂甾醇。然后,经过一系列的酶促反应,最终生成胆固醇或麦角固醇。而在植物中,2,3-环氧鲨烯经由环阿屯醇合酶(cycloartenol synthase,CAS)催化生成环阿屯醇(图2)[5-7]。环阿屯醇为五环的固醇中间产物,与羊毛脂甾醇相比含有一个额外的9,19-环丙烷环,在下游的合成步骤中需由植物特有的环丙基固醇异构酶(cyclopropylsterol isomerase,CPI)催化打开9,19-环丙烷环,最后生成四环的植物固醇终产物[8]。此外,无论是环阿屯醇,还是羊毛脂甾醇,只有去除C-14位上的一个甲基和C-4位上的两个甲基后才能成为有功能的固醇。动物和真菌中这些甲基的去除顺序是C-14、C-4、C-4,而植物中则是C-4、C-14、C-4(图2)[1,9]。虽然反应的顺序不同,但是动物、真菌和植物中去除C-4-甲基的反应过程却是相同的,都是由固醇C-4脱甲基多酶复合体(sterol C-4 demethylase multienzyme complex,SC4DM)催化完成。该复合体包含有:固醇-4α-甲基氧化酶(sterol 4α-methyl oxidase,SMO),4α-羧基固醇-C3-脱氢酶/C4-脱羧酶(4α-carboxysterol-C3-dehydrogenase/C4-decarboxylase,CSD),固醇酮基还原酶(sterone keto reductase,SKR),以及将这三个酶粘连在一起的脚手架蛋白ERG28。通过三个酶的依次反应完成一个C-4甲基的去除[9,10]。酵母、小鼠和人中这些酶都各只有1个同工酶,连续进行两轮反应完成C-4位两个甲基的去除[9]。而拟南芥中已经确定有五个SMO和两个CSD,SKR的数目还有待鉴定。拟南芥的5个SMO可以分为SMO1和SMO2两个亚家族,其中SMO1亚家族有三个成员,参与第一个C-4甲基的去除反应;SMO2亚家族有两个成员,参与第二个C-4甲基的去除反应[9-12]。去除甲基的固醇中间产物最后在Δ7-固醇-C-5-去饱和酶(DWF7)、Δ5,7-固醇-Δ7-还原酶(DWF5)和Δ5-固醇-Δ24-异构酶(DWF1)等酶的催化下生成最终的固醇产物,包括谷甾醇、豆甾醇和菜油甾醇等[5,6],其中菜油甾醇还是重要的植物激素——BR合成的前体。
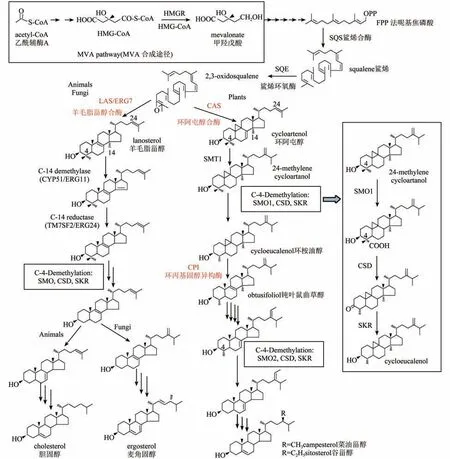
图2 动物、真菌和植物中的固醇合成途径
植物固醇合成途径中涉及到众多的酶促反应,编码这些酶的基因突变或过表达会导致其底物及下游产物含量的改变,或者使固醇的合成向旁路进行,从而引起固醇总量或者各种固醇成分比例的变化。对这些突变体或者转基因株系的研究极大地促进了我们对植物固醇功能的理解。同时,固醇在植物耐受非生物逆境或抗病虫方面也发挥着重要的作用。
2 植物固醇的功能
2.1 固醇在植物发育中的功能
通过对拟南芥固醇合成缺陷突变体的研究,逐渐揭示了固醇在植物生长发育和细胞生命活动中的重要作用。固醇合成途径上游的基因突变往往引起花粉败育、胚致死或缺陷以及幼苗致死的表型。
2.1.1 植物固醇在花粉发育中的功能。甲羟戊酸途径(Mevalonate pathway,MVA途径)是合成异戊二烯类化合物的重要过程,也是合成固醇的起始途径,其中HMG-Co A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)催化的反应是该途径的限速步骤(图2)。拟南芥中编码HMGR的基因有HMG1和H MG2。Suzuki等[13]发现hmg1突变株具有矮化、早衰和雄性不育的表型,而hmg2突变体植株则没有明显的表型。将hmg1-1突变体的花粉授予野生型植株时,花粉粒不能萌发且不能产生正常种子。DAPI染色结果表明,hmg1-1的成熟花粉与野生型一样含有一个营养核和两个精细胞核。这些结果表明,hmg1-1突变株雄性不育的原因是由于其花粉粒萌发的缺陷。hmg1-1五周龄苗的花序中总固醇含量只有野生型的25%,且外源施加鲨烯可拯救hmg1-1不育的缺陷,暗示鲨烯下游代谢产物的减少或固醇在花粉中的分布异常可能会导致雄性不育[13]。将hmg1和hmg2突变体进行杂交,无法获得hmg1hmg2双突变体植株[14]。遗传分析表明,hmg1hmg2基因型的雄配子传递率为零。对hmg1-1/+hmg2-1植株成熟花粉粒观察发现,其中约有一半的花粉粒呈皱缩状态。透射电镜的结果显示,与野生型花粉粒相比这些皱缩的花粉粒中具有更大的液泡,起源于内质网的膜结构过度肥厚。这种依赖于甾醇的膜结构异常可能是导致hmg1hmg2双突变体花粉败育的主要原因[14]。
3-羟基-3-甲基戊二酰辅酶A合酶(3-hydroxy-3-methylglutaryl-coenzyme Asynthase,HMGS)是MVA途径中催化HMGR上一步反应的酶,由单拷贝基因FKP1(FLAKY POLLEN1)编码。拟南芥fkp1突变体由于绒毡层细胞中富含脂类的两个细胞器——绒毡层小体(tapetosomes)和造油体(elaioplasts)发育异常,使得脂类物质的合成受到影响,花粉外壁中的脂类和一些多肽不足,导致fkp1的花粉外被异常,不能被柱头识别,花粉萌发和花粉管伸长受到抑制[15]。固醇合成通路中编码环阿屯醇合酶的CAS1基因突变也导致花粉败育,但其败育的时期和败育的机制目前并不清楚[7]。
真菌和植物固醇与脊椎动物固醇的不同之处在于C-24位上有一个额外的烷基。侧链的烷基化是由固醇-C-24-甲基转移酶(sterol methyltransferase,SMT)催化的[5]。在拟南芥中有SMT1、SMT2-1(SMT2)和SMT2-2(SMT3)三个成员。SMT1以环阿屯醇为底物,在其C-24位添加一个甲基基团,生成C-24-亚甲基环阿屯醇;而SMT2和SMT3则以C-24-亚甲基胆甾烯醇为底物,生成C-24-亚乙基胆甾烯醇[5]。SMT2突变影响花器官细胞分裂过程中胞质分裂的正常进行,并且在小孢子母细胞减数分裂前产生核内复制,使花粉粒的倍性增高,产生较大的花粉粒,并且smt2smt3双突变体具有更高的配子体倍性水平[16]。这些研究结果表明,植物固醇对拟南芥雄配子体的发育起着非常重要的作用。
BR是一种重要的固醇类激素,BR缺陷突变体往往具有花粉发育的缺陷。BR合成缺陷突变体cpd和BR感知缺陷突变体bri1-116从花药发育的第5期开始,绒毡层细胞明显增大并空泡化,小孢子母细胞的数量与野生型相比显著减少,至12期每个花药室产生的花粉粒只有野生型的约20%,其花粉粒外壁结构以及成熟花药的开裂也存在异常[17]。介导BR信号的主要转录因子BES1可以直接与花药和花粉发育所必需的转录因子SPL/NZZ、TDF1、MS1、MS2、At MYB103以及MS1靶基因At3g23770的启动子结合,表明BR可以直接调控拟南芥花药和花粉发育关键基因的表达[17]。
由于对于上述固醇突变体并没有检测其BR水平,也没有进行BR处理实验,目前尚不清楚这些固醇突变体花粉败育的表型是由于BR水平降低还是缺乏某种固醇成分造成的。
2.1.2 植物固醇在胚发育中的功能。拟南芥固醇合成途径的突变体表现为育性降低甚至不育,固醇除了对花粉发育是必需的外,在胚发育过程中也起着非常重要的作用。植物固醇合成途径上游的法呢基焦磷酸合酶(Farnesyl diphosphate synthase,FPS)是合成法呢基焦磷酸(Farnesyl diphosphate,FPP)的关键酶,其家族含有两个成员,即FPS1和FPS2,它们功能的完全缺失会导致胚发育停滞在球形前期[18]。鲨烯环氧酶(squalene epoxidase,SQE)催化鲨烯生成2,3-环氧鲨烯,而2,3-环氧鲨烯是固醇和三萜类化合物合成的前体。拟南芥中推测有6个编码SQE的基因序列,分别命名为SQE1-SQE6。其中SQE1-SQE3能回补酵母erg1(酵母中SQE的编码基因)突变体固醇依赖的表型,而SQE4-SQE6则不能,表明SQE1-SQE3是有功能的鲨烯环氧酶[19]。SQE1突变虽然能获得纯合子植株,但sqe1纯合体植株具有根短、植株矮小和种子败育的严重表型;而SQE2和SQE3突变则没有明显的表型,且sqe2sqe3双突变体植株也没有明显的生长缺陷[19,20]。进一步研究发现,用35S组成型强表达启动子驱动SQE3的表达能回补sqe1突变体的表型;而且sqe1-5SQE3/sqe3-1双突杂合突变体植株的角果中败育的种子数显著高于sqe1-5单突变体[20]。这些结果表明,SQE1是起主要作用的鲨烯环氧酶,只有在SQE1功能受损的情况下,SQE3在种子和胚发育中的功能才显现出来。目前对于sqe1突变体胚败育的时期及其败育的机制还有待研究。
植物固醇缺陷对胚发育的影响主要体现在胚细胞不正常分裂造成的发育停滞。FACKEL(FK)/HYDRA2(HYD2)基因编码固醇-C-14-还原酶,与酵母的ERG24同源。fk突变体幼苗表现出根短、下胚轴粗、子叶融合或有多个子叶和多个茎尖生长点及维管组织发育异常等缺陷[21,22]。幼苗的这种缺陷可以追溯到胚发育时期,fk突变体球形胚的一些细胞不能正常分裂和伸长,导致胚发育迟缓和细胞排列紊乱。在野生型的胚发育至心形期时,fk突变体的胚依然处于球形期,子叶原基没有发育或者产生多个子叶原基,这与fk突变体幼苗的表型一致[21,22]。但FK不是细胞分裂所必需的,因为fk的愈伤组织可以在培养基上正常生长。推测FK对细胞分裂的影响可能是由于在特定的时空条件下某种下游甾醇信号分子的缺失引起的[21]。HYDRA1(HYD1)编码Δ8-Δ7-固醇异构酶,该酶催化固醇合成途径中FK下一步的反应。hy d1突变体幼苗的表型和胚发育的缺陷与fk突变体非常相似[23,24]。
SMT1基因的弱突变体smt1orc的胚中垂体细胞分裂异常,导致胚形态建成异常,部分心形期的胚产生多于两个的子叶原基[25]。在smt1orc幼苗根中,生长素外输蛋白PIN1和PIN3的细胞膜定位发生紊乱[25]。smt1orc突变体中谷甾醇和豆甾醇的含量降低,尤其是谷甾醇的含量降至约为野生型的57%,而胆固醇的含量大幅增加(约为野生型的6.7倍),推测固醇成分的改变影响了膜的功能,继而影响了PIN蛋白的细胞膜极性定位[25]。
拟南芥中存在两个钝叶鼠曲草醇-14α-脱甲基酶的编码基因,分别为CYP51A1和CYP51A2,CYP51A1推测是一个假基因[26]。CYP51功能完全缺失的cyp51A2-3纯合突变体是幼苗致死的,cyp51A2-3/+杂合植株的成熟角果中存在小而皱缩的种子。但是,对胚发育处于心形期的cyp51A2-3/+杂合植株的角果进行组织透明,并没有发现形态异常的胚,表明cyp51A2-3纯合子胚在心形后期发育才出现问题[26]。
近期的研究表明,植物固醇通过影响生长素的合成和运输调节胚的发育。植物固醇合成途径中,C-4位两个甲基的去除是由两种底物特异的固醇4α-甲基氧化酶(SMO)参与完成的。SMO1参与C-4位上第一个甲基的去除,而SMO2参与去除C-4位上的第二个甲基。拟南芥中有两个SMO2编码基因SMO2-1和SMO2-2,二者的单突变体没有明显的表型,但是smo2-1smo2-2双突变体是胚致死的,其胚的发育停滞在球形期向心形期过渡或者心形期向鱼雷期过渡的阶段(图3)[11]。smo2-1smo2-2胚的形态与fk突变体胚的形态相似,但是比fk的胚要小,而且不像fk的胚那样能萌发长成幼苗。通过对DR5:GFP荧光信号的观察发现smo2-1smo2-2突变体胚中生长素信号降低,且生长素分布异常。此外smo2-1smo2-2双突变体胚中PIN1蛋白的细胞膜定位也出现了异常,表明生长素参与了SMO2对拟南芥胚生长发育的调节[11]。拟南芥中有三个SMO1编码基因SMO1-1、SMO1-2和SMO1-3,三者的单突变体均没有明显的表型。但是,smo1-1smo1-2双突变体是胚致死的。其胚形态与smo2-1smo2-2的类似,但是败育的更早一些,且胚柄细胞异常分裂,有些种子中具有双胚(图3)[12]。虽然smo1-1smo1-2胚中生长素信号也异常分布,但信号有所增强,生长素合成相关基因表达上调且异位表达,生长素外输载体PIN1和PIN7及内输载体AUX1异位表达且其亚细胞定位异常。与生长素信号变化相反,smo1-1smo1-2胚中细胞分裂素信号减弱,细胞分裂素合成相关的基因表达下调。这些结果表明,smo1-1smo1-2胚中生长素和细胞分裂素信号的平衡被打破,影响了胚的发育和形态建成[12]。

图3 smo 1-1 smo 1-2和smo 2-1 smo 2-2双突变体胚的表型[11,12]
酰基辅酶A结合蛋白(acyl-Co A-binding protein,ACBP)参与脂肪酸的代谢。Lung等[27,28]的研究表明,ACPB1通过调节脂肪酸和固醇合成影响胚的发育。他们的研究发现,拟南芥ACPB1与SMO1-1、SMO1-2和SMO1-3均存在相互作用。ACBP1与SMO1-1在内质网上共定位,acbp1/+smo1-1植株的角果中存在着约25%的败育种子,且败育种子显著小于正常种子。对败育种子进行细胞学观察发现,其胚发育停滞在合子胚的前几次分裂时期[27]。ACBP1与SMO1-2同样在内质网上共定位,并在生殖器官、根和表皮毛中共表达。acbp1/+smo1-2-RNAi突变体角果中部分种子的胚在1细胞期至球形前期败育,且其胚乳和种被都没有发育,因此整个种子也显著小于正常种子[28]。
2.1.3 植物固醇在幼苗及根发育中的功能。固醇缺陷突变体除了胚发育缺陷,往往还具有幼苗致死或者植株矮小的表型。固醇可通过影响乙烯的合成和信号转导以及活性氧的积累诱发幼苗的早衰,连同光合活性的降低,最终导致幼苗死亡。CYP51编码钝叶鼠曲草醇-14α-去甲基酶,CYP51A2的突变体cyp51A2-3中总固醇的含量仅为野生型的44%,且显著地积累CYP51的底物钝叶鼠曲草醇以及上游的固醇合成中间产物。cyp51A2-3突变体在幼苗期致死,其7日龄幼苗的根和下胚轴明显短于野生型,且细胞形状和大小不规则[26]。转录组和蛋白质组分析显示,在cyp51A2-3幼苗中乙烯合成和信号传导以及活性氧(reactive oxygen species,ROS)相关的基因表达上调,暗示乙烯和ROS在突变体中积累;光合作用相关的基因下调,表明突变体中光合活性受到了影响[29]。乙烯定量测定结果显示,cyp51A2-3突变体幼苗中乙烯的含量比野生型高4倍。利用乙烯合成和信号途径的抑制剂处理能增加其生物量和叶绿素含量。与乙烯受体突变体etr1-1杂交,cyp51A2-3etr1-1双突变体的叶色也比cyp51A2-3深,但双突变体苗的大小与cyp51A2-3单突变体相比没有明显差别[29]。
植物固醇和生长素之间在调节根发育方面也有一定的关联,固醇缺陷引起根中生长素分布及极性运输异常,从而引起根发育的缺陷。hyd2/fk突变体具有严重的根发育缺陷,萌发10~14天后,hyd2/fk幼苗的主根完全停止了生长,根冠小柱细胞缺失,并且产生大量根毛[23]。GL2是根毛细胞分化的负调控因子,其蛋白序列中有一个预测的与固醇结合相关的结构域[30]。野生型中GL2只在非根毛细胞中表达,而在hy d2/fk突变体中可观察到GL2在所有的表皮细胞中都有表达,这暗示固醇可能影响GL2的表达。进一步研究发现,hyd2/fk突变体中乙烯和生长素信号增强,在hyd2/fk突变体中引入乙烯受体突变体etr1-1或者生长素信号通路的突变体axr1-12可以将其根的表型恢复到野生型的状态,但体外施加乙烯合成途径的抑制剂不能恢复其根的表型[23]。固醇甲基转移酶SMT家族中,SMT1基因在FACKEL/HYDRA2上游,而SMT2/CVP1和SMT3在HYDRA1的下游。野生型根的表皮和皮层细胞呈长方形,而smt1/cph根的表皮和皮层细胞呈圆形。因此,smt1/cph突变体的根的表皮和皮层细胞膨大,根发育受到阻碍[31]。cvp1smt3双突变体根部细胞的分裂方向异常且细胞膨大呈现不规则的形态,这与smtl/cph根的表型相似[32]。smt1orc幼苗根尖根冠小柱细胞的细胞核和淀粉体的极性排列被打乱,根毛发生的位置也更加随机,这种细胞极性的异常暗示着生长素极性运输的缺陷。利用激光共聚焦显微镜观察发现,smt1orc幼苗根尖中生长素外输载体PIN1和PIN3的细胞膜定位异常[25]。PIN蛋白家族是重要的生长素外输载体,通常在细胞膜上极性定位,决定着生长素运输的方向[33]。在野生型拟南芥中,PIN1蛋白只在根尖中柱细胞的底部细胞膜定位;而在smt1orc根中,其在部分中柱细胞的侧向细胞膜上也有分布[25]。PIN3蛋白在野生型拟南芥根尖根冠小柱细胞的质膜上均匀分布,而在smt1orc根中则表现出不对称分布[25]。上述突变体根的表型均不能通过外施BR得到恢复,说明其根部的缺陷不是由于BR的缺少所引起的,而是固醇合成途径中某些固醇成分的改变引起的。
CPI1编码环丙基固醇异构酶,cpi1-1突变体叶片小而圆,叶色深绿,根短且向重力生长缺陷,植株极其矮小,虽然能开几朵花,但花形态异常,雌雄蕊败育,无法结种子[3]。生长素内输载体AUX1和外输载体PIN2是调控根向重力生长主要的生长素极性运输蛋白[33]。为了研究cpi1-1根向重力生长缺陷是否与AUX1或者PIN2有关,分别获得了cpi1-1aux1-T和cpi1-1pin2-T双突变体。向重力弯曲实验结果表明,cpi1-1pin2-T双突变体根的向重力生长表型与pin2-T单突相似,而cpi1-1aux1-T根的向重力生长缺陷表型强于aux1-T和cpi1-1单突。这表明cpi1-1根向重力生长缺陷主要是由于PIN2缺陷造成的[3]。利用激光共聚焦显微镜观察发现,PIN2在cpi1-1根尖细胞中的极性定位异常。在野生型根尖中,PIN2在侧根冠细胞和表皮细胞的顶部细胞膜以及皮层细胞的底部细胞膜定位,而在cpi1-1根中,在同一个表皮细胞的顶部细胞膜和底部细胞膜均有PIN2定位,且其在皮层细胞的侧向细胞膜也有较强的信号(图4)。进一步研究发现,cpi1-1突变体的固醇成分发生剧烈改变,影响了内吞过程,导致胞质分裂后PIN2不能从子细胞的底部细胞膜移除[3]。此外,cpi1-1和smt1orc突变体根尖分生组织细胞中,KNOLLE蛋白(一种在胞质分裂过程中介导膜融合的蛋白)从细胞板扩散到了侧向细胞膜,表明固醇依赖的内吞作用在维持KNOLLE的细胞板特异定位中也发挥重要的功能[4]。细胞板是富含固醇的高度有序的的膜结构,而且这种高度有序性依赖于正确的固醇组成和DRP1A(DYNAMIN-RELATED PROTEIN1A)蛋白的功能[34]。最近的研究发现,植物固醇组分不只影响生长素的极性运输,还影响生长素合成相关基因的表达[35]。cpi1-1突变体中生长素合成途径基因TAA1、YUC8和YUC9的表达上调,在cpi1-1突变体中敲除TAA1基因或者用生长素合成抑制剂Kyn(L-Kynurenine)处理可以部分恢复其根短的表型。进一步研究发现,CPI1的底物环桉油醇(Cycloeucalenol)处理能增强TAA1、YUC8和YUC9基因的表达,而固醇合成途径的终产物谷甾醇处理则下调这些基因的表达,并部分恢复cpi1-1根短的表型[35]。该研究不仅发现固醇组分能影响生长素合成,而且初步分析了特定的固醇分子对生长素合成基因表达的调控作用(图4)。
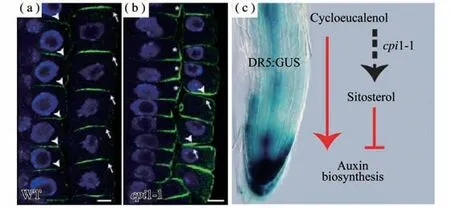
图4 cpi 1-1突变体根尖细胞中PIN2极性定位缺陷及固醇分子调控生长素合成的机制模型[3,35]
ERG28蛋白是固醇C-4脱甲基多酶复合体的脚手架蛋白,其本身没有催化功能。但是,拟南芥erg28突变体表现出植株矮小、根短和叶融合等表型,缺陷严重的植株表型类似pin1,这暗示erg28突变体中生长素途径异常[10]。激素含量测定结果显示,erg28突变体中游离生长素的含量不及野生型的一半,而且生长素向基运输的速率也低于野生型。但是,erg28突变体中PIN1蛋白的亚细胞定位并没有受到影响[10]。固醇成分测定结果表明,erg28突变体中谷甾醇、豆甾醇、菜油甾醇和胆固醇等常规固醇成分的含量与野生型相比没有明显区别,但积累一种甾醇C-4去甲基化反应的中间产物——4-羧基-4-甲基-24-亚甲基环木菠萝烷醇(4-carboxy-4-methyl-24-methylenecycloartanol,CMMC),该固醇成分在野生型中检测不到。用CMMC处理野生型拟南芥能抑制生长素的极性运输,且能模拟erg28突变体的表型[10]。这些结果暗示,CMMC可能是一种对植物生长不利的固醇中间产物,形成C-4脱甲基多酶复合体可防止该中间产物积累。
固醇在根毛发育中也发挥重要的作用。根毛为根表皮细胞产生的管状凸起,当根毛细胞伸长完成时,其外切向细胞壁的特定部位出现凸起,随后这个凸起进行顶端生长,最终形成长的管状根毛。根毛的发育依赖于细胞极性的建立与维持。在根毛凸起形成前,ROP(Rho-of-plant)小G蛋白ROP2、ROP4和ROP6以及RHD2/AtrbohC NADPH氧化酶(催化产生ROS)在即将形成凸起的细胞膜部位极性定位;在根毛伸长阶段,这些蛋白则在根毛顶端的细胞膜定位,通过调控内膜运输、细胞骨架组装和细胞壁修饰介导根毛的发育[36,37]。利用能结合固醇的荧光染料Filipin III检测显示,固醇在根毛凸起部位及正在生长的根毛顶端的胞质囊泡和细胞膜富集,根毛停止生长后固醇的这种极性分布消失[38]。对Filipin标记的囊泡进行分析,发现其为反式高尔基网络(Trans-Golgi network)和早期内体(early endosome),暗示固醇参与根毛发育过程的囊泡运输[38]。ROP2和ROP6在根毛凸起部位的极性定位依赖于固醇、PIP5K3(phosphatidylinositol-4-phosphate5-kinase3,4-磷酸磷脂酰肌醇5-激酶3)和动力相关蛋白DRP1A和DRP2B(dynamin-related protein)[39]。鲨烯环氧酶SQE的突变体dry2/sqe1-5的地上部分除了比野生型积累较多的鲨烯外,其它固醇成分几乎没有变化;而其根中的固醇成分则发生剧烈变化,主要的固醇成分谷甾醇和豆甾醇的含量分别降低至野生型的42%和60%,并大量积累C-4双甲基固醇前体[40]。dry2/sqe1-5突变体根毛细胞膜的流动性增强,RHD2信号减弱且定位异常,定位于正在伸长根毛的侧向细胞膜上,造成根毛分叉。但是,在根毛凸起形成阶段RHD2的极性定位不受影响。这些结果暗示正确的固醇组成对于根毛细胞极性的维持是必需的[40,41]。细胞学实验显示,固醇参与RHD2从TGN到早期内体及到根毛顶端细胞膜的囊泡运输[42]。最近有研究利用化学遗传学的方法筛选到了一类固醇分子Root Hair Promoting Reagent 1(RHP1),可以在纳摩尔水平显著促进单子叶和双子叶植物根毛伸长,且不影响其他组织的发育[43]。进一步研究发现,RHP1能促进根毛生长正调控因子RHD6和RSL4的表达,并激活ROP GTP酶及其下游效应因子,从而促进根毛的伸长,但不干扰根毛细胞命运决定和根毛起始[43]。
2.1.4 植物固醇在维管组织发育中的功能。Jang等[22]发现fk-J79突变体表现出明显的维管组织发育异常,这种异常从胚发育时就已经出现。在幼苗期,野生型苗的两片子叶的维管束在下胚轴的顶端交汇,而fk-J79突变体中则交汇于根组织的上方,突变体中的维管组织明显减少且不连续[22]。SMT相关突变体也具有叶脉发育缺陷,与野生型叶脉的发育模式相比,cvp1(smt2)的叶脉是片段化的并具有较少的网状结构,cvp1smt3双突变体的表型则更为严重[32]。这些表型暗示着突变体中生长素运输受阻。将响应生长素的分子标记DR5:GUS导入cvp1突变体,发现cvp1的子叶中DR5:GUS信号增强且呈弥散状[32]。进一步研究发现cvp1和cvp1smt3突变体中,生长素不能像野生型中那样抑制PIN2的内吞,表明正确的固醇组分是生长素抑制PIN2内吞所必需的[32]。
2.1.5 植物固醇在气孔保卫细胞发育中的功能。Qian等[44]发现FK的弱突变体fk-J3158的气孔保卫细胞发育存在缺陷,其叶片表皮组织中气孔和未分化的小细胞呈聚集状态。在固醇生物合成途径中最接近FK的三个催化步骤的酶的突变体cpi1-1,cyp51A2-3和hy d1也具有类似的表型[44]。在正常的气孔发育中,前体细胞经历不对称的有丝分裂产生一个大的子细胞和一个小的具有分生能力的子细胞。其中具有分生能力的子细胞继续不均等分裂1~3次或者直接分化为保卫细胞母细胞;而大的子细胞则分化成铺板细胞。而在fk-J3158中,保卫细胞前体细胞第一次分裂后产生的两个子细胞均维持有丝分裂活性并同步分裂,最终导致成簇的小细胞和气孔。表明与FK、HYD1、CPI1和CYP51A2相关的固醇成分在气孔保卫细胞不对称分裂后的细胞命运决定和细胞身份维持中发挥着重要的作用[44]。
2.1.6 植物固醇在调控开花时间中的功能。开花时间的调控通路主要包括光周期途径、自主途径、春化作用和植物激素途径,而这些途径又与抑制开花的FLOWERING LOCUS C(FLC)基因相关联。Huang等[45]发现fk-J3158突变体开花延迟,而FK过表达株系开花早于野生型。与此相对应,fk-J3158突变体中FLC基因表达上调,而开花的正调控基因SOC1表达下调。进一步发现,fk-J3158突变体中赤霉素(GA)合成相关基因表达下调,且GA和低温处理均能抑制其开花晚的表型,表明FK主要通过GA途径和春化途径影响开花时间[45]。
2.2 固醇参与植物的抗逆
2.2.1 固醇在植物抗病和抗虫中的功能。病原微生物侵染会诱导植物产生一系列代谢变化,这些变化有助于诱导抗性或者增强易感性。Griebel等[46]发现丁香假单胞菌可以诱导拟南芥积累豆甾醇,增加其易感染性。接种丁香假单胞菌后,拟南芥植株中编码甾醇-C-22-去饱和酶的CYP710A1基因表达上调,使β-谷甾醇更多地转化为豆甾醇,降低β-谷甾醇/豆甾醇的比例,这有可能利于病原菌的繁殖。相应的,cyp710a1突变体表现出抗性[46]。豆甾醇含量的增加可以被病原物相关的模式分子(pathogen-associated molecular patterns,PAMP)例如鞭毛蛋白和脂多糖等诱导,但不能被JA、SA和乙烯等防御反应相关的激素诱导,cyp710a1突变体的抗病性也不依赖于SA途径。进一步研究发现,豆甾醇含量增加导致拟南芥抗病正调节因子黄素依赖性单加氧酶FMO1的表达下降,并且接种病菌后产生的豆甾醇被整合到了膜系统中。因此,豆甾醇含量的增加可能改变了膜的理化性质,进而影响植物-病原菌的相互作用[46]。但是,另一项研究发现,cyp710a1功能完全缺失突变体的抗病性减弱,而其过表达植株表现出更强的抗病性[47]。这两项研究关于cyp710a1突变体的抗病性不一致,可能是由于前一项研究所用的cyp710a1突变体SALK_112491和SALK_014626的T-DNA均插入在CYP710A1基因的启动子区,并没有敲减其转录水平。此外,沉默烟草和拟南芥的鲨烯合酶基因SQS1均减弱植株的抗病性,拟南芥smt2突变体也对病原菌更加敏感[47]。也有研究发现,用真菌的效应因子处理烟草悬浮细胞显著降低鲨烯合酶的活性,但其转录水平不受影响,说明病原物侵染诱导鲨烯合酶的翻译后修饰[48]。在拟南芥中过表达芥菜3-羟基-3-甲基戊二酰辅酶A合酶(3-hydroxy-3-methylglutaryl-Co A synthase,HMGS)能提高总固醇尤其是豆甾醇的含量,使水杨酸(SA)依赖性病程相关基因PR1(pathogenesis-related genes)、PR2和PR5的表达水平升高,增强植株对灰霉病菌的抗性[49]。并且发现植物病程相关蛋白PR1能结合固醇,通过抑制病原菌的固醇合成及破坏其膜结构发挥抗病的功能[50]。Sharfman等[51]发现番茄环丙基固醇异构酶SlCPI1能直接与LeEix2(番茄中识别病原菌效应因子Eix的受体)蛋白互作,促进LeEix2的内吞及信号传导。还有研究发现,芥菜、黄瓜、大豆、番茄和玉米等作物遭受根结线虫侵染后,体内β-谷甾醇/豆甾醇的比例发生改变,β-谷甾醇的含量升高,豆甾醇的含量下降。此外,番茄、黄瓜和玉米中胆固醇的含量也显著增加。这暗示固醇成分也参与植物对线虫的抗性[52]。
综上,固醇不仅作为膜的成分,在抗病中发挥着重要的作用,而且固醇合成途径的酶能直接参与抗病信号传导。通过超表达固醇合成相关基因来调控固醇含量对植物抗病具有重要的意义,也为培育具有广谱抗病性的作物提供了新的策略。
2.2.2 固醇在植物抗旱中的功能。固醇是植物膜系统的重要组分,在干旱胁迫下,植物固醇以其独特的分子结构调节细胞膜的流动性和通透性抑制水分的流失。其中,固醇对植物抗旱的影响主要来自于对气孔的调节。拟南芥鲨烯环氧酶SQE的突变体dry2/sqe1-5对干旱超敏感,这是由于dry2/sqe1-5无法调节气孔关闭[40]。在湿度低的环境下或者ABA处理时,dry2/sqe1-5突变体不能像野生型那样快速关闭气孔。此外,dry2/sqe1-5根系形态异常,与野生型相比具有较短的根和分支的根毛。这些发育缺陷与异常的活性氧(ROS)产生和NADPH氧化酶RHD2/At RBOHC的异常定位相关,揭示了甾醇通过调节RHD2/AtRBOHC氧化酶的定位来调节ROS的产生,从而调节植物的气孔反应以及生长发育来增加植物的耐旱性[40,41]。固醇还能通过影响蜡质的合成增强植物的抗旱性。在番茄中过量表达金针菇(Flammulina velutipes)的C-5-甾醇-去饱和酶基因(FvC5SD)使转基因植株的叶片表皮细胞排列致密,表面覆盖的蜡质增多,增强了植株的耐旱性和对病原真菌的抗性[53]。同样,在大豆中过量表达金针菇的Fv C5SD也能提高转基因大豆的耐旱性[54]。
固醇能对多胺合成途径进行调节,而多胺对增强植物的耐旱性十分重要[55]。敲除或敲减百慕大草(bermudagrass)和水稻中的SMT1基因,可使突变体植株中胆固醇的含量升高,并上调多胺合成相关基因如SAMDC的表达,导致多胺积累,增强突变体植株的抗旱性。并且外源施加胆固醇也可提高百慕大草和水稻的耐旱性[55]。同样,在小麦中外源喷施谷甾醇也能增强其耐旱性[56]。生理指标检测显示,喷施谷甾醇能通过上调抗氧化酶的活性、提高还原性化合物的含量和降低双氧水的含量而增强小麦的耐旱能力[56]。
2.2.3 固醇在植物响应低温和UV-B胁迫中的功能。固醇在植物适应环境温度变化的过程中发挥重要的作用。在高温和低温胁迫下,植物C-24-甲基固醇(菜油甾醇)大量转化成C-24-乙基固醇(谷甾醇和豆甾醇),这种甾醇结构的变化有利于增强细胞膜的内聚力,调节植物细胞膜的状态以适应高温和低温环境。C-24-甲基转移酶SMT在调控C-24-甲基固醇和C-24-乙基固醇的比例中发挥重要的功能。在拟南芥中过量表达大豆SMT2基因能够使转基因植株的种子中C-24-甲基固醇和C-24-乙基固醇的比例发生显著改变[57]。低温处理时,大豆SMT2-1和SMT2-2基因的表达显著上调。这些结果暗示SMT2基因可能通过调节固醇组成增强植物对低温等逆境的耐受性[57]。研究发现,小麦的根相比于叶片对低温胁迫更加敏感,低温胁迫下根细胞膜的稳定性降低、电解质泄漏增加、ROS积累,而叶片中这些变化不明显[58]。进一步研究发现,利用4℃低温处理小麦幼苗使TaSMT1和TaSMT2基因表达上调,其根和叶中总固醇含量显著增加。但是,根中由于菜油甾醇的含量增加幅度大,导致C-24-甲基固醇/C-24-乙基固醇的比例升高;而叶中谷甾醇的含量增加幅度大,使C-24-甲基固醇/C-24-乙基固醇的比例显著降低。据此推测C-24-乙基固醇比例增加增强了叶片细胞膜的稳定性,使叶片比根更耐受低温[58]。
低剂量UV-B照射葡萄时,豆甾醇、谷甾醇和羽扇豆醇含量增加,且幼叶中豆甾醇和谷甾醇增加得更显著,而成熟叶中更多的积累羽扇豆醇。高剂量UV-B照射时,有抗氧化特性的化合物如二萜α和γ生育酚和植醇、倍半萜E-橙花醇和单萜α-蒎烯等的积累增加,且在成熟叶中更为突出。此外,在高剂量UV-B照射下,幼叶中与胁迫相关的ABA含量大幅增加[59]。这些结果暗示谷甾醇和豆甾醇主要在葡萄对紫外胁迫的适应中发挥作用。
3 结论及展望
固醇在植物生长发育中的作用是多效的,固醇合成通路上任意一步发生改变都可能会引起多种发育缺陷,而其原因也是多方面的。固醇是生物膜的组成成分,某类固醇的缺失或成分的改变可能造成膜的流动性和通透性的改变,膜结构的改变也会影响细胞的分裂和伸长,但固醇对细胞分裂和伸长方面的作用似乎也涉及到了分子信号的传导。与细胞伸长有关的基因XTR9和EXTENSIN-LIKE PROTEIN在hmg1-1突变体中下调[13],另有研究发现在fk突变体中积累三种非典型的8,14-二烯甾醇(CH,ER和ST),其中CH、BR、谷甾醇以及豆甾醇能增强一组与细胞分裂和伸长相关基因的表达,包括TCH4、Meri-5、β-TUBULIN和KORRIGAN(KOR)[60]。植物细胞膜中存在着与动物细胞膜类似的脂筏(lipid rafts)结构,固醇作为脂筏的组成成分,可随脂筏一起募集特定蛋白,介导细胞的信号转导,参与植物对逆境胁迫的耐受反应、植物细胞的极性生长以及胞内囊泡运输等过程[2]。植物固醇合成途径上游的基因突变往往导致胚致死或者胚发育缺陷的表型,且其胚发育缺陷不能被外源施加BR所挽救,暗示植物固醇除了作为膜的组分外,还能作为信号分子调控植物发育,尤其是胚的发育。目前对于哪种固醇分子能作为信号分子调控胚的发育还完全未知。对胚发育缺陷的固醇突变体不同发育阶段的胚进行转录组分析,找出共同差异表达的基因,或许能为下一步研究固醇调控胚发育的分子机制提供一定的线索。
动物中存在一类固醇急性调节蛋白(steroidogenic acute regulatory,St AR),具有在固醇生成细胞中将胆固醇转移到线粒体内膜的功能,也已经找到了少量St AR相关的含有脂质转移(St AR-related lipid transfer,START)结构域的结合配体[30]。Schrick等[61]的研究发现,START蛋白在植物中比动物中更为常见,且植物中的大多数START蛋白属于一类新的脂质/甾醇结合转录因子,即HD-START家族。在拟南芥中调节根毛和叶表皮毛发育的转录因子Glabra2(GL2)含有HD-START结构域,其结构域缺失造成的表型能被哺乳动物中同类型的START结构域拯救,且一些哺乳动物蛋白的START结构域能够像拟南芥的HDZip转录因子中的START结构域一样激活转录因子的活性[61]。因此植物中的START结构域极有可能像动物中的一样结合甾醇并向下游传递信号。然而目前还没有找到植物中START结构域的直接结合配体,在这方面仍需进行大量的研究。利用化学生物学的手段标记植物固醇分子,然后通过亲和纯化等手段下拉与固醇分子结合的蛋白,或许能筛选到被固醇修饰的植物蛋白,为进一步研究植物固醇信号的传导途径打下基础。
植物固醇与多种植物激素之间也存在着复杂的联系。菜油甾醇是BR的合成前体,而BR作为唯一已知的甾醇类信号分子,具有多种生理功能。植物固醇与生长素在调节胚的发育、根的发育以及维管组织的形态建成等诸多方面均有着密切的联系。固醇与乙烯、赤霉素和水杨酸等激素在植物发育和抗逆的某些方面也起着共同调节的作用。但是,除了通过改变PIN蛋白的定位造成生长素的定向运输异常外,关于植物固醇如何在激素调节中起作用目前还没有太多的报道[3]。另外,关于植物中参与固醇合成调控相关的转录因子的研究很少,仅发现WRKY(水杨酸响应因子)、MYC(茉莉酸响应因子)和ERF(乙烯响应因子)参与调节植物甾醇的合成[6]。阐明植物固醇作为信号分子发挥作用的方式可能会为研究固醇对植物生长发育、抗病抗逆的调控以及与各种植物激素之间的相互作用开辟新的思路。

