猪CD205分子CysR-FN Ⅱ截短基因的克隆表达及应用
高文昊, 杜露平, 侯立婷, 于晓明, 陈 瑾, 冯秀丽, 郑其升, 程海卫
(1.江苏省农业科学院动物免疫工程研究所/国家兽用生物制品工程技术研究中心/江苏省食品质量与安全重点实验室,江苏南京210014;2.南京农业大学动物医学院,江苏南京210095;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
树突状细胞(Dendritic cell,DC)作为专职抗原递呈细胞,可以借助其表面不同的受体进行抗原的捕获、加工与递呈,从而刺激机体产生免疫反应。1995年,Witmer-Pack等发现了小鼠DC细胞表面的一种特异性的抗原递呈受体——CD205[1]。CD205属于C型凝集素受体中的巨噬细胞甘露糖受体家族,又称为DEC-205或Ly75[2],在组织中分布广泛,高度表达于DC细胞和胸腺上皮细胞,在B细胞、T细胞、NK细胞和巨噬细胞中表达较少或几乎不表达[3]。CD205是目前在机体淋巴器官T细胞区域的DC细胞中表达最广泛的唯一受体[4],参与抗原递呈过程并起到关键作用。研究结果显示,与非靶向抗原相比较,CD205靶向可以使OVA抗原递呈效率提高至少100倍,抗原用量减少近1 000倍[5]。通过将乙肝病毒preS抗原靶向至CD205,可以在小鼠体内产生高效的IgG1和IgG2a抗体反应,对乙肝病毒感染产生预防和治疗效果[6-8]。上述研究结果显示,CD205靶向可以减少抗原用量,诱导高效的免疫应答,在抗病毒感染方面具有良好的发展潜力,已成为新型疫苗制剂研发与应用领域的前沿热点。
CD205靶向在兽医领域研究日益受到关注,但其效应机制尚不清楚。本研究拟选择猪CD205分子为研究对象,结合原核表达系统的诸多优势[9],针对编码猪CD205的N端胞外区的CysR-FNⅡ截短基因片段进行克隆表达及蛋白质纯化,制备多克隆抗体,并对其功能进行鉴定,验证本研究所获得的重组蛋白的生物学活性,为猪CD205特异性抗体的研制及猪CD205抗原靶向研究奠定基础。
1 材料与方法
1.1 试验材料
6~8周龄ICR系清洁级雌性小鼠购于南京市青龙山动物繁殖场。RNA提取试剂盒、DNA回收试剂盒均为捷瑞公司的产品,荧光抗体(Anti-mouse-IgG FITC,anti-pig-CD1 APC)购于上海优宁维公司。大肠杆菌BL21、DH5α和pET-32a质粒均由本实验室保存。根据NCBI上公布的编码猪CD205分子的CysR-FNⅡ截短基因(GenBank:GQ420669.1)设计PCR引物(表1),由上海生工生物有限公司合成。

表1 本研究用引物对序列
1.2 pET-32a-CysR-FN Ⅱ重组质粒的构建与蛋白质表达
1.2.1 猪淋巴总RNA的提取和cDNA的合成 取猪新鲜的淋巴结,运用Trizol法按照说明书操作提取RNA,按照反转录试剂盒说明书操作合成cDNA。
1.2.2CysR-FNⅡ截短基因的扩增及鉴定 以合成cDNA为模板,使用引物205R和205F,PCR扩增CysR-FNⅡ截短基因。反应条件为:95 ℃ 3 min;95 ℃ 30 s,54.5 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃ 10 min。扩增产物进行琼脂糖电泳鉴定,对目的条带进行纯化回收。将回收产物与 pMD18-T载体连接,转化至DH5α感受态细胞,随机挑选单克隆进行菌落PCR鉴定,将阳性克隆进行测序分析。
1.2.3 添加酶切位点 利用方法1.2.2所述阳性克隆为模板,使用引物205M-R和205M-F,通过PCR扩增在CysR-FNⅡ截短基因的两端添加酶切位点。反应条件为:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃ 10 min。之后鉴定步骤同方法1.2.2。
1.2.4 重组表达质粒的构建 利用限制性内切酶BamH Ⅰ和Hind Ⅲ分别对方法1.2.3所述阳性克隆质粒和pET-32a质粒(本实验室保存)进行双酶切,酶切产物经1%琼脂糖电泳鉴定,利用试剂盒进行纯化和回收。经过夜连接后,转化至BL21感受态细胞,通过菌落PCR鉴定和双酶切鉴定,阳性克隆进行测序分析。
1.2.5 重组蛋白的表达及纯化 利用方法1.2.4所述阳性克隆接种至LB液体培养基中(含0.1%氨苄青霉素),37 ℃培养至对数期,加入终浓度为1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),23 ℃进行诱导表达。之后,离心收集菌体,并使用高压均质机进行高压破碎,分别利用SDS-PAGE和Western Blot方法对表达产物进行鉴定。使用Ni2+亲和层析柱纯化,并进行鉴定。
1.3 CysR-FN Ⅱ多克隆抗体的制备与功能鉴定
1.3.1 小鼠免疫 使用纯化后的目的蛋白对小鼠进行免疫,每只小鼠皮下免疫注射50 μg。注射后第14 d采血并收集血清。
1.3.2 抗体效价测定 利用纯化后的目的蛋白作为抗原包被酶标板,将免疫后血清倍比稀释,使用HRP标记的羊抗鼠IgG作为二抗,检测免疫后14 d血清中CysR-FN Ⅱ抗体水平。
1.3.3 猪骨髓来源树突状细胞的诱导分化 参考Carrasco等的方法[10]诱导分化猪骨髓来源树突状细胞(Bone marrow-derived dendritic cell, BMDC)。取新鲜的猪胸骨,使用PBS冲洗猪胸骨得到细胞悬液。裂解红细胞后,使用淋巴细胞分离液Ficoll-Paque获得淋巴细胞悬液,在补充有10%胎牛血清、2 mmol/L谷氨酰胺、100 U/ml青霉素、100 μg/ml链霉素和50 μmol/L 2-巯基乙醇的RPMI-1640培养基中进行培养。使用25 ng/ml重组猪粒细胞-巨噬细胞集落刺激因子诱导骨髓细胞分化,之后隔日半量换液,持续培养至第7 d,收获细胞。
1.3.4 间接免疫荧光法鉴定 将方法1.3.3所获得的新鲜猪BMDC培养于细胞爬片上,待细胞融合度达到75%时,取出爬片并用PBS漂洗。之后添加4%多聚甲醛固定15 min,使用1%Triton室温透化5 min,PBS漂洗。分别使用免疫前血清和免疫后血清与猪BMDC细胞37 ℃孵育1 h。依次使用anti-mouse-IgG FITC、anti-pig-CD1 APC、DAPI染色,用激光共聚焦显微镜(PerkinElmer公司)观察。
1.3.5 流式细胞术分析 取方法1.3.3所获得的新鲜猪BMDC(1 ml 1×106)于2支1.5 ml无菌离心管中,1支依次利用免前血清、anti-mouse-IgG FITC、anti-pig-CD1 APC进行染色,另1支依次用免后血清、anti-mouse-IgG FITC、anti-pig-CD1 APC染色。利用BD Accuri C6流式细胞仪分别检测两组猪BMDC中鼠IgG与猪CD1双阳性(Mouse-IgG+CD1+)的数量,比较免疫前血清和免疫后血清孵育后猪DC细胞的特异性荧光强度。
2 结果与分析
2.1 CysR-FN Ⅱ基因的扩增及鉴定
以cDNA为模板,根据编码猪CD205分子的CysR-FNⅡ截短基因设计引物,进行PCR扩增及琼脂糖电泳检测。结果如图1所示,泳道1在500 bp与750 bp之间出现目的基因条带,大小与预期相符合。同时测序分析结果显示序列正确,无突变。
2.2 CysR-FN Ⅱ基因酶切位点的扩增及鉴定
利用获得的CysR-FNⅡ目的基因作为模板,并设计含酶切位点BamH Ⅰ和HindⅢ的引物,进行PCR扩增,扩增后进行琼脂糖凝胶电泳检测。结果如图1所示,泳道2在500 bp与750 bp之间出现目的基因条带,大小与预期相符合。同时测序分析结果显示序列正确,无突变。
2.3 重组表达质粒pET-32a-CysR-FN Ⅱ的构建与鉴定
分别利用BamH Ⅰ和HindⅢ对pMD-18T-CysR-FNⅡ质粒和pET-32a质粒进行酶切鉴定,酶切产物经电泳检测,结果如图1所示,酶切处理前后的pMD-18T-CysR-FNⅡ片段大小与预期结果一致。回收目的条带,并与pET-32a质粒双酶切产物进行连接,构建重组表达质粒pET-32a-CysR-FNⅡ,转化至BL21感受态细胞。进行PCR及双酶切鉴定,结果如图1所示,酶切处理前后的pET-32a-CysR-FNⅡ片段大小,与预期结果一致。所获得的阳性克隆测序结果正确。
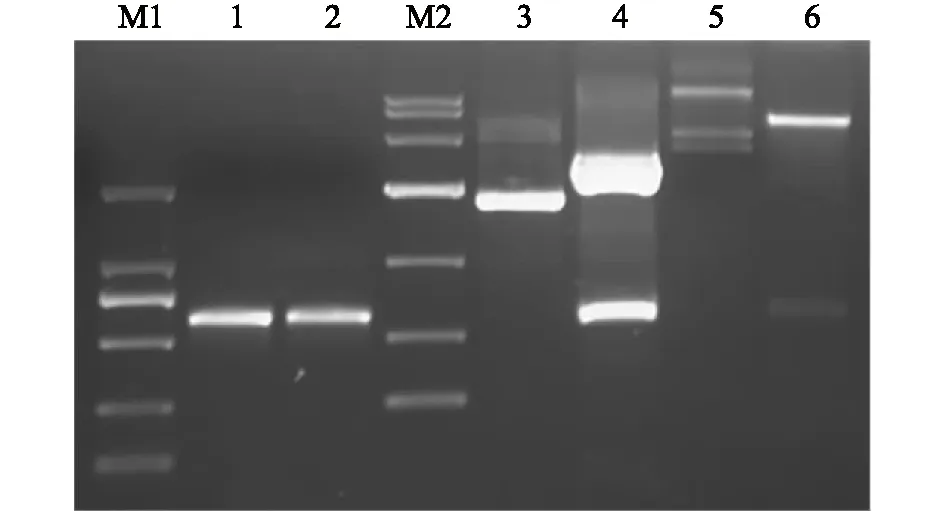
M1:DL2000 DNA marker,从上至下条带依次为2 000 bp、1 000 bp、750 bp、500 bp、250 bp、100 bp;泳道1:经PCR扩增的编码猪CD205分子的CysR-FN Ⅱ截短基因;泳道2:CysR-FN Ⅱ酶切位点的鉴定;泳道M2: DL10000 DNA marker,从上至下条带依次为10 000 bp、7 000 bp、4 000 bp、2 000 bp、1 000 bp、500 bp、250 bp;泳道3: 未经酶切处理的重组质粒pMD-18T-CysR-FN Ⅱ;泳道4:双酶切重组质粒pMD-18T-CysR-FN Ⅱ的产物;泳道5:未经酶切处理的重组表达质粒pET-32a-CysR-FN Ⅱ;泳道6:双酶切重组表达质粒pET-32a-CysR-FN Ⅱ的产物。
2.4 目的蛋白的可溶性表达与鉴定
重组表达质粒pET-32a-CysR-FNⅡ经IPTG低温诱导后,收集菌体进行高压破碎,并收集破碎后的样品。分别用诱导前的全菌样品、诱导后的全菌样品、破碎后的上清液样品以及破碎后的沉淀样品进行SDS-PAGE与Western Blot鉴定。结果如图2A所示,诱导后的全菌样品(泳道2)以及破碎后的上清液样品(泳道3)均在相对分子质量4.0×104左右出现目的条带,相对分子质量与预期结果一致,且为可溶性表达。蛋白质印迹结果如图2B所示,诱导后的全菌样品(泳道2)以及破碎后的上清液样品(泳道3)在约4.0×104处检测到目的条带。
2.5 重组蛋白CysR-FN Ⅱ的纯化
重组表达质粒pET-32a-CysR-FNⅡ表达产物经过多次纯化和SDS-PAGE鉴定,摸索出最适合的纯化条件,即洗脱液含50 mmol/L咪唑时杂蛋白去除效率最高,且目的蛋白损失较少。纯化后的目的蛋白经SDS-PAGE及Western Blot鉴定,结果如图2A、2B所示,泳道5在4.0×104左右出现单一的目的条带,纯度估计在90%以上。
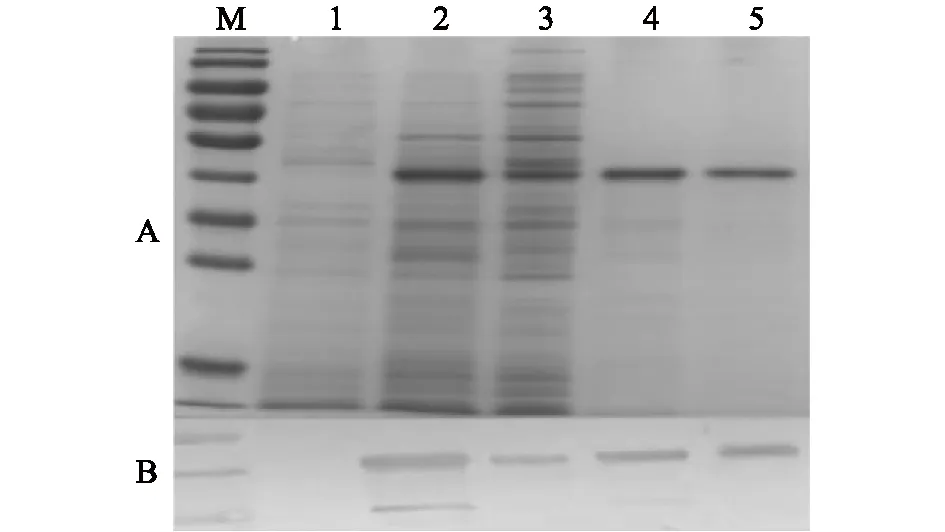
A图为SDS-PAGE鉴定重组蛋白CysR-FN Ⅱ表达及纯化结果,其中泳道M为蛋白质Marker,从上至下10条条带相对分子质量依次为2.50×105、1.50×105、1.00×105、7.0×104、5.0×104、4.0×104、3.5×104、2.5×104、2.0×104、1.5×104;B图为Western Blot鉴定重组蛋白CysR-FN Ⅱ表达及纯化结果,其中泳道M为蛋白质Marker,从上至下3条条带相对分子质量依次为5.0×104、4.0×104、3.5×104。泳道1:诱导前的全菌样品;泳道2:诱导后的全菌样品;泳道3:渗导后的全菌破碎后的上清液样品;泳道4:诱导后的全菌破碎后的沉淀样品;泳道5:渗导后的全菌纯化后的目的蛋白样品。
2.6 重组蛋白CysR-FN Ⅱ免疫小鼠血清抗体检测
免疫注射后第14 d,采用间接ELISA方法,对血清中抗体效价进行检测。结果如图3所示,血清倍比稀释至1∶6 400时,OD450数值仅为0.052,与阴性血清相比,P/N<1.5,判定为阴性,即抗体效价为1∶3 200。
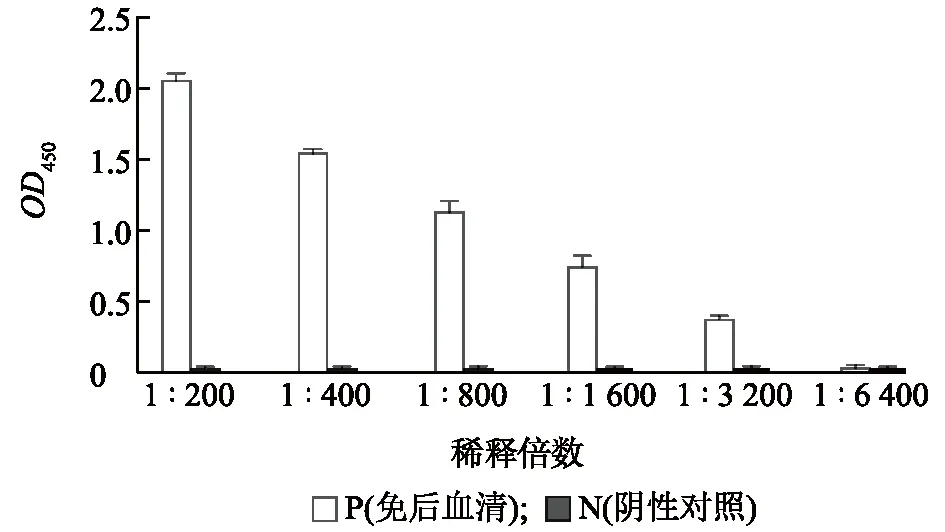
图3 重组蛋白CysR-FN Ⅱ免疫小鼠14 d后抗体效价测定
2.7 间接免疫荧光鉴定CysR-FN Ⅱ多克隆抗体与猪BMDC的共定位特性
利用获得的新鲜猪BMDC,制作细胞爬片,分别与免前血清、免后血清进行孵育。PBS漂洗后依次使用anti-mouse-IgG FITC、anti-pig-CD1 APC、DAPI染色,激光共聚焦显微镜观察结果如图4所示,免疫前血清试验组中未观察到绿色荧光,免疫后血清试验组中在胞膜及胞质中可见绿色荧光,且与APC所标记的红色荧光共定位,该结果表明本试验所获得的CD205多克隆抗体可以与猪BMDC发生特异性结合。

A组为免疫前血清实验组;B组为免疫后血清实验组。分别使用anti-mouse-IgG FITC;DAPI和anti-pig-CD1 APC进行标记。
2.8 流式细胞分析CysR-FN Ⅱ多克隆抗体与猪BMDC结合特性
利用获得的新鲜猪BMDC,分别与免疫前血清、免疫后血清进行孵育,使用荧光抗体标记后,经流式细胞仪检测猪BMDC的mouse-IgG+CD1+数。结果如图5所示,左侧曲线代表免疫前血清实验组检测到的绿色荧光强度,右侧曲线代表免疫后血清实验组检测到的绿色荧光强度,免疫后血清的绿色荧光强度与免疫前相比明显增强,表明本试验所获得的多克隆抗体可以与猪BMDC发生特异性结合。

图中左侧实线表示免疫前血清实验组流式检测FITC通道荧光强度,右侧实线表示免疫后血清实验组流式检测FITC通道荧光强度。
3 讨论
CD205作为首个报道的DC细胞特异性抗原递呈受体,是在机体淋巴器官T细胞区域的DC细胞中表达最广泛的唯一受体,在抗原递呈过程中具有关键作用[11-12]。CD205作为抗原靶向的研究热点,已经在多种病毒的疫苗设计中被研究[13-14]。同时针对免疫耐受的现象,可以通过CD205靶向抗体的作用,增强抗原的递呈,激活DC细胞,进而诱导出病毒特异性的免疫反应[15]。截至目前,多个CD205靶向人用疫苗已进入临床试验阶段[6-7]。CD205靶向在兽医领域研究日益受到关注,但其效应机制尚不清楚,而关于CD205靶标蛋白的制备,均是利用真核系统进行表达制备,表达产物虽具有一定的生物学活性,但产量较低,耗时费力[16-18]。
本试验拟利用原核系统表达编码猪CD205分子的CysR-FNⅡ截短基因,所制备的目的蛋白经SDS-PAGE和 Western Blot鉴定,均以可溶性形式表达,且相对分子质量与理论值一致。使用纯化后的蛋白质对小鼠进行免疫,免疫后14 d抗体效价达1∶3 200。间接免疫荧光实验和流式细胞分析结果均表明本试验所制备的多克隆抗体可以与猪BMDC发生特异性结合,即本试验所制备的目的蛋白具有一定的生物学活性。后续研究将利用所制备的CysR-FN Ⅱ目的蛋白,制备猪CD205特异性抗体,为研究猪CD205抗原靶向奠定基础,并对CD205介导抗原靶向递呈的作用机理进行研究,为新型疫苗设计提供参考依据。

