脊尾白虾CCNC基因序列、功能与表达分析
戴 琴,高 威,史婷婷,陈姝含,王攀攀,2,赖晓芳,2,高 焕,2,3,阎斌伦,2
( 1.江苏海洋大学,江苏省海洋生物资源与生态环境重点实验室,江苏省海洋生物技术重点实验室,江苏 连云港,222005; 2.江苏省农业种质资源保护与利用平台,江苏 南京 210014; 3.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005 )
细胞周期蛋白(CCN)广泛存在于从高等动物到酵母的各种生物中,因其在整个细胞周期中均表现出循环表达模式而得名[1]。在果蝇中,目前已发现细胞周期蛋白家族中包含A、B、C、D、E、G、H、J、K、L、T、Y这12类成员[2]。细胞周期蛋白与细胞周期蛋白依赖性丝氨酸/苏氨酸蛋白激酶(CDKs)结合,驱动细胞周期进程[3]。除此之外,细胞周期蛋白及其CDK伴侣还具有许多功能,包括蛋白水解降解、程序性细胞死亡、DNA损伤修复、新陈代谢、干细胞自我更新和生精等[4]。细胞周期蛋白C(CCNC)是细胞周期蛋白家族中保守类蛋白,在人和酵母中的氨基酸序列的一致性达到了28%[5]。CCNC发现得较晚,与早先发现的细胞周期蛋白不同,随着细胞周期的进行,CCNC在mRNA和蛋白质层面上的浓度变化并不明显,在G1期出现1个宽峰[5]。CCNC与CDK3结合,对细胞由G0期进入G1期起关键调控作用[6];除调控细胞周期,CCNC还可以与CDK8结合,调节RNA聚合酶Ⅱ的活性从而调控转录[7]。此外,CCNC还被发现在线粒体中有新型信号转导作用,氧化应激后,CCNC被释放到细胞质中,指导线粒体片段化和细胞凋亡[8-9]。目前,CCNC基因在应用层面的研究主要集中在医疗领域,CCNC被确定为潜在的抗癌靶标候选物[10],该基因的表达还可能与细胞分裂增殖有关,可加快细胞的增殖,加速创伤面的快速愈合[11]。
脊尾白虾(Exopalaemoncarinicauda)具有生长较快、繁殖周期短、抗逆性强等优点,养殖前景可期。然而,目前脊尾白虾亲虾主要来源于海捕或池塘自繁,苗种的质量和数量难以保障,严重制约规模化育苗[12]。细胞周期蛋白家族基因与甲壳类性腺发育、幼体发育方面密切相关,但有关CCNC基因的研究较少[12]。笔者拟克隆脊尾白虾CCNC(EcCCNC)基因cDNA,分析其组织特异性及在卵巢发育及幼体发育各阶段的表达特征,并通过原核表达获得重组蛋白,以期为探索其在脊尾白虾发育中的分子机制提供基础。
1 材料与方法
1.1 试验材料
脊尾白虾来源于江苏省赣榆区养殖池塘,自样品中挑选体型均等、体色正常、健康活泼的脊尾白虾[体长(5.39±0.51) cm、体质量(1.24±0.32) g],试验前暂养1周,暂养期间连续充气,养殖水循环流动,保持水温(25±2) ℃,盐度27,pH 8.1,每日早晚各投喂虾类专用配合饲料1次,及时清除残饵及粪便,记录脊尾白虾的生长情况。
1.2 试验样品的收集
1.2.1 脊尾白虾组织样品
挑选健康成年脊尾白虾3尾,分别取其眼柄、胃、肝胰腺、心脏、鳃、肠道、肌肉、卵巢、腹索神经共9个组织放入Trizol中匀浆并置于-80 ℃保存,用于抽提总RNA。
1.2.2 脊尾白虾卵巢发育时期样品
根据文献[13]的分期方式,分别取3尾脊尾白虾卵巢发育增殖期(Ⅰ期)、小生长期(Ⅱ期)、大生长期(Ⅲ期)、成熟期(Ⅳ期)及产后恢复期(Ⅴ期)的卵巢放入Trizol中匀浆并置于-80 ℃保存,用于抽提总RNA。
1.2.3 脊尾白虾幼体发育时期样品
根据文献[14]的分期方式,分别取3尾发育处于溞状幼体Ⅰ期、溞状幼体Ⅱ期、溞状幼体Ⅲ期、溞状幼体Ⅳ期、溞状幼体Ⅴ期和仔虾期的脊尾白虾幼体,整尾放入Trizol中匀浆,置于-80 ℃保存,以备抽提总RNA。
1.3 总RNA提取与cDNA第1链的合成
Trizol法(生工)提取不同组织RNA。1.0%琼脂糖凝胶电泳检测总RNA完整性,紫外分光光度计测定总RNA浓度。以1 μg总RNA为模板,根据PrimeScriptTMRT Master Mix试剂盒(TAKARA)合成第1链cDNA。
1.4 EcCCNC基因cDNA全长的克隆
自实验室已建立的脊尾白虾镉胁迫转录组数据中发现EcCCNC基因核心序列,设计用于5′RACE 的EcCCNC-GSP1和用于3′RACE的EcCCNC-GSP2(表1)。按照SMARTTMRACE合成试剂盒(Clontech,USA)使用说明对EcCCNC的cDNA末端进行扩增,产物克隆转化后进行测序。
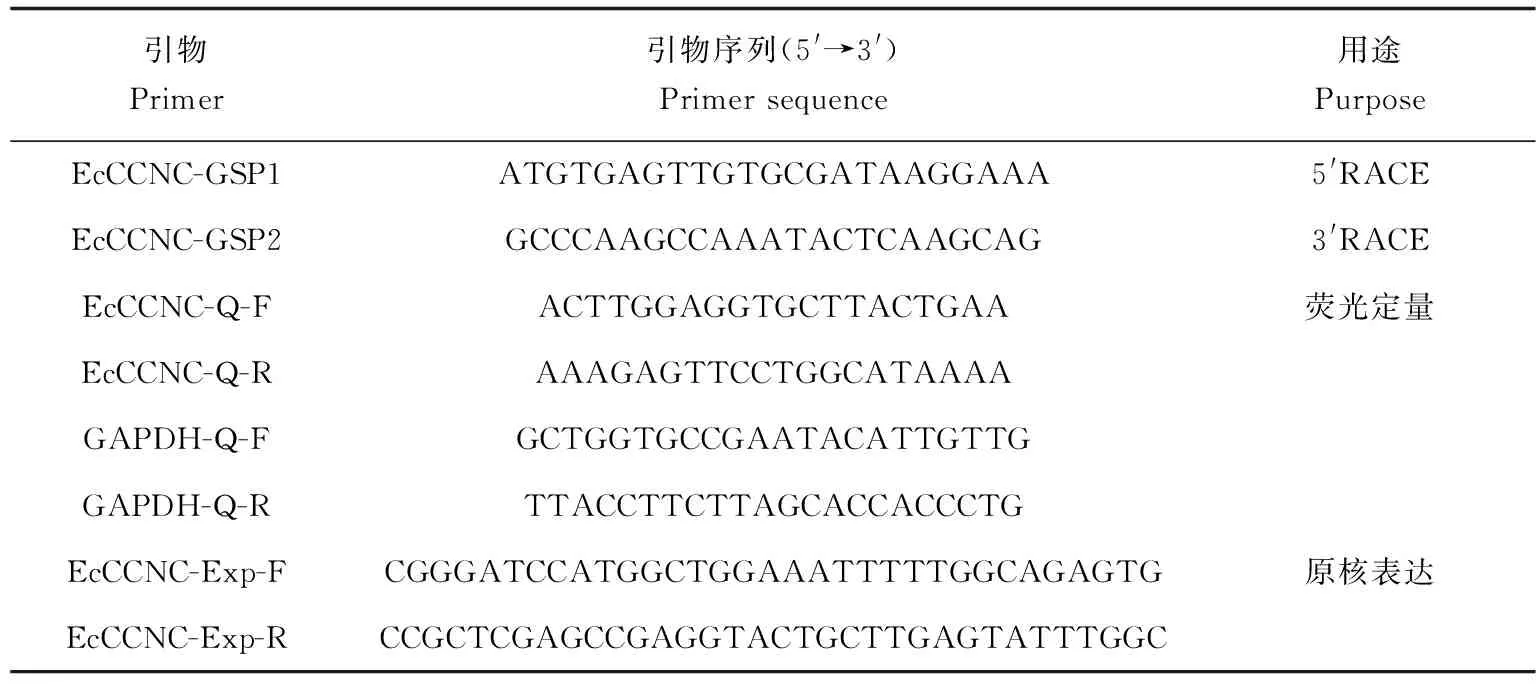
表1 EcCCNC基因克隆及表达分析引物序列
1.5 EcCCNC基因的生物信息学分析
使用DNAMAN软件对测序片段进行比对拼接;使用美国国家生物技术信息中心数据库在线的ORF Finder工具和BLAST工具查找基因的开放阅读框;序列的同源性分析使用BLAST工具;利用 Compute pI/Mw在线软件(http://web. expasy.org/compute_pi/)计算理论等电点和分子质量;蛋白结构域的分析使用SMART工具;信号肽预测使用 SignalP 在线软件(http://www.cbs.dtu.dk/services/SignalP/);多重序列比对使用ClustalX 2.0;进化树分析使用 MEGA 6.0软件。
1.6 EcCCNC基因不同组织表达水平分析
根据EcCCNC基因cDNA序列设计荧光定量引物(表1),选取脊尾白虾GAPDH作为内参基因[15]。qRT-PCR试剂盒为ChamQ SYBR qPCR Master Mix试剂盒(诺唯赞)。每个反应设置3个技术重复,反应体系和PCR程序参照说明书。荧光定量PCR仪为Step One Plus(ABI),使用2-ΔΔCt法分析定量结果[16]。
1.7 数据分析
使用Origin 9软件进行单因素方差分析,最小显著差异法比较不同数据组间的差异,结果以平均值±标准差表示,P<0.05为差异显著,P<0.01为差异极显著。
1.8 EcCCNC的原核表达
根据EcCCNC基因cDNA序列设计原核表达引物EcCCNC-Exp-F和EcCCNC-Exp-R(表1),上、下游引物的5′端分别引入BamHⅠ、XhoⅠ酶切位点及其各自的保护碱基。用BamH Ⅰ和XhoⅠ快切酶对EcCCNC基因和pET32a质粒分别进行双酶切后通过T4连接酶连接,将连接产物转化并测序。将测序正确的EcCCNC-pET32a重组质粒转化BL21(DE3)感受态细胞,在30 ℃、IPTG终浓度为0.5 mmol/L的条件下进行诱导表达。在诱导前、诱导5、12 h时分别取1 mL菌液,4 ℃,8000 r/min离心(离心半径87 mm,Hettich MIKRO 220R)10 min收集菌体,用100 μL 磷酸缓冲盐溶液重悬,加入等体积的2×蛋白上样缓冲液煮沸10 min。处理后的菌液进行SDS-PAGE,凝胶经考马斯亮蓝R-250染色、脱色后观察结果。同时进行Western Blot验证,一抗为抗His标签鼠单克隆抗体(康为世纪),抗体稀释倍数2000;二抗为羊抗小鼠IgG-HRP(金克隆),抗体稀释倍数2000。用DAB显色试剂盒(金克隆)进行显色。
2 结 果
2.1 EcCCNC基因cDNA全长序列分析
EcCCNC基因的cDNA序列见图1,全长1042 bp,其中5′非编码区82 bp,3′非编码区156 bp,开放阅读框为804 bp,编码267个氨基酸,预测蛋白质的分子质量为31.34 ku,理论等电点为5.50。EcCCNC蛋白结构域的预测结果显示,在该蛋白中有2个周期蛋白框,分别位于46~143 aa和166~236 aa。该蛋白不含信号肽。

图1 EcCCNC基因的全长cDNA及预测的氨基酸序列Fig.1 Full-length cDNA sequence and deduced amino acid sequences of EcCCNC gene起始密码子;终止密码子; AATAA多聚腺苷酸加尾信号;下划线部分表示周期蛋白框. stop codon; AATAA polyadenylation signal; the cyclin box is shown in the underlined part.
2.2 EcCCNC基因系统进化分析
根据美国国家生物技术信息中心数据库中不同物种的CCNC基因编码的氨基酸序列,用MEGA 6.0以邻接法构建系统进化树(图2)。由图2可见,系统进化树主要分为两大支,脊尾白虾首先与凡纳滨对虾(Litopenaeusvannamei)(GenBank登录号:XP_027228000.1)聚为一支,再与同属软甲纲的三疣梭子蟹(Portunustrituberculatus)(MPC59249.1)、方鼻卷甲虫(Armadillidiumnasatum)(KAB7502677.1)以及昆虫纲的德国小蠊(Blattellagermanica)(PSN54776.1)、湿木白蚁(Zootermopsisnevadensis)(XP_021936056.1)等无脊椎动物聚为一支,人(Homosapiens)(AAC50825.1)、苏门答腊猩猩(Pongoabelii)(NP_001244144.1)、热带爪蟾(Xenopustropicalis)(NP_989157.2)、欧洲鳗(Anguillaanguilla)(XP_035279305.1)、斑马鱼(Daniorerio)(NP_956245.1)等脊椎动物聚为另一大支。聚类分析结果表明,EcCCNC基因编码的氨基酸序列与凡纳滨对虾的相似性(92%)最高。

图2 EcCCNC和其他物种CCNC的氨基酸序列系统进化树Fig.2 The phylogenetic tree of EcCCNC and CCNC of other organisms based on amino acid sequences
2.3 EcCCNC基因在不同组织中的表达
EcCCNC基因在脊尾白虾不同组织间的表达特征见图3,其在肌肉、鳃、心脏、眼柄、肝胰腺、腹索神经、卵巢、胃这8种组织中均有表达,在卵巢中的表达量最高(P<0.01),在鳃中的表达量次之,在肠道中未见表达。
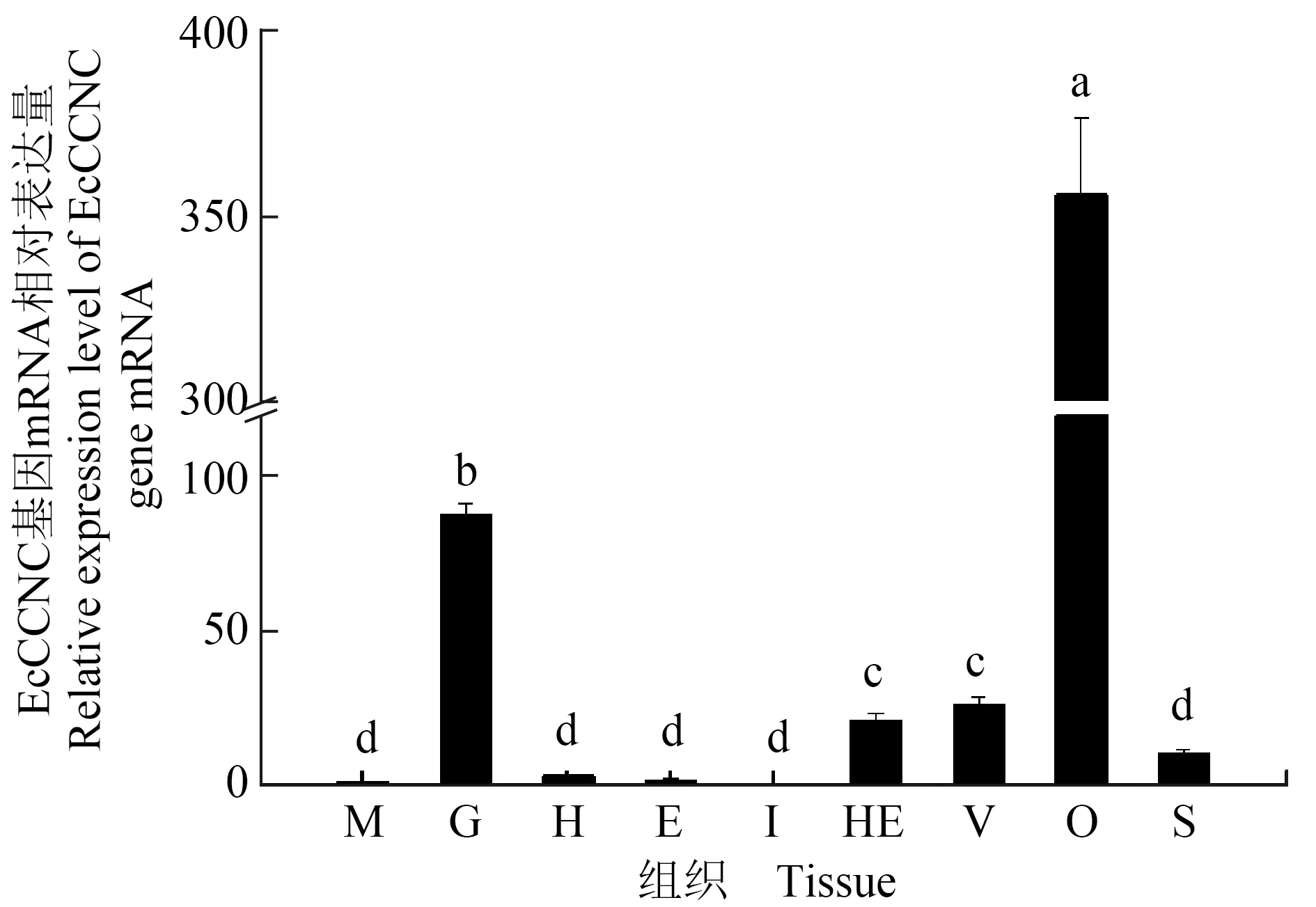
图3 EcCCNC基因在不同组织中的相对表达量Fig.3 Relative expression level of EcCCNC gene in various tissuesM.肌肉; G.鳃; H.心脏; E.眼柄; I.肠道; HE.肝胰腺; V:腹索神经; O.卵巢; S:胃;柱形图上方不同字母表示各时期差异极显著(P<0.01),下同.M.muscle; G.gill; H.heart; E.eyestalk; I.intestine; HE.hepatopancreas; V.ventricular nerve; O.ovary; S.stomach; different letters above vertical bars indicate significant difference between different tissues (P<0.01), et sequentia.
2.4 EcCCNC基因在卵巢不同发育时期的表达
EcCCNC基因mRNA在卵巢不同发育时期的表达量呈先升后降的趋势,在大生长期表达量达到最高(P<0.05)(图4)。

图4 EcCCNC基因在卵巢不同发育时期中的相对表达量Fig.4 The relative expression level of EcCCNC gene in ovary with different development stages Ⅰ.增殖期; Ⅱ.小生长期; Ⅲ.大生长期; Ⅳ.成熟期; Ⅴ.产后恢复期. Ⅰ.proliferation period; Ⅱ.protoplasm growth period; Ⅲ.egg yolk growth period; Ⅳ.mature period; Ⅴ.recovery from spawning period.
2.5 cCNCC基因在幼体不同发育时期的表达
EcCCNC基因mRNA在脊尾白虾幼体发育各时期的相对表达量呈先升后降再升的趋势,在溞状幼体Ⅱ期的表达量最高,发育到Ⅲ期时表达水平回落到Ⅰ期且在余下的溞状幼体期均维持在这个水平,变态发育至仔虾时表达量再次升高(图5)。
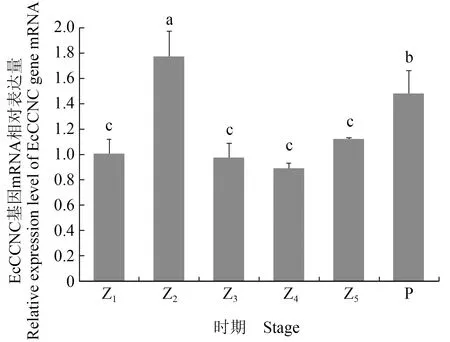
图5 EcCCNC基因在幼体发育不同时期中的相对表达量Fig.5 The relative expression level of EcCCNC gene in different stages during larval developmentZ1.溞状幼体Ⅰ期;Z2.溞状幼体Ⅱ期;Z3.溞状幼体Ⅲ期;Z4.溞状幼体Ⅳ期;Z5.溞状幼体Ⅴ期;P.仔虾.Z1.zoea stage Ⅰ; Z2.zoea stage Ⅱ; Z3.zoea stage Ⅲ; Z4.zoea stage Ⅳ; Z5.zoea stage Ⅴ; P.postlarva.
2.6 EcCCNC基因的原核表达
将未经IPTG诱导、诱导5 h、诱导12 h后的菌液经处理后进行SDS-PAGE电泳,凝胶经考马斯亮蓝染色后,在诱导5 h、诱导12 h组45 ku处可见一条带(图6a),该条带与预测的重组蛋白分子质量一致;而未诱导组未发现相应条带。用抗His标签鼠单抗与HRP偶联的二抗进行Western Blot验证,结果表明该蛋白带有His标签,进而确认为EcCCNC-pET32a重组蛋白(图6b)。

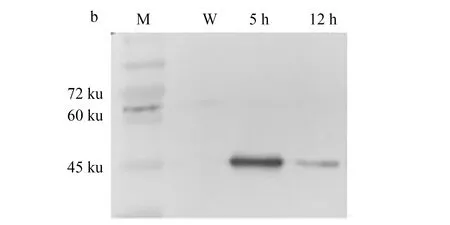
图6 EcCCNC-pET32a重组表达Fig.6 Recombinant expression of EcCCNC-pET32aa.EcCCNC-pET32a诱导表达的SDS-PAGE; b.EcCCNC-pET32a免疫印迹; M.预染蛋白Marker; W.未诱导组; 5 h、12 h分别代表诱导时间.a.SDS-PAGE analysis of recombinant expression of EcCCNC-pET32a; b. Western blot of EcCCNC-pET32a; M.pre-stained protein marker; W.non-induced; 5 h and 12 h represent the induced time.
3 讨 论
3.1 EcCCNC基因cDNA序列
周期蛋白框是普遍存在于细胞周期蛋白分子中的一个保守结构,其与CDKs结合并调节它们的酶活性[4]。笔者首次克隆出EcCCNC基因的cDNA全长。蛋白结构域预测显示,EcCCNC含有两个周期蛋白框,C末端周期蛋白框帮助蛋白正确折叠,N末端则与CDK3或CDK8结合,形成复合体。CCNC-CDK3复合体在调控细胞周期由G0期转入G1期的进程中发挥重要作用[6];CCNC-CDK8复合体通过磷酸化RNA聚合酶Ⅱ的碳末端结构域来促进或抑制其酶活性,从而调控基因特异性转录[17-18]。通过进化树分析和多序列比对,发现EcCCNC氨基酸序列与凡纳滨对虾的聚为一支且具有92%的相似性,确定其为CCNC基因。
3.2 EcCCNC基因的时空特异性
EcCCNC基因转录本在卵巢中的表达极显著高于其他组织,与斑节对虾(Penaeusmonodon)中CCNC基因的表达特征一致[19]。CCNC作为细胞增殖活动中的重要因子,可以预见在卵巢这类细胞分裂旺盛的组织中的表达更高。虽然CCNC基因的报道较少,仅见上述斑节对虾1例,但细胞周期蛋白家族其他成员在虾蟹类中的组织表达谱也可以佐证这一观点,如刀额新对虾(Metapenaeusensis)中的CCNB基因[20]、三疣梭子蟹中的CCNH基因[21]、斑节对虾[22-23]中的CCNT和CCNY基因等,均显示出在卵巢中的相对表达量显著高于其他组织的特征。进一步的研究结果显示,EcCCNC基因mRNA在卵巢发育的各个时期普遍表达,随着卵巢发育成熟,呈先升后降的趋势,在大生长期表达量达到最高。这可能是因为在大生长期时卵巢内细胞分裂最为旺盛、代谢最为活跃,结合脊尾白虾卵巢发育的组织学特征,卵巢处于大生长期时,外源性卵黄合成期卵母细胞占大部分,内源性卵黄合成期卵母细胞则很少;到Ⅳ期卵巢中主要为成熟期卵母细胞,此时EcCCNC基因mRNA的表达量有所下降,外源性卵母细胞较少,内源性卵母细胞彻底消失[12,24]。随着卵巢发育不同阶段主要细胞类型的变化,EcCCNC基因mRNA的表达量也有所涨落,推测其与脊尾白虾的卵子发生和卵黄发生有关[25]。EcCCNC在脊尾白虾幼体发育各时期的表达量呈先升后降再升的趋势,在溞状幼体Ⅱ期的表达量最高。脊尾白虾溞状幼体Ⅰ期,此时靠卵黄营养,并不摄食;进入Ⅱ期后,头胸甲内仍残留少量卵黄,但已开始摄食;进入Ⅲ期后卵黄消耗殆尽,此时完全靠摄食提供营养[15]。由此推测,EcCCNC可能参与了脊尾白虾幼体营养方式转变的过程,在分子机制层面上,溞状幼体Ⅱ期是否发生特殊事件仍待进一步探究。以上研究结果表明,EcCCNC在脊尾白虾卵巢发育和幼体发育过程中可能发挥了重要作用,这为脊尾白虾分子辅助育种提供了思路。
3.3 EcCCNC蛋白的原核表达
笔者构建了EcCCNC-pET32a重组表达载体,在大肠杆菌(Escherichiacoli)中表达后成功获得了1个重组蛋白,经验证后确认该重组蛋白就是EcCCNC基因的表达产物。该结果不仅验证了笔者克隆获得了EcCCNC基因,还表明该基因比较容易经由重组表达载体进行表达,这为进一步制备该EcCCNC蛋白的抗体奠定了基础。通过EcCCNC蛋白抗体的制备,探讨该基因在脊尾白虾卵巢及幼体发育中的时空表达特征还有待于今后深入研究。
4 结 论
笔者获得了脊尾白虾CCNC(EcCCNC)基因cDNA序列,其中开放阅读框为804 bp,编码267个氨基酸;蛋白结构域分析EcCCNC含有2个高度保守的周期蛋白框。qRT-PCR结果表明:EcCCNC基因mRNA在脊尾白虾卵巢中的相对表达量最高;在卵巢不同发育时期中,处于大生长期时表达量最高;在幼体不同发育时期中,溞状幼体Ⅱ期时表达量最高。通过原核表达获得了EcCCNC重组蛋白,为进一步探索EcCCNC基因在脊尾白虾发育中的生物学功能提供了材料保障。

