优化乳杆菌高产共轭亚油酸的研究进展
成晓艳,张丁洁,田艾迪,刘 瑛,陈佳璐,陈莹莹,洛 雪
(沈阳农业大学食品学院 沈阳 110866)
共轭亚油酸 (Conjugated linoleic acid,CLA)是亚油酸(Linoleic acid,LA)的一组位置和空间异构体的总称,近年来,大量研究报道CLA 具有抗癌、抗动脉硬化症、减肥、提高机体免疫等功效[1-2]。人们最早了解亚油酸异构酶(LAI)是通过反刍动物瘤胃溶纤丁酸弧菌 (Butyfivibfio flbfisolvens)中的LAI 将LA 催化为CLA[3-4]。在CLA 异构体中,真正具有生理活性的只有顺-9,反-11 和反-10,顺-12-CLA 两种[5-6],其结构式如图1所示。由于瘤胃溶纤丁酸弧菌在多不饱和脂肪酸生物氢化的过程中产生的cis-9,trans-11 CLA 较少,因此探究如何提高CLA 的产量成为研究重点。
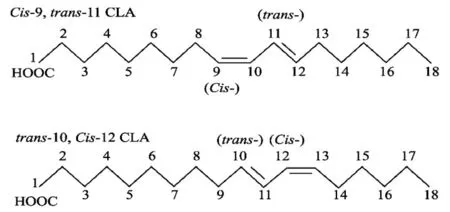
图1 c9,t11-CLA 和t10,c12-CLA 结构式Fig.1 Structures of c9,t11-CLA and t10,c12-CLA
工业上合成CLA 的方法大多采用化学合成法和生物合成法。化学合成法操作简捷,产量较高,然而生产得到的产物多为混合物,存在多种CLA 的异构体,分离纯化相对困难,且含有有毒物质,对食品工业造成负面影响[7]。许多科学家致力于研究生物合成法生产CLA。LAI 具有专一性,在LAI 催化下,LA 的转化程度远高于其它脂肪酸。动物瘤胃溶纤丁酸弧菌、植物乳杆菌、嗜酸乳杆菌、德氏乳杆菌、保加利亚乳杆菌及痤疮丙酸杆菌等细菌能够使游离的LA 转化为CLA,在培养基中加入底物LA,可显著提高CLA 的转化率。如表1所示,不同类型菌种的底物及其添加量各不相同,合成CLA 的能力也不同。

表1 不同类型菌种合成CLA 的能力Table 1 The ability of different types of strains to synthesize CLA
虽然生物法能够合成单一的CLA,作用条件温和,但是其产量还是比较低,而且不同的菌株对应不同的反应机制,因此优化产LAI 的条件是高产CLA 的重要途径[8]。本文概述了近年来利用诱变技术及基因工程技术生产和改造LAI,进而提高CLA 含量的相关研究。
1 利用物理方法提高CLA 的产量
在多数研究中,通过自然方法筛选获得的菌株,产LAI 能力有限,因此利用如诱变技术来提高菌株产酶能力是常用的方法[9]。紫外诱变(Ultraviolet mutagenesis,UV mutagenesis)、低温等离子体诱变(Low temperature plasma mutagenesis)、常温常压等离子体诱变 (Atmospheric and room temperature plasma,ARTP)等技术,可诱变LAI 产生菌,促使菌株高产LAI,从而提高CLA 的转化率,并对该诱变菌株产酶条件进行相应优化,提高CLA 产量。
1.1 紫外或微波诱变
紫外线在260 nm 波长下的辐射致死量最优,紫外诱变在微生物菌种的诱变研究中较常见,也是应用较为广泛的方法[10]。紫外辐射可以引起碱基转换、颠倒互换、移码突变或缺失。紫外线能量低,对遗传物质造成的伤害小,同时,操作方法简单安全,诱变效率较高,而且诱变后产生的突变性状在无光照条件下不容易恢复,因此紫外诱变技术较广泛地应用于菌种诱变研究[11]。微波诱变是一种低能电磁辐射,它能够对生物体产生热效应和非热效应,引起生物体局部温度上升,产生生化反应的便是热效应;而非热效应产生的生理生化反应与温度无关[12]。
近些年,关于紫外线诱变,崔玮等[13]以嗜酸乳杆菌为出发菌株,经15 W 紫外线2 次诱变,得到1 株CLA 高产菌株,对其发酵条件进行优化后,诱变菌株酶活比原始菌株提高了1.51 倍;对培养基的产酶条件进行优化后,酶活提高了1.1 倍。曹健等[14]采用紫外诱变,在35 ℃,pH 4.0 条件下,保温48 h,CLA 的产率达38.1%,之后用超声波处理细胞后,CLA 的产率也有显著提高。此外,柯薇等[15]采用微波间歇诱变的物理诱变方法以乳酸杆菌为出发菌株,经诱变后,筛选得到5 株正突变菌株,其中CLA 产量最高为L4,较诱变前提高了41.4%。
综上,经过适当条件的紫外线诱变,可有效提高出发菌株产CLA,LAI 酶活也相对提高,并且利用超声波、微波进行微生物诱变,对LAI 活性也有较明显的提高效果。
1.2 等离子体诱变
等离子体诱变是近年来新兴的诱变技术,在诱变育种过程中采用等离子体诱变的方法,既解决了化学诱变高污染和突变单一等缺点,又弥补了物理诱变遗传不稳定,突变率不高等缺陷。而且与离子注入诱变法相比,等离子体诱变技术不会因真空产生的低温或由离子束产生的高温而使细胞失活,该诱变技术可以在较大程度上提高细胞存活率及诱变效率[16]。在微生物的诱变应用中,主要有低温等离子诱变和常温常压等离子诱变[17-18]。
1.2.1 低温等离子体诱变 低温等离子体诱变技术是通过中性活性粒子来改变微生物遗传特性的,可直接改变核苷酸水平的分子结构,也可作用于细胞而间接影响胞内遗传物质[19-20]。如孙丽慧等[21]从东北酸菜汁中获得菌株SC-05,经低温等离子体处理后,筛选得到突变株A-08,其CLA 产量达到119.24 μg/mL,比出发菌株增加了83.0%,经传代培养后突变株A-08 的遗传性状具有较好的稳定性。随后王庆山[22]将突变株A-08 的培养基利用单因素及响应面法进行发酵条件优化,产量增加了64.60%,发酵罐采用批式发酵和批式流加发酵的方式进行培养,CLA 的产量达到了213.26 μg/mL。由此可见,采用LTP 诱变出发菌株,改变其遗传特性,并将其培养条件进行优化,最终得到的CLA 产量显著提高。
1.2.2 常温常压等离子体诱变 ARTP 诱变作为新的诱变技术,已经被广泛应用于真菌、细菌、微藻等微生物的基因改良[23-25],ARTP 工作温度低、操作简单、成本低、安全无毒,而且诱变效率高于常见的诱变方法,比如紫外线辐射或化学诱变剂诱变。与其它诱变方法相比,ARTP 突变具有更大的DNA 损伤和更高的突变率,且突变菌株遗传稳定性好、无污染[26-27],ARTP 诱变的基本流程如图2所示。
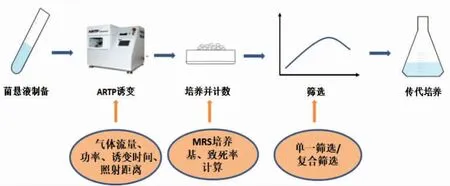
图2 ARTP 诱变基本流程图Fig.2 Basic flow chart of ARTP mutation
ARTP 技术在其它菌种诱变应用比较广泛,如Liu 等[28]为获得高产碱性蛋白酶菌株,对枯草芽孢杆菌进行了ARTP 处理,结果表明,该菌株在诱变时间为50 s 时,有较高的正突变率,最终经ARTP反复诱变获得高产突变株A59,酶活力由6 835 U/mL 提高到8 433 U/mL,提高了23.38%,最终A59菌株的酶活达14 026 U/mL,是原菌株的2.05 倍;Qiu 等[29]利用ARTP 技术诱变蜡样芽胞杆菌以提高QCG 菌株的1-萘酚产量,经诱变后该菌株比原菌株增产47.32%。Cheng 等[30]利用ARTP 诱变得到了高产L-苏氨酸的抗噬菌体大肠杆菌突变株,其L-苏氨酸转化率较出发菌株提高10.9%。而在ARTP 诱变提高LAI 产量的研究中,张珂等[31]对嗜酸乳杆菌进行ARTP 多轮诱变处理,筛选出1株LAI 高产突变菌株B5,经单因素实验结合响应面试验对其突变株生长条件进行优化后,LAI 产量达到1 214.1 U/mL,是原始菌株的2.84 倍。
除了单一利用ARTP 诱变技术来诱变微生物之外,近年来科研人员还将ARTP 与其它技术相结合[32],以复合诱变的方法应用于微生物生产中,如EMS-ARTP 技术结合诱变选育高产DHA 裂殖壶菌[33]、ARTP-NTG 联合选育得到高产中性蛋白酶菌株[34]、ARTP 与微生物微滴培养(MMC)技术培养筛选几丁质脱乙酰基酶高产菌株[35]、ARTP-DES结合连续诱变选育高产ε-聚赖氨酸突变株[36]、ARTP-EMS 联合多重诱变有效地提高了草酸青霉粗淀粉降解酶的产量[37]、ARTP-UV 复合诱变选育高性能绿僵菌菌株[38]、ARTP 与5-溴尿嘧啶复合诱变选育腺苷高产菌株[39]等。复合诱变相应的出发菌株,最终得到的正突变率远远大于负突变率,且高于运用单一诱变方法的突变率,经过多次传代培养后,其突变菌株的遗传性状也是稳定的。由此可知,复合诱变能够形成更丰富的突变位点,为以后产生研究所需要的基因性状提供有效、快捷的方法。
2 利用化学方法提高CLA 的产量
2.1 化学诱变
化学诱变是对菌株使用某些化学试剂处理,使其直接与菌株DNA 分子链上的碱基发生作用,从而使菌株产生可遗传的变异,提高菌株突变率。常用的诱变剂主要有烷化剂、碱基类似物和无机化合物。而烷化剂在微生物变异中应用最为广泛[40],常见为甲基磺酸乙酯(EMS)[41]、亚硝基胍(NTG)[42]、乙烯亚胺(EI)[43]、硫酸二乙酯(DES)[44]等,其中NTG 作为一种超强诱变剂,是公认效果显著的化学超诱变剂[34]。
科研人员利用化学诱变剂,以及物理与化学方法结合的方式对菌种进行诱变,然而多数研究表明,物理化学复合诱变获得CLA 突变菌株的效果更好。如甄妮[45]以德氏乳杆菌为出发菌株,采用紫外和DES 复合诱变的方法,获得D-2-2 CLA高产菌株的突变菌株,产量达0.210 mg/mL,经过培养基优化后达0.267 mg/mL,再将CLA 菌株生长条件优化后,其产量提高到0.292 mg/mL,且突变菌株高产特性能够稳定遗传。而在之前相关研究中,王璟等[46]以植物乳杆菌为出发菌株,利用紫外和DES 复合诱变的方法,加入0.1%的高浓度LA 初筛后,再进行摇瓶复筛,最终得到L.pian H3-1 突变株,其CLA 产量高达0.3067 mg/mL,较出发菌株提高264.5%。吴荣荣等[47]利用2 株嗜酸乳杆菌HS111 和HS112 经紫外和NTG 复合诱变处理后,HS111 的CLA 产量共提高了19 μg/mL,而HS112 提高了27.7 μg/mL。结果表明,2 株嗜酸乳杆菌经复合诱变CLA 产量都明显提高,然而不同种类的嗜酸乳杆菌,产CLA 的能力也有差异。
采用单一的物理诱变或者单一的化学诱变可能得到比较单一的突变体,最终产CLA 的效果也不够好,而采用物理与化学复合诱变的方法[48],能够有效弥补单一诱变的缺陷,从而有效提高菌株的突变率,进而提高CLA 产量。
2.2 离子注入
离子注入诱变法是离子在真空环境中被加速和筛选,带有相同能量的离子被导入反应室,离子和目标物开始一系列的物理和化学的相互作用[49],其中N-离子束诱变是其最常见的方法。N-离子束诱变技术具有突变谱宽、突变率高、重复性好、易于获得理想变异菌株等特点[50-52]。
在多数研究中,研究人员以植物乳杆菌作为出发菌株,利用N-离子束将其诱变,以达到菌株高产CLA 的目的。如蔡玉华[53]以植物乳杆菌为出发菌株,经N-离子束注入并反复诱变,得到突变菌株ANLP 的CLA 量由出发菌株的33.04 μg/mL提高到103.26 μg/mL,而且突变株遗传性状稳定。慈志敏等[54]对植物乳杆菌P8 采用N-离子束注入法进行诱变处理,结果表明,P8 经N-离子束诱变,得到产CLA 正突变菌株共36 株,最高CLA 质量浓度为0.2751 mg/mL,转化率为27.51%;负突变菌株共66 株,最低CLA 质量浓度为0.0330 mg/mL,转化率为3.30%。之后陈丽娟等[55]对植物乳杆菌ANCLA01 进行N-离子注入,结果显示,N-离子注入使其CLA 产量从33.44 μg/mL 提高到66.67 μg/mL,且经5 次传代培养后突变菌株产CLA 也很稳定。王婧波[56]以植物乳杆菌LL-ZSDS001 菌株为原始菌株,进行铯137γ-射线辐照和N-离子束诱变共同处理,最终诱变得到CLA产量为118.921 μg/mL,比原始菌株54.234 μg/mL提高了119.27%。
通过以上研究发现,离子注入诱变技术能够有效提高乳杆菌CLA 的产量,而单一利用离子注入法提高的程度有限,将辐照或其它方法与离子注入相结合,进行出发菌株的诱变,其产CLA 的能力也会有所改变。
3 利用基因工程技术提高CLA 的产量
为提高出发菌株CLA 的产量,随着生物合成及诱变技术的不断发展,近几年通过基因工程技术对生产菌株进行改造[57],例如菌株能够通过基因重组获得新的遗传型及具有优良性状的高产工程菌株,或者通过微生物间的转基因而获得新菌种。基因工程育种是按照人们意愿,对目的菌株的基因进行设计以得到所希望的性状,是真正意义上的理性选育[58]。
3.1 基因定点突变
基因定点突变是指通过PCR 等方法向目的DNA 片段中引入所需变化[59],包括碱基的增加、删除、易位、点突变等,其原理图如图3所示。定点突变能快速筛选目的蛋白所表达的性状,将定点突变技术应用于LAI 基因构建中是有效的手段[60-61]。

图3 定点突变原理示意图Fig.3 Schematic diagram of mutation principle
研究表明LAI 可以催化LA 转化为CLA,然而在研究过程中发现有些菌种属于厌氧菌或兼性厌氧菌,不利于大规模产酶培养且生长缓慢,于是构建基因工程菌来表达LAI 就成为生产CLA 的又一重要途径[62]。黄亮等[63]对嗜酸乳杆菌的LAI 基因进行体外定向进化,成功构建基因突变文库后,通过IPTG 诱导基因表达后,最终筛选出1 株重组菌LI-mut2,测定其LAI 活力为8.2 U,嗜酸乳杆菌LAI 活力为17.3 U,可见测得的酶活性并不高,还需进一步探索LAI 活力快速测定的方法。刘海霞[64]以植物乳杆菌P8 基因组为模板,构建重组菌pQE30-LAI,经过LAI 基因序列比对分析,将193 位苯丙氨酸定为突变位点,改变578 位碱基T为C,成功构建了突变体pQE30-F193LAI,结果表明突变体表现出了酶活被破坏的特性,然而将表达的野生型和突变型的酶提取后检测发现两者有相同的条带,说明LAI 均得到表达。贾丽[65]对5 个LAI 活性位点进行定点突变研究,且都能够成功构建突变体,最终结果表明,与野生型LAI 相比,突变体G68A-LAI 几乎丧失酶活力,突变体R107L-LAI 的酶活力上升,而突变体H172P-LAI的酶活力下降,从而初步确定第68 位、第107 位和172 位均为LAI 的必需氨基酸。时旭[66]将植物乳杆菌HAC01 和痤疮丙酸杆菌的LAI 基因成功克隆,结果显示pCold-gfp-yclai-p 重组菌产量最高的为39 号菌,CLA 产量为(11.6186±0.0036)μg/mL,较未突变株提高了3.99 倍。
通过以上研究发现,改变引物中的某些碱基而改变基因序列,进行定点突变,而以PCR 为介导的体外定点突变为基因修饰、改造提供了另一条途径[67],进而得到LAI 重组菌株,同时较有效地提高了LAI 的酶活力。
3.2 基因重组
基因重组法也称体外重组DNA 方法,经过体外剪切、拼接,再将菌株的遗传物质重新组合在一起,然后转入受体细胞内,进行无性繁殖,并使目的基因在受体中表达,生产人类所需要的物质或生物种类,以达到定向改变生物性状的目的[68],其原理图如图4所示。体外重组DNA 方法广泛应用于生物界的遗传工程中,在生物制药、植物抗病虫害以及各理论研究方面都有广泛的应用,是一项新潮技术[69]。
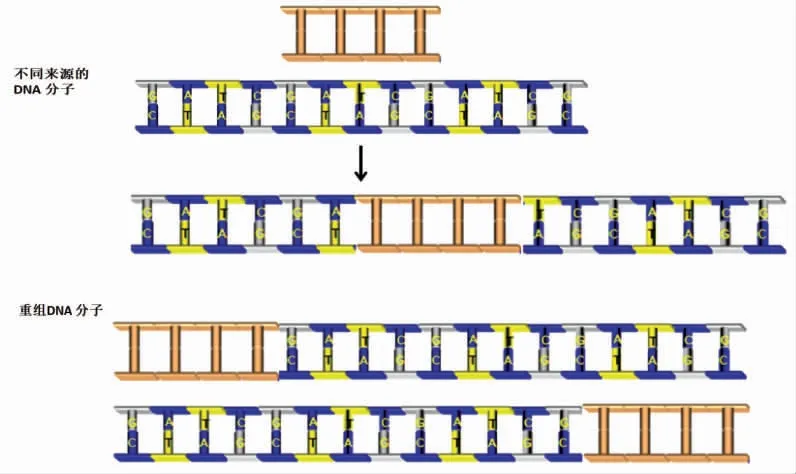
图4 基因重组原理图Fig.4 Schematic diagram of gene recombination
基因重组技术广泛应用于细菌基因的改造,以期获得具有优良遗传特性的新菌株,其获得的重组菌株经过相应分离、纯化,进而提高LAI 的酶活。李晨曦[70]通过PCR 扩增得到植物乳杆菌P-8来源的LAI 基因,连接至表达载体pKLAC1 上,转化至乳酸克鲁维酵母菌CICC 中,测序鉴定,成功构建了表达LAI 的酵母基因工程菌,经SDSPAGE 为单一条带,测得酶活为(9.10±0.01)×103U/mL,并对影响酶活的各因素进行优化,其中影响最大的为pH、时间、温度。刘晓华等[71]提取了从黄牛瘤胃中分离得到的1 株干酪乳杆菌Fx 的基因组DNA,经扩增及克隆后将得到的重组质粒与表达质粒同时进行双酶切,得到重组表达载体pET-DsbA-LAI,经PCR 鉴定和酶切后转化至大肠杆菌BL21 中,得到具有LAI 活性的重组菌株,且能够特异性合成c9,t1l-CLA,表明从出发菌株Fx 成功克隆LAI,且合成不同CLA 异构体的LAI存在特异性,经定量测定,酶活力最大可达206 U/mL。洛雪等[72]将痤疮丙酸杆菌的LAI 基因扩增到大肠杆菌中表达,分离纯化上清液中的LAI 后检测到该蛋白分子质量为55 ku,电泳得到的条带大小与LAI 大小相符,气相色谱检测该蛋白催化生成t10,c12-CLA,且酶活为(34.775±0.07)U/mL。
经过基因重组技术能够成功构建具有LAI 活性的重组菌株,且能特异性合成CLA 异构体c9,t1l-CLA、t10,c12-CLA,进而有效提高LAI 酶活,并对影响酶活的各因素进行优化,最终能够较好达到提高CLA 产量的效果,是一直以来研究的重要方向。
3.3 基因敲除
基因敲除技术是建立在基因同源重组技术和胚胎干细胞技术基础上的一种新分子生物学技术,是用含有一定已知序列的DNA 片段与受体细胞基因组中序列相同或相近的基因发生同源重组,整合至受体细胞基因组中并得到表达的一种外源DNA 导入技术[73]。CRISPR-Cas9 是基因编辑的主要表现形式,它能够通过DNA 剪接技术选择性敲除特定蛋白的基因,是对靶向基因进行特定DNA 修饰的技术,其原理图如图5所示。基因敲除针对某个序列已知而功能未知的序列,通过改变生物的遗传基因,进而对生物体造成影响,最终推测出该基因的生物学功能,是微生物功能基因组学研究的有力工具之一[75]。

图5 CRISPR-Cas9 基因敲除原理图Fig.5 Schematic diagram of CRISPR-Cas9 gene knockout
基因敲除技术采用逆向思维,利用同源重组的方法敲除目的基因,使被研究的基因功能完全失活,从而推测该基因在整个过程中所起的作用[76],李娅妮等[77]在植物乳杆菌P8 的基础上,分别在LAI 基因的上游和下游序列设计了2 对引物,扩增出LAI 基因上下游序列的同源臂,成功构建敲除载体pUC18△LAI 以敲除LAI 基因,同时添加抗性筛选标记来快速筛选缺失菌株。倪丽娟[78]成功构建了LAI 单基因敲除菌株和双基因敲除菌株,对比其t10,c12-CLA 降解率,PEX10 降解率最低,稳定CLA 产量效果最佳。随即以PEX10 为出发菌株,构建LAI 多拷贝整合菌株,并筛选得到1株高产t10,c12-CLA 的菌株PEX10/1292,产量为22.3 mg/L。之后添加红花籽油优化培养,结果显示t10,c12-CLA 总产量提高到7.6 g/L,是单拷贝菌株的2 倍,且降解率为23.0 mg/L/h,敲除菌株对稳定CLA 产量非常有效。
由此看出,基因敲除在一定程度上避免了质粒整合产生的影响,也能够对底物LA 的降解起到缓解作用,同时也将为有效地提高CLA 产量提供帮助,为工业化生产CLA 提供一定的理论基础。
4 通过优化培养条件提高CLA 产量
在CLA 的生产与应用中,其菌株产酶条件及培养基的优化必不可少。通过优化菌株的产酶条件及培养菌株的培养基条件来提高CLA 的产量是最基本的,也是最便捷的方法。除此之外,一些金属离子也对CLA 的合成有显著影响。
罗玉芬[79]在泡菜中筛选得到1 株CLA 产量较高的明串珠菌QL2,对其发酵培养基成分进行优化后,发酵液中CLA 产量由原来的23.263 μg/mL提高到37.831 μg/mL,LA 转化率提高到6.31%,是未优化前的1.63 倍。接着对菌株的发酵条件进行优化,CLA 产量达到40.953 μg/mL,LA 转化率提高到6.83%,是先前的1.08 倍。Zeng 等[80]采用尿素一步络合法对黄油中c9,t11-CLA 的富集条件进行了优化,最终测定生产中c9,t11-CLA 的纯度为22.55%,c9,t11-CLA 和t10,c12-CLA 的浓度由原来的17.8 mg/g 和1.02 mg/g FA 分别提升到225.5 mg/g 和13.11 mg/g FA。许媛等[81]采用尿素包合法和响应面优化法对CLA 的2 种异构体进行分离,结果显示所得样品中t10,c12-CLA 与c9,t11-CLA 的比值高达2.47,且共轭亚油酸总量为97.3%,有效提高了CLA 的产量。刘华鼐等[82]利用响应面优化茶籽油制备CLA 的生产工艺条件,分离纯化后茶油的CLA 纯度从53.45%提高到了90.4%。Saber 等[83]采用Box-Behnken 和组合设计,建立了乳酸双歧杆菌BB12、嗜酸乳杆菌LA5及其共培养物转化CLA 的预测模型。结果表明,在最佳条件下,乳酸双歧杆菌BB12 和嗜酸乳杆菌LA5 生物合成CLA 的量分别为(110.03±4.58)μg/mL 和(82.42±3.66)μg/mL,可见纯乳酸双歧杆菌BB12 和嗜酸乳杆菌LA5 具有良好的产生物活性CLA 的能力,而乳酸双歧杆菌BB12 产生的CLA 能力要高于嗜酸乳杆菌LA5。Özer 等[84]在植物乳杆菌AB20-961 和植物乳杆菌DSM 2601 生产的半干发酵香肠中优化其发酵条件,以此获得最高含量的CLA,发酵后植物乳杆菌AB20-961和DSM2601 生产的香肠中CLA 含量分别为4.15 mg/g 脂肪和7.54 mg/g 脂肪,且用植物乳杆菌DSM2601 生产的香肠,发酵后的CLA 含量比之前测定的CLA 含量增加了121%。曹健等[14]研究发现,Na+、Fe2+、Mg2+有助于提高CLA 的产量,相反Hg2+、Co2+、Cu2+、Mn2+、Fe3+不利于共轭亚油酸的合成。苗世达等[85]由植物乳杆菌L-29 分离纯化得到LAI,分子质量达43 ku;对其酶学性质进行研究,结果表明,温度在37 ℃,pH 6.0 时,酶活性较高;Co2+、Fe2+可提高酶的活性,而Cu2+、Zn2+则对酶活力有抑制作用。
由此可见,将培养菌株的培养基成分,如碳源、氮源等比例进行调节优化,其CLA 产量会明显提高,在此基础上,若将菌株的产酶条件,如发酵温度、初始pH、发酵时间以及底物添加量等加以优化,及添加Na+、Fe2+、Mg2+等化学元素也能够有效提高LAI 的活性,显著提高了CLA 产量。根据相关文献,对不同乳杆菌产CLA 的优化条件进行了对比总结,如表2所示。
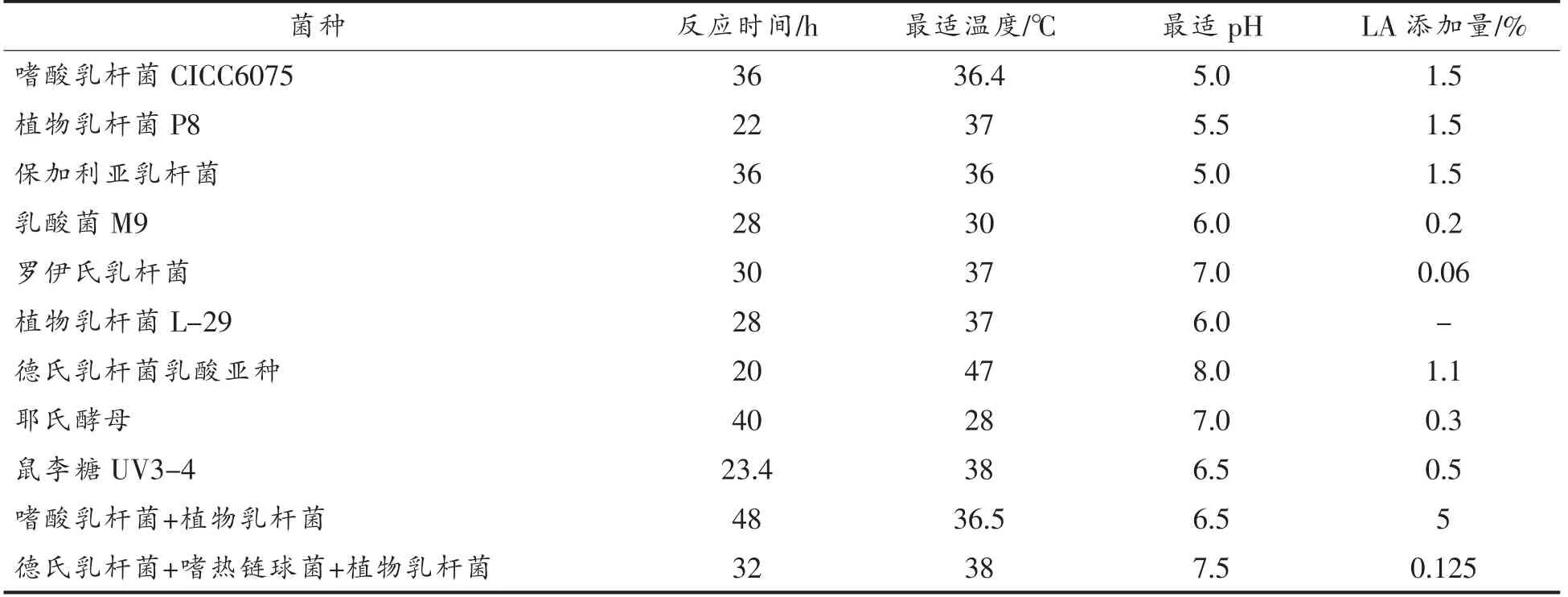
表2 不同菌种产CLA 的基本优化条件对比Table 2 Comparison of basic optimization conditions for CLA production by different strains
5 总结与展望
随着人们生活水平的日益提高及健康意识的逐渐提高,由于CLA 具有抗癌、抗动脉硬化症、减肥、提高机体免疫等重要的生理功能,其市场需求量将会持续增加,天然来源的CLA 远远满足不了人们的需求[86],而传统获取CLA 的方法缺陷较多,如化学合成法生产得到的产物存在CLA 的异构体种类较多,分离纯化相对困难,而且可能存在有毒物质;生物合成法较化学合成法能够单一合成CLA,然而其产量不高,故传统方法不是长期稳定生产CLA 的最优途径。于是研究人员近年来利用新兴技术,例如:物理诱变、化学诱变、离子注入和等离子体诱变等诱变技术,以及利用基因工程的方法对原菌株的LAI 基因组进行改造,重新构建LAI 基因整合菌株来提高CLA 的产量。通过研究发现,诱变技术可以有效提高CLA 的产量,然而采用单一的诱变方法可能得到的突变体比较单一,最终产CLA 的效果也不够理想,而采用复合诱变的方法,能够有效弥补这一的缺陷,从而有效提高菌株的突变率,进而提高CLA 产量。基因工程技术通过重新构建LAI 基因突变文库,改造菌株的性能,使菌株能够高产CLA。在此基础上,将得到诱变或重新构建的菌株的培养基条件或者产酶条件加以优化,其CLA 产量会得到更大的提高。在今后CLA 的研究中应顺应时代发展,提高生产CLA 过程的安全性,着重研究通过提高LAI的活性来提高CLA 的产量,同时也要注重生产CLA 的新技术的开发与研究。

