建立超高效液相色谱特征图谱评价燀桃仁饮片质量
刘青,肖炯昌,张文芳,高永坚,魏梅,詹若挻,林碧珊
(1.国药集团广东环球制药有限公司,广东佛山 528305;2.国药集团广东一方制药有限公司,广东佛山 528244;3.广州中医药大学中药学院,广东广州 510006)
桃仁为蔷薇科植物桃Prunus persica(L.)Batsch或山桃Prunus davidiana(Carr.)Franch.的干燥成熟种子,味苦、甘,性平,归心、肝、大肠经,具有活血祛瘀、润肠通便、止咳平喘的功效,广泛用于经闭痛经、癥瘕痞块、肺痈肠痈、跌扑损伤、肠燥便秘、咳嗽气喘等病证。临床中,多用其燀制饮片。但目前对燀制后的药材饮片缺乏有效的质量控制和评估的手段,无法对其效果进行直接且全面的评价。《中国药典》中燀桃仁含量测定项主要是检测苦杏仁苷,而本课题组前期研究发现,若仅仅按照上述方法难以准确评价燀制效果,因为只对苦杏仁苷一种成分的测定无法评估燀制前后化合物的变化。炮制过程中燀制不彻底,就起不到杀酶保苷(酶为苦杏仁苷酶,苷为苦杏仁苷)的目的,影响药效的发挥[1-2]。由于苦杏仁苷酶的水解作用,苦杏仁苷降解生产氢氰酸[3],常用苦味酸试纸法检测氰化物的含量[4]。在种子类药材炮制中,该方法能间接反映苦杏仁苷酶的活性,从而判断燀制效果,但只能用作定性判断,主观性大。故开发一种直接判断燀制工艺的有效方法很有必要。本研究采用超高效液相色谱(UPLC)法,建立燀桃仁饮片特征图谱测定方法,用于评价燀桃仁饮片的燀制质量,现将研究结果报道如下。
1 材料
1.1 仪器 H-class超高效液相系统(美国沃特世公司);KQ-250DB数控超声波清洗器(昆山市超声仪器有限公司);AL104万分之一电子分析天平[梅特勒-托利多仪器(上海)有限公司];超纯水仪(美国Milipore公司);HH-4水浴锅(常州奥华仪器有限公司);HN101电热鼓风干燥箱(上海苏进仪器设备厂)。
1.2 药物与试剂 19批桃仁药材产地如表1所示,由国药集团广东环球制药有限公司林碧珊副主任药师鉴定为蔷薇科植物山桃Prunus davidiana(Carr.)Franch.。市售燀桃仁(批号:20191101)购自国药集团冯了性(佛山)药材饮片有限公司。苦杏仁苷对照品(纯度90.7%),购自中国食品药品检定研究院,批号:110820-201607;野黑樱苷对照品(纯度97.0%),购自阿拉丁试剂公司,批号:B2019085;杏仁腈对照品(纯度≥98%),购自Chem Faces公司,批号:CFS301903;色氨酸对照品(纯度99.9%),购自中国食品药品检定研究院,批号:140686-201904;磷酸,购自阿拉丁试剂公司,批号:B1214004;色谱级甲醇,购自美国BCR公司,批号:0212210501;水为超纯水;其他试剂均为分析纯。
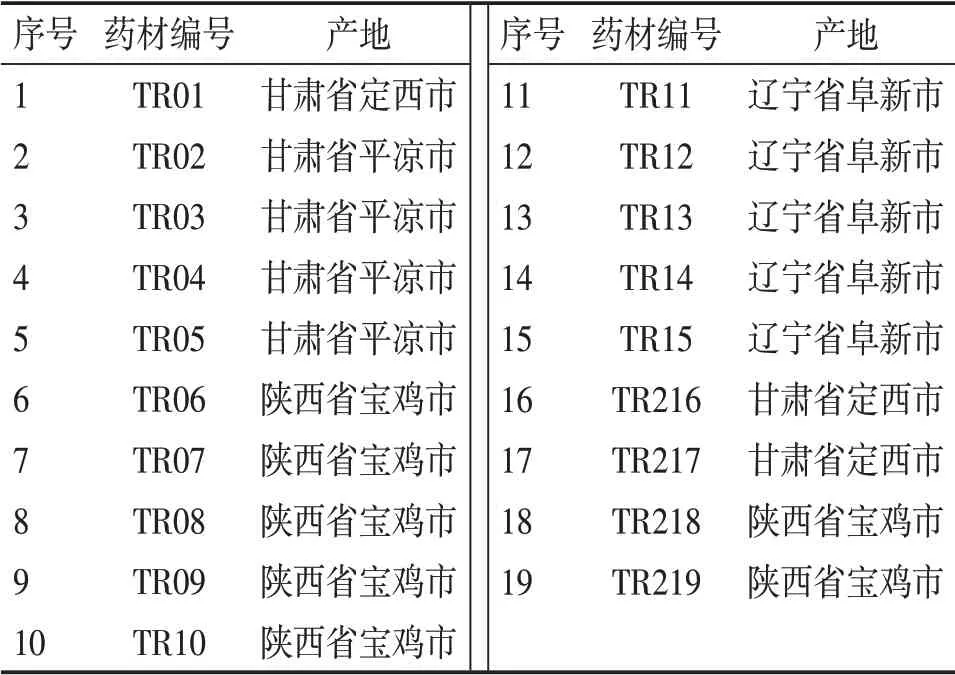
表1 桃仁药材产地信息表Table 1 Table of information on the habitat of Semen Persicae materials
2 试验方法
2.1 试验对象的制备 随机选取3批桃仁药材(批号分别为TR06、TR15、TR216),每批各选取200 g,分为4份,分别用于制备沸水实验组和热水对照组的试验样品。①热水对照组:取桃仁药材50 g,投入10倍量的热水中,10 min后捞出,冷浸1 min,手工搓去皮,55℃烘干,分别记为CTR06Y1、CTR15Y1、CTR216Y1。②沸水实验组:取每批桃仁药材50 g,各3份,投入10倍量的沸水中,分别于5、10、15 min后捞出,冷浸1 min,手工搓去皮,55℃烘干,分别记为CTR06Y2/CTR06Y3/CTR06Y4、CTR15Y2/CTR15Y3/CTR15Y4、CTR216Y2/CTR216Y3/CTR216Y4。取19批桃仁药材,参照沸水实验组的制备方法(10 min),制备19批燀桃仁饮片,记为CTRnY5。
2.3 含量测定 按照《中国药典》2020年版四部通则“0512”中燀桃仁的含量测定项,采用高效液相色谱法进行测定。
2.3.1 色谱条件 以十八烷基硅烷键合硅胶(柱长100 mm,内径2.1 mm,粒径1.8μm)为填充剂;以甲醇-水(体积比20∶80)为流动相;检测波长为
210 nm。理论板数:苦杏仁苷峰>3 000。
2.3.2 制备对照品溶液 精密称取苦杏仁苷对照品,加70%甲醇配制成含苦杏仁苷80μg/mL的溶液,备用。
2.3.3 制备供试品溶液 取燀桃仁饮片样品粗粉约0.3 g,精密称定,置于锥形瓶中,加入50 mL石油醚(60~90℃),加热回流1 h;冷却后滤过,弃去石油醚液,挥干药渣中溶剂,放入原锥形瓶中;精密加入70%甲醇50 mL,称定质量,加热回流1 h,待冷却再称定质量,用70%甲醇补足质量,摇匀,过滤。精密量取5 mL续滤液,置于10 mL量瓶中,加入50%甲醇至刻度,摇匀即得。
2.3.4 测定方法 对照品及供试品溶液各1μL,注入液相色谱仪,进行测定。
2.4 特征图谱 按《中国药典》2020年版四部通则“0512”测定。
第四,树立核心价值,衔接具体实践。一方面,要建立好以治理腐败存量与增量为核心的反腐价值体系,保障多元价值的内在一致性。如政治价值中的民主、代表性、回应性,管理价值中的服务性、效率性、公开性,绩效价值中的反思与革新性,不同价值间存在对应和衔接,都服务于减存遏增目标。另一方面,在决策链上,规则制定与资源分配以政治价值为主导;在行政链上,政策执行与资源消耗以管理价值为指导;在评估链上,绩效评价与跟踪反馈以绩效价值为主导。每一重点领域都应合理定位主导价值,以免出现价值矛盾对立。
2.4.1 色谱条件 填充剂:十八烷基硅烷键合硅胶;流动相A:甲醇;流动相B:0.1%磷酸溶液,以表2中的规定梯度洗脱;柱温:25℃;检测波长:210 nm。理论板数:苦杏仁苷峰>3 000。
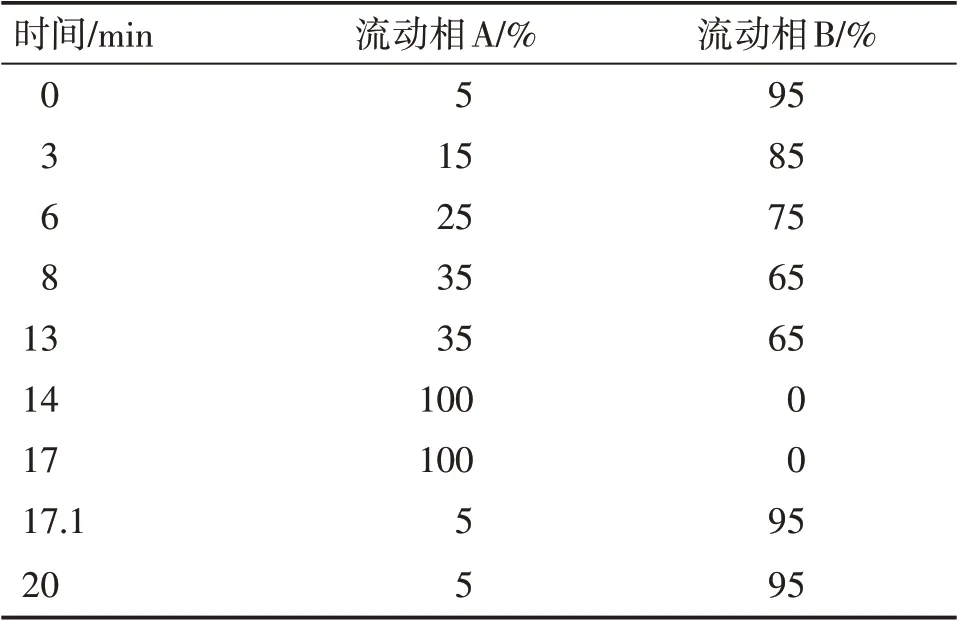
表2 燀桃仁特征图谱方法梯度洗脱表Table 2 Gradient elution table of characteristic chromatogram method for chan Semen Persicae
2.4.2 制备供试品溶液 取0.3 g燀桃仁饮片样品于250 mL烧瓶中,加入15 mL水浸泡30 min;再加入35 mL甲醇,待冷却后称定质量;超声30 min,冷却后用70%甲醇补足质量,摇匀,过滤,取续滤液即得。
2.4.3 测定方法 取对照品与供试品溶液各1μL,注入液相色谱仪,进行测定。
2.5 特征图谱方法学考察
2.5.1 精密度考察 取燀桃仁饮片,按照“2.4.2”项方法制备供试品溶液,按“2.4.1”项色谱条件,连续进样6次进行测定,进样量为1μL。以苦杏仁苷(峰4)为参照峰,记录其他共有峰相对保留时间。在精密度考察中,燀桃仁饮片中的色谱峰相对保留时间相对标准偏差(RSD)<0.3%,相对峰面积RSD均≤2%(n=6),结果表明,仪器精密度良好。
2.5.2 稳定性考察 取燀桃仁饮片,按照“2.4.2”项方法制备供试品溶液,按“2.4.1”项色谱条件,分别在0、2、4、8、18、24、30 h进样。以苦杏仁苷为参照峰,计算相对保留时间。结果测得各共有峰相对保留时间的RSD≤0.6%,相对峰面积的RSD≤5%(n=7),表明供试品溶液在30 h内稳定性良好。
2.5.3 重复性考察 取燀桃仁饮片,按照“2.4.2”项方法制备供试品溶液,按照“2.4.1”项色谱条件,考察特征峰相对保留时间的一致性。结果测得燀桃仁饮片各个特征峰的相对保留时间RSD<0.3%,说明该方法的重复性良好。
3 试验结果
3.1 性状 2个实验组的燀桃仁性状如图1所示,沸水或热水燀制所得的燀桃仁在外观上无明显区别。

图1 沸水实验组和热水对照组的燀桃仁性状图Figure 1 Character map of the chan Semen Persicae in the boiling water experimental group and the hot water controlgroup
3.2 含量 对沸水或热水燀制所得的燀桃仁进行了苦杏仁苷的含量检测,结果如表3所示。沸水或热水燀制所得的燀桃仁中苦杏仁苷含量差异不明显,且燀制前后的苦杏仁苷含量差异也不明显。因此,不能通过含量的差异用作燀制效果的判断指标。

表3 3批桃仁药材及燀制品苦杏仁苷含量表Table 3 Content table of amygdalin of 3 batches of Semen Persicae herbs and their chan products(含量/%)
3.3 苦味酸试纸试验
3.3.1 沸水或热水燀制的区别 采用苦味酸试纸检测桃仁燀制后的苦杏仁苷酶活性,结果如图2所示,热水燀制所得的燀桃仁(CTR216Y1)的苦味酸试纸在热水保温前已稍有变色,热水保温5 min已完全变色,表明其苦杏仁苷酶活性仍很强。而沸水燀制所得的3批燀桃仁在热水保温前无明显变色,热水保温5 min后,沸水燀制5 min和10 min的燀桃仁(CTR216Y2和CTR216Y3)的苦味酸试纸稍有变色,沸水燀制15 min的燀桃仁(CTR216Y4)的苦味酸试纸均无明显颜色,表明沸水燀制10 min以上的燀桃仁的苦杏仁苷酶活性已基本灭活。市售的燀桃仁(20191101)的酶活性与沸水燀制5 min的燀桃仁(CTR216Y2)相当。其余2批桃仁药材的结果趋势一致。

图2 桃仁燀制后苦味酸试纸试验结果Figure 2 Test results of picric acid test strips after the processing of“chan”
3.3.2 苦味酸试纸变化的基本条件 根据苦味酸试纸反应需要加水,因此,推测苦杏仁苷酶解过程需要水的环境。本研究观察热水燀制所得的燀桃仁在不加水条件下苦味酸试纸的变化情况,结果如图3所示。不加水组的苦味酸试纸在水浴反应30 min后,仍无明显变化,证实了苦杏仁苷酶解过程需要水参与的这一假设。

图3 桃仁燀制后不加水的苦味酸试纸试验结果(热水保温30 min后)Figure 3 Test result of picric acid test strips without water after the processing of“chan”(after holding hot water for 30 minutes)
3.4 特征图谱
3.4.1 加水浸泡的影响 根据苦杏仁苷酶解过程需要水,本研究对特征图谱供试品处理方法进行优化,对比了供试品处理过程中加水浸泡的差异。将所得的供试品上机检测,特征图谱如图4所示。加水浸泡的燀桃仁样品中,苦杏仁苷色谱峰后有一大峰,通过与对照品定位,初步确定新生成的峰为野黑樱苷;而未加水浸泡的燀桃仁样品中野黑樱苷峰面积小。
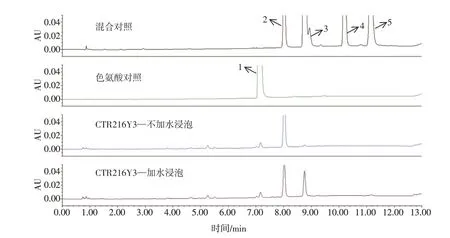
图4 加水浸泡对燀桃仁特征图谱的影响Figure 4 Effect of soaking with water on the characteristic chromatogram of chan Semen Persicae
3.4.2 加水浸泡时间的影响 结果如表4。取CTR216Y3批燀桃仁饮片,对加水浸泡时间进行考察。随着浸泡时间的逐步增加,图谱中苦杏仁苷峰面积的占比逐渐下降,并在浸泡30 min时达到平台期。通过计算苦杏仁苷、野黑樱苷和杏仁腈峰面积的总和,发现总峰面积差异不大,进一步证明这3个成分存在相互转换的关系。

表4 CTR216Y3批燀挑仁特征图谱峰面积汇总表Table 4 Summary of peak areas for characteristic chromatogram of CTR216Y3 chan Semen Persicae
3.4.3 燀制效果对特征图谱的影响 采用浸泡30 min的供试品处理方法,对比了热水组和沸水组燀桃仁特征图谱的差异,结果如图5所示。热水燀制所得的燀桃仁的苦杏仁苷主峰已完全降解,且无酶解产物野黑樱苷和杏仁腈相应的色谱峰,只有1个未知峰,猜测是苯甲醛;而沸水燀制所得的燀桃仁的苦杏仁苷主峰稍有下降,可确定部分苦杏仁苷已酶解成野黑樱苷。
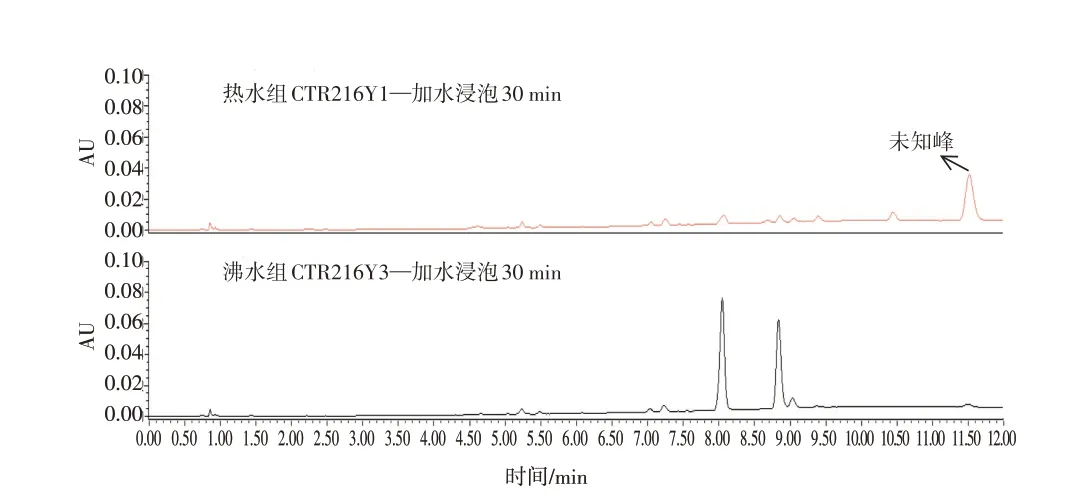
图5 热水组和沸水组燀桃仁的特征图谱Figure 5 Characteristic profiles of the chan Semen Persicae in the hot water group and boiling water group
3.5 多批燀桃仁饮片的质量分析
3.5.1 含量 对19批桃仁进行燀制处理,具体的炮制工艺如下:取桃仁药材,置10倍量的沸水中,燀制10 min,放凉,手工脱皮,烘干。对19批燀桃仁进行含量检测,结果如表5所示。19批桃仁药材燀制前后苦杏仁苷含量差异不明显。

表5 19批桃仁药材燀制前后的苦杏仁苷含量表Table 5 Amygdalin contents of 19 batches of Semen Persicae herbs before and after the processing of“chan” (含量/%)
3.5.2 苦味酸试纸 对19批燀桃仁进行苦味酸试纸检测,并对试纸变色情况进行评分,评分结果如表6所示。19批燀桃仁的评分结果差异不明显,波动范围为3~6分。
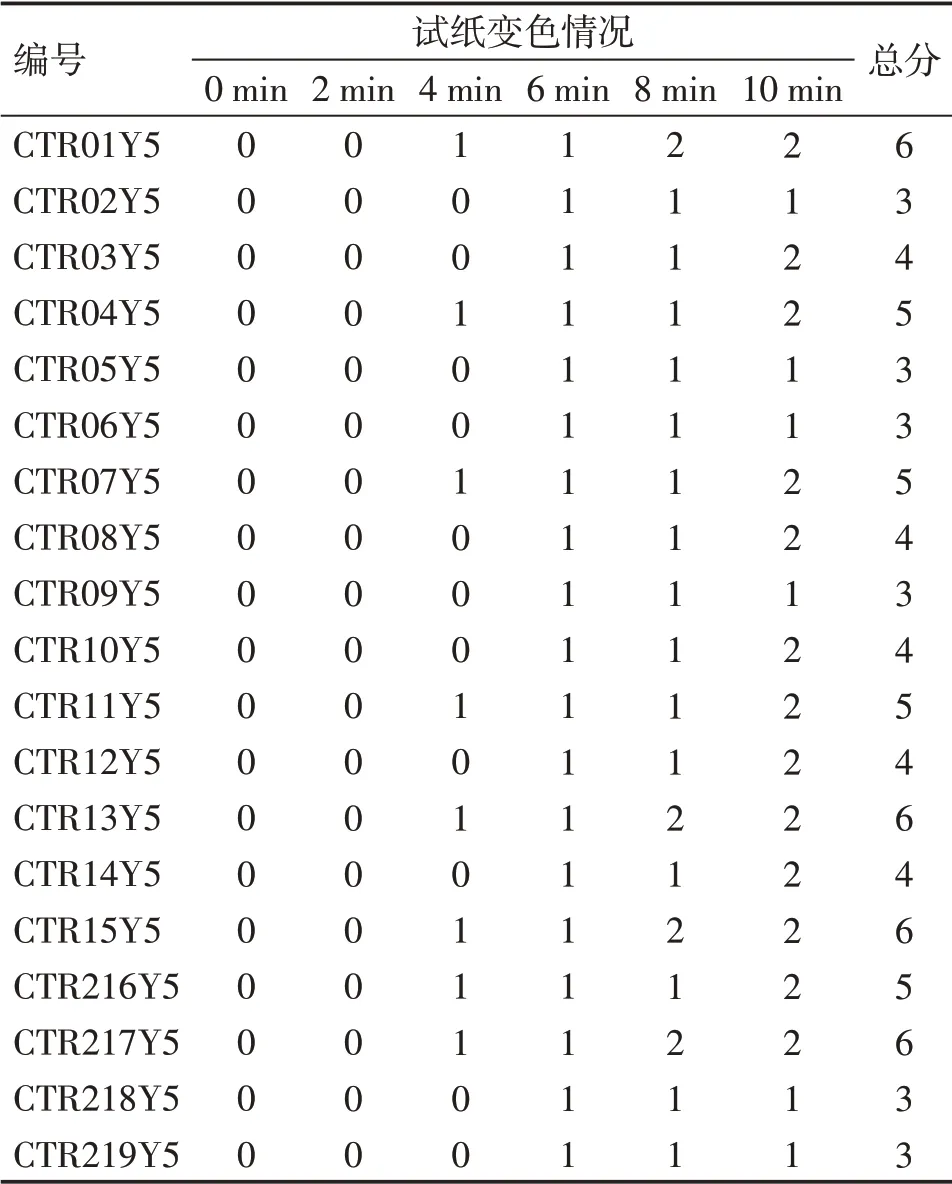
表6 19批燀桃仁饮片的苦味酸试纸试验评分表Table 6 Tablets of scores of picric acid test strips for 19 batches of chan Semen Persicae Decoction Pieces (评分/分)
3.5.3 特征图谱 对19批燀桃仁进行特征图谱检测,并计算苦杏仁苷峰面积与总峰面积的比值,结果如表7所示。19批燀桃仁的苦杏仁苷峰面积与总峰面积的比值变化波动范围为0.65~0.89。

表7 19批燀桃仁饮片的特征图谱峰面积汇总表Table 7 Summary tablets of the peak areas of the characteristic chromatogram of the 19 batches of chan Semen Persicae Decoction Pieces
3.5.4 苦味酸试纸评分和特征图谱的相关性 对19批燀桃仁的苦杏仁苷峰面积与总峰面积的比值与苦味酸试纸的评分结果进行相关性分析,结果如图6所示。19批燀桃仁的苦杏仁苷峰面积与总峰面积的比值与苦味酸试纸的评分结果呈负相关,苦杏仁苷峰面积与总峰面积的比值越大,苦味酸试纸的评分结果越小,则酶活性越低。因此可用该特征图谱方法替代苦味酸试纸法,用于评价桃仁的燀制效果。

图6 苦味酸试纸评分和特征图谱的相关性Figure 6 Correlation of scores of picric acid test strips and characteristic chromatogram
4 讨论
4.1 含量测定结果 与桃仁燀制工艺相关的文献报道多以苦杏仁苷的含量变化衡量燀制效果[5-6]。但根据《中国药典》2020年版的苦杏仁苷含量测定方法中规定用石油醚对苦杏仁苷进行回流除去油脂成分后,再用70%甲醇超声提取苦杏仁苷。采用石油醚这个有机溶剂,会直接将苦杏仁苷酶灭活,则无法评价燀制的灭酶目的。有文献报道,苦杏仁苷在炮制过程中,部分溶解、酶解或受热破坏导致含量降低[7]。也有文献报道,桃仁生品、燀桃仁和炒桃仁饮片中苦杏仁苷含量无显著性差异[8]。本研究制备的19批燀桃仁,苦杏仁苷的含量在炮制前后差异不大,与文献研究[8]报道的基本一致。
4.2 苦味酸试纸结果 按照苦味酸试纸的变色情况由浅至深,可反映出氢氰酸的含量由少至多,能定性地判断出各样品中苦杏仁苷酶的活性[9]。但因只能肉眼观察试纸的颜色变化,凭借个人主观感觉对颜色进行打分,且无法反映苦杏仁苷的含量变化情况,故该检测方法存在粗糙、无法定量的劣势。
4.3 特征图谱结果 关于加水浸泡的供试品处理过程:有研究指出,苦杏仁苷酶的最佳反应条件为略酸的缓冲液体系,且反应温度为50℃[10]。故本研究在50℃水浴下进行苦味酸试纸试验。同时,本研究还确定了苦杏仁苷酶反应条件需要水的参与,若样品中不加入水,即使样品中的苦杏仁苷酶活性再大,也无氢氰酸的产生,苦味酸试纸也不发生变色反应(如图2所示)。因此,本研究在特征图谱供试品处理过程中增加了加水浸泡的步骤,再检测苦杏仁苷酶解反应后的底物和新生成的物质,来判断饮片中的苦杏仁苷酶在炮制过程中的破坏程度。高家鉴等[11]曾提出,为了判断不同炮制过程对苦杏仁中苦杏仁苷酶的破坏效果,可将供试品在45℃酶解1 h后,再检测底物即苦杏仁苷的含量;本研究首次将此方法应用于特征图谱检测,并同时反映苦杏仁苷及其降解产物的变化情况。关于反映苦杏仁苷降解过程:苦杏仁苷酶将苦杏仁苷降解为野黑樱苷,樱叶酶将野黑樱苷进一步水解成杏仁腈,杏仁腈又易分解成氢氰酸和苯甲醛[12]。郭咪咪等曾报道了一种HPLC方法可同时检测苦杏仁苷与野黑樱苷[13];而本研究建立的特征图谱方法,可同时反映苦杏仁苷、野黑樱苷和杏仁腈的变化情况,更显全面、直观。本研究计算了19批燀桃仁中苦杏仁苷峰面积与苦杏仁苷、野黑樱苷、杏仁腈三者峰面积之和的比值的变化情况,结果显示其波动范围为0.65~0.89,与张晓男等[5]报道的“苦杏仁苷色谱峰在HPLC指纹图谱特征峰峰面积之和中约占60%”相一致。本研究结果还显示,19批燀桃仁的苦杏仁苷峰面积与总峰面积之比与苦味酸试纸的评分结果呈负相关。因此,可对燀桃仁饮片进行UPLC分析,其特征图谱能体现燀制饮片中苦杏仁苷酶的活性,进而评价燀制工艺。
综上所述,本实验建立的燀桃仁特征图谱方法简便、快速、稳定,可用于评价桃仁药材的燀制效果,对全面系统地评价和控制桃仁及其炮制品饮片的质量具有一定的意义。

