AFB1污染花生油激光诱导荧光信号受温度干扰规律及温度全局模型研究
何学明, 陈 敏, 杨小云, 张曼曼, 沈 飞, 袁 建, 胡秋辉, Firew Tafesse Mamo
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心,南京 210023)
花生油在日常生活与食品生产中发挥着重要作用,2020年,我国花生油总生产量达到320万t,位居世界第一。然而作为一种季节性较强的农作物,花生在收获前,当受到干旱和虫害的威胁时,易被黄曲霉感染,收获后,盛夏季节高温多雨,空气中水分含量较大,受温湿度和储藏方式等诸多因素影响,也极容易发生霉变[1]。对于已经发霉、破损的花生原料在储藏期间都会增加霉变的概率,在储藏过程中产生的真菌毒素会迅速扩散污染更多的作物[2]。花生油中的真菌毒素超标原因主要有:原料污染带入、加工过程污染、储存运输不当、精炼工艺不当等[3]。花生油中污染的主要是黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1) 及黄曲霉毒素G2(AFG2)4种。黄曲霉毒素难溶于水、乙烷和乙醚,但易溶于甲醇、氯仿和乙腈等有机溶剂中,熔点为200~300 ℃,热稳定好,耐高温[4, 5];黄曲霉毒素在弱酸环境中相对比较稳定,但在强酸强碱中会发生降解,丧失荧光性[6]。研究表明AFB1是所有黄曲霉毒素中毒性最强,且是花生油中含量最多的一种,约为黄曲霉毒素总量的65%~80%[7]。AFB1是目前发现的致癌力最强的天然物质(约为氰化物的10倍,砒霜的68倍),1993年世界卫生组织国际癌症研究机构将AFB1定为I类致癌物质[8, 9]。它主要是对人及动物肝脏组织具有强烈致癌、致畸和致突变等破坏作用。黄曲霉毒素危害人体健康主要是通过食用被黄曲霉毒素污染的食物,即使是痕量级水平的毒素长时间摄入可造成慢性中毒引起纤维病变[10]。我国2017年颁布的《食品安全国家标准食品中真菌毒素限量》(GB 2761—2017) 规定花生油中AFB1限量指标为20 μg/kg[11],美国食品与药物管理局同样规定花生油中黄曲霉毒素总量不得高于20 μg/kg[12]。
目前用于AFB1的检测方法主要有:生物鉴定法、化学分析法、免疫分析法与仪器分析法。其中生物鉴定法需要饲养动物进行实验,实验周期长,不可控因素多,灵敏性和专一性较低。化学分析法常用的是薄层色谱法(TLC),该方法的原理是:在紫外波长365 nm的照射下,AFB1将产生蓝紫色的荧光,根据薄层板上所显示荧光的最低检测量来确定黄曲霉素的含量。虽然该方法成熟较早但检测精度低,在实验过程中的挥发物质对实验人员与环境造成危害,样本前处理繁琐,因此难以在实际中应用。免疫分析法包括酶联免疫吸附法(ELISA)、免疫荧光标记技术、免疫亲和柱法(IAC)和免疫胶体金技术(ICS)等。其中ELISA法在植物油中有相关研究[13],该方法具有灵敏、操作简单、处理量大、不需要专用的大型设备、对操作人员要求也不高、成本也相对较低的优点,但是由于酶生产技术有限,且对保藏要求高,因此酶的不确定性使该方法经常出现假阳、阴性结果,除此之外,样品提取程度和样品基质对抗原抗体反应的影响也会导致在实际样品的定量分析过程中常会发生测定值偏差的现象。目前被普遍采用的仪器分析法有高效液相色谱、气相色谱法(GC)和液相色谱质谱联用法(LC-MS),这些传统仪器分析技术可以实现高精度AFB1的检测,但仪器昂贵,样本需要前处理,操作复杂,检测速度较慢,检测成本高。
近些年来,为了能够检测到农产品中微弱的黄曲霉毒素信号,将传统荧光法中的光源替换成了激光,并引入化学计量学方法分析光谱数据中隐藏信息,该方法即为激光诱导荧光光谱法(LIF)。LIF技术检测AFB1的原理是根据AFB1在紫外光激发下(340~400 nm)会发出蓝色(450 nm)荧光,该方法使用激光作为激发光源,提高了检测灵敏度,且该技术在对污染样本判别时所依据的是AFB1的特征荧光峰,是一种直接测量方法。现已有大量文献报道将LIF技术应用于检测受AFB1污染的花生[14]、 榛子[15]、开心果[16]等。结果显示,检测花生中AFB1时,其相关系数可达到0.99,区分AFB1污染和未污染榛子的正确率为92.3%,开心果中AFB1的检测结果与HPLC检测一致。Rasch等[17]利用LIF技术在葡萄酒生产过程中定性和定量测定真菌毒素污染情况,结果表明对于受AFB1污染的不同品种酒,其荧光光谱形状是存在一定差异的。
激光诱导荧光光谱技术易受温度等环境因素的影响。其中温度的影响对荧光光谱检测产生影响的因素非常多,当被检测样品确定时,环境温度对检测的影响较大。通常,溶液中分子运动加剧,就会有更多的荧光分子与溶剂发生碰撞,发生荧光猝灭,从而降低荧光强度[18]。目前研究证明大多数物质的荧光强度是随温度的升高而降低。梁颖等[19]研究了温度对三角褐指藻叶绿素荧光特性的影响,结果发现温度对荧光参数有显著影响且温度高的实验组具有较低的荧光强度。易黎丽等[20]研究发现炼油厂中石油类污染物的荧光峰光谱的轮廓形状和荧光峰的位置不随检测温度的变化而改变,但荧光强度随着温度的升高而降低,从而提出对含油污水中油的种类及含量检测时的温度校正补偿。因此,在进行常规荧光技术检测时,若把这种温度变化对建立的模型影响降低,常用的方法是建立数学模型时,将温度变化因素考虑进去。即通过建立模型时加入实际应用中所涉及到的温度范围数据,降低温度波动对预测模型的影响。
1 材料与方法
1.1 实验材料
本实验共购买10个品牌花生油,采用酶联免疫吸附法(ELISA)测定样品中AFB1的含量(GB/T 5009.22—2016),经测量均未检出AFB1。各品牌花生油生产地点、生产方式与等级汇总在表1中。

表1 10个品牌花生油生产地点、生产方式与等级
称取黄曲霉毒素B1标准品(纯度≥98%)1 mg于100 mL容量瓶中用乙腈(色谱纯)溶解并定容配制成黄曲霉毒素B1标准液母液 (10 000 μg/kg),母液存于-18 ℃冰箱中备用。加入18、36、72、90、108 μL的10 000 μg/kg的AFB1溶液,配制污染AFB1为5、10、20、25、30 μg/kg的花生油,作为污染样本组。加入108 μL的乙腈到花生油中,配置AFB1浓度为0的植物油样本,纯花生油作为控制组。每个污染浓度与对照组各10个样本,每种花生油在每个温度的样本数为70。
使用恒温水浴锅(HH-6)与冰箱将花生油温度分别控制在10、20、30、40、50 ℃,通过温度计(TA601)测量温度。每个品牌植物油共准备350份,共3 500个样本。
1.2 激光诱导荧光光谱系统
本研究中使用的激光诱导荧光光谱系统示意图如图1所示。该系统主要包括激光器(MW-GX-375, 长春镭仕)用于发射波长为375 nm的激发光,激光器通过UPS稳压电源(C1K)供电。直径为1 000 μm的照明光纤(P1000-2-VIS-NIR)用与连接激光器与准直镜(COL-20K),投射出准直激发光,垂直入射到植物油样本表面。植物油样本用比色皿(24 mm×24 mm×42 mm)装盛,比色皿放置在升降台上。植物油受激光激发后发射出的荧光通过滤光片(LPF400)与准直镜(74-UV-02),以过滤掉强度较大的发射光及杂散光,通过接收光纤与光谱仪(QE-Pro)以获取210~980 nm波长的光谱信号。

图1 激光诱导荧光光谱系统示意图
荧光光谱通过OceanView软件采集得到,积分时间设置为1 000 ms,平滑与平均次数均为2。每个样本采集3次光谱,平均后的光谱为样本实际光谱。
1.3 多元统计分析
主成分分析法(PCA),作为一种无监督学习方法,被用于对未超标(<20 μg/kg)与超标(≥20 μg/kg)花生油的聚类趋势分析[21]。采用Kennard-Stone算法,将每个温度下的植物油样本的数据分别按 3∶1的比例随机分成校正集和验证集[22]。分别使用线性判别分析(LDA)、偏最小二乘判别分析(PLS-DA)与不同核函数(Linear, Polynomial, RBF)的支持向量机(SVM)对未超标与超标花生油进行判别分析,通过总分类正确率(CCR)、假阳性率(FPR)与假阴性率(FNR)对各模型效果进行评价,探索适用于植物油AFB1判别的最优建模算法。CCR表示正确预测的样本总数的百分比。假阴性是指AFB1超标样本被误判为未超标样本,由于AFB1对人体危害极大,因此假阴性样本更应该避免。因此,好的模型应具有较低的FPR、FNR(尤其是FNR)和较高的CCR[23]。PCA在Unscrambler X (Version 10.4)软件中进行,样本分组、LDA、PLS-DA与SVM算法建模在Matlab (2019a)软件中处理。
为了体现温度对AFB1预测模型的影响,对分温度模型与全局模型的预测效果进行比较。分别使用10、20、30、40、50 ℃下的校正集样本进行建模,共建立5个AFB1判别模型,然后根据每个温度下的校正模型对本温度及其他4个温度下的验证集进行预测,分析分温度模型对本温度与其他温度下验证集的预测效果,并与全局模型进行比较。
2 结果与分析
2.1 光谱分析
LIF技术检测AFB1的原理是根据AFB1在紫外光激发下(340~400 nm)会发出蓝色(450 nm)荧光,而G族黄曲霉毒素发绿色荧光[24]。从图2可知,在不同温度下,花生油在400~600 nm波段范围内的荧光强度随AFB1含量的增长均呈上升趋势。表明在温度恒定的情况下,花生油的荧光强度与AFB1有较强线性关系。随着温度的升高,光谱轮廓形状无明显变化,但荧光强度随着温度的升高会出现不同幅度降低,基本满足线性变化。样本温度变化不是太大,因此引起荧光强度的降低不是花生油样本荧光基团发生变化导致的,可能是由于温度升高,导致花生油的黏度降低,会发生荧光猝灭现象[25]。可以确定样品温度会对荧光强度产生影响,从而影响模型预测效果。为把这种温度变化对建立的模型影响降低,常用的方法是建立数学模型时,将温度变化因素考虑进去。即通过建立模型时加入实际应用中所涉及到的温度范围数据,降低温度波动对预测模型的影响。
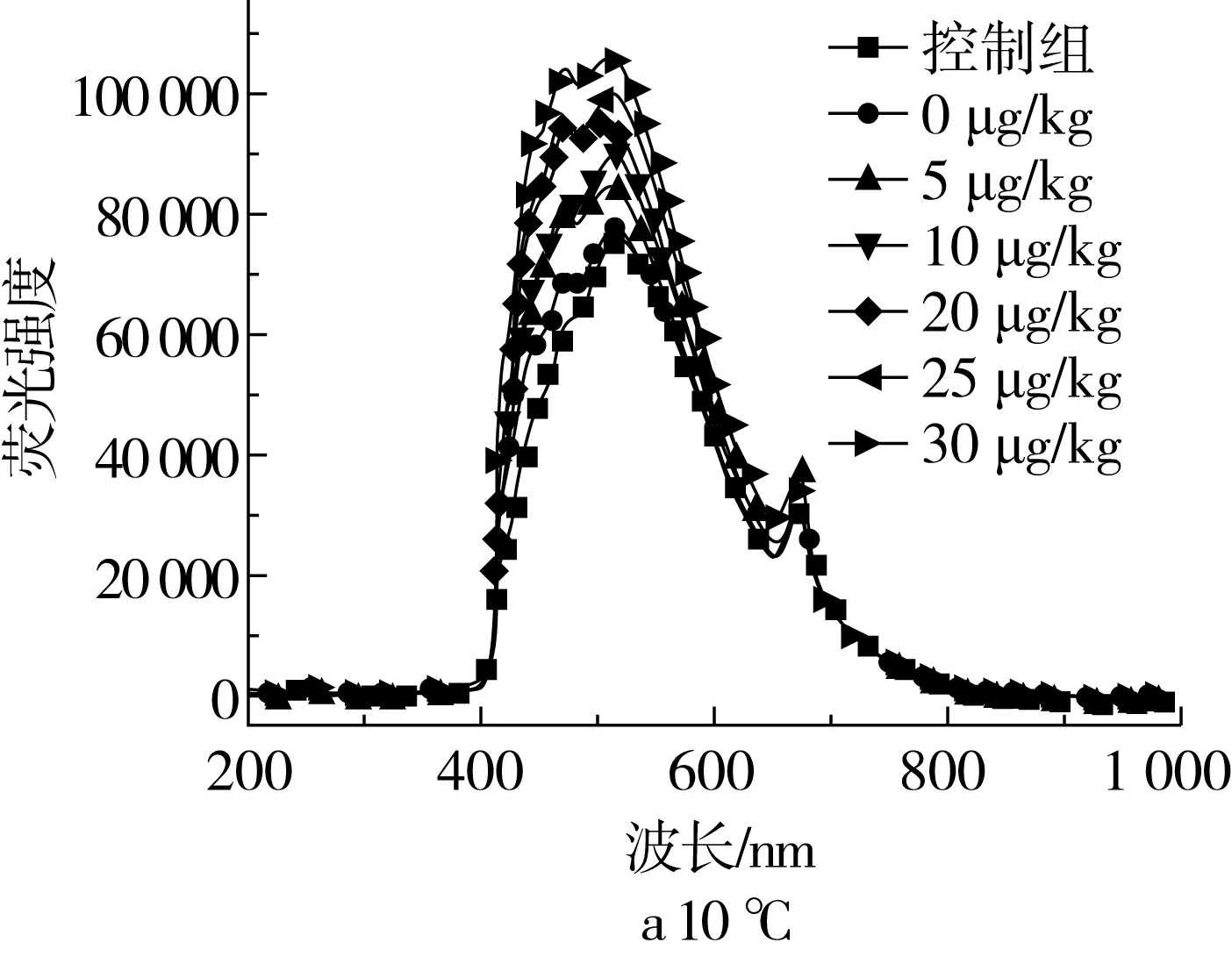
图2 品牌1花生油在不同温度下的平均荧光光谱
2.2 PCA结果
采用PCA对单个温度及不同温度花生油污染AFB1的荧光光谱数据结构进行了聚类分析。图3是样本PCA得分图,无论单一温度还是将5个温度混合后花生油的AFB1未超标样本和超标样本之间分离趋势均不明显,原因是本研究中所检测的花生油样本有10个品牌,不同品牌间花生油样本相关品质有区别,对AFB1荧光信号有一定的干扰,通过PCA得分图难以将正常样本与AFB1超标样本精确区分。后续采取不同定性建模方法对正常与AFB1超标样本进行判别。

图3 样本PC得分图
2.3 判别结果
2.3.1 全局模型
基于10、20、30、40、50 ℃,5个温度下的校正集样本建立判别模型,对5个温度下的验证集样本进行预测,使用不同建模方法(LDA、PLS-DA、SVM(Linear)、SVM(Polynomial)与SVM(RBF))对未超标与超标花生油进行判别分析,400~600 nm范围内的荧光强度光谱作为模型自变量,通过总分类正确率(CCR)、假阳性率(FPR)与假阴性率(FNR)对各模型效果进行评价,不同模型预测结果如表2所示。不同模型校正集和验证集预测效果有较大差别,其中SVM(RBF)预测效果最好,校正集CCR高达100%,FPR与FNR均为0,验证集CCR高达99.66%,FPR为0.60%,FNR为0。LDA与PLS-DA模型效果较优,CCR可以达到80%左右,验证集FNR为27%左右。SVM(Linear)与SVM(Polynomial)效果较差,CCR低于80%,验证集FNR超过33%。由SVM(RBF)建立的温度全局模型能够极准确地对各温度下的正常与AFB1超标花生油样本进行判别,相对于其他模型,其CCR提高了超过18%,验证集FNR提高了超过25%。表明径向基函数(RBF)作为一种可以解决非线性的映射问题的函数,可以有效对不同品牌、不同温度下花生油样本的正常与AFB1超标样本进行判别。在模型校正过程中,通过交叉验证,确定核函数最优参数组合为:Kernel参数=0.2,C惩罚参数=1,Support Vectors=1 721。

表2 不同建模方法全局模型效果
2.3.2 单温度模型
为了体现温度对AFB1预测模型的影响,并根据全局模型结果中SVM(RBF)效果最优,通过SVM(RBF)并基于各温度下的校正集样本建立判别模型。使用各分温度判别模型对本温度与其他4个温度下的验证集样本进行AFB1预测,预测结果如表3所示。

表3 不同温度下SVM(RBF)分温度判别模型预测AFB1效果
可以发现各分温度模型,对于预测本温度验证集效果极优,但是对于其他4个温度下的验证集预测效果极差。如10 ℃模型预测10 ℃验证集样本,正确率高达98.86%,FPR低至0,FNR低至2.67%,当该模型预测其他4个温度验证集样本时,CCR只有57%左右或者42%左右,且对于20 ℃与30 ℃验证集,其FNR超过98%,表明验证集样本中超标样本绝大部分被误判成正常样本,对于40 ℃与50 ℃验证集,其FPR为100%,表明正常样本全部被误判成超标样本。其他温度分温度模型预测结果也类似,但对于不同温度其FNR与FPR的规律不相同。可以得出结论,当使用LIF技术对花生油样本AFB1含量进行判别时,需要控制花生油温度一致,否则将会出现极大误差。若检测时,不能达到控制样品温度的条件,可以建立不同温度的全局模型,提高预测精度。
3 结论
本研究探索了温度对AFB1污染的10种不同品牌花生油LIF光谱信号的影响规律,结果表明随着温度的升高,光谱轮廓形状几乎没有变化,但荧光强度随着温度的升高会出现不同幅度降低,表明温度对AFB1特征荧光强度有较强干扰。使用5种不同建模方法建立全局模型,通过比较预测结果发现SVM(RBF)方法所建立的全局模型预测效果最优,其正确率超过99%,FNR为0,FPR为0.6%。在此基础上使用SVM(RBF)建立分温度模型,并使用各分温度模型分别对5个温度下验证集进行预测,结果表明各分温度模型在预测本温度验证集时,预测效果极优,正确率均高于97%,验证集FPR与FNR不超过5.5%,但在预测其他温度验证集时,效果极差。这表明使用LIF技术检测花生油AFB1含量时,当样本温度不一致时,通过建立全局模型能够提高判别模型的鲁棒性。为了更加符合实际应用要求,后续研究需要针对自然AFB1污染花生油样本进行检测,探索建立适用的、鲁棒性强的判别模型。

