嗜酸细胞浸润食管固有肌层诱导小鼠贲门失弛缓症样食管运动障碍
张凌云,赵威
(天津医科大学总医院消化科,天津 300052)
贲门失弛缓症(AC)是一种罕见的食管运动障碍性疾病,表现为体重减轻、吞咽困难、反流和胸痛。虽然发病率低,但是患病率并不低,贲门失弛缓症严重影响患者的生活质量[1]。它的发病机制至今仍然未知,目前现有的治疗方式如腹腔镜heller肌切开术(LHM)、球囊扩张术(PD)或经口内镜肌切开术(POEM)等都只能控制症状,而不能治愈疾病。虽短期效果好,但长期效果不理想,复发率高[2-3]。这使得研究AC的发病机制至关重要。
免疫介导的神经节炎可能诱发AC的食管肌层神经元损伤,包括嗜酸性粒细胞在内的各种炎症细胞参与了这一过程[4-6]。笔者还在AC患者POEM期间采集的肌肉标本中发现了食管固有肌层嗜酸性粒细胞浸润,并与神经节炎和肌神经元损伤有关[7]。由于嗜酸细胞释放的物质,如嗜酸细胞阳离子蛋白(ECP)和嗜酸细胞源性神经毒素(EDN)可损伤神经[8],而POEM前食管肌层内的嗜酸细胞浸润与治疗后预后不良有关[7]。笔者推测,食管平滑肌中的嗜酸性粒细胞浸润可能与AC的发病机制有密切的关系。然而,缺乏食管固有肌层嗜酸细胞浸润的动物模型是进一步研究的主要障碍。
在本研究中,笔者借鉴嗜酸性粒细胞食管炎(EoE)动物模型的方法制作了嗜酸性粒细胞浸润食管肌层的AC模型。此外,笔者还研究了抗原暴露时间与食管壁嗜酸粒细胞浸润程度、食管肌层神经元的丧失以及食管运动异常之间的关系。
1 材料和方法
1.1 实验材料BALB/c小鼠50只,雌雄各半,约4~6周龄。均由北京维多利亚实验动物技术有限公司提供。
1.2 方法
1.2.1 分组 适应性喂养1周后,使用抽签法将小鼠随机分为两组:对照组(n=20)和模型组(n=30)。分别在每个时间点(0 d、21 d、28 d)比较两组的体重、食管下括约肌压力(LESP)、食管宽度和食管排空情况。食管壁的嗜酸细胞数量和食管固有肌层神经元的数量也分别在基线和终点进行了组间比较。此外,还比较了模型组在每个时间点的食管运动和组织学参数。在模型组,在每个时间点,使用抽签法随机选择10只小鼠处死后进行食管病理检查。而在对照组中,也分别在基线和终点随机选择10只小鼠进行同样的检查。
1.2.2 模型构建 用3%的异氟烷吸入法对小鼠进行轻度麻醉,并腹腔注射含50 μg卵清蛋白(Sigma,美国)和1 mg明矾(Sigma,美国)的PBS溶液(50 μg/1.0 mg/0.5 mL),两次间隔14 d。从第15天开始,在吸入10%异氟烷麻醉的情况下,用微吸管向小鼠鼻内注射150 μg卵白蛋白(OVA)。上述操作每周进行3次,持续2周。除最后1次外,每次手术后1 h给予小鼠正常的饮用水和饮食。而对照组则给予与模型组相同体积的PBS溶液。
1.2.3 食管测压 吸入麻醉后,使用水灌注压力测量系统(MMS,荷兰)进行测压。记录小鼠的LESP。
1.2.4 食管排空 小鼠保持仰卧位,将0.1 mL碘海醇注入食管内。X光透视下最宽处为食管的宽度。然后,将另一个带改良针头的灌胃针将标记物(直径1 mm的不锈钢球,运城县康达钢球有限公司)从针尖释放到食管的胸骨角水平处。通过X射线透视并记录标记物通过食管的整个过程。标记物从胸骨角水平到贲门水平和通过贲门的时间分别被记录为食管通过时间和贲门通过时间。
1.2.5 组织学分析 将LES部位组织进行固定包埋,制成5 μm的切片,进行HE及免疫组化染色。对主要碱性蛋白(MBP)、嗜酸细胞阳离子蛋白(ECP)和SOX-10进行免疫组化染色,以分别识别活化的嗜酸性粒细胞和食管肌层神经元。
1.2.6 免疫组织化学评价 在光镜下进行免疫组化染色的半定量分析,通过免疫组织化学评分(IHS)进行评估。IHS的计算方法是将数量评分(1%~10%为1,11%~50%为2,51%~80%为3,81%~100%为4)与染色强度评分(0=阴性,1=弱,2=中等,3=强)相乘。IHS的范围从0到12。9~12分的IHS被认为是强免疫反应性,5~8分是中度,1~4分是弱,0分是阴性。
1.3 统计学处理 使用用SPSS 22.0进行分析。符合正态分布的计量资料以±s表示。组间和模型组内的比较酌情使用非配对t检验或Mann-Whitney U检验进行分析。嗜酸细胞计数与食管肌层神经元之间的相关性用Spearman等级相关进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠的一般状况和体重 模型组小鼠从第21天摄取的食物量显着减少,并表现出活动减少和毛发竖立等症状。随着OVA刺激时间的延长,模型组小鼠体重低于对照组,实验结束时(第28天,t=-2.569,P=0.019)差异有统计学意义(图1)。

图1 不同时间节点的体重Fig 1 The body weight at different time points
2.2 小鼠的LESP与对照组相比,模型组小鼠在基线和第21天时LESP无统计学差异,而在第28天时,模型组LESP比对照组高(t=2.187,P=0.042)。同时,模型组随着OVA刺激时间的延长,与基线状态相比,LESP在28 d时增高(t=3.082,P=0.004),见图2。

图2 不同时间节点的LESPFig 2 The LESP during different time points
2.3 食道排空和食道放射检查 与对照组相比,模型组的食管通过时间在第21天(t=2.540,P=0.017)和第28天(t=3.993,P=0.001)时明显延长,贲门通过时间在第28天时明显延长(t=2.168,P=0.044),食管宽度无显著差异。随着OVA刺激时间的延长,与基线状态相比,模型组在第21天(t=5.429,P<0.000 1)、第28天(t=7.149,P<0.000 1)时食管通过时间明显延长,在第28天时,贲门通过时间明显延长(t=2.227,P=0.032),而食管宽度在整个实验过程中无明显差异(图3)。

图3 食管排空和X线放射检查Fig 3 Esophageal emptying test and esophageal radiography
2.4 小鼠食管的组织病理学HE染色 两组在基线时食管内几乎没有嗜酸性粒细胞。实验结束时,模型组固有肌层(t=4.587,P<0.000 1)和黏膜层(t=8.417,P<0.000 1)的嗜酸性粒细胞数量均超过对照组。此外,模型组随着OVA刺激的延长,食管固有肌层第28天时(t=4.429,P=0.000 3)嗜酸性粒细胞较基线增加,黏膜层第21天(t=5.219,P<0.000 1)和第28天(t=4.623,P=0.000 2)较基线增多(图4、5)。

图4 食管组织中嗜酸性粒细胞数量Fig 4 Number of eosinophils in esophageal tissue
免疫组化染色发现,模型组食管肌层MBP阳性嗜酸性粒细胞散在或局灶分布,并伴有散在的ECP和EDN阳性颗粒。相反,在对照组中未观察到MBP、ECP和EDN的表达(图5)。

图5 第28天时对照组和模型组小鼠食管组织的嗜酸性粒细胞、神经细胞的免疫组织化学染色(400×)Fig 5 Immunohistochemical staining of the esophageal tissue for eosinophils,and nerve cells of mice in control and model group at D28(400×)
2.5 SOX-10显示的肌层神经元 基线时,两组无差异,第28天时,模型组肌层神经元减少(t=-4.283,P<0.000 1)。随着OVA暴露时间的延长,与基线相比,模型组的肌间神经元在第28天时(t=-4.328,P=0.000 4)明显减少(图6)。
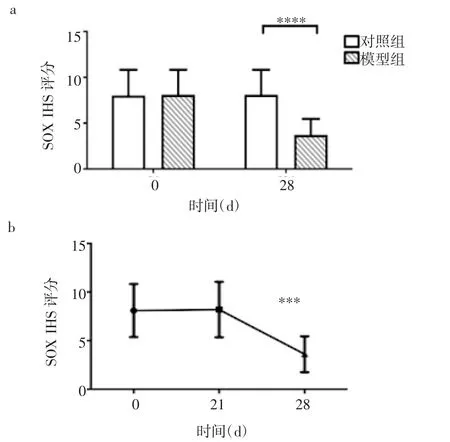
图6 SOX-10显示的肌间神经元Fig 6 Myenteric neurons indicated by Sox-10
2.6 肌层嗜酸性粒细胞浸润与肌间神经元的相关性 食管平滑肌层嗜酸性粒细胞的数量与Sox-10表达所表明的肌间神经元呈负相关(r=0.531)(图7)。

图7 肌层嗜酸性粒细胞浸润与肌间神经元的相关性Fig 7 The correlation between eosinophil infiltration and the myenteric neurons
3 讨论
在建立EoE动物模型的各种方法中[9-12],呼吸道抗原,如卵清蛋白(OVA),操作简单,成本低,易于控制实验条件[13]。然而,在上述小鼠模型中[9,12-13],嗜酸粒细胞浸润的深度主要在食管鳞状上皮、黏膜肌层和黏膜下层,这与以往AC的病理发现不一致。与传统的EoE小鼠模型相比,在致敏小鼠中,较长时间的呼吸道抗原暴露可诱发食管固有肌层的嗜酸细胞浸润、食管固有肌层神经元的丧失和AC样食管运动障碍。
在研究结束时,小鼠食管固有肌层出现嗜酸性粒细胞浸润,并出现类似AC的食管异常运动。此外,食管肌层中嗜酸性粒细胞的增加与食管神经元的减少呈正相关。由于X射线没有发现食管狭窄,因此可以合理推测,食管肌层中的嗜酸细胞浸润可能诱发神经元的减少和AC样食管运动障碍。这可能与嗜酸细胞分泌物释放,LES蠕动和松弛障碍,或细胞毒性嗜酸性粒细胞分泌物的释放,如ECP和EDN[8]有关。在本研究中,ECP和EDN均由免疫组化证实,支持该假设。今后,有必要在小鼠模型中进一步探讨相关的细胞毒性物质。
也有研究表明,OVA也可以诱导肥大细胞在食管壁的浸润[14]。Mavi等[15]发现,在一个跨基因的EoE小鼠模型中,食管运动功能障碍是由于肥大细胞炎症。但在以前的研究中,食管固有肌层中嗜酸细胞和肥大细胞的浸润程度以及肌层神经元的数量都未得到明确的体现。因此,以前的研究结果不能作为排除本研究中由嗜酸细胞浸润引起的AC样食管运动障碍的可能性的证据。
嗜酸性粒细胞和肥大细胞都可以在AC患者的食管固有肌层标本中发现[5,7,16]。除了上述不一致的证据外,一个临床证据甚至认为,由于食管运动的改善和嗜酸细胞浸润的减少,对AC使用泼尼松龙会导致吞咽困难的完全消失[17]。迄今为止,仍不清楚哪些炎症细胞对AC的发生贡献最大。在这个问题上,这种OVA诱导的小鼠模型具有类似AC的食管组织学和功能特征,为今后的研究提供了一个合适的平台。
嗜酸粒细胞浸润食道的深度与呼吸道抗原的类型和接触时间有关。简单的呼吸道过敏原(如狗、猫、蟑螂、尘螨和A.fumigatus)刺激,持续21~28 d,可以促进嗜酸细胞主要在上皮细胞中浸润[10,18]。然而,如果通过腹腔注射OVA使小鼠致敏,然后通过呼吸道接触OVA 14 d,可以发现嗜酸细胞浸润的趋势更深,大部分嗜酸细胞浸润到黏膜和黏膜下层[19]。为了支持以前的研究结果,笔者还观察了从21 d开始食管黏膜和黏膜下层的嗜酸细胞浸润情况。正如预期的那样,与黏膜中的嗜酸细胞相比,在OVA刺激的后期,嗜酸细胞出现在食管肌层中,表明长时间的OVA治疗有利于食管壁中嗜酸细胞浸润的加深。这可能是由于第一次致敏促进了特异性T和B细胞反应,以及随后的过敏性发展[19]。
笔者还发现食管壁中嗜酸细胞的数量随着OVA暴露时间的延长而增加。然而,与以前的研究相反,本研究中的增加曲线不是已往的“S”形或倒“V”形[18,20],而是线性的。这可能与所采用的方案不同有关,也可能与本研究中治疗时间不够长以达到嗜酸性粒细胞的峰值有关。为了弄清嗜酸细胞浸润的动力学,今后应进一步延长OVA治疗时间,同时增加停药观察期。
当然,笔者的研究也有局限性。虽然食管肌层的嗜酸细胞浸润比较突出,但不能排除同一部位有其他炎症细胞浸润的可能性。作为食管固有肌层嗜酸性粒细胞浸润的小鼠模型,虽然符合AC的功能和病理特征,但也可能是嗜酸细胞性食管肌炎(EoEM),与AC有一定程度的区别[21-22]。尽管如此,这是唯一一项专门研究固有肌层中的嗜酸细胞浸润以及它与小鼠食管肌层神经元和食管运动关系的研究。
综上所述,本研究表明,长期OVA刺激可能诱发食管固有肌层的嗜酸细胞浸润、肌层神经元的丧失和食管的AC样运动障碍。虽然还需要进一步验证,但本研究讨论的方法有助于探索嗜酸细胞浸润与AC之间的关系,甚至有助于未来相应的治疗方案。

