蜜蜂脂肪体的形态和功能研究进展
王荣华,孟丽峰,魏俏红,李建科
(中国农业科学院蜜蜂研究所,北京 100091)
蜜蜂是一种典型的资源昆虫,隶属于膜翅目(Hymenoptera)蜜蜂科(Apidae)蜜蜂属Apis。蜜蜂养殖所带来的各类蜂产品既具较高的经济价值,又能对人类健康发挥重要作用。同时,蜜蜂在农作物增产和生态系统的维护中发挥着重要作用,产生的生态价值令人瞩目。蜜蜂作为开花植物的关键传粉者,世界上主要农作物的85%都依赖于蜜蜂等昆虫授粉(Kleinetal.,2007)。在美国,受益于蜜蜂授粉的农作物产值超过总量的30%(Robinsonetal.,1989),蜜蜂授粉所产生的价值是其蜂产品价值的143倍(Levin,1983)。然而,在日益严重的环境污染、寄生虫和病原体等不利因素的影响下蜂群的生存受到了严峻挑战,这对环境稳态而言是一个不容忽视的威胁(van Engelsdorpetal.,2009)。为了应对这种担忧,科学家正在对其关键器官和组织展开研究,脂肪体正是其中之一。
脂肪体(fat body)存在于昆虫及如蛙类和蟾蜍类等的多数两栖类动物体内(朱玉芳,2001),昆虫脂肪体是一种结构相对简单,但生理功能非常复杂的组织。脂肪体在昆虫能量储存和利用中起着关键作用,它是营养物质的中央储存库,兼具生物合成和分解代谢活性(Law and Wells,1989)。脂肪体合成大部分血淋巴蛋白和循环代谢物。大多数昆虫的中间代谢发生在脂肪体中,包括脂肪和碳水化合物的代谢、蛋白质的合成以及氨基酸和氮的代谢。所有有机体都具备感知营养储备的生理系统,在昆虫体内营养感知的任务主要由脂肪体承担(Mirth and Riddiford,2007)。脂肪体是昆虫体内激素的重要靶器官,在激素和营养信号的整合中起着核心作用,监测和响应昆虫在不同发育阶段和不同环境条件下的生理需求,通过储存或释放生理活动所必需的物质和能量来协调昆虫的生长、滞育、体型、寿命、生物钟、取食行为和求偶行为(Gäde,2004;Schooleyetal.,2005)。脂肪体还能组织产生抗菌蛋白和多肽(Hoshizaki,2005;Ferrandonetal.,2007)并能以尿酸的形式排泄蜜蜂代谢过程中产生的氮(Keeley,1985)。此外,脂肪体内的多功能氧化酶还能发挥解毒功能(Enayatietal.,2005)。
因此,脂肪体已经成为研究代谢紊乱、免疫疾病和衰老机制的一个重要器官模型(Hsieh and Hsu,2011;Lietal.,2019)。本文对昆虫脂肪体的形态和功能的研究进展进行了综述,重点对蜜蜂脂肪体的形态及细胞组成、功能和作用等相关研究进行了归纳总结,以期为蜜蜂脂肪体的深入研究提供参考信息及一些新的思路。
1 脂肪体形态和细胞组成
1.1 脂肪体形态
昆虫脂肪体的功能与脊椎动物的肝脏十分类似,但又与肝脏固体的结构不同,它是一个动态、松散的组织(Law and Wells,1989)。脂肪体分布于昆虫腹部、胸部甚至头部腔体内,但位于肠道、马氏管和性腺附近的脂肪体最为发达(Deanetal.,1985)。如图1所示,脂肪体细胞来源于胚胎祖细胞,在胚胎发育过程中,这些细胞经历有丝分裂、分化和复制形成脂肪体组织(Edgar and Orr-Weaver,2001)。在幼虫期,脂肪体细胞摄取并储存了脂质、糖原和蛋白质等大量养分。变态过程中,脂肪体在形状、大小和功能上都会发生剧烈的变化,重新形成成虫脂肪体,这一过程被称为脂肪体重塑,包括自噬、凋亡和细胞解离过程,受激素和营养信号调节(Haunerland and Shirk,1995)。脂肪体重塑过程动员储存在幼虫脂肪体组织中的脂质和蛋白质,支持全变态昆虫成虫的生长和发育(Aguilaetal.,2007;Zhengetal.,2016)。成虫的脂肪体组织可以由剩余的幼虫脂肪体细胞重塑,也可以由成虫祖细胞重建(Lietal.,2019)。成虫脂肪体合成的卵黄原蛋白对蜂王的繁殖极为重要并与蜜蜂的社会行为紧密相关(Nilsenetal.,2011;Royetal.,2018)。此外,蜜蜂成虫脂肪体内存在的磁性氧化铁微粒很可能是机体的磁场感受器(Kuterbachetal.,1982)。

图1 蜜蜂脂肪体的发育和功能(仿Li等,2019)Fig.1 Development and function of honeybee fat body (adapted from Li et al.,2019)
昆虫脂肪体包括外周脂肪体(peripheral fat body/subcuticular fat body)和围脏脂肪体(perivisceral fat body/visceral fat body)两种类型。前者紧邻体壁下方,因此又称皮下脂肪体,后者包围消化道,占据体腔的大部分空间,因此又称体腔脂肪体。围脏脂肪体具有生物合成机能,而外周脂肪体则更多地承担物质贮备的职能(Romaetal.,2008)。较围脏脂肪体而言,外周脂肪体结构紧凑,这种脂肪体细胞的紧密排列有利于细胞间的物质交流和信号传输(de Oliveira and Cruz-Landim,2003)。通常情况下脂肪体浸于血淋巴中,最大程度地与血淋巴接触。随时获取血淋巴对于昆虫及时地适应能量循环中物质浓度的变化来说是至关重要的,这在极端能量需求的情况下尤其关键(Keeley,1985)。血淋巴和脂肪体细胞之间紧密接触的布置造就了一个非常适合昆虫的独特生理系统。
1.2 脂肪体的细胞组成
蜜蜂脂肪体中常见3种细胞:营养细胞(trophocyte)、尿酸盐细胞(urocyte)和绛色细胞(oenocyte)。尿酸盐细胞由营养细胞分化而来,这种分化不仅取决于脂肪体细胞的定位和功能,而且还随着昆虫的发育而变化(Deanetal.,1985;Haunerland and Shirk,1995)。
1.2.1营养细胞:营养细胞是在昆虫脂肪体中占数量优势的细胞,由中胚层发育而来,也是许多昆虫脂肪体的唯一细胞,因此营养细胞又称为脂肪细胞。但值得注意的是,有学者指出用脂肪这种功能简单的代谢沉积物来描述功能多样的营养细胞并不恰当(de Oliveira and Cruz-Landim,2003)。
营养细胞内存在大量脂滴(de Oliveira and Cruz-Landim,2003),脂滴作为营养细胞内特殊的细胞器,不仅是被动的脂类储存库,而且在能量代谢中起着关键作用(Olofssonetal.,2009)。营养细胞含有大量的脂肪、蛋白质和糖原等颗粒,它们都是由营养细胞利用血淋巴运送来的物质为原料合成并储存在营养细胞中的,脂肪体因此得名昆虫物质和能量的制造工厂与储存仓库。营养细胞之间通过桥粒连接(desmosome junction)和间隙连接(gap junction)结合在一起,形成带状或片状组织。细胞质外被覆一层由营养细胞产生的基膜(basal lamina),成为细胞与血淋巴之间的通透性屏障(Deanetal.,1985)。
营养细胞的形态和作用因昆虫发育阶段的不同而不同。当昆虫由幼虫期向成虫期转化时,脂肪体中营养细胞的形态也会随之发生巨大的变化(Anand and Lorenz,2008)。蜜蜂营养细胞的尺寸在幼虫期达到最大,成为体内最大的细胞(Marxetal.,1987)。在幼虫期末,营养细胞内的大部分空间被脂滴、糖原和蛋白质颗粒占据(Deanetal.,1985)。成虫营养细胞较幼虫而言内质网发育较好,在生物合成方面比幼虫更活跃(Cruz-Landim,1974)。蜜蜂作为一种社会型昆虫,蜂群中不同种性的营养细胞在形态和功能上也有所不同,这种差异主要由它们的生殖潜力决定(Stracheckaetal.,2021)。蜂王的脂肪体组织比工蜂发育得更好,营养细胞更大,液泡化程度更高,细胞核更不规则,蛋白质合成增加(Cruz-Landim,1985;Romaetal.,2005,2006a,2006b;Stracheckaetal.,2021),雄蜂营养细胞的分化程度较低(Locke,1984)。
1.2.2尿酸盐细胞:尿酸盐细胞由部分营养细胞分化而来,目前未有报道尿酸盐细胞的分裂,常见于蜚蠊和蜂类幼虫(蜜蜂和胡蜂)的脂肪体中。区别于营养细胞,尿酸盐细胞专门储存尿酸盐颗粒等排泄物(Keeley,1985),这些尿酸盐颗粒主要是蛋白质降解或核酸代谢产生的废物(Tojoetal.,1978)。与营养细胞相比,尿酸盐细胞体积较大且细胞中线粒体较少并存在大的尿酸盐晶体颗粒(Tojoetal.1978;Locke,1984)。有研究表明,部分昆虫尿酸盐细胞储存的尿酸可以在饥饿条件下启动分解代谢,为氨基酸合成提供氮源(Mullins and Cochran,1974;Cochran,1985)。蜜蜂尿酸盐细胞的细胞核中含有大量的染色质,在蜜蜂幼虫期结束到成虫期开始的这段时间内由于其马氏管无法代谢废物,尿酸盐细胞广泛存在于蜜蜂脂肪体中(Chobotow and Strachecka,2013)。同时,在蜜蜂生命的所有阶段均存在着介于营养细胞和尿酸盐细胞之间、具有中间特征的细胞,这种细胞含有一些尿酸盐颗粒,是从血淋巴吸收到营养细胞中的蛋白质代谢物(Cruz-Landim,2000)。
1.2.3绛色细胞:绛色细胞源于外胚层,是一种大型细胞,散布于营养细胞间,是大部分昆虫脂肪体内第二丰富的细胞(Skowroneketal.,2021)。蜜蜂绛色细胞的颜色通常比营养细胞更深,且随着蜜蜂日龄的增长而加深(Chobotow and Strachecka,2013)。在蜜蜂工蜂中,绛色细胞的数量与营养细胞的数量相近,而在蜂王中,绛色细胞比营养细胞多;蜂王蛹的绛色细胞的直径最小8~15 μm,最大176 μm,一般为60~100 μm(黄少康,2011)。绛色细胞内原生质紧密,有发育良好的光面内质网,但无泡状结构。绛色细胞在脂质、蛋白质和碳氢化合物的合成中发挥重要作用(Lockey,1988),还可能在昆虫饥饿条件下进行脂质动员(Gutierrezetal.,2007)。
2 脂肪体的功能
脂肪体形态和功能的深入研究为拓宽其在昆虫生命活动中的功能和作用的了解提供了助力。脂肪体最主要的功能是能量物质的储存和代谢。当单糖、氨基酸和脂肪酸等营养物质被中肠吸收进入血淋巴后,在脂肪体中多酶复合体的作用下,转换成海藻糖、糖原、脂肪、蛋白质等储存于脂肪体中。许多重要的蛋白质也是在脂肪体中合成的,如载脂蛋白(apolipophorin)、卵黄原蛋白(vitellogenin,Vg)、储存蛋白(hexamerin)、热休克蛋白(heat shock protein)、抗菌蛋白(antibacterial protein)和抗菌肽(antimicrobial peptide)等(Feitosaetal.,2006;Cardosoetal.,2010)。脂肪体具有各种能量和物质相互转换的酶系,通过磷酸戊糖途径,各种单糖经由转酮基和转醛基作用转变成葡萄糖合成糖原,或通过代谢转换合成甘油三酯进行储存,也可合成海藻糖进入血淋巴,维持血糖含量。在大量消耗糖时,脂肪体又可以通过糖异生过程,将氨基酸转变生成必需的糖类物质。储存在脂肪体内的甘油三酯在脂肪动员激素的作用下,可迅速转化成甘油二酯释放入血淋巴中。脂肪体内的糖原可以被分解成葡萄糖,用于合成几丁质。
脂肪体作为蜜蜂重要的中间代谢器官,除了进行结构物质和能源物质的代谢外,还承担代谢水的供应并合成嘌呤和嘧啶(王荫长,2004)。同时,脂肪体还参与昆虫免疫反应(Casteelsetal.,1993;Evans and Lopez;2004,Bianetal.,2005;Gutierrezetal.,2007)、在幼虫期以贮存排泄的方式排出体内代谢产生的废物、通过调节血淋巴中的物质浓度积极参与昆虫的稳态维持(Haunerland and Shirk,1995)。脂肪体能发挥解毒作用,有机杀虫剂进入虫体后能在脂肪体内多功能氧化酶的作用下分解,并通过马氏管和直肠排出体外(Enayatietal.,2005)。脂肪体可以利用贮存的能量物质生成甘油、山梨糖醇等来降低过冷却点,提高昆虫的抗寒能力(Storey and Storey,1988)。脂肪体还充当了蜜蜂的磁场感受器,蜜蜂脂肪体细胞沉积的磁性氧化铁微粒受地球磁场和其他电磁信号的影响(Gouldetal.,1978)。脂肪体填充在各器官之间,能防止体腔内各器官移位以及和体壁产生的磨擦,对器官起到了良好的保护作用(冯丽春和沈卫德,2015)。
2.1 脂肪体的物质储备和利用
脂肪体的基本功能是储存脂肪、蛋白质和碳水化合物,这些功能也是变态昆虫生命活动的基础。营养细胞不仅能从血淋巴中吸收并储存代谢物,还能在细胞内进行营养物质的合成并输送到血淋巴。所以,脂肪体是昆虫中间代谢的主要器官(Thomsen and Thomsen,1978;Wyatt,1980;Gutierrezetal.,2007)。幼虫积累的能量至少要满足变态发育时的能量消耗才能使昆虫在变态过程中生存下来(Mirth and Riddiford,2007),脂肪体在幼虫摄食阶段积累的能量在用于变态发育消耗的同时也为羽化后的成虫提供能量储备。幼虫体内储存的营养对成虫后的生活有重要影响,幼虫时储能较少会导致羽化后的成虫繁殖力下降(Briegel,1990)。
意大利蜜蜂Apismelliferaligustica幼虫阶段虫体生长旺盛,脂肪体细胞数量快速增加,在幼虫2-3日龄时出现一个峰值,至蛹发育的第3天时趋于稳定;同时,幼虫阶段脂肪体细胞的体积增大了约2倍,期间脂肪体细胞中间代谢活跃,储存蛋白质、脂类、糖原等化合物为变态发育做准备(李兆英,2013),这些特点同其他膜翅目(Romaetal.,2008)以及双翅目(Scottetal.,2004)昆虫类似,此时的脂肪体为接下来的幼虫发育储备了充足的物质和能量。开始化蛹时,营养细胞内蛋白质颗粒急剧増长,充满细胞;蛹期时脂肪体细胞的胞膜破裂,将蛋白质和糖原释放到血淋巴中,为迅速生长的蜂蛹提供营养(马德风,1993)。
进入成虫期后,脂肪体形态及营养物质的存量随蜜蜂劳动分工和季节的变化而变化。蜜蜂营养细胞中的蛋白质是合成幼虫饲粮蜂王浆的原料,从事哺育工作的青年工蜂脂肪体细胞充满脂肪,蛋白质贮存极少;随着日龄的增长,成为采集蜂的大龄工蜂失去一半的脂肪(Toth and Robinson,2005),脂肪体细胞中蛋白质的含量逐渐増加,与此对应,较外勤蜂而言内勤蜂日常消耗更多的花粉(黄少康,2011)。同时,脂肪体脂质储存作用于工蜂劳动分工的转化,脂质储存较少的工蜂能更早转变为采集蜂(Tothetal.,2005)。对比5,12,19和25日龄成年工蜂的营养细胞发现,5日龄的细胞横截面积最小,12日龄的最大,19日龄(采集蜂)后逐渐下降,降至25日龄时稳定;对比它们绛色细胞的大小,也是12日龄的最大,19和25日龄的减小(黄少康,2011)。蜜蜂在冬季的脂肪体重量、营养细胞大小和卵黄原蛋白产量高于夏季的(Koubováetal.,2021)。夏季的哺育蜂脂肪体蛋白质含量较少且寿命只有几十天;冬季的蜜蜂,没有或很少饲喂幼虫,脂肪体中蛋白质的含量较高,寿命较长,在冬天可生活数月(马德风,1993)。另外,工蜂与雄蜂、蜂王脂肪体中的物质储备也存在区别,包括不同级型间脂肪体蛋白质种类和数量的差异(黄少康,2011)。
营养条件对蜜蜂脂肪体的发育起决定性作用,当食物匮乏时,蜜蜂通过调动脂肪体内的营养来维持生命活动(Kelleretal.,2005;Tothetal.,2005;Corby-Harrisetal.,2019)。早春时越冬蜂将脂肪体贮存的营养物质逐渐耗尽,这时如果蜂群缺乏花粉贮备,由于蜜蜂脂肪体所含的蛋白质极少,工蜂无法生产蜂王浆和饲喂幼虫(马德风,1993)。
昆虫成虫在非觅食期依靠脂肪体的能量储备来维持生命活动,在觅食期利用食物供应来改善其脂肪体能量储备,尤其是在为繁殖做准备的时候。卵子的发育涉及到从脂肪体到卵巢能量储备的大规模调动,昆虫幼虫阶段的脂肪体能量储备对卵子的发生至关重要(Shiaoetal.,2008)。昆虫在飞行时代谢率会增加50~100倍,大多数昆虫飞行过程中消耗的能量由脂肪体负责补充(Beenakkersetal.,1984),但蜜蜂区别于其他昆虫,专门利用碳水化合物为飞行提供动力,这些碳水化合物来自植物中的糖分而不是脂肪体中的储备(Suarezetal.,2005)。
2.1.1碳水化合物:碳水化合物以主要以葡萄糖聚合物,即糖原(glycogen)的形式积累,大多数昆虫脂肪体中糖原可占干重的10%~25%,蜜蜂脂肪体内糖原含量较高,占比33%(Chobotow and Strachecka,2013)。来源于食物中碳水化合物或氨基酸的UDP-葡萄糖在糖原合成酶的作用下合成糖原,糖原的转化消耗了葡萄糖总量的35%(Steele,1982)。在意大利蜜蜂工蜂脂肪体中,糖原合成酶和胞液的糖原颗粒结合在一起,糖原合成在糖原颗粒上进行(王荫长,2004)。UDP-葡萄糖也可用于合成海藻糖,海藻糖是血淋巴中的循环糖(Thompson,2003),当脂肪体海藻糖达到一定浓度时其合成被抑制并转而将UDP葡萄糖用于糖原合成(Friedman,1978)。研究发现,对蜜蜂微孢子虫Nosemaapis有抗性的蜜蜂较其他蜜蜂在细胞中表现出更高的海藻糖水平(Romaetal.,2010)。
作为昆虫血液淋巴中最重要的糖,糖原可根据需要轻易地降解用作糖酵解底物(Steele,1982)。同时,糖原被用来合成几丁质(Lockey,1988)和糖醇,糖醇能够帮助昆虫适应寒冷(Storey,1997)和干旱(Watanabeetal.,2002)。成虫脂肪体组织中,糖原的含量在很大程度上随着昆虫的摄食、活动和季节、生活、生理条件的变化而产生波动(Steele,1982;Keeley,1985;Timmermann and Briegel,1999;Lorenz and Anand,2004;Anand and Lorenz,2008)。在昆虫变态发育时,糖原资源几乎被完全利用,而羽化后的新成虫一旦开始进食就会重新储存糖原(Ziegler,1991;Lorenz and Anand,2004)。
2.1.2脂质:脂质主要以无水甘油三酯(anhydrous triglycerides)的形式存在,由食物中的碳水化合物、脂肪酸或蛋白质合成,是昆虫中含量最高、贮能最多的物质,可作为昆虫持续需能期间的主要能源(Canavosoetal.,2001)。类似于脊椎动物组织中脂肪的生成,脂肪体内甘油三酯 (triglyceride,TG)的直接前体是甘油二脂,甘油二脂酰基转移酶(DGAT2)在脂肪酰基辅酶A(fatty acyl-CoA)的催化下使甘油二脂酯化(Athenstaedt and Daum,2006)。此过程中脂肪酸被脂肪体迅速吸收且并入甘油三酯,少量并入其他甘油和磷脂,昆虫的发育阶段和摄食情况决定了脂肪体并入脂肪酸的多寡(Lorenz,2001;Athenstaedt and Daum,2006;Pontesetal.,2008)。
脂肪体可塑性极强,储存的甘油三酯通常占脂肪体干重的70%以上,通过β氧化生产能量(Ziegler,1991;Lorenz and Anand,2004;Athenstaedt and Daum,2006)。甘油三酯产生并储存在营养细胞的脂滴中(Olofssonetal.,2009),脂肪体由葡萄糖合成脂肪的能力远高于糖原合成能力,脂肪体获得的葡萄糖有超过一半参与脂肪的合成,所以在昆虫脂肪体中脂肪含量高于糖原(Arrese and Soulages,2010)。同时,甘油三酯的热量也高于糖原,并且在氧化时产生约为糖原两倍的代谢水(Downer and Matthews,1976)。脂肪储备是昆虫在滞育期间用来满足其能量需求的最重要的储备(Hahn and Denlinger,2007),为发育中的胚胎提供能量(Ziegler and van Antwerpen,2006),并为部分昆虫长时间的飞行提供燃料(Beenakkersetal.,1984)。脂质储备对于昆虫的其他生理功能也是必不可少的,脂肪酸是合成信息素的前体,磷脂和蜡质的合成需要大量的脂肪酸(Lockey,1988;Stanley,2006)。膜翅目和双翅目的几种寄生蜂在成虫期无法储存脂肪,虽然这些物种以富含糖分的食物(如蜂蜜或花蜜)为食,但它们不能将多余的碳水化合物转化为脂质,这种特殊情况背后的生理机制尚不清楚(Visser and Ellers,2008)。
2.1.3蛋白质:脂肪体中的部分蛋白质颗粒源于胞饮作用,营养细胞选择性地从血淋巴中吸收并存储蛋白质。选择性吸收是由细胞膜表面的特定蛋白质连接引起的,因此它们只结合有膜受体的蛋白质(Locke,1984)。同时,脂肪体合成并分泌大量蛋白质,例如作为氨基酸储存库的昆虫贮存蛋白(Haunerland and Shirk,1995)、负责脂质运输的载脂蛋白和作用于卵子成熟的卵黄原蛋白等(Keeley,1985)。蛋白质在取食期幼虫脂肪体内合成后释放到血淋巴中,在末龄幼虫期蛋白质含量达到最高水平;当昆虫准备化蛹时,脂肪体中蛋白质合成中断,分泌到血淋巴的蛋白质被重吸收并以颗粒形式储存在细胞中(Haunerlandetal.,1990)。蜕皮时,蛋白质颗粒再次进入血淋巴,为成虫器官发育和新组织的形成提供蛋白质和氨基酸(Ancsin and Wyatt,1996)。免疫蛋白也能在昆虫脂肪体中合成,蜜蜂脂肪体合成的免疫蛋白在蜜蜂后天免疫中发挥重要作用(Fries,1988)。值得一提的是,蜜蜂能产生特殊的抗菌蛋白和多肽以应对植物源性病原体(Darkin-Rattrayetal.,1996;Stracheckaetal.,2018)。
卵黄蛋白的前体卵黄原蛋白是营养细胞产生的一种重要蛋白质,具有抗氧化和促进免疫系统的正常运作的功能。同时,卵母细胞摄取卵黄原蛋白是影响昆虫卵子成熟的关键因素。卵黄原蛋白通过血液淋巴进入发育中的卵母细胞(Haunerland and Shirk,1995),血淋巴中的卵黄原蛋白浓度由脂肪体中卵黄原蛋白的合成速率和卵母细胞的摄入速率决定(Mazzinietal.,1989)。对于大多数社会昆虫来说,卵黄原蛋白仅由可育的雌性产生。然而,在蜜蜂和蚂蚁中,工蜂(工蚁)和雄蜂(雄蚁)也可以合成卵黄原蛋白(Trenczeketal.,1989),对蜜蜂而言,卵黄原蛋白使蜂群产生了不同级型的社会行为。蜜蜂工蜂体内卵黄原蛋白的含量随季节变化,在秋季增加冬季减少(Flurietal.,1982)。但即使蜜蜂工蜂脂肪体能产生卵黄原蛋白,与蜂王相比也只是后者产生卵黄原蛋白的1/20(Engelsetal.,1990)。营养细胞还生产载脂蛋白,载脂蛋白对于昆虫信息素和黄体激素的包装、储存、运输起着重要作用(Trowell,1992),卵母细胞中积累的大多数脂质由载脂蛋白从脂肪体运送到卵巢(Ziegleretal.,2001;Ziegler and van Antwerpen,2006)。
值得注意的是,造成蜜蜂孢子虫病的蜜蜂微孢子虫抑制了工蜂脂肪体的发育,导致蜜蜂免疫蛋白无法正常合成(Fries,1988)。同时,对蜜蜂瓦螨Varroa寄生虫病的研究指出,瓦螨摄取的主要宿主组织是蜜蜂的脂肪体,脂肪体组织的损失是造成蜂群健康状况严重下降的主要原因(Ramseyetal.,2019)。
2.1.4磁性氧化铁微粒:蜜蜂是最早在脂肪体中发现磁性氧化铁(Fe3O4)微粒的昆虫之一(Gouldetal.,1978;Kuterbachetal.,1982),黄腰虎头蜂Vespaformosana(Hsu,2004)中也发现了类似的微粒。蜜蜂脂肪体营养细胞磁性氧化铁微粒积累迅速,出房5 d后就达到最高水平(Shawetal.,2018)。对于工蜂来说,含有磁性氧化铁微粒的营养细胞很可能是机体的磁场感受器,在地磁的影响下作用于工蜂的出巢采集和以舞蹈为载体的信息传递。
2.2 脂肪体激素作用和营养信号整合
脂肪体在昆虫激素和营养信号的整合中起着核心作用,是昆虫发育和行为调控过程中各种激素和营养信号的交换中心,这些激素和营养信号形成了一个复杂而有效的调控网络,用于调控昆虫的生命活动。
2.2.1激素和营养信号调控脂肪体发育:脂肪体形态在昆虫的整个生命周期中经历了一系列剧烈的变化,在激素和营养信号的调控下,脂肪体细胞在胚胎发育过程中经历有丝分裂,在幼虫阶段经历复制,在变态过程中经历重塑。脂肪体细胞在发育过程中的有丝分裂和复制由激素和营养信号协同调控(表1)。

表1 激素和营养信号调控昆虫脂肪体细胞有丝分裂和复制Table 1 Hormones and nutritional signals regulate the mitosis and replication of insect fat body cells
脂肪体的重塑包括幼虫脂肪体细胞的程序性死亡(programmed cell death,PCD)以及成虫脂肪体组织的形成(Nelliotetal.,2006)。脂肪体细胞的程序性死亡主要有两种类型:Ⅰ型PCD细胞凋亡(apoptosis)和Ⅱ型PCD细胞自噬(autophagy)。凋亡由caspase级联反应引起,导致脂肪体细胞结构快速破坏(Ryoo and Baehrecke,2010)。自噬由一系列相关基因调控,产生了一个高度可控的自我降解过程。昆虫化蛹过程中脂肪体的自噬由激素和营养信号协同调控(表2),20-羟基蜕皮激素(20-hydroxyecdysone,20E)和保幼激素(juvenile hormone,JH)对脂肪体细胞重塑作用强烈(Collins,1969)。20E是双翅目昆虫体内的主要调节激素,昆虫的主要发育转变由其引起,20E与其核受体复合物ECR/USP一起触发caspase级联反应从而诱导细胞程序性死亡消除幼虫组织,促进成虫组织的形成(Yamanakaetal.,2013)。在工蜂体内,蜕皮激素主要由大脑合成和分泌,并在大脑和脂肪体内转化为20E(Yamazakietal.,2011)。JH是一种结构独特的倍半萜类激素,仅见于节肢动物(Gilbertetal.,1996)。JH对蜜蜂意义重大,在蜜蜂的生长发育、级型分化及寿命等方面具有显著的调控作用(Hartfelder and Engels,1998)。JH控制营养细胞中蛋白质颗粒的存在,在变态期间,保幼激素和它的类似物保幼激素Ⅰ(JH-I)引起营养细胞的液泡化和变态的加速(Engelmann,1976;Coubleetal.,1979;Cotton and Anstee,1991)。在蜜蜂的脂肪体自噬过程中JH浓度的增加减缓了营养细胞中线粒体数量的增加和高尔基体面积的减少;20E减缓了核体积的减少,诱导了细胞质中空泡和蛋白质颗粒的增加以及自噬结构的出现(Locke,1980)。

表2 激素和营养信号调控昆虫脂肪体自噬Table 2 Regulation of autophagy in insect fat body by hormones and nutritional signals
2.2.2激素和营养信号调控营养物质代谢:脂肪体内营养物质的合成和分解代谢受激素和营养信号调控(表3)。脂肪体能量动员主要受脂动激素(adipokinetic hormone,AKH)家族和胰岛素样蛋白(insulin-like/related peptides,ILPs)家族的控制。AKH在结构和功能上与哺乳动物胰高血糖素相似,ILPs包括胰岛素(insulin)和胰岛素样生长因子(insulin-like growth factor)。ILPs和AKH二者共同作用,平衡脂肪体组织中的营养储存和能量动员(Gäde,2004)。胰岛素/胰岛素样生长因子信号(insulin/IGF signaling,IIS)和20E是通过调节生长速率和生长周期来决定昆虫最终身体大小的两个主要因素(Nijhout and Callier,2015)。IIS上调雷帕霉素标靶(target of rapamycin,TOR)通路(Edgar,2006)和JH(Coronaetal.,2007)的胞内靶点。另外,CREB活性调节转导子1(transducer of regulated CREB activity 1,TORC1)和AMP活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)是脂肪体组织中两种主要的营养感受器。AMPK活性被糖饥饿诱导,TORC1被氨基酸和IIS激活,被AMPK抑制(Chang and Neufeld,2009)。
2.2.3激素和营养信号调控生殖及劳动分工:许多研究表明了激素和营养信号调控影响着蜜蜂表型可塑性的不同方面。脂肪体通过合成和分泌卵黄原蛋白和其他雌性生殖所需的蛋白质调节蜜蜂生殖。所有昆虫的雌性生殖都需要IIS和营养信号来诱导卵黄发生(Royetal.,2018)。JH 拮抗20E信号,防止中期幼虫早熟变态(Liuetal.,2018)。胰岛素信号传导与调节蜜蜂的级型分化紧密相关(Wheeleretal.,2006;Pateletal.,2007)。
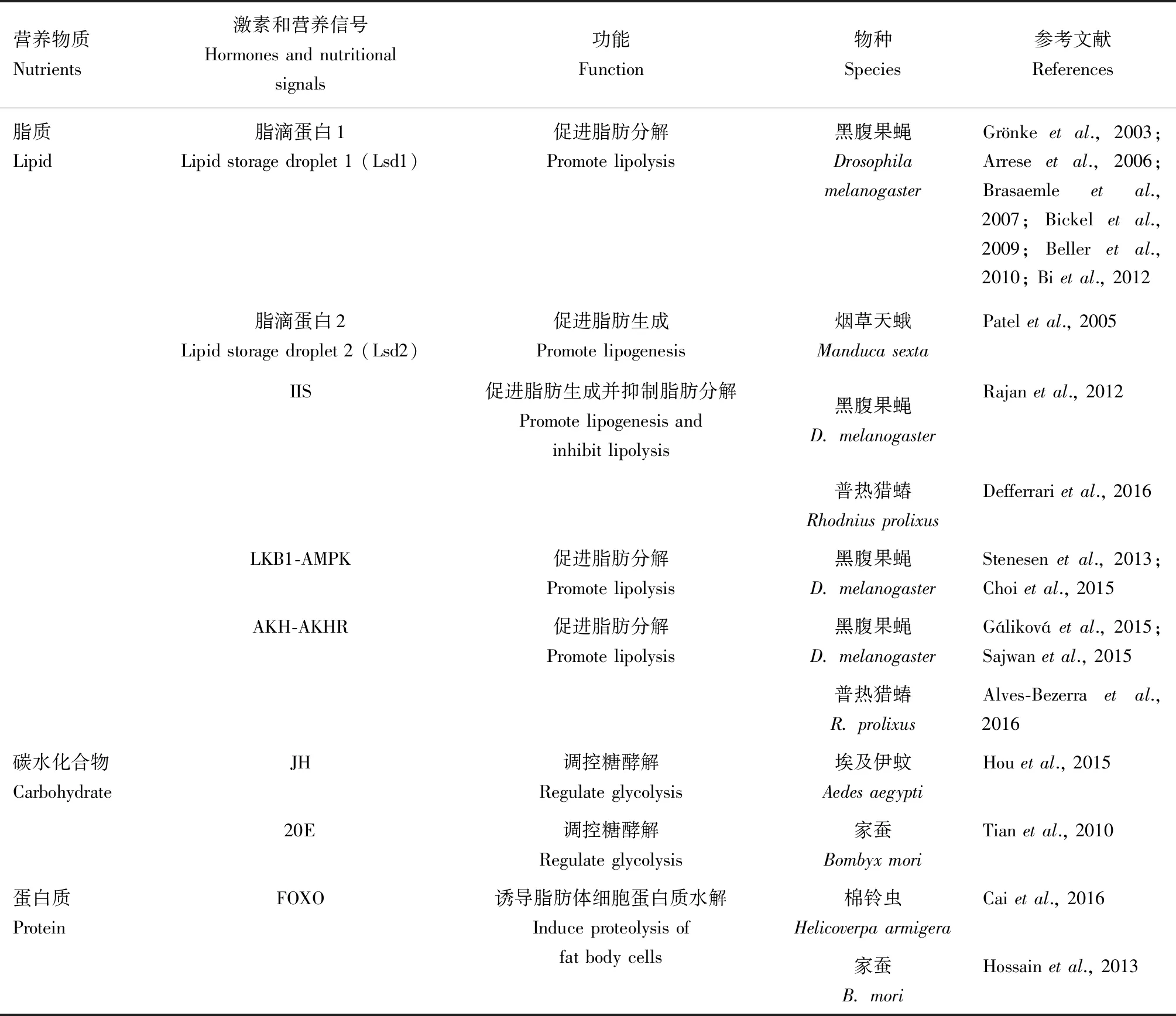
表3 激素和营养信号调控昆虫脂肪体营养储备和代谢Table 3 Regulation of nutritional reserve and metabolism in insect fat body by hormones and nutritional signals
此外,研究表明蜜蜂的脂肪体营养信号还能作用于蜜蜂的劳动分工。在大多数动物体内,ILPs通常在高水平的营养物质环境下产生(Mortonetal.,2006)。值得注意的是,在工蜂体内,虽然储存的营养物质影响胰岛素信号基因的表达,但它们的作用方向截然相反:脂质存量较高的蜜蜂ILPs表达较低。区别于传统胰岛素信号通路的稳态机制,这种相反的作用可能反映了采集蜂相对于哺育蜂脂质储备调节点的变化(Amentetal.,2008)。但是,在蜜蜂的整个生命周期中,“反向”IIS基因的表达并不是常态。在幼虫发育过程中,营养和胰岛素信号之间成传统的稳态关系(Wheeleretal.,2006)。这些结果表明,蜜蜂胰岛素信号通路的特殊变化可能是调节成年工蜂的劳动分工的因素之一。另有研究表明,采集蜂脂肪体胰岛素相关转录物较哺育蜂上调(Coronaetal.,2007),TOR通路能影响工蜂开始觅食的时间并具有季节依赖性(Amentetal.,2008)。JH加速了工蜂的行为成熟,促成劳动分工的转变(Robinsonetal.,1989;Sullivanetal.,2000),并导致了能量代谢和脑神经水平上的变化(Sullivanetal.,2003;Velardeetal.,2009)。同时,蜜蜂脂肪体通过分泌卵黄原蛋白来抑制JH信号和内勤蜂的采集行为(Amdam and Omholt,2003;Nilsenetal.,2011)。
3 小结与展望
脂肪体作为蜜蜂中间代谢的核心,在营养信号整合过程中发挥着关键作用。当前关于昆虫脂肪体营养信号方面的研究对象主要为果蝇和家蚕等物种,蜜蜂脂肪体营养信号通路并未引起足够的关注。有研究证实,蜜蜂工蜂胰岛素信号通路不同于传统的稳态机制并在蜜蜂的劳动分工中发挥作用(Amentetal.,2008)。基于此,蜜蜂其他脂肪体激素和营养信号通路与果蝇、家蚕等传统模式昆虫的区别以及其可能在蜜蜂生命活动中发挥的特殊作用及机理还有待进一步研究。
脂肪体能量状态与蜂王浆的生产息息相关(Corby-Harrisetal.,2019),从脂肪体的能量储存、动员和营养信号整合等角度切入可以使研究者更好地辨析脂肪体调控蜂产品生产的分子机制,并在生产实践中围绕脂肪体相关指标选育蜂蜜、蜂王浆等高产性状的良种。同时,蜜蜂在生态稳态中的价值不容小觑。目前很多关于蜜蜂病敌害的研究显示脂肪体在蜜蜂病理过程中发生了相应的变化(Fries,1988;Ramseyetal.,2019)。因此,关注脂肪体在蜜蜂病理过程中的变化规律可能有助于我们加深对蜜蜂病敌害的了解,更好地进行防治。
昆虫体内甘油三酯的储存和动员在过程上的保守使得昆虫脂肪代谢较脊椎动物简单,对昆虫脂肪体的研究将为研究者提高对脂肪代谢的深入了解提供优势,以果蝇为代表的模式生物已被用于研究肥胖等人类疾病(Bharucha,2009)。同时,脂肪体在昆虫中间代谢、营养信号整合和免疫中的重要作用已经让研究者意识到脂肪体模型在研究代谢紊乱和免疫疾病方面的价值。蜜蜂因其快速的繁殖能力、表型可塑性、特殊的群体行为和孤雌生殖等特点,被科学界高度关注并作为模式生物广泛用于社会行为学(Robinsonetal.,2005)、发育生物学(Hooveretal.,2003)、神经生物学(Heisenberg,2003)、遗传学(Page and Robinson,1991;Page and Peng,2001)、免疫学(Evansetal.,2006)和衰老(Amdam and Omholt,2002)等方面的研究。由此可见,蜜蜂脂肪体模型在研究脂肪代谢、代谢紊乱和免疫疾病等方面同样具有巨大的潜力,可以扩大我们对于昆虫能量代谢机制的认识,帮助回答与人类健康有关的问题。

