基于EST-SSR标记鉴定猴耳环自由授粉的全同胞子代
李丹丹,翁启杰,甘四明,3,周长品,黄世能,李 梅*
(1.中国林业科学研究院热带林业研究所, 热带林业研究国家林业和草原局重点实验室,广东 广州 510520;2.南京林业大学林学院, 江苏 南京 210037;3.中国林业科学研究院,林木遗传育种国家重点实验室, 北京 100091)
猴耳环(Archidendronclypearia)是豆科(Leguminosae)云实亚科(Caesalpinioideae)猴耳环属(Archidendron)的重要药用树种,广泛分布于亚洲热带地区[1]。其药用价值极高,可治疗上呼吸道感染、急性咽炎和扁桃体炎等疾病,也是治疗阿尔茨海默病等神经退行性疾病的有效候选药物[2-5]。此外,猴耳环木材可用于制作家具和生产纸浆,药渣还可制备高密度复合材料[4]。但是,猴耳环野生资源受人为活动的严重干扰,加之其天然更新能力较弱,导致现存自然群体多为小或极小种群[6]。
全同胞家系在遗传和育种研究中应用广泛,如配合力、遗传力和遗传增益的估算以及遗传图谱构建和数量性状位点定位等[7]。全同胞家系常常通过控制授粉获得,但对于树体高大的林木,控制授粉存在诸多不便,而通过分子标记鉴定自由授粉的子代来自母本附近某个或某几个父本则可快速构建全同胞家系。并且,父本的确定也可为天然群体的花粉传播范围和异交率等提供有用信息。目前,已利用分子标记对多个树种的自由授粉子代进行了父本鉴定而获得全同胞家系,如美洲黑杨(Populusdeltoides)[8]和尾叶桉(Eucalyptusurophylla)[9]等。
简单序列重复(simple sequence repeats,SSR)标记是以2~6个核苷酸为重复单位的串联重复序列,在基因组中数量丰富,具有多态性高、稳定性和重复性好、共显性等优点,已被广泛应用于植物多个领域的研究,包括花粉(基因)流和父本分析[10-12]。SSR标记已用于多种林木的亲本分析,如杉木(Cunninghamialanceolata)[13]及豆科植物孪叶豆(Hymenaeacourbaril)[14]和香脂树属树种(Copaiferalangsdorffii)[15]。目前,猴耳环属中已有SSR标记开发的报道[16],亲本分析和全同胞子代鉴定将是猴耳环SSR标记应用研究的有益尝试。
本研究利用开发自表达序列标签(expressed sequence tag,EST)的SSR(EST-SSR)标记,对猴耳环自然群体内1株母本的1 489株自由授粉子代进行父本和全同胞子代的鉴定,旨在为基于全同胞群体的后续研究提供材料基础。
1 材料与方法
1.1 树种生物学特性和采样地概况
猴耳环为常绿乔木,喜阳光充足和气候温润的环境,通常沿着沟谷溪河边缘散布生长[4]。花期2—6月,果期4—8月;雌雄同花,数朵花聚成小头状花序,排成顶生和腋生的圆锥花序,雄蕊长约花冠2倍,子房具短柄(http://www.iplant.cn/info/猴耳环;2021年7月19日登录)。但是,猴耳环的传粉方式、传粉距离和是否存在自交等均鲜见报道。
采样的自然群体位于广东省广州市二龙山国际生态园(113°44″E,23°21″N,最高海拔441 m)。该地属南亚热带海洋性季风气候,年降雨量1 700 mm左右,年均气温21.6 ℃。该自然群体沿一条西南至东北流向的小溪边零散分布,海拔范围241~188 m,单株距溪边1.0~20.0 m。因猴耳环自然群体多为小或极小种群[6],该群体是笔者目前发现最大的两个自然群体之一(另一个位于海南省尖峰岭国家森林公园)。
1.2 植物材料和DNA提取
2018年6月和2019年6月在上述自然群体中采集母树ELS31的种子。同时,采集所有可见的挂果单株的嫩叶,共39株,距离母本10.0~559.1 m。因猴耳环为雌雄同花,挂果单株当年开花,均可能对ELS31进行了授粉,是ELS31自由授粉子代的潜在父本。种子按常规措施育苗,次年1月采集幼苗嫩叶,共计1 489株。
嫩叶DNA提取采用Ezup柱式植物基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司]。采用1.2%(质量分数)琼脂糖凝胶电泳检测DNA的完整性,利用NanoDrop 2000(美国Thermo Scientific)测定DNA的浓度和纯度,并稀释至10 ng/μL备用。
1.3 PCR扩增和毛细管电泳检测
利用前期基于转录组测序开发的15个EST-SSR标记的引物对[16],进行聚合酶链式反应(polymerase chain reaction,PCR)。引物序列见文献[16],引物合成委托生工生物工程(上海)股份有限公司,前向引物5′端进行HEX、6-FAM、ROX或TAM荧光修饰。PCR体系为10 μL,包括1.0 μL 10× buffer[100 mmol/L Tris-HCl pH 9.0,100 mmol/L KCl、80 mmol/L(NH4)2SO4、0.5%(质量分数)NP-40和20 mmol/L MgCl2]、200 μmol/L dNTP、正向和反向引物各0.25 μmol/L、1单位TaqDNA聚合酶(上海博乐生物科技有限公司)和10 ng DNA。PCR仪为DNA Engine(美国Bio-Rad),扩增程序为:94 ℃预变性4 min;35个循环包含94 ℃变性30 s,58 ℃或者60 ℃退火30 s,72 ℃延伸50 s;最后72 ℃延伸5 min。
取PCR产物1.0 μL加入0.16 μL GeneScanTM500 LIZ内标和9.34 μL超纯甲酰胺(美国Applied Biosystems)稀释,95 ℃变性5 min后迅速置于冰块中冷却。SSR标记分型在遗传分析仪ABI 3130xl(美国Applied Biosystems)上进行,具体参照仪器操作手册,利用GeneMapper 4.1软件(美国Applied Biosystems)进行等位片段的判读和数据收集。
1.4 数据分析
利用软件GenAlEx 6.5[17]计算等位片段数(number of alleles,Na)、有效等位片段数(number of effective alleles,Ne)和等位片段范围(allelic size range,ASR)等标记参数。利用软件Cervus 3.0[18]计算观测杂合度(observed heterozygosity,Ho)、期望杂合度(expected heterozygosity,He)和多态性信息量(polymorphic information content,PIC)等多样性参数,其中PIC基于自然群体内无亲缘关系的18株挂果单株(相距50 m以上)进行计算。
利用软件CERVUS 3.0[18]中“Parentage”母本已知模型,基于最大似然法确定父本的可能性,通过建立似然函数,计算每个候选父本的概率对数(logarithm of odds,LOD),确定父本的可能性,LOD为负值表明候选父本为随机样品、非子代的真实父本,LOD为正值表明候选父本为真实父本的可能性大于随机样品,LOD值越大则为真实父本的可能性也越大。软件设置的模拟循环为10 000次,候选父本取样比例和不匹配的标记位点比率分别设为0.80和0.01。初步确定LOD值最大的候选父本为真实父本,再结合母本、父本和子代在所有位点上的分离与重组进行人工校正,母本相同时同一父本的子代群体即为全同胞家系。
利用Joinmap 4.1[19]对全同胞家系中标记分离是否符合孟德尔期望分离比进行卡方检验。
2 结果与分析
2.1 半同胞群体多样性与标记多态性
15个EST-SSR标记的引物(对)均能有效地对母本ELS31的自由授粉子代进行扩增,共获得89个等位片段(表1)。对于单个标记,Na最低为4,最高为12(平均为5.9);Ne最低1.220,最高3.318(平均2.237);Ho最低0.191,最高0.823(平均0.584);He最低0.185,最高0.699(平均0.525)。其中,He是衡量群体多样性的最主要参数,平均为0.525,为中等水平。特别地,基于18株无亲缘关系的单株计算的EST-SSR标记PIC为0.577~0.885(平均0.736),表明所用EST-SSR均为高多态性标记,可较好地保证群体多样性和父本分析的有效性(表1)。母本ELS31、候选父本ELS14和6株子代在标记ARCeSSR366上的等位片段情况见图1。
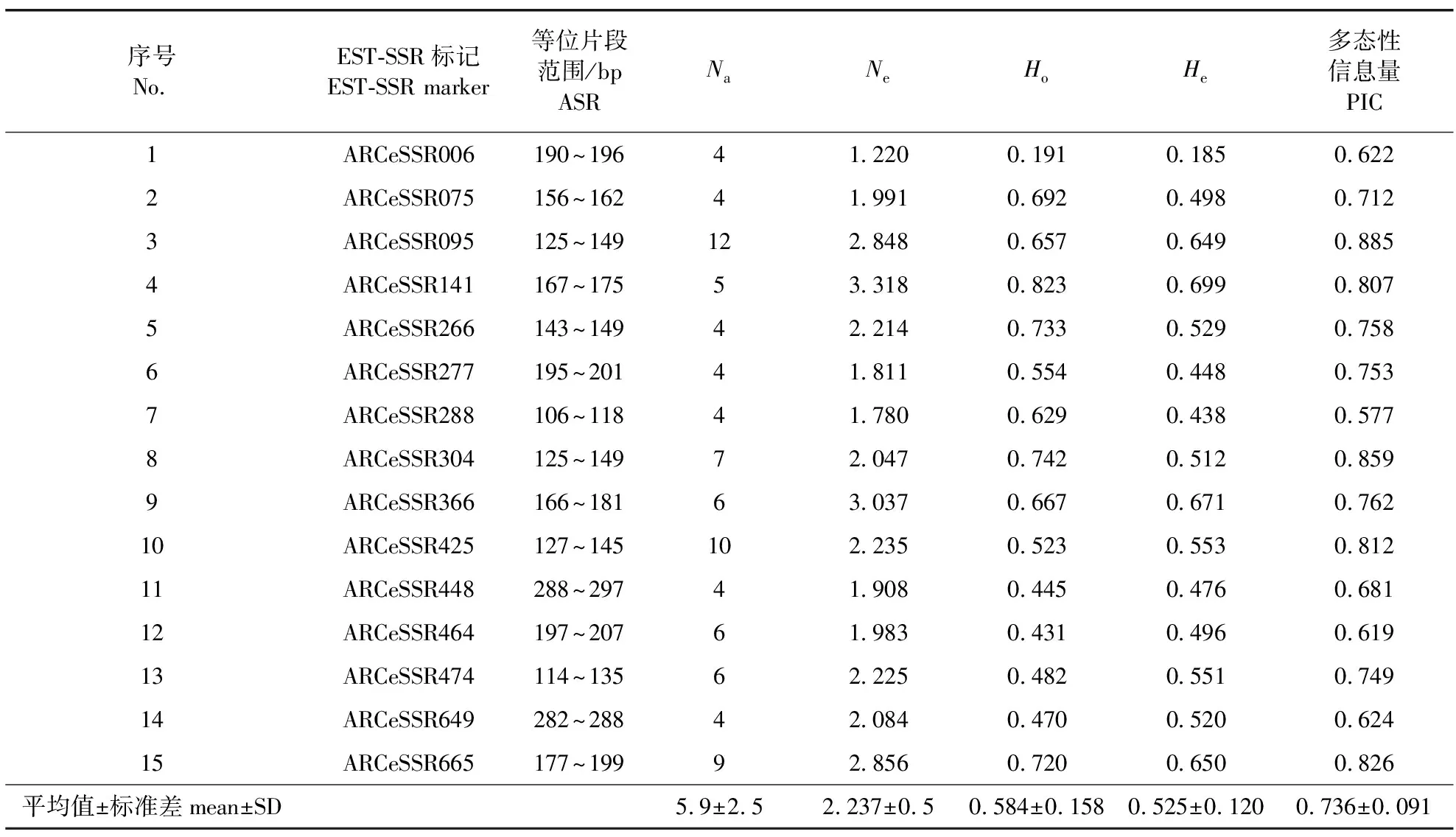
表1 参试15个EST-SSR标记及其多态性参数
2.2 父本鉴定及花粉传播距离
母本ELS31的1 489株自由授粉子代中,857株(57.6%)确定了父本(表2),但632株(42.4%)因LOD较低未能确定父本。图1也显示了父本ELS14的3株子代和3株非亲子代在标记ARCeSSR366上的等位片段。共确定了34株父本,包括子代数20株以上父本10个、单个父本(全同胞家系)的子代数量为26~184个(表2),其他24个父本共产生了139株子代,单个父本的子代数量为1~19株(数据未列示)。同时,也将母本ELS31作为父本进行了分析,未发现自交子代,表明猴耳环是异交物种,自交的可能性极低。
对子代数量20株以上的10个父本对应的全同胞家系进行分析,Ho为0.502~0.693,He为0.417~0.544(表2),均为中等水平的多样性。不高的多样性水平可能与遗传基础只有两个亲本有关,因任一亲本(二倍体)一旦出现SSR纯合位点则在子代中不分离(无多样性),易影响子代群体的多样性。各家系均是Ho>He,存在杂合子过剩现象。
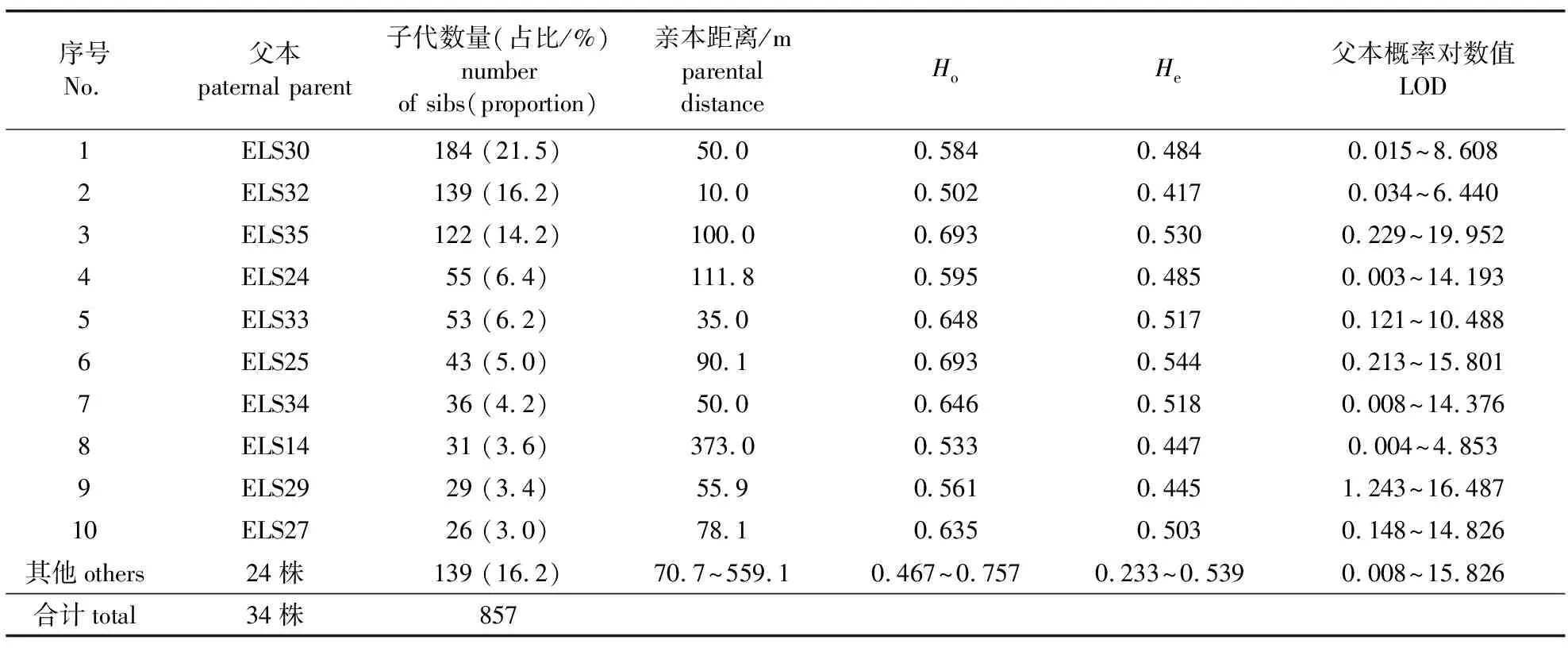
表2 鉴定的父本和子代数量及全同胞家系的多样性参数
父本与母本的距离及子代数量的关系见图2。
花粉传播距离即确定的父本与母本ELS31的直线距离。花粉传播距离的范围为10.0~559.1 m,平均119.2 m。主要传播距离在150 m以内,10株父本共产生了716株子代(83.5%)。随着距离的增加,150 m之外的父本产生的子代数趋于减少,但个别较远单株仍可产生较多子代,如距母本373 m的父本ELS14产生了31株子代,距离最远的父本ELS01(559.1 m)和ELS02(552.2 m)分别产生了9株和12株子代(图2)。
2.3 全同胞家系的标记偏分离
对子代数量20株以上的10个全同胞家系的卡方检验结果见表3。
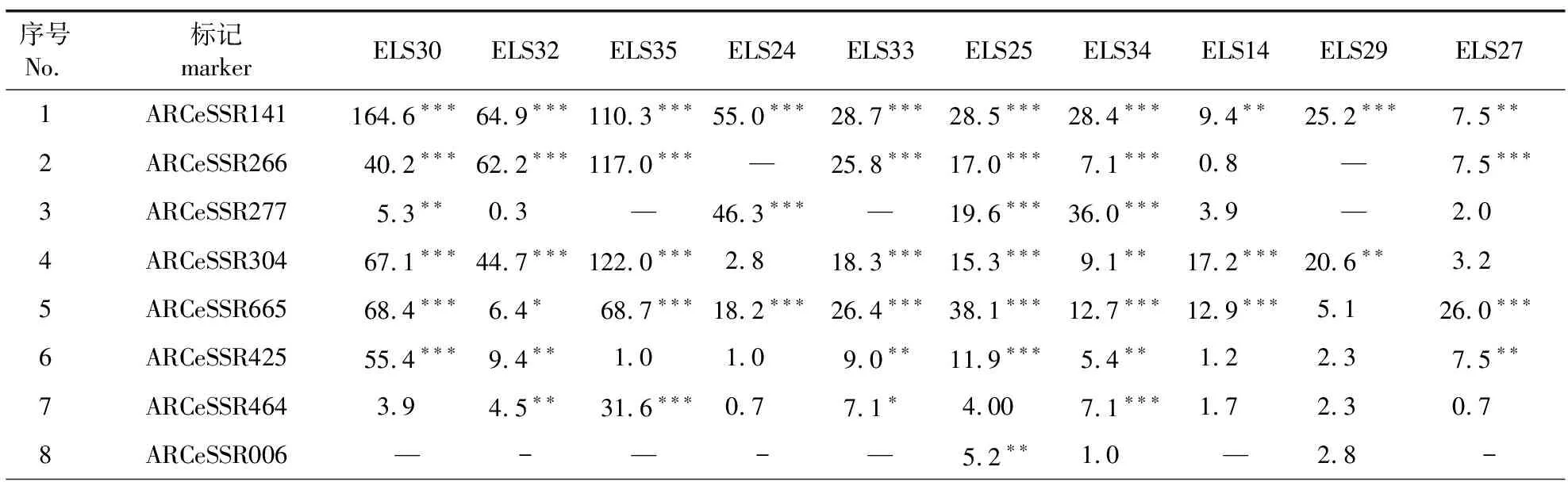
表3 EST-SSR标记在不同父本的全同胞家系中分离比的卡方检验
表3表明,不同家系存在不同标记数量或不同程度的偏离孟德尔分离期望比,平均每家系的偏分离标记数为8.6个,父本ELS29和ELS25的家系偏分离标记分别为最少的3个和最多的12个(P< 0.05)。偏分离最严重的是标记ARCeSSR141在父本ELS30的全同胞家系中χ2值高达164.6(P< 0.001)。此外,多个全同胞家系中标记ARCeSSR464、ARCeSSR649和ARCeSSR448因母本和父本均为纯合而无分离。
3 讨 论
对猴耳环1株母本的1 489株自由授粉子代进行了父本鉴定,共有857株(57.6%)子代确定了父本(花粉)来源,鉴定比例高于黄竹(Dendrocalamusmembranaceus)的56.4%[20]和中国沙棘(Hippophaerhamnoidessubsp.sinensis)的53.9%[21],但低于马尾松(Pinusmassoniana)的72.5%[22]、日本落叶松(Larixkaempferi)的93.7%[23]和美洲黑杨的97.9%[8]。父本鉴定的子代比例常与候选父本数量、其他花粉来源、标记(位点)的数量和多态性等因素有关。本研究使用了15个共显性EST-SSR标记,在数量上满足父本鉴定的要求[24],并且对二龙山群体的多态性亦较高[16]。因此,相当数量的子代(632株,42.4%)未鉴定到明确父本很可能是因为候选父本不足或存在其他花粉来源(附近父本未完全采样),如有的植株因种子成熟较早、ELS31采种时已经掉果而被认为未开花且不会授粉,未被作为父本,或者有的父本树体较小、在密林中不易发现而被遗漏,尤其是在远至500余米仍可有效授粉的情况下。此外,SSR位点的突变可能导致重复单元数的增减而产生非亲本等位片段,从而影响鉴定的比例,如苹果(Malusdomestica)中发现亲本与子代SSR位点间发生了重复单元数的突变、但两端的引物结合序列没有发生变化[25]。
猴耳环花粉传播范围主要集中在150 m以内,采样群体内平均传播距离为119.2 m,最远可达559.1 m。这与牛蹄豆属植物Pithecellobiumelegans平均花粉传播距离142 m相近,但短于巴拿马天蓬树(Dipteryxpanamensis)平均240~557 m的距离[12]。猴耳环传粉媒介鲜见报道,基于其为豆科植物且花粉散布范围较远,推测应为虫媒或以虫媒为主的传粉方式。总体而言,花粉传播的趋势是距离越远,子代数越少,授粉率越低,这与植物花粉流强度随距离增加而减弱的普遍规律一致[26]。
15个EST-SSR标记在部分或全部10个全同胞家系中均有不同程度的偏分离。偏分离在多种植物中普遍存在[27],其可能的原因较多,一般认为从配子产生、合子形成到合子后发育过程中,基因互作、遗传分化、细胞质影响和环境因素均可导致偏分离的产生[27]。一些实验因素,如群体类型与大小、标记种类等,也可能影响偏分离[27]。并且,偏分离也是一种重要的进化动力,可以增加杂合等位基因的频率[28],从而表现为杂合子过剩的现象。此外,偏分离标记仍可有效用于全同胞群体的亲本的遗传图谱构建,因其对作图的准确性没有影响或影响极小[29]。
本研究基于15个EST-SSR标记鉴定了猴耳环1株母本的1 489株自由授粉子代的父本,获得了子代20株以上的10个父本的全同胞家系。这为后续遗传测定、遗传图谱构建和数量性状位点定位等研究提供了材料基础。

