复合盐碱胁迫对OT百合生长和生理特性的影响
杨雨华,鉴晶晶,邱小蝶,王贵娇,宗建伟
(河南牧业经济学院艺术学院,河南 郑州 450046)
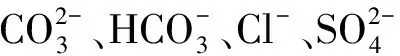
百合(Liliumspp.)为百合科百合属多年生草本球根花卉,在鲜切花、医药、食用等方面具有广泛的应用[9]。百合在甘肃、湖南、江苏、河南等地均有分布,其中,河南省百合科植物有39属、145种、18个变种,主要分布于太行山、伏牛山、桐柏山和大别山等山区[10]。由于自然因素和人为因素的影响,河南土壤盐碱化严重且主要分布在黄河沿岸的平原地区,这势必成为河南省百合产业发展的限制因素。目前关于百合的研究集中在百合对中性盐的响应及缓解机制,而针对混合盐碱下百合的生理生化响应规律及与单盐胁迫的差异研究较少。本研究模拟我国河南省盐碱土环境,以OT杂种系百合‘红色宫殿’为研究对象,设置了单盐(NaCl)、中性混合盐(NaCl和Na2SO4)和碱性混合盐(NaCl、Na2SO4、Na2CO3和NaHCO3)3个处理组,探讨百合在盐碱胁迫下的生理响应机制和耐受能力,以期为百合在盐碱地区的栽培和推广提供理论依据。
1 材料与方法
1.1 试验地概况及试验材料
试验在河南牧业经济学院苗圃内(113°80′E,34°80′N)进行。试验地属暖温带大陆性气候,四季分明,年平均气温14.4 ℃,年均降水量640.9 mm,无霜期220 d,年日照时间约2 400 h,可满足百合对光照和热量的需要。
2019年3月选用大小一致且无病虫害的OT杂种系百合‘红色宫殿’(Lilium‘Red Palace’)种球栽植于花盆(上下直径均280 mm,高180 mm)中,每盆定植1个鳞茎。栽培基质为河沙、草炭土、珍珠岩,体积配比为2∶2∶1。
1.2 试验设计
1.2.1 盐碱复合处理
试验选用2种中性盐NaCl、Na2SO4和2种碱性盐NaHCO3、Na2CO3(均为分析纯)模拟河南省主要盐碱土类型。按不同质量比混合成3个处理组:Ⅰ组为单盐NaCl,Ⅱ组为中性混合盐m(NaCl)∶m(Na2SO4)=1∶2,Ⅲ组为碱性混合盐m(NaCl)∶m(Na2SO4)∶m(NaHCO3)∶m(Na2CO3)=5∶23∶9∶3,每组设置50、100、150、200 mmol/L 4个浓度梯度,以蒸馏水作为对照(CK),每个盐浓度重复3次,共39盆,分别用含有相应浓度的混合盐碱溶液进行胁迫处理。测定各组的pH,Ⅰ组的pH为6.67~6.80,Ⅱ组为7.13~7.38,Ⅲ组为8.49~8.64。为避免盐激反应,盐溶液从低浓度(最终浓度的1/4)开始加入,每3 d递增1个梯度,4次后累计达到设定浓度。每盆浇灌溶液300 mL,花盆底部配置托盘,以确保试验准确性;全部处理达到目标浓度时为胁迫处理第1天,此后每隔5 d的17:00—18:00定期浇灌300 mL蒸馏水,并在大棚内进行避雨栽培。胁迫处理30 d,进行取样与各生理指标的测定。
1.2.2 指标测定及方法
1)肉质根数采用目测法测定。用卷尺和数显游标卡尺测量株高和地径,选取相同部位功能叶利用方格网法[11]对叶面积进行测量。选取植株的地上部分、地下部分,以蒸馏水洗净后用吸水纸吸干,称取鲜质量;装入纸袋并于105 ℃杀青30 min,80 ℃烘干至恒定质量,称取干质量[12]。同时计算根冠比(R/S)=根生物量/地上生物量。
2)采用DDS-307A电导率仪测定相对电导率,植株地上、地下部分Na+和K+含量通过FP6400A火焰光度计测定,丙二醛含量采用硫代巴比妥酸法测定,可溶性蛋白含量采用考马斯亮蓝法测定,根系活力采用氯化三苯基四氮唑(TTC)法[13]测定,用鲜质量法[14]测定叶片的相对含水量。
1.3 数据处理
采用Excel 2010整理数据和绘制图表,利用SPSS 24.0对不同盐浓度下百合的各生理指标进行双因素方差分析(Two-way ANOVA)和相关性分析,采用隶属函数法[15]比较各处理对百合的胁迫程度。
2 结果与分析
2.1 盐碱胁迫对百合形态指标的影响
随盐碱浓度的增加,3个处理组百合叶面积整体呈下降趋势(图1A),盐碱浓度200 mmol/L时降至最低,Ⅰ、Ⅱ处理组相比CK分别显著降低了38%、62%(P<0.05),Ⅱ处理组在200 mmol/L时相比100 mmol/L降低45%(P>0.05);其中Ⅰ、Ⅱ处理组叶面积分别在50、100 mmol/L胁迫浓度时达到最大值,这说明低浓度盐可使百合叶面积增大。肉质根数(图1B)在Ⅰ、Ⅲ处理组随胁迫浓度的增大均显著(P<0.05)低于CK;而Ⅱ处理组肉质根数与CK比较无显著差异(P>0.05)。百合株高在Ⅱ处理组随胁迫浓度增大呈“降—升—降”的变化趋势;3个处理组株高(图1C)在盐碱处理下有变化,但差异不显著(P>0.05);此外,3个处理组均在盐碱浓度150~200 mmol/L时出现明显下降趋势。Ⅰ、Ⅲ处理组茎粗(图1D)随胁迫浓度增大呈现相似变化趋势,而Ⅲ处理茎粗低于Ⅰ处理,Ⅱ处理变化趋势呈倒“N”形。相比CK,3个处理组的茎粗变化趋势均不显著(P>0.05)。
2.2 盐碱胁迫对百合生物量及根冠比的影响
随盐碱浓度增加,各处理的地上部生物量均呈先升后降的趋势,Ⅰ、Ⅱ、Ⅲ处理分别在50、150、50 mmol/L时达到最大值,且显著高于CK(P<0.05),均在200 mmol/L时降至最低(表1)。相比CK,Ⅰ处理的地下部生物量和总生物量均有所下降,Ⅱ、Ⅲ处理则呈先升后降的趋势。Ⅰ处理根冠比在50~200 mmol/L浓度范围表现为先升后降,相比CK,Ⅱ、Ⅲ处理组根冠比显著降低(P<0.05),200 mmol/L时分别下降为CK的46.61%、65.16%。

表1 百合生物量和根冠比对盐碱胁迫的响应
2.3 盐碱胁迫对百合渗透调节特性的影响
1)叶片相对电导率的变化。相对电导率能较准确反映植物叶片细胞膜透性水平[16]。如图2A所示,各处理的百合叶片相对电导率随胁迫浓度升高呈增加态势,浓度为200 mmol/L时达到峰值。相比CK,Ⅰ、Ⅱ、Ⅲ处理组的相对电导率依次升高16%、20%、36%。Ⅰ、Ⅲ处理组在盐浓度为50 mmol/L时开始下降,说明百合具有一定的抗盐碱能力。
2)叶片丙二醛(MDA)含量的变化。丙二醛是膜质过氧化的产物之一,其含量越高,膜质氧化程度越大,植物受到的盐害也越重[17]。本研究表明(图2B),Ⅰ、Ⅱ处理下,百合叶片内MDA含量随胁迫程度增大呈先降后升的趋势,且分别在浓度为150、50 mmol/L时达到最低值,在Ⅲ处理下呈波动上升趋势,但各处理组浓度间差异均不显著(P>0.05)。
3)叶片可溶性蛋白含量的变化。Ⅰ和Ⅱ处理组叶片的可溶性蛋白含量呈“V”形变化趋势,而Ⅲ处理组呈“降—升—降”(图2C)。各处理组的可溶性蛋白含量均在盐浓度为50 mmol/L时达到最低,与CK相比差异不显著(P>0.05),依次降低19.36%、6.94%、17.79%。盐浓度为200 mmol/L时Ⅰ和Ⅱ处理组的可溶性蛋白含量达到峰值,相比CK分别升高了32.31%、9.60%。百合通过增加叶片的可溶性蛋白含量,保护细胞免受伤害。而Ⅲ处理组在150 mmol/L时达到最大值,可能是由于盐浓度的继续增加,致使细胞渗透调节系统失衡。
4)叶片相对含水量的变化。不同盐碱胁迫对百合叶片相对含水量的影响如图2D所示。在胁迫条件下,叶片相对含水量随盐浓度的增加先缓慢升高转而骤降,各处理组变动幅度不同。与对照相比,Ⅱ处理组在100 mmol/L、Ⅰ和Ⅲ处理组均在50 mmol/L时相对含水量达到最大值,分别比CK提高了2.12%、4.22%、1.91%;胁迫浓度在200 mmol/L时3种处理的百合相对含水量均显著低于CK(P<0.05)。
5)百合不同部位Na+、K+含量的变化。各处理百合地上、地下部分的Na+含量均高于CK(表2),且随胁迫浓度升高呈上升态势,而K+含量先升后降。不同胁迫处理之间相比,盐浓度达200 mmol/L时,地上、地下部分Na+含量均以Ⅲ处理组最高,比CK相应部位分别显著升高了195.26%、50.87%,其次是Ⅱ处理组,Ⅰ处理组升高幅度较低;地上、地下部分K+含量以Ⅲ处理组最低,分别为CK相应部位的76.81%、70.97%,Ⅰ和Ⅱ处理组较高。各处理组均以地上部分K+含量高于地下,Na+含量则相反,说明根部吸收的K+主要向地上部分茎叶转运,而Na+主要存在于地下部分,向地上茎叶转运较少。随着盐胁迫浓度增加,各处理幼苗地上、地下的K+/Na+值均下降,说明盐处理促使百合吸收了大量Na+,从而抑制了幼苗对K+的吸收。盐浓度为200 mmol/L时,百合幼苗Ⅰ、Ⅱ、Ⅲ处理组中地上部分K+/Na+值分别降为CK的42.19%、41.00%、25.98%,地下部分K+/Na+值则分别降为CK的79.39%、58.33%、45.83%。
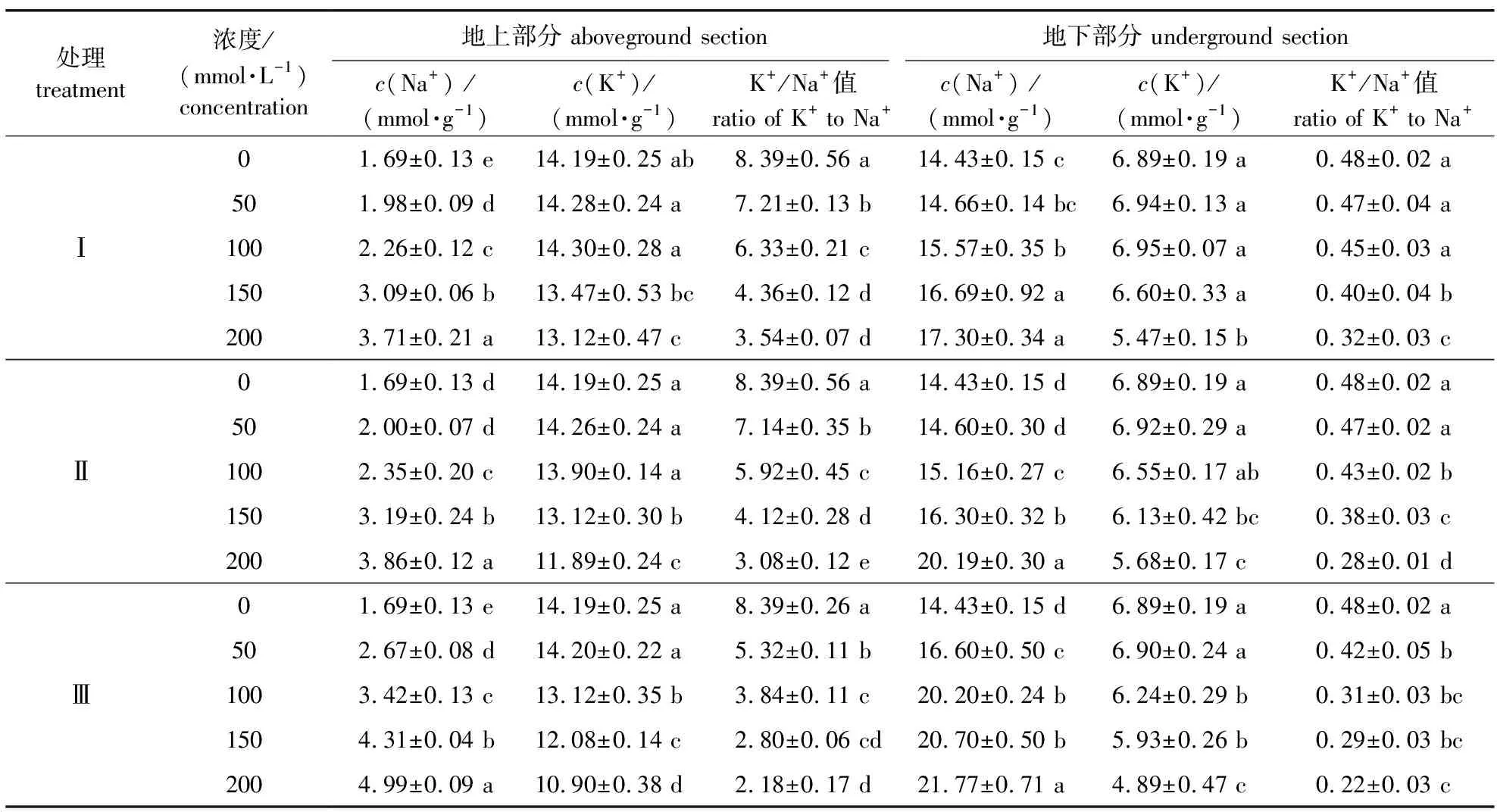
表2 百合Na+、K+含量和K+/Na+值对盐碱胁迫的响应
2.4 盐碱胁迫对百合根系活力的影响
根系是植物最先感受土壤逆境胁迫的部位[18],而根系活力是衡量植物根系生理状况的重要指标。分析可知,本研究中盐浓度在0~100 mmol/L内,Ⅰ处理组的根系活力逐渐升高,100 mmol/L时为峰值,较CK增幅为44.60%(图3)。
当盐浓度超过100 mmol/L后,根系活力逐渐下降;150 mmol/L时Ⅱ处理组根系活力出现拐点,较CK增加了79.68%,且差异显著(P<0.05);Ⅲ处理组根系活力随浓度增加呈先升后降的趋势,在0~100 mmol/L范围内根系活力呈倒“V”形变化,峰值比CK显著升高了118.38%(P<0.05)。
2.5 胁变指标与盐浓度和盐组合之间的双因素方差分析
不同盐浓度和盐处理以及两者之间的交互作用对百合的总鲜质量、总干质量、根冠比、根系活力以及相对含水量的影响均达到极显著水平(P<0.01);对丙二醛和可溶性蛋白含量的影响不显著(P>0.05)。盐浓度对相对电导率的影响达到极显著水平(P<0.01)(表3)。

表3 不同盐浓度和盐组合以及两者之间的交互作用对百合各生理指标的影响
2.6 盐碱胁迫后百合生理指标间的相关性分析
将不同程度盐碱胁迫后百合的各项指标进行相关性分析,得到相关系数矩阵(表4)。从表4可以看出,百合在Ⅰ、Ⅱ处理组的根冠比与总鲜质量及总干质量之间达到了极显著正相关水平(P<0.01),Ⅲ处理组根冠比与总鲜质量呈显著正相关(P<0.05),与总干质量呈极显著正相关(P<0.01)。Ⅰ、Ⅱ处理组的根系活力与总鲜质量及总干质量之间呈显著正相关(P<0.05)。此外,Ⅱ、Ⅲ处理组相对含水量均与相对电导率存在极显著负相关(P<0.01)。丙二醛含量和可溶性蛋白含量均与根冠比不存在显著相关性(P>0.05)。
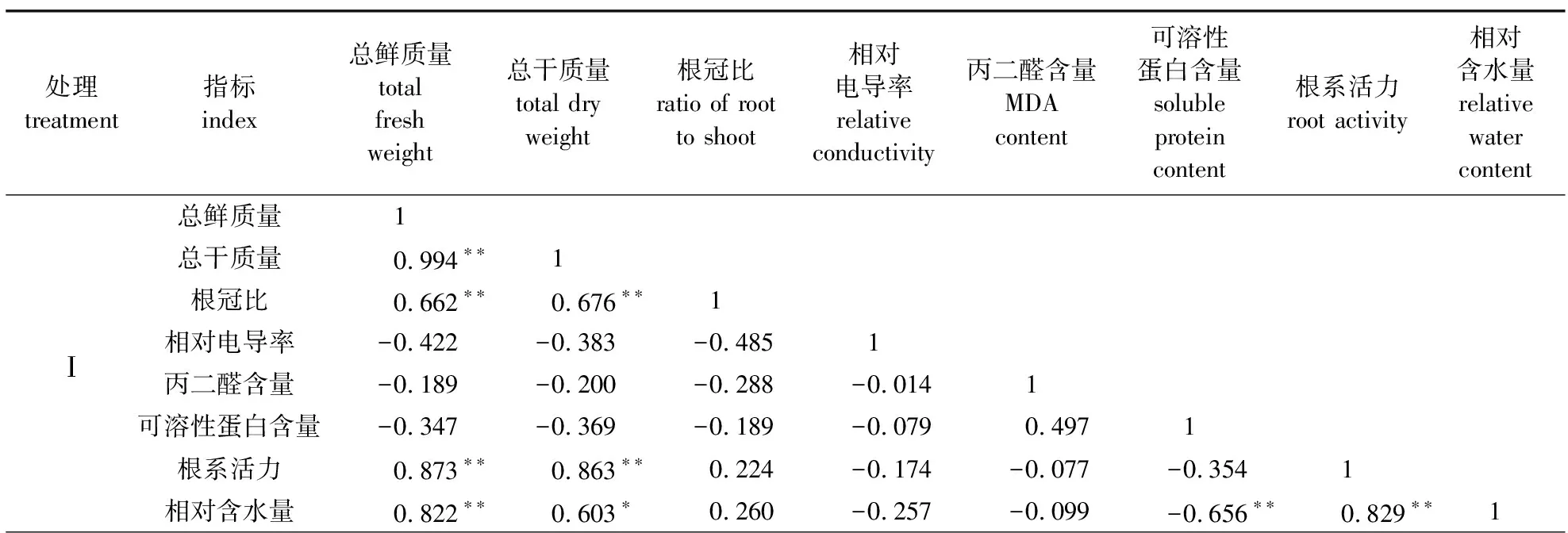
表4 不同类型盐碱处理下各生理指标的相关性分析
2.7 不同盐碱胁迫程度对百合影响的综合评价
通过隶属函数法对盐碱胁迫下百合8个指标进行综合评价,可知单盐、中性混合盐、碱性混合盐的隶属函数值分别为0.439、0.529、0.604,3个盐碱处理组胁迫程度由强到弱依次为碱性混合盐>中性混合盐>单盐(表5)。
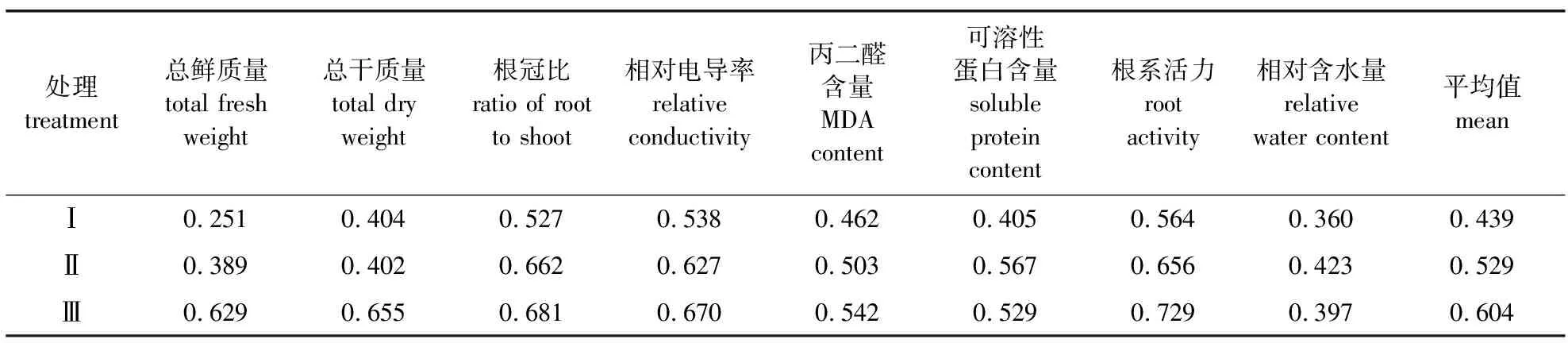
表5 不同类型盐碱处理各生理指标的隶属函数值
3 讨 论
3.1 百合形态指标对盐碱胁迫的响应
有研究发现,在逆境处理下,植物可以通过放缓生长速度或缩小叶片面积等以缓解水分亏缺造成的危害[19]。本试验中百合的叶面积、茎粗、株高、肉质根数目在初期低浓度下变化差异不明显,随浓度升高开始出现下降,降低幅度因处理不同而产生差异。Ⅰ、Ⅲ处理组叶面积、肉质根在胁迫浓度达200 mmol/L时与CK差异显著,而Ⅱ处理组则差异不显著。3个处理组株高和茎粗都随浓度增加而逐渐下降。对不同处理结果分析可得,Ⅱ处理组的百合形态变化最小。这表明Ⅱ处理组对百合生长的抑制作用最小,Ⅰ、Ⅲ处理组胁迫作用较大。这与李子英[20]对盐柳幼苗在混合盐碱胁迫下的研究结果相似。因此,百合对盐碱胁迫的适应最终体现在形态指标的变化。
3.2 百合生物量对盐碱胁迫的响应
盐碱胁迫会抑制植物生长和生物量的积累,甚至直接导致植株死亡[21]。本试验发现,‘红色宫殿’百合幼苗通过增加地上部分生物量及减小根系生物量以抵抗盐碱环境对其伤害,具有明显的可塑性。这与严青青等[18]对海岛棉(Gossypiumbarbadense)幼苗的研究结果基本一致。植物根系是吸收、传送营养物质的主要器官,它的生长状态在很大程度上决定着植物汲取水分和养分的能力[22]。程贝等[23]发现低盐浓度处理可促进番茄侧根对盐分的适应能力,形成一定的耐盐碱机制,但高盐浓度会抑制根系生长。本研究发现,百合根系活力的变化先上升后下降,这表明在一定浓度盐碱处理下,百合会通过提高根系活力来缓解胁迫。牛素贞等[24]研究认为,植物通过提高根系活力以维持一定量的吸水能力,保证其正常生长,这与本研究结果相似。即随处理浓度升高,根系受到损伤,活力下降,以致百合生长受到抑制,且Ⅰ、Ⅱ、Ⅲ处理组浓度分别在100、150、50 mmol/L时根系活力出现最大值,随后开始下降,这表明3种处理对百合的抑制程度表现为碱性混合盐>中性混合盐和单盐。
3.3 百合渗透生理指标对盐碱胁迫的响应
渗透调节是植物抵御逆境胁迫的重要生理机制之一。细胞膜对于维持胞内代谢环境的稳定具有重要的意义[25]。在盐碱胁迫应答过程中,电解质、丙二醛是衡量细胞膜损伤程度的重要指标[26],相对含水量可反映盐碱胁迫对植物渗透胁迫的大小,而可溶性蛋白是逆境胁迫诱导积累的重要渗透调节物质,可增强细胞持水力、参与酶的代谢活动及细胞骨架构成[27]。
植物叶片相对含水量降幅越小,叶片保水能力越高[28]。本试验中叶片相对含水量呈先升后降的趋势,低盐胁迫下,Na+可作为渗透调节物质进入百合体内,部分代替K+维持细胞渗透压,增加吸水[29],而高浓度盐碱胁迫造成渗透胁迫,导致相对含水量减少。盐碱胁迫处理下百合的相对电导率随胁迫浓度增加整体呈递增趋势,细胞膜透性增大,外渗物增多。Ⅰ、Ⅲ处理组在50~100 mmol/L胁迫浓度内相对电导率有所下降,可能是低浓度胁迫导致百合叶片细胞膜脂过氧化,膜透性增大。而随着胁迫浓度升高,植物会通过积累渗透物质,以降低胁迫伤害。试验发现丙二醛随处理浓度的增加表现出不同程度变化态势。Ⅲ处理组的丙二醛含量随盐浓度升高而上升,而Ⅰ、Ⅱ处理组表现为先降后升,这与韩丽霞等[30]对流苏(Chionanthusretusus)幼苗的研究结果相似。说明百合具有一定的抗氧化能力,能避免细胞膜受损害,而随着胁迫浓度升高,丙二醛含量不断累积,百合叶片过氧化程度加剧,自身调节能力失衡,细胞膜表现为受害的症状。陆瑛等[31]认为可溶性蛋白含量的增加可维持功能蛋白的数量和细胞渗透势。本试验中Ⅲ处理组可溶性蛋白在50~150 mmol/L胁迫浓度时上升,在胁迫浓度为200 mmol/L时略下降,表明轻度胁迫下植物发生应激反应,产生胁迫蛋白,导致蛋白质含量阶段性增加[32]。当盐胁迫超出细胞渗透调节作用的上限时,蛋白酶活性变大,蛋白质水解速度加快,可溶性蛋白含量下降。同时,可溶性蛋白又是一种衡量细胞受损程度的有效物质,并且有研究证实Ca2+可抑制蛋白质的分解[33],本研究发现3个处理组的可溶性蛋白含量均在盐浓度为50 mmol/L时下降,这与赵明明[34]得出的变化曲线相似。出现此结果的原因可能是丙二醛与膜脂蛋白结合,使细胞膜受损,外界离子进入细胞与蛋白质结合,抑制可溶性蛋白的合成。其中,Ⅲ处理组对电解质、丙二醛和可溶性蛋白起显著抑制作用时的浓度比Ⅰ、Ⅱ两组低,这与高剑[35]对龙葵的研究结果相似,说明碱性混合盐胁迫程度大于中性盐胁迫。
盐碱胁迫下,Na+在植物组织、器官中积累,对植物造成单盐毒害[36],而K+具有平衡渗透调节、物质运输调节等功能。本研究发现低盐浓度可促进百合根系对K+的选择性吸收,增强自身耐盐性[37]。各处理幼苗地上、地下的K+/Na+值均下降,可能是因为盐碱胁迫促使百合吸收大量Na+,且K+和Na+生理生化特性存在相似性,Na+竞争质膜上的K+吸收位点,导致K+含量降低[38],其中Ⅲ处理组K+/Na+值低于Ⅱ和Ⅰ处理组。
综上所述,本试验中不同盐碱胁迫下百合的耐受性表现不同,碱性混合盐处理组对百合生长抑制程度比单盐、中性混合盐处理组要高。从盐碱胁迫下百合形态指标可看出,低浓度(≤150 mmol/L)盐碱胁迫条件下,可促进植物生长,高浓度(200 mmol/L)则抑制其生长。植物受到高浓度盐碱胁迫会导致相对含水量降低、细胞膜脂过氧化、膜透性增大、相对电导率、丙二醛含量上升、K+/Na+值下降。低浓度(≤150 mmol/L)盐碱胁迫下可以促进‘红色宫殿’百合生长,根系活力上升,内外渗透压趋于平衡;而随着胁迫强度的提高,根系活力下降,蛋白质水解速度加快,可溶性蛋白含量降低。双因素分析结果表明,盐浓度的影响大于盐类型,且百合的总鲜质量、总干质量、根冠比、相对含水量、根系活力均受到了盐浓度和盐类型的协同效应。

