不同蔗糖浓度对索邦百合离体繁殖与植株再生的影响
李卫东 其麦邓珠 其麦翁姆 赵心怡 陈钟吼 刘 帆*
(1白玉藏品农业发展有限责任公司,四川白玉 627150;2四川农业大学农学院,四川成都 611130)
百合(Lilium brownii var.viridulum Baker)是百合科百合属植物的统称,为多年生草本球根植物,原产于中国。百合花色丰富、花形各异、芳香宜人,是名贵的切花和盆花,其大部分鳞茎既可食用又能药用[1-2]。东方百合有较高的观赏价值和经济价值,是世界四大切花之一[3]。索邦百合属于东方百合,植株高80~120 cm,茎秆硬度大,叶较狭长,呈披针形,亮绿,有光泽,花呈粉红色,边缘具狭窄白边,红色乳突分布于花瓣中部以下,有香味[4]。
目前,我国切花产业中东方百合所占的比重越来越大,是栽培的主要新品种。生产上百合繁殖主要采用常规分球、分珠芽、鳞片扦插、鳞片包埋等繁殖方法。但是,生产上百合繁殖量较小,繁殖速度缓慢[5-6],短期内难以满足市场需求。连续多代繁殖,百合易发生病毒病,最终导致种球产量下降,花色变淡,花冠变小,观赏价值降低[7-10]。组织培养技术的应用极大地提高了东方百合的繁殖系数,且易保持原品种的优良观赏特性[11],对保护此品种资源具有重要意义。
本试验探究了在最适宜的激素浓度配比下,不同浓度蔗糖对索邦百合组织培养的影响,以期为建立高质量的索邦百合快速离体繁殖体系提供参考。
1 材料与方法
1.1 试验材料
以植株健壮、无病虫害的百合作为试验材料。此材料采自市场,经鉴定为索邦百合。
1.2 试验方法
1.2.1 前期处理。具体包括外植体选取与灭菌、培养基配制两方面内容。
(1)外植体选取与灭菌。以索邦百合鳞茎作为外植体,用流水冲洗鳞茎1~2 h,剥去鳞茎外皮及外部2~3层鳞片,切去少许顶部及基部,用75%乙醇浸泡15 s,用无菌水洗2~3次,再使用0.1%升汞溶液处理8 min,用无菌水洗4~6次后备用。
(2)培养基配制。①愈伤组织生长培养基。以MS为基本培养基,添加6 g/L琼脂粉,调节pH值至5.8。根据添加蔗糖浓度的不同,设6个处理,见表1。②诱导丛生芽培养基。以M5为基本培养基,添加6 g/L琼脂粉,调节pH值至5.8,添加诱导愈伤组织分化形成丛生芽的最佳浓度配比的激素(6-BA 1.0 mg/L、NAA 0.5 mg/L)和对应浓度的蔗糖。共设6个处理,具体见表2。③诱导生根培养基。以1/2MS(大量元素减半)为基本培养基,添加6 g/L琼脂粉,调节pH值至5.8,添加诱导丛生芽生根的最佳浓度配比的激素(IBA 0.25 mg/L、NAA 0.1 mg/L)和对应浓度的蔗糖。共设6个处理,具体见表3。
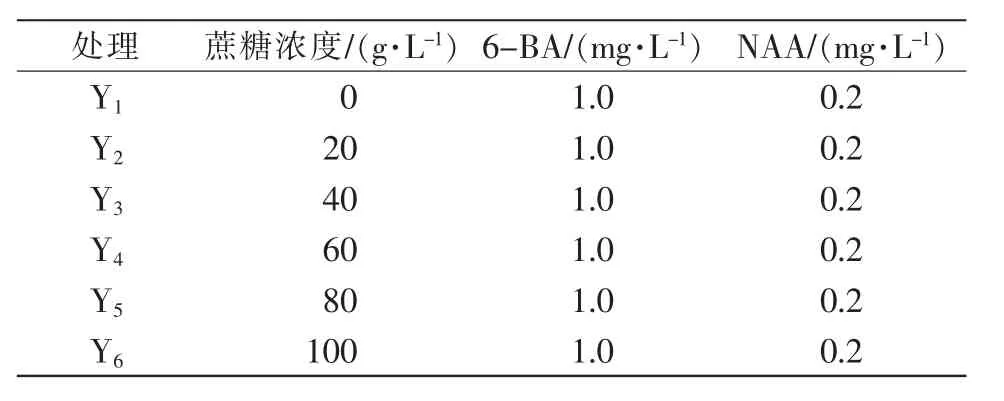
表1 愈伤组织生长培养基设计

表2 诱导丛生芽培养基设计
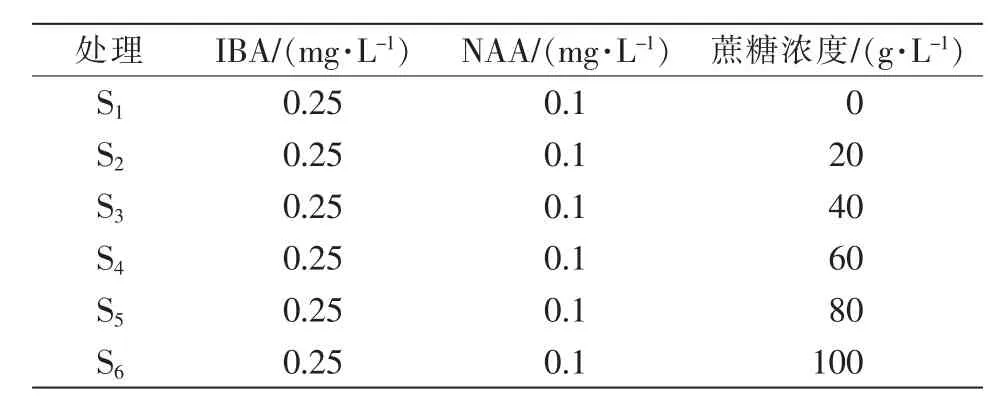
表3 诱导生根培养基设计
1.2.2 试验过程。主要包括不同蔗糖浓度对愈伤组织生长、丛生芽生长、壮苗生根的影响以及炼苗移栽等方面内容。
(1)不同蔗糖浓度对愈伤组织生长的影响。将鳞片切成2 cm×1 cm的小块,接种于放置3 d的无污染培养基中。每个处理5瓶,每瓶接种3块。转接完毕后将培养瓶置于(22±2)℃的恒温培养室中遮光培养。
将诱导出的愈伤组织转接至愈伤组织生长效果最佳的培养基内,置于光照强度2 000 lx、温度(22±2)℃的恒温培养室中培养,光照时长12 h/d,增殖时间为30 d。每3 d观察记录1次试验现象,30 d后统计愈伤组织数目和发生时间,记录愈伤组织的生长情况,筛选出最佳蔗糖浓度。相关公式如下:
愈伤组织诱导率(%)=愈伤组织数/接种数
(2)不同蔗糖浓度对丛生芽生长的影响。将小鳞茎上长至3~4 cm的丛生芽分成单芽,接入诱导丛生芽的培养基中。每个处理5瓶,每瓶接种3块。转接完毕后将培养瓶置于(22±2)℃的恒温培养室中光照培养,光照强度2 000 lx,光照时长12 h/d。
将诱导出的丛生芽转接至丛生芽生长效果最佳的培养基内,置于光照强度 2 000 lx、温度(22±2)℃的恒温培养室中培养,光照时长12 h/d,增殖时间为30 d。每3 d观察记录1次试验现象,30 d后统计丛生芽数目、诱导率、发生时间,记录丛生芽生长情况、筛选出最佳蔗糖浓度。相关公式如下:
丛生芽诱导率(%)=萌芽数/接种数
(3)不同蔗糖浓度对壮苗生根的影响。将生长状况良好的丛生芽切成单芽接入诱导生根的培养基中。每个处理5瓶,每瓶接种3块。转接完毕后将培养瓶置于(22±2)℃的恒温培养室中光照培养,光照条件同上。每3 d观察记录1次试验现象,30 d后统计丛生芽生根数目、诱导率和发生时间,记录根的生长情况,筛选出最佳蔗糖浓度。相关公式如下:
生根诱导率(%)=生根数/接种数
(4)炼苗移栽。将生长健壮的组培苗置于室温条件下炼苗3 d后,揭开瓶口继续炼苗3 d。取出培养瓶苗,用清水和毛刷将植株根系的培养基冲洗干净,再用多菌灵800倍液消毒基质15 min,然后将培养瓶苗栽植于基质(腐殖质∶蛭石=2∶1)中,并为植株套上带有微孔的保鲜袋。每天在植株叶面喷雾2次,保持植株表面湿润,培养7 d。7 d后待植株有新叶长出,取掉保鲜袋,观察其生长情况,调查其移栽存活率。
1.3 数据分析
所有试验数据采用Excel软件进行统计分析。
2 结果与分析
2.1 不同蔗糖浓度对愈伤组织生长的影响
从表4可以看出,适宜诱导愈伤组织的蔗糖浓度范围为60~80 g/L,其愈伤组织的诱导率均达到了100%。愈伤组织的诱导率在一定范围内随着蔗糖浓度的升高而增加,而当蔗糖浓度继续升高时,愈伤组织的诱导率则开始下降。愈伤组织发生时间在试验所设置的蔗糖浓度范围内随着蔗糖浓度的升高而减短。其生长速度在一定范围内随着蔗糖浓度的升高而加快,颜色在一定范围内也随着蔗糖浓度的升高而由浅变深。综合比较发现,诱导愈伤组织生长的蔗糖浓度为60 g/L时,愈伤组织质地最好,呈湿润的瘤状突起,颜色为绿色(图1)。

表4 愈伤组织诱导情况统计

图1 60 g/L蔗糖诱导的愈伤组织
2.2 不同蔗糖浓度对丛生芽生长的影响
从表5可以看出,适宜诱导愈伤组织分化形成丛生芽的蔗糖浓度范围为20~40 g/L,丛生芽的发生时间随着蔗糖浓度的升高而缩短。丛生芽诱导率在一定范围内随着蔗糖浓度的升高而增加;当蔗糖浓度为40 g/L时,丛生芽的诱导率达到最大值(100%),此时芽叶颜色呈绿色(健康状态);当蔗糖浓度超过40 g/L时,丛生芽的诱导率呈下降趋势,且芽叶颜色随着蔗糖浓度的升高而变浅、发黄,甚至枯萎;当蔗糖浓度为60 g/L时,芽、叶的生长速度最快,而当蔗糖浓度继续升高时,其生长速度逐渐减缓。综合比较发现,最佳诱导愈伤组织分化形成丛生芽的蔗糖浓度为 40 g/L(图2)。

表5 丛生芽诱导情况统计

图2 40 g/L蔗糖诱导的丛生芽
2.3 不同蔗糖浓度对壮苗生根的影响
从表6可以看出,适宜丛生芽诱导分化形成不定根的蔗糖浓度范围为40~60 g/L。生根数与生根诱导率在一定的蔗糖浓度范围内都随着蔗糖浓度的升高而增加;当蔗糖浓度为60 g/L时,生根数与生根诱导率达到最大值;当蔗糖浓度继续上升时,生根数与生根诱导率开始下降。不定根的诱导时间在一定的蔗糖浓度范围内随着蔗糖浓度的升高而呈现缩短趋势;当蔗糖浓度为40 g/L时,不定根诱导的时间最短,为18 d。不定根的生长情况也随着蔗糖浓度的升高而呈现不同现象,当蔗糖浓度为60 g/L时,不定根的生长情况最佳,根短而粗壮,呈白色(图3)。
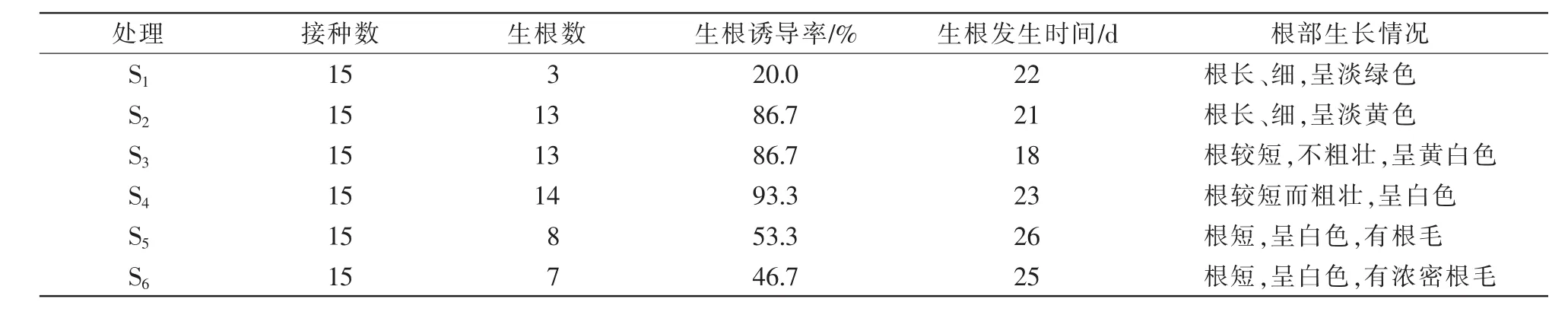
表6 生根诱导情况统计

图3 60 g/L蔗糖诱导的不定根
2.4 炼苗移栽
共移栽组培苗120株,存活118株,存活率为98.3%。
3 结论与讨论
由试验结果可知,诱导愈伤组织生长的最佳蔗糖浓度为60 g/L,此浓度下愈伤组织生长速度较快,生长情况佳,这与付迎军等[12]研究结论基本一致。诱导丛生芽生长的最佳蔗糖浓度为40 g/L,此浓度下丛生芽生长速度较快,丛芽数多。诱导不定根生长的最佳蔗糖浓度为60 g/L,此浓度下根较短而粗壮,呈白色;在0~60 g/L的蔗糖浓度范围内,诱导不定根生长的效果随着蔗糖浓度的升高而增强,但当蔗糖浓度再次上升后,诱导效果则开始减弱,表现为生根诱导率降低,根短,有根毛。这与卢其能[13]的研究结果相似。经炼苗移栽后,组培苗存活率高达98.3%。
蔗糖是组织培养中最常用的碳源。在植物组织培养中,糖的用量不仅影响培养物的生长速度和生长量,还影响其代谢水平、次生代谢物的合成以及细胞的形态和发生。因此,建议在索邦百合离体培养过程中,将诱导生长的蔗糖浓度调节至最适宜的浓度值,从而建立高质量的索邦百合快速离体繁殖体系,为索邦百合组织培养的工厂化生产和其他后续科学研究奠定良好的基础。

