艾叶挥发油成分分析及其抗氧化活性谱效关系*
李雨铭,李齐激,3,王 丽,杨 艳,葛丽娟,杨小生,3
(1 贵州中医药大学,贵州 贵阳 550025;2 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014;3 贵州省天然产物高效利用工程研究中心,贵州 贵阳 550014)
艾叶为菊科蒿属多年生草本植物艾ArtemisiaargyiLevl.et Vant的干燥叶,广布于全国各地[1]。作为我国重要的药食用植物资源,艾叶在医药保健与生活日常中得到广泛应用,特别是在抗氧化、抗炎、抗菌、抗过敏、驱虫等方面[2-3]。挥发油作为艾叶功效不可或缺的物质基础,目标组分的清晰与否对后续精油加工与产品研制至关重要。由于挥发油难分离的特殊性,现有艾叶挥发油主要含有单萜、倍半萜、酮、醛、醚、脂肪酸等多种类型的化合物[4];针对艾叶挥发油的研究主要集中在成分组成、功效与生物机制方面[5-6],关于其组成成分与功效的关系构建研究鲜见报道。前述原因的叠加,造成了艾叶挥发油主要功效组分的不明晰,也成为制约后续精油加工与产品研制的重要影响因素。
随着现代药学技术的发展,通过把生物活性与光谱、色谱行为相结合的“谱效关系”得到广泛应用,该方法为阐明传统药物功效与物质间的相关性提供新的思路[7-9]。本文以艾叶挥发油在医药、日化产品中广泛应用的抗氧化活性为基础,通过把挥发油GC-MS成分分析与抗氧化活性相关结合,利用聚类分析法、灰色关联度法构建艾叶挥发油不同类型组分与抗氧化活性的谱效关系,为艾叶挥发油精制及其产品加工过程提供参考。
1 仪器与试剂
艾叶于2021年6月购于山东枣庄(S1)、广西南宁(S2)、陕西商洛(S3)、河南南阳(S4)、北京(S5)、福建平和(S6)、湖北襄阳(S7)、安徽淮南(S8)、贵州黔南(S9)、江苏徐州(S10)等地,经贵州中医药大学孙庆文教授鉴定为菊科蒿属艾(ArtemisiaargyiLevl.et Vant)。
乙醇(分析纯,批号:20210623);1,1-二苯基-2-三硝基苯阱(DPPH),上海梯希爱化成工业发展有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二胺盐(ABTS,批号:20220407),南京建成生物研究所;总抗氧化能力试剂盒(FRAP,批号:20220406),南京建成生物研究所;HP6890/5975C 气相色谱-质谱联用仪,美国Agilent公司;Vaioskan LUX酶标仪,赛默飞世尔科技(中国)有限公司;JA2003电子天平,上海菁海仪器有限公司。
2 实验方法与结果
2.1 色谱条件
色谱柱为Agilent HP-5MS弹性石英毛细管柱(60 m×0.25 mm×0.25 μm),柱温40 ℃,保持1 min,以3.5 ℃/min升温至180 ℃,再以10 ℃/min升温至310 ℃,运行62 min;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压15.98 psi,载气流量1.0 mL/min;分流比20:1;溶剂延迟6 min。
离子源为EI源;离子源温度230 ℃;四级杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1824 V;接口温度280 ℃;质量范围29~500 amu。对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist20和Wiley275标准质谱图,确定艾叶挥发性化学成分,用峰面积归一化法测定了各化学成分的相对质量分数。
2.2 试验方法
2.2.1 艾叶挥发油提取
参照《中国药典》(2020年版)一部中挥发油提取法-水蒸气蒸馏法进行提取[10]。分别取粉碎后不同产地艾叶各50 g,置于500 mL圆底烧瓶中,加入300 mL蒸馏水,进行水蒸气蒸馏6 h,待挥发油含量不再增加时停止加热,取油相成分密闭保存。
2.2.2 抗氧化活性测定
(1)溶液制备
取适量S1~S10艾叶挥发油,分别制备成质量浓度为50、100、150、200、250、300 μg/mL的样品溶液。精密称取Vc适量,依次制备成相同质量浓度对照品溶液,-5 ℃避光保存,现配现用[11]。
(2)DPPH自由基清除能力测定
吸取100 μL,0.1 mmol/L DPPH与等体积不同质量浓度样品溶液于96孔板内(避光孵育30 min),以无水乙醇为对照品,517 nm处测定吸光度Ai。无水乙醇与等体积0.1 mmol/L DPPH溶液混合液吸光度Ae,无水乙醇与等体积样品溶液混合液吸光度Aj,重复三次取平均值[11]。按照如下公式计算样品溶液自由基清除率:
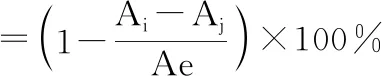
(3)ABTS阳离子自由基清除能力测定
吸取10 μL系列浓度为0.1、0.2、0.4、0.8、1.0 mM的Trolox溶液,与20 μL酶溶液(配置溶液)、170 μL ABTS溶液混合,以蒸馏水为对照品(室温反应6 min),405 nm处测定吸光度,以吸光度值为横坐标,Trolox溶液浓度为纵坐标绘制标准曲线。吸取10 μL待测样品以Trolox溶液配置方式测定吸光度,重复三次取平均值[11]。根据标准曲线计算待测样品的当量浓度,计算该浓度下Trolox的摩尔浓度除以待测样品的质量浓度,最后以mmol/g表示。
(4)总抗氧化能力测定
吸取5 μL系列浓度为0.15、0.3、0.6、0.9、1.2、1.5 mM的FeSO4-7H2O溶液,与180 μL的FRAP溶液混合,蒸馏水为对照品,37 ℃下孵育3~5 min,593 nm处测定吸光度,各孔减去空白组OD值后,以FeSO4-7H2O溶液的OD值为横坐标,FeSO4-7H2O溶液的浓度为纵坐标绘制标准曲线。吸取5 μL待测样品以FeSO4-7H2O溶液配置方式测定吸光度值,重复三次取平均值[11]。根据标准曲线,将样品测定的吸光度值(减去空白组吸光度值后)获得相应的FeSO4-7H2O浓度,表示为当量浓度(FRAP值)。结果以每mg样品中FeSO4-7H2O的量(mmol/L)表示。
2.2.3 统计学方法
采用SPSS 26.0进行数据处理;Origin、Tbtools进行图表绘制。
2.3 艾叶挥发油中成分GC-MS分析
经GC-MS分析,峰面积归一化法确定了10产地艾叶挥发油的相对含量,采用Nist20和Wiley275标准质谱图比对,按80以上匹配度进行归属,从挥发油中共计鉴定化学成分428种,10产地艾叶挥发油总离子流图见图1。
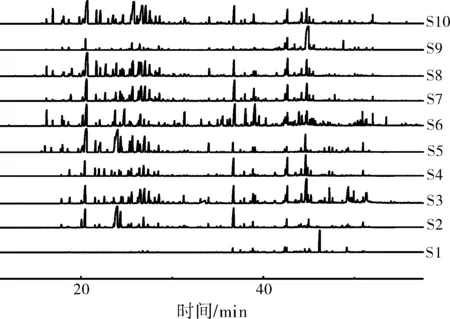
图1 不同产地艾叶挥发油GC-MS总离子流图
从S1~S10的艾叶挥发油分别鉴定出78、104、118、79、95、136、109、123、110和118种成分,相对含量依次为85.729%、84.155%、79.632%、76.783%、92.234%、73.906%、88.861%、88.937%、78.938%和87.827%。根据这些化学成分的特点,10产地艾叶挥发油成分类型有倍半萜类(110种)、单萜类(111种)、长链不饱和烃类(85种)、长链烷烃类化合物(9种)、酚类化合物(18种)和其他类化合物(95种),其中倍半萜类和单萜类成分占51.63%。
从单一产地挥发油成分占比来看,各产地仍以倍半萜类和单萜类成分为主,如山东枣庄(S1)产样品中含大量兰香油奥(31.257%)、石竹烯(3.509%)等,广西南宁(S2)产样品中崖柏酮(22.179%)、石竹烯(10.068%)、桉油精(7.705%)等接近40%,北京(S5)产样品中含丰富的[1S-(1α,4α,5α)]-4-甲基-1-(1-甲基乙基)二环[3.1.0]己烷-3-酮(17.403%)、桉油精(14.341%),贵州黔南(S9)产样品中含有大量的长马鞭草酮(35.32%)、氧化石竹烯(9.366%)等。与之前报道相比,倍半萜类和单萜类主成分基本趋于一致,其它成分变化复杂,主要影响因素或与生长环境、采收期、处理方式等因素有关[12-13]。
2.4 抗氧化活性评价
2.4.1 DPPH自由基清除作用
10个产地艾叶挥发油都具有抑制DPPH自由基产生的作用,并随着挥发油浓度的增加,自由基清除率呈上升趋势(图2)。运用SPSS 26.0计算不同产地的艾叶挥发油清除DPPH自由基的IC50值。S1~S10的艾叶挥发油对DPPH自由基的IC50分别为0.762、0.951、1.600、3.080、1.041、2.045、2.129、1.122、2.937、1.514 mg/mL,阳性对照Vc的IC50为7.08×10-8mg/mL。表明:10个产地艾叶挥发油均具有抑制DPPH自由基产生的作用。DPPH自由基清除能力山东枣庄(S1)最好,其余依次为S2>S5>S8>S10>S3>S6>S7>S9>S4。
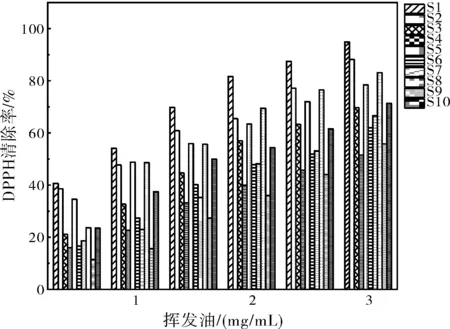
图2 十个产地艾叶挥发油对DPPH自由基的清除作用
2.4.2 ABTS阳离子自由基清除作用
10个产地艾叶挥发油均可抑制ABTS阳离子自由基的产生,以Trolox吸光度值为横坐标(X),Trolox溶液浓度为纵坐标(A)进行回归,得到回归方程为A=-0.9867X+1.1394(r=0.9957)。经测定,S1~S10的艾叶挥发油清除ABTS阳离子自由基的能力分别是0.9688、0.8766、0.6145、0.3972、0.8106、0.5957、0.5887、0.7049、0.4770、0.6801 mmol/g。清除ABTS阳离子自由基的能力山东枣庄(S1)最好,其余依次为S2>S5>S8>S10>S3>S6>S7>S9>S4。结果与清除DPPH自由基的能力一致。
2.4.3 总抗氧化能力测定
10个产地艾叶挥发油的总抗氧化能力具有差异,以FeSO4-7H2O溶液的OD值为横坐标(X),各OD值对应的FeSO4-7H2O溶液的浓度为纵坐标(A)进行回归,得到回归方程为A=0.116X+0.1157(r=0.9984)。经测定,S1~S10的艾叶挥发油的总抗氧化能力(FRAP)均值分别为0.2597、0.1783、0.1573、0.1308、0.1752、0.1429、0.1527、0.1694、0.1340、0.1663 mmol/L。对照品Vc的FRAP均值为8.004 mmol/L。S1~S10总抗氧化能力均小于对照品,总抗氧化能力山东枣庄(S1)最好,其余依次为S2>S5>S8>S10>S3>S7>S6>S9>S4,该结果与DPPH、ABTS法一致。总体来说,山东枣庄(S1)、广西南宁(S2)、北京(S5)的抗氧化能力最好。
2.5 谱效关系的构建
聚类分析是通过成分差异分析物种相似性与差异性一种方法,而灰色关联度可把化学组分与药效指标进行有效联系,二者结合在谱效关系构建中也有广泛的应用基础[7-8]。
2.5.1 聚类分析
采用SPSS 26.0软件对十个产地的艾叶挥发油成分的相对含量进行聚类分析(图3)。取阈值为10时,样品阈值分割后可分为4类,S3、S4、S5、S6、S7、S8、S10聚为第1类,S2单独聚为第2类,S1单独聚为第3类,S9单独聚为第4类。

图3 十个产地艾叶挥发油化学成分聚类分析结果
对比各聚类从成分相对含量可知,第1类(S3、S4、S5、S6、S7、S8、S10)共有成分相对含量在56.61%~73.04%间,如顺式对薄荷-2-烯-1-醇、乙酸香芹酯、4(14),11-桉叶二烯、桉油精、马鞭草烯醇、顺式香芹醇、1-石竹烯、Α-葎草萜、氧化石竹烯等。第2~4类除与第1类有相似的共有成分外,多种丰量物质的出现是其单独聚类的关键因素,如第2类(S1)中含有兰香油奥(31.257%)、右旋大根香叶烯(4.178%)、棕榈酸(4.847%)、桉油烯醇(4.336%),第3类(S2)含有大量的崖柏酮(22.179%)、侧柏酮(7.318%)、4-萜品醇(6.064%)、二氢香芹醇(3.377%)、甲基环戊烷(2.279%)、4-异丙基甲苯(2.448%),第4类(S9)含有大量的长马鞭草酮(35.32%)以及樟脑(2.078%)等。
2.5.2 灰色关联度分析
结合挥发油组分与功效相关性、日常使用往往以成分类群为主的应用特点等因素[14],本文将S1~S10中艾叶挥发油化学成分分为长链烷烃类(A)、长链不饱和烃类(B)、酚类(C)、单萜类(D)、倍半萜类(E)、其他类化合物。进而与抗氧化活性进行灰色关联度分析,通过关联度(表1)明确药效指标和化学成分之间的相关性[15]。
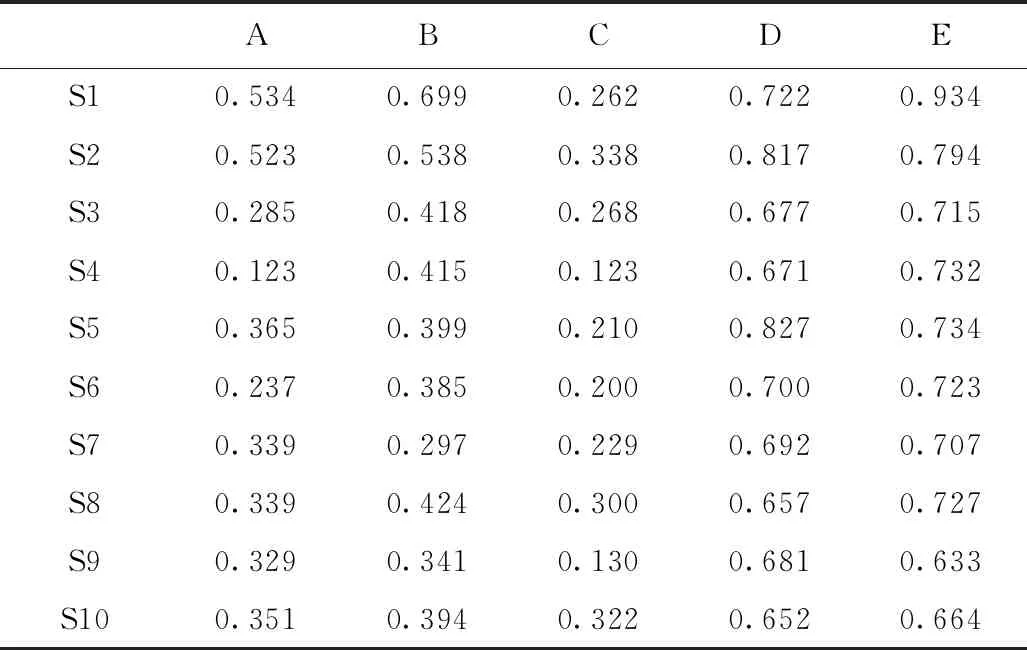
表1 特征成分与IC50的关联度
由表1可知,S1~S10中单萜(D)和倍半萜类(E)化合物与抗氧化活性的关联度均大于0.6,说明其与抗氧化活性紧密相关。如S1中,倍半萜类对DPPH自由基的清除贡献最大(0.934),其中主成分兰香油奥(含量为31.257%)也是得到广泛关注具有显著抗氧化活性的物质[16]。这与单萜、倍半萜类化合物作为重要抗氧化剂被广泛应用的事实基本一致[17-18]。
3 结 论
本研究共分析了10个产地的艾叶挥发油的化学成分,共鉴定出428种化学成分,相对含量在73.906%~92.234%之间。抗氧化活性检测发现山东枣庄(S1)、广西南宁(S2)、北京(S5)产艾叶挥发油抗氧化能力明显高于其他产地。进一步的谱效关系分析揭示了单萜、倍半萜为其抗氧化活性的主要成分类群。
总体来说,10个产地的艾叶挥发油化学成分存在一定差异,也表现出一定的抗氧化活性,其活性均与其含有丰富的单萜、倍半萜有着直接的关系。该谱效关系的构建为艾叶挥发油后续产品精制和相关产品研发提供重要依据。

