芸豆体外模拟消化液的抗氧化和α-淀粉酶抑制活性及其淀粉水解动力学
石 娟 包鸿慧 张 佩 张倜培 周 睿
(湖北文理学院食品科技学院,湖北 襄阳 441053)
芸豆又名四季豆和菜豆,全球种植面积仅次于大豆,尤其在亚洲国家被广泛应用于焙烤产品、豆馅、沙拉及罐头等传统食品中[1]。芸豆富含膳食纤维、淀粉、蛋白质、植物化学物质及微量元素等多种营养组分[2]。与马铃薯淀粉和谷类淀粉相比,芸豆淀粉(C-型)具有较高的直链淀粉含量、更加牢固的直链淀粉间交互作用及较低的淀粉消化率[3]。芸豆蛋白无麸质,富含赖氨酸且消化率高,是人类膳食蛋白质的优质来源,具有降胆固醇、癌症预防及2型糖尿病防治等多重健康益处[4]。此外,酚酸、类黄酮(儿茶素和原花青素等)和缩合单宁是芸豆籽粒主要的酚类化合物,具有良好的抗氧化、降血糖、抗炎、抗动脉粥样硬化、抗肿瘤及抗衰老等功效[5]。
目前,有关芸豆的研究主要集中在营养组分[5],功能活性[1,6-7],加工工艺对物化特性、活性组分及功能活性的影响[3,8-10]等方面。芸豆各营养组分只有经人体胃肠道消化吸收并参与新陈代谢,才能有效发挥其最大功效。体外模拟消化是通过体外构建与体内消化环境相近的消化模型,模仿口腔、胃和肠道阶段对食物的消化分解历程,已被广泛应用于食物中活性组分的生物可及性和生物可利用性评估[10-14],但芸豆体外胃肠模拟消化的研究仅局限于芸豆α-淀粉酶抑制剂[10]、芸豆蛋白[13]及芸豆淀粉[14]的体外消化特性研究,而有关煮制芸豆体外胃肠模拟消化液的生物活性及其淀粉消化动力学与葡萄糖扩散性能的研究尚未见报道。
研究拟选用3种花色芸豆(白、红和黑色)为原料,通过体外胃肠模拟消化模型,分析煮制芸豆消化液总酚、总黄酮和酸性多糖含量、抗氧化活性与α-淀粉酶抑制活性,以及消化过程中淀粉水解动力学与葡萄糖扩散性能,并探究消化液活性组分含量与体外生物活性及淀粉水解特征参数的相关性,旨在合理认知与评价全芸豆食品的生理功效,为不同花色芸豆资源的功能性开发与应用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
黑芸豆:产地为黑龙江省哈尔滨市,长度为(9.82±0.79) mm,宽度(5.76±0.56) mm,单粒重(0.20±0.03) g(n=50),市售;
红芸豆:产地为山西省大同市,长度为(16.12±1.33) mm,宽度(7.28±0.78) mm,单粒重(0.54±0.10) g(n=50),市售;
白芸豆:产地为湖北省恩施州利川市,长度为(25.24±2.08) mm,宽度(16.34±1.35) mm,单粒重(1.82±0.36) g(n=50),市售;
α-淀粉酶(A3176)、胃蛋白酶(P7000)、胆汁盐(48305)、胰酶(P7545)、α-葡萄糖苷酶(G5003):美国Sigma-Aldrich公司;
2,2-联苯基-1-苦基肼基(DPPH)、2,2′-联氮-双(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(ABTS)、4-硝基酚-α-D-呋喃葡萄糖苷(pNPG)、2,4,6-三吡啶基三嗪(TPTZ):上海阿拉丁有限公司;
L-抗坏血酸(VC)、芦丁、没食子酸、β-D-半乳糖醛酸:上海源叶生物科技有限公司;
D-葡萄糖测定试剂盒:爱尔兰Megazyme公司;
其他化学试剂均为国产分析纯。
1.1.2 仪器与设备
高速多功能粉碎机:BO-1000S1型,永康市铂欧五金制品有限公司;
电子分析天平:FA1004N型,上海精密科学仪器有限公司;
高速离心机:LC-LX-L6OD型,上海力辰邦西仪器科技有限公司;
恒温振荡水浴锅:SHA-B型,上海力辰邦西仪器科技有限公司;
鼓风干燥箱:LDO-9070A型,上海龙跃仪器设备有限公司;
紫外可见分光光度计:L5S型,上海精密仪器仪表有限公司;
纯水机:Milli-Q 型,美国Millipore公司。
1.2 试验方法
1.2.1 样品预处理 精选籽粒饱满、质地均匀、无虫蚀劣变的干净芸豆,粉碎,过60目筛,密封避光冷藏(-20 ℃)备用。其中,白芸豆粉、红芸豆粉及黑芸豆粉淀粉含量分别为(46.84±0.31)%,(49.44±0.55)%,(48.49±0.82)%;水分含量分别为(10.31±0.26)%,(9.35±0.21)%,(9.82±0.18)%;蛋白质含量分别为(22.27±0.52)%,(24.00±0.37)%,(23.52±0.49)%;脂肪含量分别为(1.86±0.04)%,(1.61±0.06)%,(2.11±0.08)%;灰分含量分别为(4.01±0.07)%,(4.55±0.15)%,(4.16±0.11)%。
1.2.2 体外模拟消化 参照Minekus等[11]的方法并修改。准确称取0.5 g豆粉,加入装有5 mL蒸馏水的消化试管中。室温磁力搅拌10 min,旋盖封口,95 ℃水浴20 min,37 ℃恒温水浴锅冷却得豆粉糊液。
(1) 体外模拟口腔消化阶段(SSF):向豆粉糊液中加入3.5 mL磷酸盐缓冲溶液(0.05 mol/L,pH 7.0)以及3粒玻璃珠,震荡1 min,依次添加0.5 mLα-淀粉酶液(1 gα-淀粉酶悬浮于10 mL蒸馏水中,3 500 r/min离心10 min)和150 μL CaCl2溶液(50 mmol/L),混匀,100 r/min、37 ℃水浴5 min。
(2) 模拟胃液消化阶段(SGF):向模拟口腔消化液中加入5 mL蒸馏水,并用1 mol/L HCl溶液迅速调节体系pH至3.0,添加1 mL胃蛋白酶液(1%)和30 μL CaCl2溶液,100 r/min、37 ℃水浴2 h。
(3) 模拟肠道消化阶段(SIF):用1 mol/L NaOH溶液迅速调节模拟胃消化体系pH至7.0,依次加入10 mL磷酸盐缓冲溶液、5 mL胰酶和胆汁盐混合溶液(胰酶20 mg/mL,胆汁盐50 mg/mL)和240 μL CaCl2溶液,100 r/min、37 ℃水浴2 h。消化结束后,将消化管于沸水浴中煮制5 min,冷却至室温。5 000 r/min离心10 min并收集上清液,用蒸馏水定容,用于活性组分含量、抗氧化及α-淀粉酶抑制活性测定。同时,将模拟消化液直接转入透析袋中进行模拟葡萄糖吸收特性评价。
1.2.3 活性组分测定
(1) 总酚含量:福林酚比色法。
(2) 总黄酮含量:三氯化铝比色法。
(3) 酸性多糖含量:硫酸咔唑比色法[15]。
1.2.4 抗氧化活性测定
(1) DPPH自由基清除活性:参照Brand-Williams等[16]的方法。
(2) ABTS+自由基清除活性:参照Re等[17]的方法。
(3) 铁离子还原抗氧化能力(FRAP):参照Benzie等[18]的方法。
1.2.5α-淀粉酶抑制活性测定 参照Tan等[19]的方法并略作修改。采用0.1 mol/L磷酸缓冲液(pH 6.9)配制小麦淀粉溶液(质量分数为1%),并煮沸15 min。α-淀粉酶溶液(1 U/mL)用含有6.7 mmol/L NaCl的磷酸缓冲液配制。加入20 mL 3,5-二硝基水杨酸(96 mmol/L)和8 mL 酒石酸钾钠(5.31 mol/L,2 mol/L NaOH配置),混匀,加入12 mL去离子水稀释制备DNS溶液。将500 μLα-淀粉酶与500 μL样品混匀,37 ℃孵育10 min。加入500 μL淀粉溶液,孵育10 min,加入1 mL DNS试剂,沸水浴灭酶5 min,冷却,加入10 mL去离子水,混匀,测定540 nm处吸光度,并按式(1)计算α-淀粉酶活性抑制率。
ω=[1-(A3-A4)/(A1-A2)]×100%,
(1)
式中:
ω——α-淀粉酶活性抑制率,%;
A1——非抑制组,即磷酸缓冲液、淀粉液、酶液及DNS试剂混合体系的吸光值;
A2——空白对照组,即磷酸缓冲液、淀粉液及 DNS试剂混合体系的吸光值;
A3——抑制组,即样品、淀粉液、酶液及DNS试剂混合体系的吸光值;
A4——背景对照组,即样品、淀粉液及DNS试剂混合体系的吸光值。
1.2.6 芸豆淀粉消化性能测定 参照Zhang等[20]的方法并略作修改。从模拟口腔消化结束阶段、模拟胃消化结束阶段以及模拟肠消化阶段(0,10,20,30,60,90,120 min)分别等量量取0.1 mL消化液转移至装有0.9 mL 95%乙醇的微量离心管中,旋盖涡流震荡混匀,终止酶反应,12 000 r/min离心5 min取上清液,采用GOPOD试剂盒法测定消化液中释放的葡萄糖含量。并分别按式(2)~式(5)计算淀粉水解率(HI)以及快速消化淀粉(RDS)、缓慢消化淀粉(SDS)和抗性淀粉(RS)含量。
HI=[(At-A)×0.9]/W×100%,
(2)
RDS=[(A20-A)×0.9]/W×100%,
(3)
SDS=[(A120-A20)×0.9]/W×100%,
(4)
RS=[1-(A120-A)×0.9/W]×100%,
(5)
式中:
At——体外模拟消化过程中t时刻释放的葡萄糖量,mg;
A20、A120——模拟肠消化20,120 min后释放的葡萄糖量,mg;
A——消化前混合体系所含的游离葡萄糖量,mg;
W——淀粉总质量,mg。
C=C∞[1-exp(-Kt)],
(6)
式中:
C——水解过程中t时刻的淀粉水解率,%;
C∞——淀粉水解的平衡浓度,%;
K——一级反应动力学速率常数,min-1。
1.2.7 消化液葡萄糖扩散性能测定 参照Zhang等[20]的方法并略作修改。将消化产物转入透析袋(分子量截留值3 500 Da)中,置于装有450 mL磷酸缓冲液(pH 6.8)的烧杯中,37 ℃恒温水浴,分别于0,10,20,30,60,90,120,150,180 min量取0.1 mL等份样品,采用GOPOD试剂盒测定透析液中葡萄糖浓度。每次等量取出样品后,再等量补充0.1 mL磷酸缓冲液于烧杯中,并按式(7)计算消化液葡萄糖扩散速率。
V=Gt/t,
(7)
式中:
V——葡萄糖扩散速率,μg/min;
Gt——透析过程中t时刻透析液中的葡萄糖量,μg;
t——透析时间,min。
1.2.8 数据处理 所有试验平行测定3次,结果表示为平均值±标准差。采用Excel 2019软件进行基本数据统计;采用SPSS 26.0软件进行Duncan多重比较及相关性分析;采用ANOVA算法进行单因素方差分析;采用Origin 9.0软件进行图表绘制。显著性水平选定P<0.05。
2 结果与分析
2.1 芸豆消化液的活性组分含量
由表1可知,3种芸豆消化液总酚含量为14.80~17.47 mg GAE/g,高于王何柱等[22]的研究结果;总黄酮含量为3.63~6.32 mg RE/g以及酸性多糖含量为34.00~39.38 mg AGE/g,其中黑芸豆消化液的总酚、总黄酮及酸性多糖含量最高,白芸豆的最低。Kan等[23]研究发现,26种芸豆总黄酮含量为0.19~7.05 mg RE/g,与试验测定值略有差异,且其对原料生豆粉中水溶性膳食纤维的半乳糖醛酸的测定值(0.15%~0.60%)远低于试验测定结果。此外,梁亚静等[24]研究发现,黑芸豆总酚含量为7.3 mg GAE/g,总黄酮含量为2.4 mg RE/g,低于试验煮制黑芸豆消化液的测定值(17.47 mg GAE/g和6.32 mg RE/g),这可归因于体外胃肠模拟消化体系有利于芸豆粉中酚类物质及多糖等活性组分的释放[25]。
2.2 芸豆消化液的抗氧化活性
由表2可知,3种芸豆消化液对DPPH自由基与ABTS+自由基清除能力及铁离子还原抗氧化能力分别为6.74~8.75,45.74~49.75,4.39~19.82 mg AAE/g。黑芸豆和红芸豆消化液的抗氧化能力明显强于白芸豆,且存在显著性差异(P<0.05),与王何柱等[22]的结论保持一致,可能是由不同花色芸豆消化液中的多酚、黄酮类及酸性多糖等抗氧化活性物质含量差异所致。

表1 芸豆消化液总酚、总黄酮及酸性多糖的含量†
2.3 芸豆消化液对α-淀粉酶的抑制活性
由表2可知,3种芸豆消化液对α-淀粉酶具有一定的抑制能力,活性抑制率为20.99%~31.22%,黑芸豆消化液抑制能力最强,红芸豆次之,白芸豆最弱,且样品间抑制率差异显著(P<0.05),可归因于芸豆籽粒中富含α-淀粉酶抑制剂[26],但体外模拟胃消化环境易引起α-淀粉酶抑制剂活性组分的破坏损失,导致其α-淀粉酶抑制活性有所降低[10]。

表2 芸豆消化液的抗氧化活性与α-淀粉酶抑制活性†
2.4 芸豆淀粉体外消化动力学
由图1可知,在0~5 min模拟口腔消化阶段(SSF)与125~245 min模拟肠消化阶段(SIF),由于淀粉酶的存在,促使淀粉水解速率加快;而在5~125 min模拟胃消化阶段(SGF),由于淀粉酶的缺失与低pH环境,导致淀粉水解速率变缓。SSF消化阶段,白芸豆、红芸豆及黑芸豆的淀粉消化水解率分别为5.75%,4.34%,3.79%;SIF消化结束时,3种芸豆淀粉水解率分别提升至52.73%,49.11%,47.28%。模拟肠消化阶段(SIF)前20 min内,3种芸豆淀粉消化速率快速增加,随后淀粉消化曲线趋于平缓。与白芸豆相比,红芸豆与黑芸豆淀粉水解率在SIF阶段20 min时分别下降了15.46%,19.37%,在SIF消化阶段120 min时分别下降了6.87%,10.34%。

图1 芸豆淀粉体外模拟消化Figure 1 In vitro simulated digestion of kidney bean starch
由表3可知,3种芸豆淀粉消化过程曲线拟合性较好(R2>0.96),芸豆淀粉的水解动力学速率常数K为0.061~0.081 min-1,其中红芸豆与黑芸豆的K值较小,白芸豆的较大,表明红芸豆与黑芸豆淀粉的消化速率明显低于白芸豆。王苗苗等[3]研究发现,芸豆籽粒细胞淀粉消化速率K为0.000 1 min-1,消化程度为4.21%,远低于试验结果,主要是由于其采用猪胰酶体外酶解生芸豆试验体系与试验选用的煮制芸豆体外胃肠模拟消化模型存在显著差异所致。白芸豆中快速消化淀粉含量(RDS)较高为42.05%,缓慢消化淀粉含量(SDS,10.67%)与抗性淀粉(RS,47.28%)含量相对较低,而红芸豆与黑芸豆RDS含量相对较低(35.55%和33.91%),SDS与RS含量相对较高(13.55%和13.37%,50.90%和52.72%)。马梦婷等[27]研究发现,10种蒸煮杂豆粉的RDS含量为61.2%~70.6%,明显高于试验结果,可能是由于原料品种来源及选用的体外淀粉消化方式不同所致。

表3 芸豆淀粉体外模拟消化特征参数†
2.5 芸豆消化液中葡萄糖扩散特性
由图2可知,透析液中葡萄糖浓度呈先快速上升后增加变缓的趋势,而葡萄糖扩散速率呈先快速降低后趋于平缓的趋势。透析0~20 min,3种芸豆消化液中葡萄糖扩散能力较强,但透析20~180 min,葡萄糖扩散速率明显减慢。当透析时间为10 min时,白芸豆、红芸豆和黑芸豆透析液中葡萄糖质量浓度分别为78.60,71.07,68.54 mg/L,相应的葡萄糖扩散速率分别为3 536.80,3 198.07,3 084.52 μg/min。透析结束时,3种芸豆透析液中扩散葡萄糖最终质量浓度分别提高至113.48,105.55,101.77 mg/L,但相应的葡萄糖扩散速率(283.69,263.88,254.42 μg/min)却快速降低了91%以上。与白芸豆相比,透析180 min时,红芸豆与黑芸豆透析液葡萄糖浓度分别下降了6.99%,10.32%,表明红芸豆与黑芸豆消化液中的葡萄糖扩散能力明显弱于白芸豆。这可能与消化液体系中活性物质的组成及含量差异性有关。Zhang等[20]研究发现,具有增强体系黏稠特性的水溶性膳食纤维(多糖)有助于延缓消化释放葡萄糖的扩散性与吸收性。

图2 芸豆消化液中葡萄糖的扩散能力Figure 2 Glucose diffusion ability of kidney bean digestive solution
2.6 相关性分析
由表4可知,芸豆消化液活性组分总酚、总黄酮及酸性多糖含量与3种抗氧化活性均呈显著正相关性(r>0.99,P<0.05),表明芸豆经体外胃肠模拟消化后释放的总酚、总黄酮及酸性多糖等活性组分对消化液表现出的抗氧化活性起到重要作用,与梁亚静等[24]的结论一致。芸豆消化液活性组分与葡萄糖扩散速率V180呈显著负相关性(r>0.99,P<0.05),表明芸豆相关活性组分对消化液中的葡萄糖扩散起到了一定的抑制作用,可能归因于:① 芸豆模拟消化期间酚类物质不断释放,一定程度上减弱了淀粉酶的消化降解,导致豆粉颗粒细胞破裂崩解程度变缓,消化残渣颗粒的阻碍作用延迟了葡萄糖的扩散;② 消化体系释放的水溶性多糖大分子有助于消化液黏稠度的增强,从而抑制葡萄糖的扩散[20,28];③ 可溶性膳食纤维表面吸附的带正电荷花色苷可通过与葡萄糖分子活性羟基相结合,促进葡萄糖的吸附及葡萄糖扩散的抑制[29]。芸豆消化液活性组分与α-淀粉酶抑制率及淀粉水解速率常数(K)的相关性不显著,但Pearson相关系数r高达0.88以上,可能是由于芸豆消化体系中其他组分(可溶性蛋白、多肽等)及组分间的协同效应(多酚—蛋白及多酚—多糖等)对α-淀粉酶抑制活性和淀粉消化吸收性产生了重要影响[9,30]。因此,颜色较深芸豆品种有利于胃肠模拟消化体系的抗氧化活性和α-淀粉酶抑制活性的增强,以及淀粉消化速率与释放葡萄糖扩散速率的减弱,具有潜在的健康促进功效。
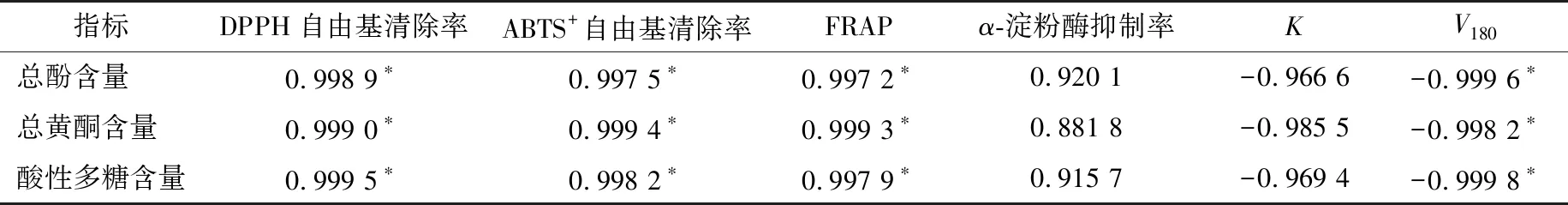
表4 芸豆消化液活性组分与体外抗氧化和α-淀粉酶抑制活性及淀粉消化特征参数的相关性†
3 结论
利用体外胃肠模拟消化模型研究了3种芸豆消化液的总酚、总黄酮和酸性多糖含量、抗氧化活性及α-淀粉酶的抑制活性,并考察了淀粉体外酶解动力学与葡萄糖扩散性能。结果表明,3种芸豆消化液均具有良好的抗氧化活性和一定的α-淀粉酶抑制活性。黑芸豆消化液总酚、总黄酮和酸性多糖含量、α-淀粉酶抑制活性以及缓慢消化淀粉和抗性淀粉含量最高,而淀粉水解率、一级动力学淀粉水解速率、平衡浓度、快速消化淀粉含量以及消化液葡萄糖扩散量和扩散速率均最低。Pearson相关性分析表明,芸豆消化液活性组分含量与抗氧化活性呈显著正相关,与葡萄糖扩散速率呈显著负相关。后续可进一步研究芸豆体外和体内消化过程中可溶性膳食纤维(多糖)—多酚、多酚—蛋白(多肽)等协同交互效应对芸豆消化活性物质的释放、生物利用率及其生物活性的影响机制。

