丹参饮预处理对心肌缺血再灌注大鼠血流动力学和线粒体能量代谢的影响
呼明哲, 李湘玲, 金静怡, 王敏燕, 高俊杰*
(1.上海中医药大学附属曙光医院,上海 201203;2.国家中医心血管病临床医学研究中心分中心,上海 201203)
冠状动脉闭塞引起的缺血性心脏病是威胁人类健康的主要死亡原因之一,目前对心肌缺血主要采用经皮冠状动脉介入、溶栓、冠状动脉搭桥等恢复心脏血供的救治措施,但治疗过程中出现的心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury,MIRI)严重影响疗效[1-2]。MIRI属于中医“胸痹”“心痛”范畴,血液运行失常,血脉瘀阻是其主要病机,大多从调节气血方面进行干预[3]。丹参饮是具有活血化瘀功效的中药经典方剂,方中丹参可有效改善血液流变学指标和红细胞变形性,降低血液黏稠度[4]。课题组前期研究发现,丹参饮预处理能降低I/R大鼠心肌梗死面积,减轻炎症反应,减少线粒体肿胀,具有防治MIRI的作用[5-6]。
MIRI发病机制十分复杂,一般认为与氧自由基的产生、线粒体能量代谢紊乱、炎症反应、心肌细胞凋亡等因素有关。心肌缺血缺氧时,线粒体功能和结构受损,Cyt-C水平升高,促进氧自由基的形成;再灌注时,大量氧自由基产生导致氧化应激,使线粒体通透性增加、膜电位丧失和Cyt-C释放。Cyt-C通过激活caspase途径或通过抑制氧化磷酸化而降低细胞ATP水平进而诱导细胞凋亡,加剧MIRI[7-8],故改善心肌细胞能量代谢、减轻心肌细胞凋亡对防治MIRI至关重要。本研究采用大鼠I/R模型,拟从血流动力学、心肌能量代谢、心肌细胞凋亡3个角度探讨丹参饮抗MIRI的作用及机制。
1 材料
1.1 动物 SPF级Wistar雄性大鼠60只,体质量(220±20)g,购自北京维通利华实验动物技术有限公司上海分公司,实验动物生产许可证号SCXK(沪)2017-0011,饲养于上海中医药大学实验动物中心,室温22~24 ℃,相对湿度50%~55%,给予普通饲料喂养。所有操作均符合实验动物伦理委员会规定,经上海中医药大学实验动物伦理委员会审批通过,伦理号PZSHUTCM9032901。
1.2 试剂与药物 丹参饮由丹参30 g、砂仁6 g、檀香6 g组成,购自上海康桥药业有限公司,由上海中医药大学附属曙光医院制剂室制作,方法为加10倍量水浸泡30 min后煎煮,煮沸后保持微沸1 h,滤过,滤渣加10倍量水继续煎煮1 h,滤过,合并2次滤液,浓缩至生药量1 g/mL,即得。三磷酸腺苷酸(ATP,批号N30M11W114336,纯度≥96.0%)、二磷酸腺苷(ADP,批号S14M11Y112970,纯度≥98.0%)、5-腺苷一磷酸(AMP,批号M14M7Y14791,纯度≥98.0%)均购自上海源叶生物科技有限公司;5-氟尿嘧啶(内标,批号100187-201203,纯度99.6%)购自中国食品药品检定研究院;Cyt-C ELISA试剂盒(批号20200810)购自南京建成生物工程研究所有限公司;TUNEL试剂盒(货号G1501)购自武汉赛维尔生物科技有限公司;cleaved caspase-3(货号9664)、GAPDH(货号5174)、anti-rabbit IgG(货号7074)均购自美国Cell Signaling Technology公司;Bcl-2(货号40639)购自南京川博生物技术有限公司;Bax(货号T40051F)购自艾比玛特医药科技(上海)有限公司。乙酸铵(批号4093405)购自北京迪科马科技有限公司;氨水(批号C10923265),购自上海麦克林生化科技有限公司。
1.3 仪器 PowerLab/4SP型生物信号处理和分析系统,购自埃德仪器国际贸易(上海)有限公司;LC-MS/MS液质联用仪、1260 Infinity液相系统,购自美国Agilent公司,AB API 4000质谱仪、Analyst 1.5.2软件,购自美国Applied Biosystem公司;Nikon Eclipse C1型正置荧光显微镜,购自日本尼康公司;Synergy H1型酶标仪,购自德国Bio-Tek公司。
2 方法
2.1 分组与给药 60只大鼠随机分为假手术组、缺血再灌注(ischemia/reperfusion,I/R)模型组及丹参饮高、中、低剂量组,每组12只。根据大鼠与人给药剂量换算,丹参饮高、中、低剂量组每天分别以8.4、4.2、2.4 g/kg剂量灌胃给药,假手术组、模型组灌胃给予等量双蒸水,每天1次,连续7 d。最后1次用药后1 h内,进行I/R造模。
2.2 造模 参考文献[5-6]报道,钝性剥开大鼠心包膜及胸腺,暴露左心耳及左心室,用6-0无损伤线于左心耳下缘下2 mm处进针,右1/3处出针,结扎左前降支。结扎左前降支时将1张纱布网垫置于结扎处以避免损伤血管,心电图显示ST段抬高,结扎心肌变白即为造模成功,结扎30 min后将丝线结松开,再灌注24 h后结束实验。空白对照组大鼠同法行开胸及心脏穿线,但不打结。
2.3 血流动力学指标检测 造模结束后,大鼠腹腔注射肝素钠(1 200 U/kg)抗凝20 min,腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉,固定后分离右侧颈总动脉,插入PE-50型聚乙烯心导管,心导管在动脉中时测定心率(HR)、主动脉收缩压(SAP)、主动脉舒张压(DAP),连续稳定10 min后将其进一步插入左心室,稳定5 min后测定左室峰压(LVSP)、左室舒张末压(LVEDP)、左室内压最大上升速率(LV+dp/dtmax)及左室内压最大下降速率(LV-dp/dtmax)。
2.4 HE染色 造模结束后取出大鼠心脏,10%甲醛固定,乙醇脱水,石蜡包埋,切片,HE染色,在光镜下观察心肌组织病理形态学变化。
2.5 TUNEL染色 大鼠心脏经石蜡切片后常规脱蜡至水,滴加蛋白酶K工作液,在37 ℃下孵育30 min,滴加3% H2O2室温封闭,滴加破膜工作液,在37 ℃下孵育20 min,滴加TDT酶,置于37 ℃湿盒中孵育2 h,滴加DAPI染液,避光,在37 ℃下孵育10 min,抗荧光淬灭封片剂封片,镜检拍照,计算TUNEL染色阳性率。
2.6 心肌组织能谱检测
2.6.1 样品制备 大鼠心脏用预冷的甲醇-水(50∶50)以10 mL/g比例进行匀浆,4 ℃、12 500×g离心15 min,取10 μL上清,加入190 μL内标溶液[含100 ng/mL 5-氟尿嘧啶的甲醇-水(50∶50)]混匀,4 ℃、12 500×g离心15 min,取上清进样分析,以随行标曲进行定量。
2.6.2 色谱条件 Eclipse XDB-C18色谱柱(4.6 mm×150 mm, 5 μm);流动相水(含2 mmol/L乙酸铵和0.03%氨水)-甲醇(90∶10);体积流量1 mL/min;柱温40 ℃;进样量5 μL;自动进样器温度6 ℃。
2.6.3 质谱条件 电喷雾电离源(ESI),负离子扫描模式;电压-4 500 V;离子源温度600 ℃;离子源Gas1/Gas2 50 psi(1 psi=6.895 kPa);Cur Gas 20 psi;多反应离子监测模式(MRM),碰撞气压力Medium;扫描时间150 ms;去簇电压(DP)、碰撞能量(CE)、碰撞室出口电压(CXP)及用于定量分析的母离子(Q1)、子离子(Q3)参数见表1。
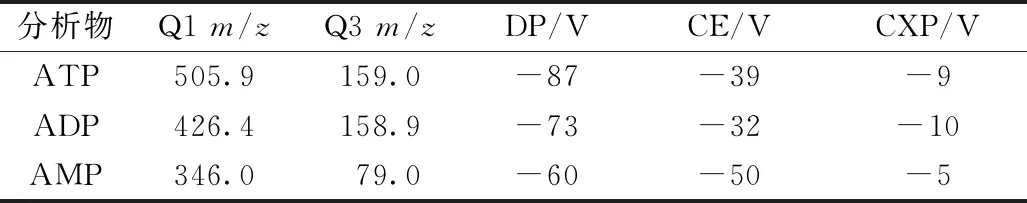
表1 分析物和内标质谱参数
2.7 大鼠心肌组织中Cyt-C水平检测 造模结束后取大鼠新鲜心肌组织,剪成糊糜,采用组织线粒体分离试剂盒,全程低温操作,洗涤、匀浆、多次离心后制成胞浆提取液,采用Cyt-C ELISA试剂盒,按照说明书步骤操作,检测胞浆提取液中Cyt-C水平。
2.8 Western blot检测大鼠心肌组织中cleaved caspase-3、Bcl-2、Bax蛋白表达 取100 mg大鼠心肌组织,经匀浆、裂解、离心后取上清液,采用BCA试剂盒检测蛋白浓度,蛋白变性后电泳、湿转、封闭、洗膜,cleaved caspase-3(1∶1 000)、GAPDH(1∶1 000)、Bcl-2(1∶2 000)、Bax(1∶1 000)抗体孵育后显色,采用Image J软件获得灰度值,计算目的蛋白相对表达。

3 结果
3.1 大鼠一般情况 在造模过程中,模型组、丹参饮高剂量组大鼠各死亡1只。在血流动力学检测过程中,模型组、丹参饮高剂量组、丹参饮低剂量组大鼠各死亡1只。
3.2 丹参饮预处理对I/R大鼠心脏血流动力学指标的影响 与假手术组比较,模型组大鼠SAP、DAP、LVSP、LV+dp/dtmax、LV-dp/dtmax均降低(P<0.05,P<0.01),LVEDP升高(P<0.01);与模型组比较,丹参饮中剂量组大鼠SAP升高(P<0.05),丹参饮中、低剂量组大鼠LVSP、LV+dp/dtmax均升高(P<0.05,P<0.01),丹参饮中、低剂量组大鼠LVEDP均降低(P<0.05),见表2~3。
表2 丹参饮对I/R大鼠心脏血流动力学指标的影响

表3 丹参饮对I/R大鼠心脏血流动力学指标的影响
3.3 丹参饮预处理对I/R大鼠心肌病理形态的影响 如图1所示,假手术组大鼠心肌组织细胞排列整齐、纹理清楚;模型组大鼠心肌细胞肿胀变形,可见心肌纤维断裂,纤维间隙增宽,大量炎性细胞浸润;丹参饮各剂量组大鼠心肌纤维排列较整齐,间隙减小,细胞轻度肿胀,均较模型组明显减轻。
3.4 丹参饮预处理对I/R大鼠心肌细胞凋亡的影响 与假手术组比较,模型组大鼠心肌细胞凋亡率升高(P<0.01);与模型组比较,丹参饮各剂量组大鼠心肌细胞凋亡率均降低(P<0.01),见图2、表4。

表4 丹参饮预处理对I/R大鼠心肌细胞凋亡率的影响
3.5 丹参饮预处理对I/R大鼠心肌能谱的影响 与假手术组比较,模型组大鼠ATP、ADP、总核苷酸(TAN)、能荷(EC)水平均降低(P<0.05,P<0.01);与模型组比较,丹参饮中剂量组大鼠ATP、ADP、EC水平及ATP/ADP比值均升高(P<0.05,P<0.01),丹参饮中、低剂量组大鼠TAN水平均升高(P<0.05,P<0.01),丹参饮高剂量组各项指标无明显变化(P>0.05),见表5、图3。

表5 丹参饮对大鼠心肌能谱的影响
3.6 丹参饮预处理对I/R大鼠心肌组织中Cyt-C水平的影响 与假手术组比较,模型组大鼠心肌组织中Cyt-C水平升高(P<0.01);与模型组比较,丹参饮各剂量组大鼠心肌组织中Cyt-C水平均降低(P<0.01),见表6。
3.7 丹参饮预处理对I/R大鼠心肌组织凋亡调控蛋白表达的影响 与假手术组比较,模型组大鼠心肌组织cleaved caspase-3蛋白表达升高(P<0.05),Bcl-2/Bax蛋白表达比值降低(P<0.01);与模型组比较,丹参饮各剂量组大鼠心肌组织cleaved caspase-3蛋白表达均降低(P<0.05),丹参饮中、低剂量组大鼠心肌组织Bcl-2/Bax蛋白表达比值均升高(P<0.05),见图4、表7。

表6 丹参饮预处理对I/R大鼠心肌组织中Cyt-C水平的影响

表7 丹参饮预处理对I/R大鼠心肌组织cleaved caspase-3、Bcl-2、Bax蛋白表达的影响
4 讨论
心肌血流短时间中断后再恢复灌注,反而会加重心肌损伤[9-10],即心肌缺血再灌注损伤。心脏的作用是推动血液流动,向器官、组织提供充足的血流量,以供应氧和各种营养物质[11],但当心肌缺血再灌注损伤发生时其泵血功能受到一定影响。心导管血流动力学检测是评价心脏泵血功能的经典方法,一般认为左室峰压(LVSP)、左室内压最大上升速率(LV+dp/dtmax)反映了左室收缩功能,而左室舒张末压(LVEDP)、左室内压最大下降速率(LV-dp/dtmax)反映了左室舒张功能[12]。本研究显示,当心肌缺血再灌注发生时,大鼠左室收缩与舒张功能受损,而丹参饮预处理后LVSP、LV+dp/dtmax升高,LVEDP降低,表明它可改善缺血/再灌注大鼠损伤的左室功能。
MIRI是一个复杂的病理过程,钙超载、能量代谢障碍、氧自由基的堆积、细胞凋亡等均可造成心肌细胞的损伤[13-14]。目前认为,心肌能量代谢障碍是心肌缺血再灌注损伤的始发环节[12]。ATP是心肌细胞的直接供能物质[15],在心肌细胞节律性收缩时会大量消耗,在缺血、缺氧条件下有氧氧化受到抑制,该物质产生不足,并且心脏能量代谢以糖酵解为主[16];再灌注时由于大量氧自由基的产生,进一步导致其合成受到抑制,可能使线粒体内钙离子超载,最终导致线粒体出现不可逆性的损害[7]。本研究发现,丹参饮预处理可以升高I/R大鼠心肌组织中ATP、ADP、TAN、EC水平,改善缺血/再灌注大鼠心肌线粒体的能量代谢。
细胞凋亡,特别是线粒体途径细胞凋亡是与MIRI密切相关的生物学环节,Bcl-2、Bax是线粒体凋亡途径的调控分子[9]。Bcl-2蛋白家族决定了细胞凋亡命运[17],Bcl-2/Bax降低可触发Cyt-C从线粒体释放,从而激活起始凋亡蛋白酶如caspase-9,并最终激活凋亡细胞死亡的执行者caspase-3活化为cleaved caspase-3,并激活内切酶导致DNA片段化和细胞骨架破坏等一系列引起细胞凋亡事件[18-19]。本研究发现,丹参饮预处理可降低I/R大鼠心肌细胞浆中Cyt-C水平,升高心肌细胞中Bcl-2/Bax,降低cleaved caspase-3表达,并减轻I/R大鼠心肌细胞凋亡。
综上所述,丹参饮预处理可改善缺血/再灌注大鼠损伤的左室功能,提高其心肌能量代谢水平,改善心肌细胞凋亡,具有防治MIRI的心脏保护作用。