东南景天转运Cd 蛋白HMA3 基因载体的构建及栾树遗传转化体系的建立
周韬,白 磊,何其浩,王平
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
林木转基因研究起始于20 世纪80 年代末[1],开始主要是利用一些标签基因研究树木的转化。随着基因技术的发展,进入90 年代后,具有技术价值的基因如抗虫、抗除草剂基因陆续被导入到一些林木中。植物基因工程技术在林木中的应用弥补了常规育种周期长、定向改良难以控制、远缘杂交或种间杂交难以实现的困难与不足[1]。但树木生长在开放的自然环境中会遇到各种恶劣的环境,如重金属、高盐碱等。因此,抗环境胁迫的基因工程成为林木遗传改良的重要领域[2]。木本植物稳定遗传转化涉及基因组整合与再生过程,目的在于使外源基因不仅能在后代植株中稳定表达,还需具备遗传特性,从而研究某种基因功能或改良某种植物性状[3]。目前针对林木进行了遗传转化体系的研究,有农杆菌介导转化法、基因枪转化、电穿孔法和PEG 诱导法转化等[4]。农杆菌介导法以其费用低、拷贝数低、重复性好、基因沉默现象少、转育周期短及能转化较大片段等独特优点而备受科学工作者的青睐[5]。Cd 污染危害植物根系,造成根系生理代谢失调,生长受到抑制[6]。栾树因其根系发达、环境适应性强,研究者将其应用于重金属污染土壤的修复并取得了良好的效果[7]。同一植物对不同重金属富集量也不同,如重金属在土壤—桧柏Sabina chinensis系统中的富集能力依次为 镉(Cd)>锌(Zn)>汞(Hg)>铅(Pb)[8]。造成植物体内重金属含量不同的原因有很多,从根向地上部运输能力的差异是其中之一[9]。由于植物组织对重金属的转移和运输具有一种屏蔽作用,能阻止重金属从地下部向地上部转移,所以一般认为,重金属在植物器官中的累积量为根>茎>叶[10]。栾树同样存在这个问题,富集的Cd 大量存在于根部,很难向地上部运输[11],且栾树的生长周期缓慢,很难短时间对Cd 重污染地区产生影响。HMA家族基因(Heavy metal ATPase)中的HMA基因是P1B-ATPase 家族的成员[11],目前对该家族基因的研究多集中在HMA2/HMA3/HMA4上,且以拟南芥和水稻等植物为主。AtHMA3主要介导Cd 和Pb 的转运,通过酵母互补试验发现其能互补Cd/Pb 敏感型菌株ycf1,而不能互补Zn 敏感型菌株zrc1[12]。AtHMA3基因主要定位于液泡膜上,过表达后植物体内Cd 含量比野生型增加了2~3 倍,说明AtHMA3主要通过将Cd等重金属转运至液泡里,从而起到解毒的作用[13]。Morel等[14]利用QTL 方法从低累积Cd 的水稻中定位到一个OsHMA3基因,他是一个特异性的Cd转运基因,主要在根部表达,通过将Cd 转运到根部细胞的液泡中储存,从而减少了Cd 向地上部转运。上述研究表明,HMA基因在植物对重金属的转运和解毒,特别是在维持锌镉等重金属在细胞中的稳态过程中起到了非常关键的作用。因此,本研究计划构建栾树遗传转化体系并将超转运蛋白HMA3 转入栾树,以实现栾树的定向改良,使其对Cd 的富集能力和转运能力获得显著提升。
1 材料与方法
1.1 材料
基因型分析内参为番茄,转化受体材料为复羽叶栾树;转化菌株为农杆菌LBA4404;转化载体为pCAMBIA1302[15]。
1.2 流式细胞术对栾树进行基因型分析
将样品置于0.8 mL预冷的MGb解离液(45 mM MgCl2·6H2O,20 mM MOPS,30 mM 柠檬酸钠,1%(W/V) PVP 40,0.2% (V/V) Tritonx-100,10 mM Na2EDTA,20 μL/mLβ-巯基乙醇,pH 值7.5)中,用刀片将组织切碎,使其在解离液中冰上静置10 min,然后用400 目滤网过滤,即得到细胞核悬浮液。在细胞核悬液中加入适当体积的预冷的碘化丙啶(Propidium iodide,PI)(母液浓度1 mg/mL)和适当体积的RNAase 溶液(母液浓度1 mg/mL),置于冰上避光染色0.5~1 h。PI 染液和RNAase溶液的工作浓度均为50 μg/mL。
以番茄为内参,将待测样品的悬液和内参样品的悬液按适当比例混合。利用BD FACScalibur流式细胞仪对染色后的细胞核悬浮液样品上机检测,采用488 nm 蓝光激发,检测碘化丙啶的发射光荧光强度,每次检测收集10 000 个颗粒。变异系数CV%控制在5%以内,使用Modifit 3.0 分析软件作图分析。
1.3 转化载体的构建
以从超富集东南景天Sedum alfrediiHance 中提取的RNA 为模板(PureLink RNA 小量试剂盒),逆转录得到超富集东南景天的cDNA 文库(SureScriptTMcDNA 第一条链合成试剂盒),设计特异性Cd 转运HMA3基因序列(KM376975.1)的引物(F:5′ATGGATTCTGGATTGGATGAAGTCA3′,R:5′GGCATCCATCTGGCCTTTCGTCTTA3′),以cDNA 为模板,使用高保真酶KODFX(Takara)进行PCR 扩增,获得超富集东南景天HMA3基因CDS 序列。BgI Ⅱ和Spe Ⅰ双酶切PCR 纯化产物及pCAMBIA1302 表达载体,然后通过DNA 连接酶进行连接,转入大肠杆菌TOP10 体内,通过筛选克隆、酶切检测以及测序分析获得正确的HMA3基因的表达载体。最后转化农杆菌LBA4404 感受态,于-80℃下保存备用。
1.4 愈伤组织的诱导及继代
1.4.1 复羽叶栾树种子萌发
将过6 目筛的栾树种子进行65%~75%浓硫酸浸泡3~4 min 后,60 g/L 的碳酸氢钠溶液反复清洗种子彻底中和浓硫酸,再利用60 g/L 的碳酸氢钠水溶液浸泡种子10~12 min,然后对种子进行消毒处理:70%乙醇50 s,0.1%升汞2~10 min,无菌水冲洗3 次以上获得无菌种子,最后将冲洗好的种子放到灭菌滤纸上晾干5 min。在每个倒有促萌发培养基的培养瓶中放入3~4 粒种子,放入培养箱(23±1℃)中光照培养,光照周期16/8,光照强度为40 μmolm-2s-1。经过7 d 的培养,发芽成为无菌苗。(促萌发固体培养基为DKW基本培养基,6-BA,2.0 mg/L,NAA,0.4 mg/L,GA3,0.4 mg/L)。
1.4.2 复羽叶栾树愈伤组织的诱导
将无菌苗切割,其中茎段与根系切割为0.5~1 cm,转入愈伤组织快速诱导培养基上进行诱导,培养基设定添加聚乙烯吡咯烷酮(PVP)100 mg/L与无PVP,以及设定吲哚丁酸(IBA)、萘乙酸(2,4-D)、椰汁含量优化栾树愈伤组织培养基,放入培养箱(23±1℃)、黑暗环境下培养。经过21 d 的黑暗诱导,挑选愈伤组织,用镊子轻轻分为3 份,转入新的继代培养基中培养10~30 d。
1.5 农杆菌介导转化体系建立
从固体划线平板上挑取已转化pCAMBIA1302-HMA3农杆菌LBA4404 单克隆菌株,对栾树愈伤组织进行侵染转化具体操作步骤参考《植物基因工程》[16]。将抗性愈伤继代增殖培养形成成熟的愈伤块,继代培养基设定细胞分裂素(6-BA),IBA、噻苯隆(TDZ)含量优化栾树继代培养。将两轮筛选后的愈伤组织转移到不定芽分化培养基中,培养20~40 d 出现新的芽点,继而转入生根培养基中,诱导生根。待幼苗长出较为发达的根系后进行移栽炼苗,除继代培养基外其他培养基配方参考传统植物组培培养基配方[17-18]。
1.6 转基因植株的检测
1.6.1 目的基因PCR 检测
剪去植株的幼嫩叶片,液氮研磨,利用RNAprep Pure 多糖多酚植物总RNA 提取试剂盒提取栾树抗性筛选后的愈伤组织RNA,PrimeScript ™II 1st Strand cDNA Synthesis Kit cDNA 合成试剂盒(TaKaRa 公司)逆转录cDNA 作为模板,利用Premier5 设计目的基因东南景天HMA3(AJF37113.1)转运蛋白引物,利用高保真酶进行PCR 克隆,反应条件:98℃2 min;98℃10 s,55℃30 s,72℃1 min,35 个循环,琼脂糖凝胶电泳验证目的基因已顺利插入栾树基因转录组。
1.6.2 栾树原生质体制备及激光共聚焦观测GFP表达
取4 g 筛选后的愈伤组织,用镊子轻轻捣碎,于30 mL 酶解前溶液漂洗3次,每次5min。(酶解前溶液:0.4MD-Mannitol、20 mM MES)。用孔径为0.15 mm 的滤网过滤溶液,将愈伤组织转移至酶解液中(酶解液:20 mM MES、0.4M D-Mannitol、20 mM KCl、0.40% macerozyme R-10、1.50% Cellulase R-10,加ddH2O 至10 mL,用KOH 调pH 值至5.7,55℃,10 min,冷却至室温后加入随后试剂至终浓度,10 mM CaCl2,0.1%BSA。加ddH2O 至30 mL)。锡纸包裹避光,于摇床中26 ℃、50 rpm 下摇荡,酶解6~10 h,去除离心管上层液2 mL。用孔径为0.15 mm 滤网过滤,尽量减少滤液流动距离,动作轻柔,用等体积W5溶液(154 mM NaCl,125 mM CaCl2,5 mM KCl,5 mM glucose,0.03% MES,KOH调pH值至5.8,高温高压灭菌20 min,4℃)可保存一个月,可以保持原生质体的渗透压,防止原生质体破裂。清洗离心管及滤渣至酶解后溶液中,终止反应。去除滤渣,得到滤液后在显微镜观察完整细胞比例,在激光共聚焦下观测细胞中GFP 的瞬时表达。
1.7 转基因栾树Cd 吸附能力检测
将转基因阳性的栾树幼苗与未转基因的栾树幼苗进行相同程度的Cd 胁迫处理。20 mg/L 处理7 d 后用HNO3-HClO4湿法消解测定。用自来水清洗干净后用超纯水润洗,将新鲜的根、新长的嫩茎和叶分开。放入烘箱中105℃下杀青30 min 后将温度降至80℃,烘干至恒质量。用粉碎机粉碎,装袋保存。称取0.5 g 粉碎的植物样品于100 mL三角瓶中,加入5 mL 浓硝酸,盖上弯颈漏斗,摇匀后静置过夜。次日,置于电热板上,在通风橱180℃下加热30 min,每30 min 升高5℃,至4 h后棕色气体基本赶完。取下三角瓶冷却,加1.5 mL高氯酸,电热板升高温度至200℃加热1~2 h 产生浓白烟挥发大部分高氯酸,至三角瓶中溶液为无色透明,植物残渣为白色,取下冷却。用去离子水过滤,定容于50 mL 的容量瓶,转至75 mL小白瓶,根据样品中各待测元素含量和仪器的最低检测限值适当稀释,最后用原子吸收分光光度计测定。
2 结果与分析
2.1 复羽叶栾树基因组大小分析
碘化丙啶是一种荧光染料,能均匀地嵌入到双链核酸碱基对中,因此可以对DNA 进行特异性染色。在488 nm 激发光下,PI 发出的荧光可被流式细胞仪检测。并且,PI 在着色过程中的嵌入量与DNA 量成正比,故荧光强度可以表示出基因组DNA 的相对含量。观察待测样品和对照植物PIDNA 复合体的荧光峰值,即可得出2 种植物DNA含量的比值,再乘以内参植物的C 值,即可计算出待测植物的C 值。即计算公式:待测样品DNA含量=内参DNA 含量×待测样品的荧光强度/内参样品的荧光强度。根据图1 可知,测定3 组生物学重复栾树叶片样品,Modifit 3.0 计算峰图面积得出样品吸光度分别为20.32、21.62、20.28,剔除可能因采样手段或样品自身病变造成的误差数据21.62,根据与内参番茄相比可知栾树基因组的大小为335 Mb 左右(表1 和图1)。栾树的基因型为2n=32[19]。较小的基因组以及二倍体的特性决定了栾树有较好的遗传性,插入的外源基因更不容易丢失,预示着复羽叶栾树品种具有基因工程改良可能性,尤其是对于景观栽培花色改良或环境应用修复植物品种选育都具有应用前景。
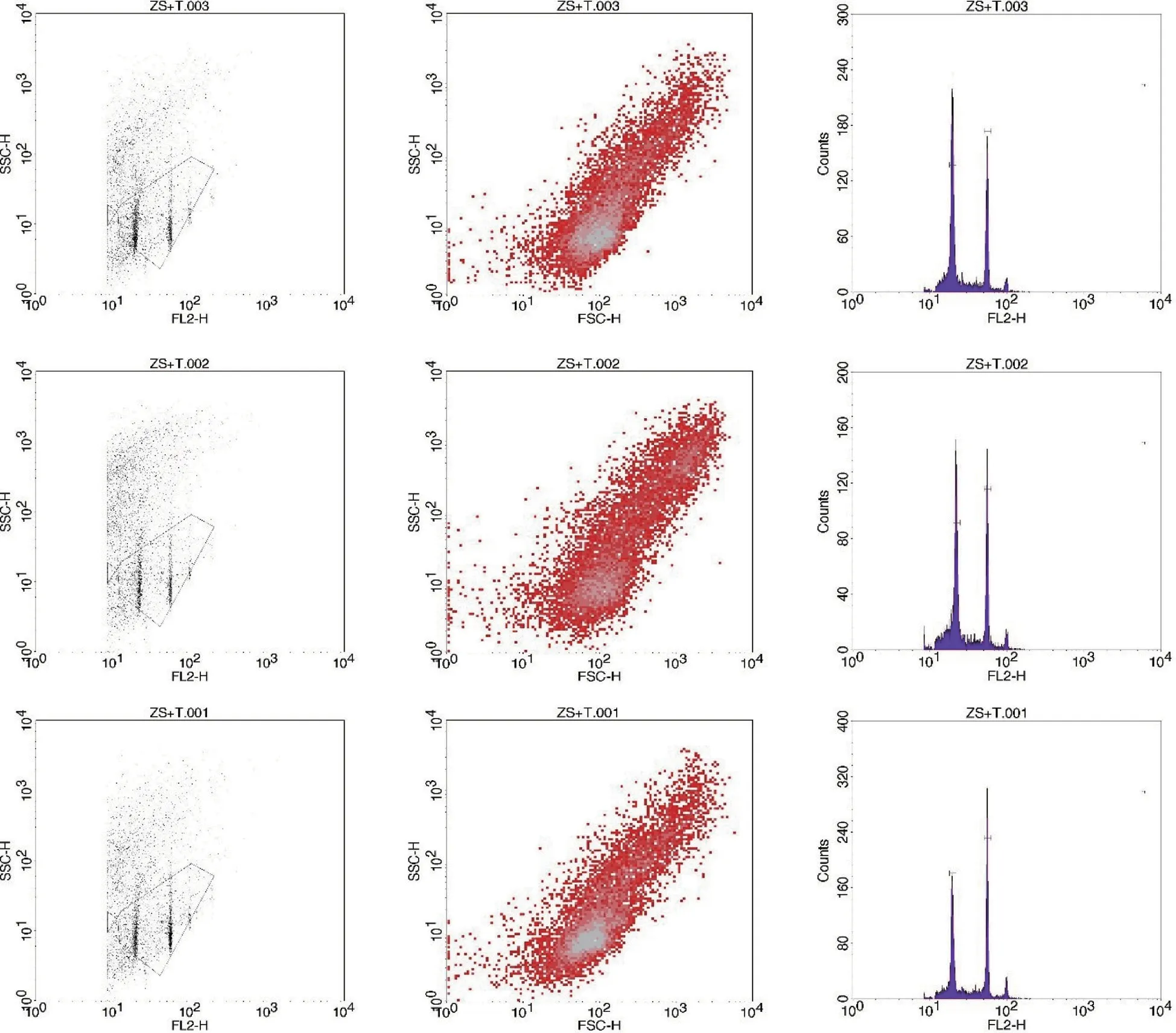
图1 栾树基因组大小结果直方图Fig.1 Histogram of the Koelreuteria paniculata genome size
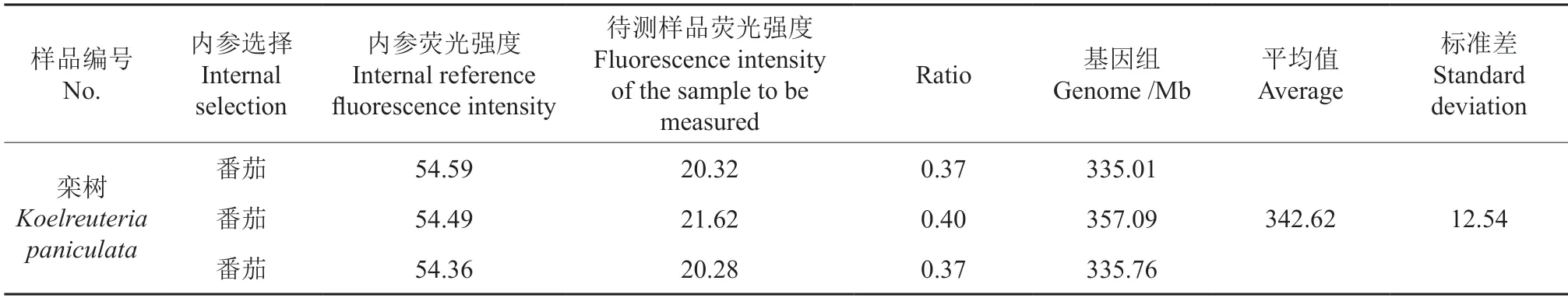
表1 栾树相较于番茄基因组结果Table 1 Koelreuteria paniculata genome versus tomato genome
2.2 表达载体HMA3+pCAMBIA1302 的获得
通过高保真酶PCR 扩增HMA3基因(ID:KM376975.1),将该基因通过双酶切与酶连反应,连接到pCAMBIA1302 载体上,目的基因插入载体位置及该载体功能组件如图2 所示。该载体具有潮霉素(Hyg)与卡那霉素(Kan)筛选位点,在农杆菌转化步骤可利用Kan 抗性筛选阳性转化农杆菌。植物组培阶段可利用Hyg 抗性筛选阳性转化组培植株,目的基因尾端连接有荧光蛋白(GFP)融合表达可用于后续的激光共聚焦观察目的基因在细胞内的表达细胞器部位分析表达模式。由此可见,该载体非常适用于植物的遗传转化构建,可缩短转化筛选步骤时间周期,且有利于后期基因表达纯化及功能研究。转入大肠杆菌T10 中获得大量载体拷贝,提取质粒进行酶切验证(图3),酶切后的目的基因大小为2 401 bp,符合东南景天HMA3基因大小,其余荧光片段为载体片段大于5 000 bp,进一步对质粒进行测序比对,确定质粒序列、碱基序列无移码突变,可用于后续试验。

图2 pCAMBIA1302 质粒图谱Fig.2 pCAMBIA1302 plasmid
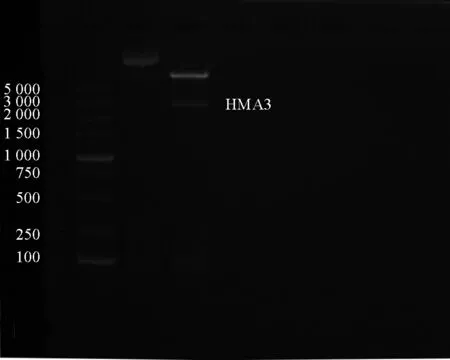
图3 pCAMBIA1302 质粒酶切验证Fig.3 Validation of the digestion of pCAMBIA1302 plasmids
2.3 农杆菌介导栾树遗传转化
木本植物遗传转化效率普遍较低,严重阻碍了木本植物的转基因工作开展。为了提高栾树的转化效率,对农杆菌介导的栾树遗传转化体系中的培养基配方进行了系统优化,该体系可高效且稳定地获得栾树遗传转化幼苗(图4)。相对于已有报道的传统植物培养基,本研究对愈伤组织诱导培养基与转化后愈伤组织继代培养基配方进行了大幅度的优化,使栾树愈伤组织形成与农杆菌转染后培养可稳定获得目的基因转化植株。在愈伤组织诱导培养基中添加聚乙烯吡咯烷酮(PVP)防止愈伤组织褐化,而相较于未加 PVP 组栾树,愈伤组织的抗褐化能力有了明显的提升(图5),每10 瓶栾树愈伤组织培养过程中未添加PVP 出现个体愈伤组织褐化率约为56.1%,添加后降低至33.1%,PVP 极显著降低了愈伤组织褐化率。0.25 mg/L IBA,1.0 mg/L 2,4-D 及10%的椰汁,使得栾树愈伤组织的诱导成功率与继代成长速度都有了明显的提升,同时有效地减少了在潮霉素抗性筛选培养基中的玻璃化幼苗的产生(表2~3)。可见,优化后的培养基对于栾树遗传转化体系的构建明显优于传统植物组织培养基,提高愈伤组织获得效率,降低了抗性筛选过程中对栾树转化后的愈伤组织的消耗。

表2 栾树愈伤组织诱导培养基Table 2 Callus induction medium of Koelreuteria paniculata

图4 栾树遗传转化体系培育动态Fig.4 Dynamic diagram of Koelreuteria paniculata culture in the genetic transformation system
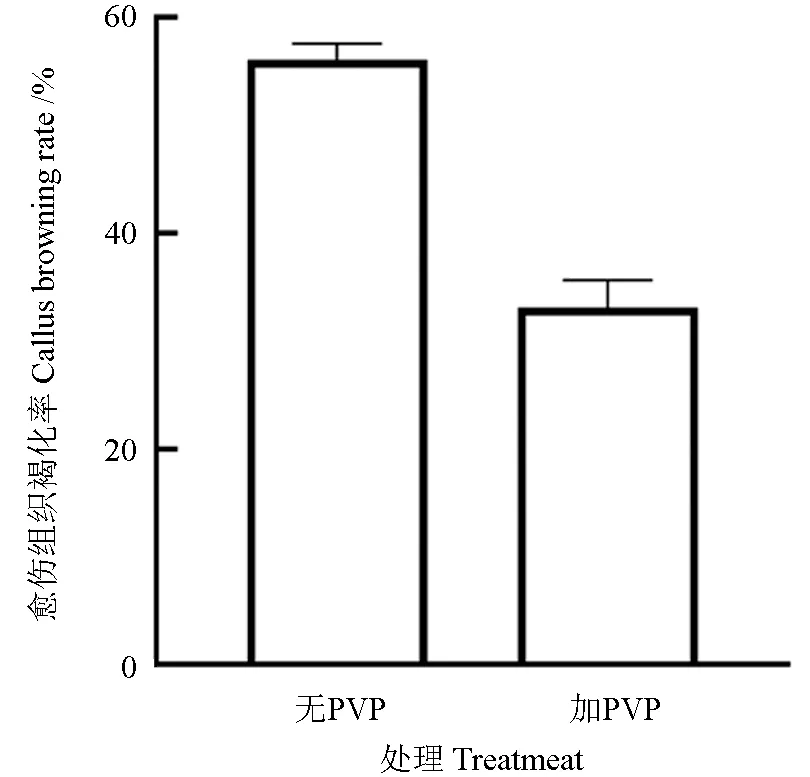
图5 栾树愈伤组织褐化率Fig.5 Callus browning rate of Koelreuteria paniculata
2.4 转基因植株的激光共聚焦检测,PCR 检测及阳性苗的获得
将经过抗性筛选的部分阳性愈伤组织制备成原生质体,并在激光共聚焦显微镜下观察,结果如图6 所示。目的基因与GFP 为融合表达基因,且HMA3 为跨膜转运蛋白,在激光共聚焦下GFP发出绿色荧光,其表达模式与目的基因一致,都在栾树原生质体细胞膜附近。以获得的抗性转化苗的叶片总DNA 为模板,以AJF37113.1F/R为引物进行PCR 扩增反应,分别取PCR 产物5 μL,采用1%的琼脂糖凝胶电泳进行检测,结果如图7 所示,共检测随机植株17 株,其中可以扩增出HMA3基因的有5 株,据此获得的阳性率即成功表达HMA3基因植株得率为29.4%。同时激光共聚焦结果表明,东南景天HMA3基因在栾树细胞中的表达具有相同的表达模式即细胞膜表达,进一步说明该基因的生物学功能可能会在栾树中产生相关表型。

图6 栾树阳性转化愈伤组织原生质体GFP 激光共聚焦亚细胞定位Fig.6 Subcellular localization of the positive callus protoplasts of Koelreuteria paniculata observed by GFP laser confocal

图7 栾树转化再生植株PCR 检测结果Fig.7 PCR detection results of the transformed Koelreuteria paniculata plants
2.5 转基因栾树Cd 富集能力检测
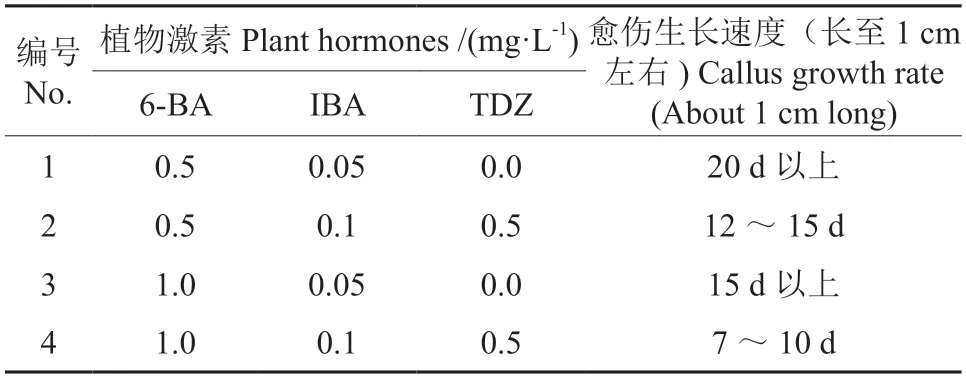
表3 栾树转化愈伤组织继代培养基Table 3 Medium for the subculture of Koelreuteria paniculata callus
栾树作为对Cd 有一定富集能力的木本植物,其本身对Cd 吸收后主要富集于地下部分,即主要位于根部,较难向地上部运输。特别是随着Cd 浓度的升高,其转运能力进一步降低[15]。转入HMA3基因后,转基因栾树获得了更强的富集能力与转运能力。相较于阴性对照,其整体富集Cd 含量增加了40.3%,根部富集Cd 含量增加了26.2%,且地上部(茎、叶)的Cd 含量占比相较于阴性对照提升了62.9%。栾树对Cd 的富集系数(Bioconcentration factors,BCF,为栾树体内Cd 含量除以水培液中的Cd 含量)提升了40.3%;转运系数(Translocation factors,TF,为栾树地上部Cd含量除以地下部的Cd 含量)提升了29.3%(表4)。这些结果表明转入HMA3基因的栾树幼苗有更强的富集能力和转运能力,该结果证明了东南景天HMA3 蛋白在栾树中同样行使了Cd 转运功能,且使栾树富集系数与转运系数发生了显著性变化。然而与同生物量草本植物相比仍然处于劣势,这可能是由于植物响应Cd 胁迫反应并非点反应,而是复杂的基因网络调控响应,木本植物与草本植物相比仍然具有较大差异。因此,东南景天HMA3基因在栾树细胞内并没有完全发挥特异性转运Cd的生物学功能。
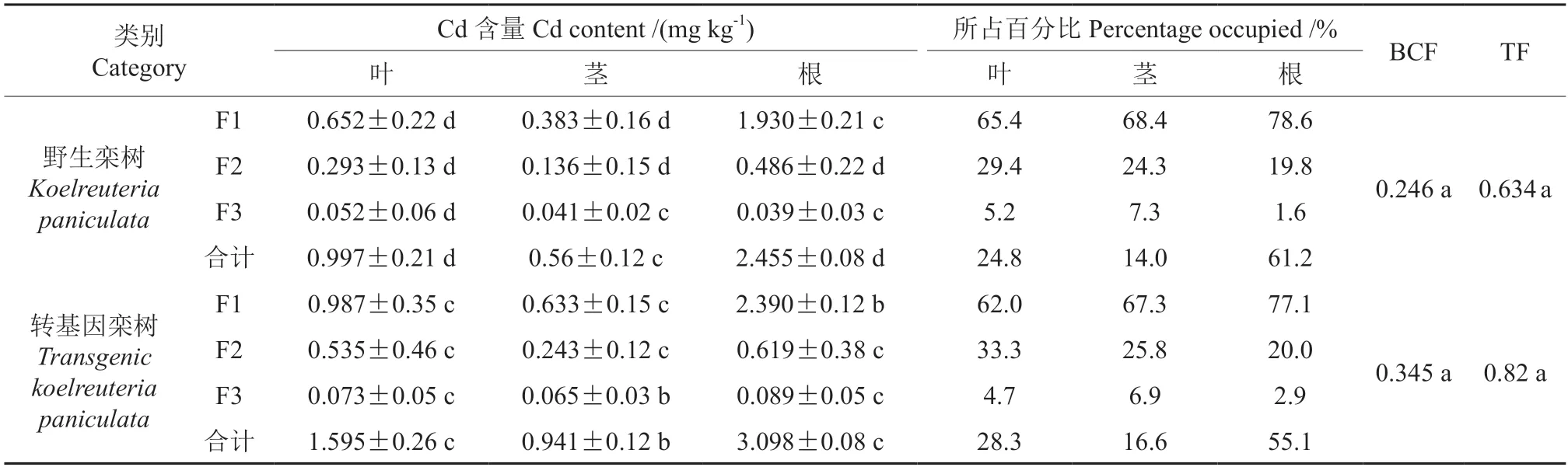
表4 栾树根、茎、叶中Cd 浓度及其亚细胞结构分布†Table 4 Cd concentration and subcellular structure distribution in roots,stems and leaves of Koelreuteria paniculata
3 讨论与结论
3.1 讨论
重金属植物修复技术因其低成本和无害化而被广泛应用,植物修复应用于重金属的修复技术可分为3 个类型,植物提取、植物挥发、植物稳定。栾树是我国南方地区一种常见的绿化树种,因其根系发达、环境适应性强,研究者将其应用于重金属污染土壤的修复并取得了良好的效果。在湘潭锰矿区成功建成以栾树为修复树种的生态修复基地,开创了我国栾树修复重金属矿区的先例。选用栾树、千头柏、棕榈、洒金柏等植物进行土培试验,发现栾树对重金属矿渣土壤基质的适应性很强,是用于重金属矿渣废弃地生态修复的理想树种。
然而,栾树却很难将地下部分(根部)富集的Cd 转运至地上部分(茎,叶),无法发挥其生物量大的优势。本研究组前期转录组分析研究表明,栾树响应Cd 胁迫主要通过根系的吸附作用实现,其分子机理可能是栾树根系具有响应Cd胁迫分泌根系代谢物,螯合Cd 离子阻遏进入细胞质,且转录数据显示栾树并不具有特异性高表达响应Cd 胁迫的金属离子转运蛋白,这与大部分高抗性木本植物研究报道的结果一致[20-22],因此,栾树具有较强的Cd 抗性而不具备高富集性的分子机制。栾树作为环境修复植物的应用虽具有生态修复的主要承载体价值[23],却缺乏高效修复的属性。随着基因工程的发展,筛选利用特异性Cd 转运基因对栾树的富集表型改造将有利于解决这一问题。
首先通过对比番茄的基因组,发现栾树的基因组大小为335 Mb 左右,具有较小的基因组以及二倍体的特性,使得栾树在遗传转化上有着更大的优势。然而,林木转基因技术的难题主要在不定芽与不定根的诱导[24]以及目的基因的准确表达,我们通过优化培养基的激素配比,同时在其中加入PVP 预防褐化,成功诱导形成了栾树愈伤组织,并诱导其长出不定芽与不定根,说明本研究的激素配方适宜栾树的无性繁殖体系,这有力地保障了栾树快繁的同时,使得转化基因的稳定遗传成为可能。转运蛋白HMA 家族是一种对重金属特异性很强的转运蛋白,通过转运金属离子参与细胞内的信号调节,其中拟南芥中的AtHMA3主要介导Cd 与Pb 的转运。东南景天同样具有特异性Cd转运富集的HMA3基因,且仅存在于超富集东南景天中,该基因在东南景天中的生物学功能主要表现为将地下部的Cd 离子转运至地上部,并且通过跨膜运输富集于植物液泡中,使得超富集东南景天具有高富集性的同时具有高Cd 抗性[25]。因此,本研究成功克隆了超富集东南景天Cd 特异性的超转运蛋白HMA3基因,利用农杆菌介导的方式转入栾树愈伤组织,通过筛选培养,选育阳性幼苗,以及表达模式分析得出草本植物东南景天的HMA3基因在栾树中同样具有表达与Cd 转运生物学功能。最后对转基因栾树Cd 胁迫试验可以得出,转入HMA3基因的栾树幼苗,对Cd 的富集能力,由地下部转移至地上部的能力均有显著提升,但是相较于超富集草本植物,其相同生物量的富集系仍然较低,说明木本植物存在复杂的Cd 胁迫响应机制,并非改变转运基因就能获得相同的转运效率与富集量,因此,栾树的Cd 胁迫响应机制的揭示有待进一步研究。
3.2 结论
本研究建立了由农杆菌介导的栾树遗传转化体系,其最佳转化体系为:栾树愈伤组织诱导培养基:0.25 mg/L IBA,1.0 mg/L 2,4-D,100 mg/LPVP 及10%的椰汁;栾树愈伤组织继代培养基:1.0 mg/L 6-BA,0.1 mg/L IBA,0.5 mg/L TDZ,100 mg/L PVP 及10%的椰汁,并成功转入东南景天HMA3基因,使得栾树对Cd 的富集能力得到了显著的提升,该结果将为后续研究栾树逆境分子机制下的基因调控网络提供技术支持。

