KLF15基因敲除加重急性心肌梗死小鼠心肌损伤*
高诗娟,黄山,方光明,张燕红,杜杰
(首都医科大学附属北京安贞医院,北京市心肺血管疾病研究所,北京 100029)
急性心肌梗死是因冠状动脉堵塞,导致急性、持续性缺血缺氧引起心肌细胞凋亡、坏死。组织损伤产生的内源性信号分子通过激活Toll样受体启动炎性反应,招募中性粒细胞、巨噬细胞等炎性细胞浸润,清除梗死区域坏死细胞和细胞外基质碎片。但持续存在的炎症则加重心肌细胞丢失,加重收缩功能障碍、心室壁变薄,最终导致心脏破裂[1,2]。因此,减轻缺血缺氧诱导的心肌细胞凋亡、及时抑制梗死后炎症,对于避免炎症扩大加剧缺血心肌损害具有重要意义。转录因子Kruppel样因子15(Kruppellike factor 15,KLF15)在多种心血管疾病中发挥保护作用,通过抑制促心肌肥大转录调节因子的活性发挥抗心肌肥厚的作用[3],通过抑制核因子κB(nuclear factor-κB,NF-κB)介导的炎症在动脉粥样硬化中发挥保护作用[4]。但KLF15是否参与心肌梗死后细胞凋亡及炎症的调控尚不清楚。本研究通过在KLF15基因敲除鼠中构建急性心肌梗死模型,观察KLF15对心肌梗死后心功能、心肌细胞凋亡及梗死后炎症的作用。
材料和方法
1 动物
10~12周龄SPF级雄性C57BL6/J小鼠购自北京唯尚立德公司,以C57BL6/J为背景的KLF15基因敲除小鼠由本室构建,饲养于北京安贞医院SPF级动物房。所有动物实验均遵守首都医科大学附属北京安贞医院实验动物管理委员会的相关规定。
2 主要试剂
KLF15抗体购自Abcam;p65、p-p65及Bax抗体购自Cell Signaling Technology;麦胚凝集素(wheat germ agglutinin,WGA)和α-actinin抗体购自Sigma;总RNA提取试剂TRIzol购自Invitrogen;RevertAid First Strand cDNA Synthesis Kit和T-PER组 织蛋白 提取液购自Thermo Fisher Scientific;SYBR real-time PCR试剂购自TaKaRa;Masson染色液购自北京索莱宝科技有限公司;双萤光素酶报告基因检测试剂盒和TUNEL细胞凋亡检测试剂盒购自Promega;小鼠IL-6 ELISA检测试剂盒购自BD Biosciences。
3 主要方法
3.1 小鼠心肌梗死模型构建采用冠状动脉左前降支结扎术建立小鼠心肌梗死模型[5-6],具体如下:异氟烷麻醉小鼠后,仰卧位固定于鼠板,于第3、4肋间隙心脏部位做纵向约1.5 cm的切口,用3-0 proline丝线打一荷包松结备用。钝性分离胸大肌肉与肋骨外肌肉,于第3~4肋间穿破肋间隙和心包膜,迅速挤出心脏,于左心耳下缘下约2 mm处以6~0 proline丝线结扎冠状动脉,观察到左心室前壁由鲜红转为暗紫至苍白,快速把心脏推入胸腔,挤出胸内气体,系紧先前备用的荷包线,关胸。假手术组丝线仅穿过左冠状动脉主干,不做结扎。
3.2 小动物超声仪测定心功能心肌梗死术后28 d使用小动物超声系统(Vevo 2100 High Resolution Imaging System)进行心脏超声心动图检测。小鼠麻醉后仰卧位固定,保持心率在500~600 min-1时,采集胸骨旁长轴和心室中短轴图像,记录乳头肌水平的M型轨迹。使用VisualSonics Vevo 2100软件进行图像分析。心功能评价指标包括左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短分数(left ventricular fractional shortening,LVFS)。
3.3 Masson胶原纤维染色收集心肌梗死术后28 d的野生及KLF15基因敲除小鼠心脏组织,10%中性甲醛固定后,石蜡包埋,制备4µm切片,脱蜡至水。使用Masson染色液染色,基本步骤如下:铁苏木素染色5~10 min,酸性乙醇分化5~15 s;Masson蓝化液返蓝3~5 min;丽春红品红染色5~10 min;磷钼酸溶液洗1~2 min;苯胺蓝染色1~2 min;乙醇脱水、中性树胶封片。倒置电子显微镜(Nikon)采集图像,胶原纤维呈蓝色,心肌细胞呈红色。采用NIS Br 3.0软件计算纤维化面积。
3.4 WGA染色前述制备的心脏石蜡切片经二甲苯和梯度乙醇脱蜡至水后,抗原热修复,羊血清工作液室温封闭30 min,1∶100稀释的WGA,37℃避光孵育1 h,PBS洗后,DAPI封片液封片。倒置荧光电子显微镜(Nikon)采集图像,采用NIS Br 3.0软件计算心肌纤维横截面积,每张切片统计200个左右的肌纤维。
3.5 免疫组化收集假手术组及心肌梗死术后3 d的小鼠心脏组织,制备石蜡切片,脱蜡至水后,柠檬酸中抗原高压热修复,内源性过氧化酶阻断剂处理20 min后PBS洗,血清室温封闭30 min,加入KLF15抗体,4℃过夜,PBS洗后加辣根过氧化物酶标记的Ⅱ抗室温30 min,PBS洗后DAB显色;苏木素复染3 min,自来水洗,盐酸乙醇分化数秒,自来水洗;脱水、透明、封片及镜检。使用Nikon ECLIPSE 90i显微镜采图。
3.6 RNA提取及RT-qPCR分离野生小鼠心肌梗死术后0、1、3、7 d,以及野生与KLF15敲除小鼠心肌梗死术后3 d的心脏组织,使用TRIzol法提取总RNA。RevertAid First Strand cDNA Synthesis Kit将2µg总RNA逆转录成cDNA:RNA与Oligo dT混合后,65℃孵育5 min,加入逆转录酶及缓冲液,42℃60 min反应,70℃5 min灭活逆转录酶。得到的cDNA使用SYBR试剂进行实时荧光定量PCR。GAPDH为内参照,以2-ΔΔCt法计算mRNA表达量。引物序列见表1。
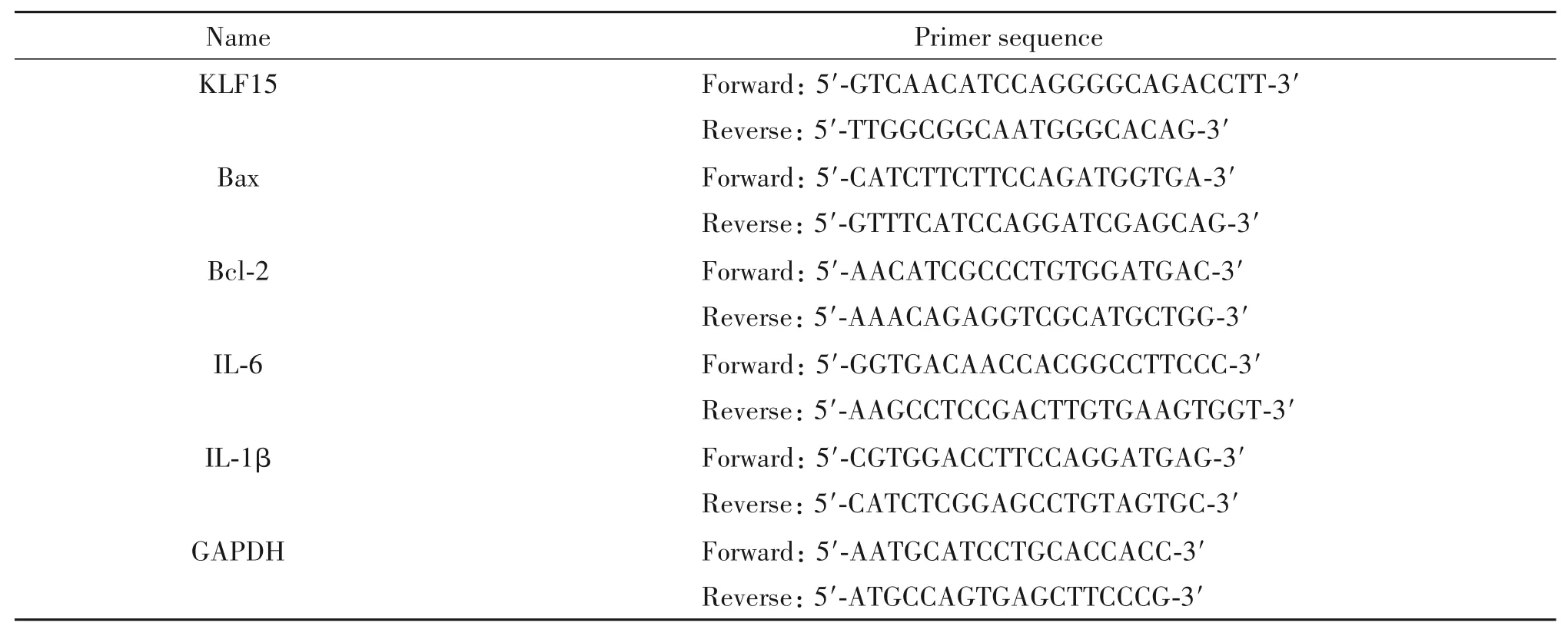
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
3.7 Western blot检测分离心肌梗死术后3 d的野生及KLF15基因敲除小鼠心脏,T-PER组织裂解液(补充0.5 mol/L EDTA、蛋白酶抑制剂和磷酸酶抑制剂)提取总蛋白,BCA蛋白浓度测定试剂盒定量。将总量为80µg的蛋白经聚丙烯酰胺凝胶电泳分离后电转至硝酸纤维素膜。5%脱脂奶粉室温封闭1 h,分别加入p-p65及p65抗体,4℃孵育过夜。加入Ⅱ抗室温孵育2 h,使用Odyssey红外荧光扫描成像仪捕获目的条带。
3.8 萤光素酶报告基因实验大鼠心肌细胞H9C2共转染KLF15、NF-κB-Luc萤光素酶报告质粒和pRL-TK海肾萤光素酶内参照质粒,并给予缺氧诱导(5% CO2,94% N2,1% O2)48 h后,收集细胞,用Promega双萤光素酶报告基因检测试剂盒检测萤光素酶活性,结果通过多功能酶标仪读取。
4 统计学处理
用GraphPad Prism 7.0软件进行数据统计分析。结果以均数±标准差(mean±SD)表示。两组间均数比较采用t检验;多组间均数比较用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 心肌梗死早期KLF15表达下降
首先在Human Protein Atlas数据库中分析了KLF15的组织及细胞表达(https://www.proteinatlas.org/ENSG00000163884-KLF15/single+cell+type),结果显示心脏组织中KLF15主要表达于心肌细胞(图1A)。野生小鼠构建心肌梗死模型,分别于术后0、1、3、7 d收集心脏组织,RT-qPCR检测KLF15表达,结果显示心肌梗死早期(术后1 d)KLF15的mRNA表达水平显著下降(P<0.05),见图1B。免疫组化及Western Blot在心肌梗死术后3 d的心脏组织中均从蛋白水平证实了KLF15的表达降低(图1C、D)。上述结果表明心肌梗死早期KLF15的表达下降。
2 KLF15基因缺失降低心肌梗死后小鼠存活率及心功能
野生小鼠18只及KLF15基因敲除小鼠17只行心肌梗死术,统计存活率:野生小鼠于术后第3天死亡3只,第4天死亡2只,第5天死亡1只,存活率为66.67%;KLF15基因敲除小鼠于术后第3天死亡5只,第4天死亡5只,第5天死亡1只,第7天死亡1只,存活率为29.40%。KLF15敲除小鼠心肌梗死术后存活率明显低于野生小鼠(P<0.05),见图2A。术后28 d小动物超声心动图检测心功能,结果显示KLF15敲除小鼠LVEF及LVFS均低于野生小鼠(P<0.01),见图2B。这表明KLF15基因缺失加重心肌缺血损伤,导致心梗后存活率下降,心功能降低。
3 KLF15基因缺失加重心肌梗死后心脏重构
心肌梗死术后28 d,收集野生及KLF15基因敲除小鼠心脏组织,观察梗死后心脏重构情况。首先用Masson染色比较两组心脏梗死瘢痕面积。与对照鼠相比,KLF15基因敲除小鼠心脏梗死瘢痕面积增加(P<0.01),见图3A。WGA染色观察非梗死区心肌细胞代偿性肥大情况,结果显示KLF15基因敲除小鼠的心肌细胞较野生小鼠明显增大(P<0.05),见图3B。这些结果表明,KLF15基因敲除促进心肌梗死后心脏重构。
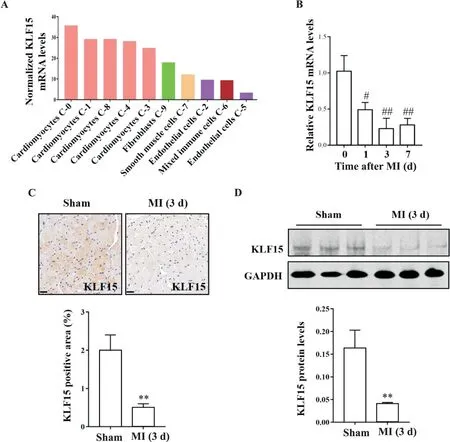
Figure 1.Expression of KLF15 was down-regulated in hearts after myocardial infarction(MI).A:single-cell RNA sequencing data set from Human Protein Atlas showed the normalized KLF15 mRNA levels in individual cells in hearts;B:KLF15 mRNA levels in infarcted mouse hearts at indicated time points after MI(n=5);C:immunohistochemistry analysis of KLF15 protein levels in hearts at 3 d after MI(n=5;scale bar=20µm);D:Western blot analysis of KLF15 protein levels in hearts at 3 d after MI(n=3).Mean±SD.#P<0.05,##P<0.01 vs 0 d;**P<0.01 vs sham group.图1 KLF15在心肌梗死后表达下降
4 心肌梗死中KLF15调控凋亡及炎症因子表达
心肌梗死后缺血缺氧,诱导心肌细胞凋亡、坏死,并分泌炎症因子,激活炎性信号,导致炎性损伤[2]。收集心肌梗死术后3 d野生及KLF15基因敲除小鼠结扎线下的心脏组织,RT-qPCR检测凋亡相关蛋白(Bax和Bcl-2)及炎症因子(IL-6和IL-1β)的mRNA表达。结果显示,KLF15基因敲除小鼠心脏组织中促凋亡蛋白Bax的mRNA表达水平显著升高(P<0.01),抗凋亡蛋白Bcl-2的mRNA表达水平显著降低(P<0.05),促炎因子IL-6及IL-1β的mRNA表达水平均显著升高(P<0.01),见图4A。进而分别通过Western blot及ELISA检测证实了KLF15基因敲除小鼠心脏组织中促凋亡蛋白Bax及促炎因子IL-6在蛋白水平表达升高,见图4B、C。TUNEL凋亡染色结果显示,KLF15基因敲除小鼠心脏组织中TUNEL阳性染色的细胞核比例显著高于野生小鼠,见图4D。上述结果表明,KLF15基因敲除促进心肌梗死后细胞凋亡,增加梗死后炎症反应。
5 KLF15抑制缺氧诱导的NF-κB活化

Figure 2.KLF15 deficiency aggravated cardiac dysfunction after myocardial infarction(MI).A:survival curves of wild-type(WT)mice(n=18)and KLF15 knock out(KO)mice(n=17)after MI;B:representative M-mode echocardiograms of WT and KLF15 KO mice at 28 d after MI were shown,and left ventricular ejection fraction(LVEF)and left ventricular fractional shortening(LVFS)were measured(n=5).Mean±SD.*P<0.05,**P<0.01 vs WT.图2 KLF15基因敲除加剧小鼠心肌梗死后心功能障碍
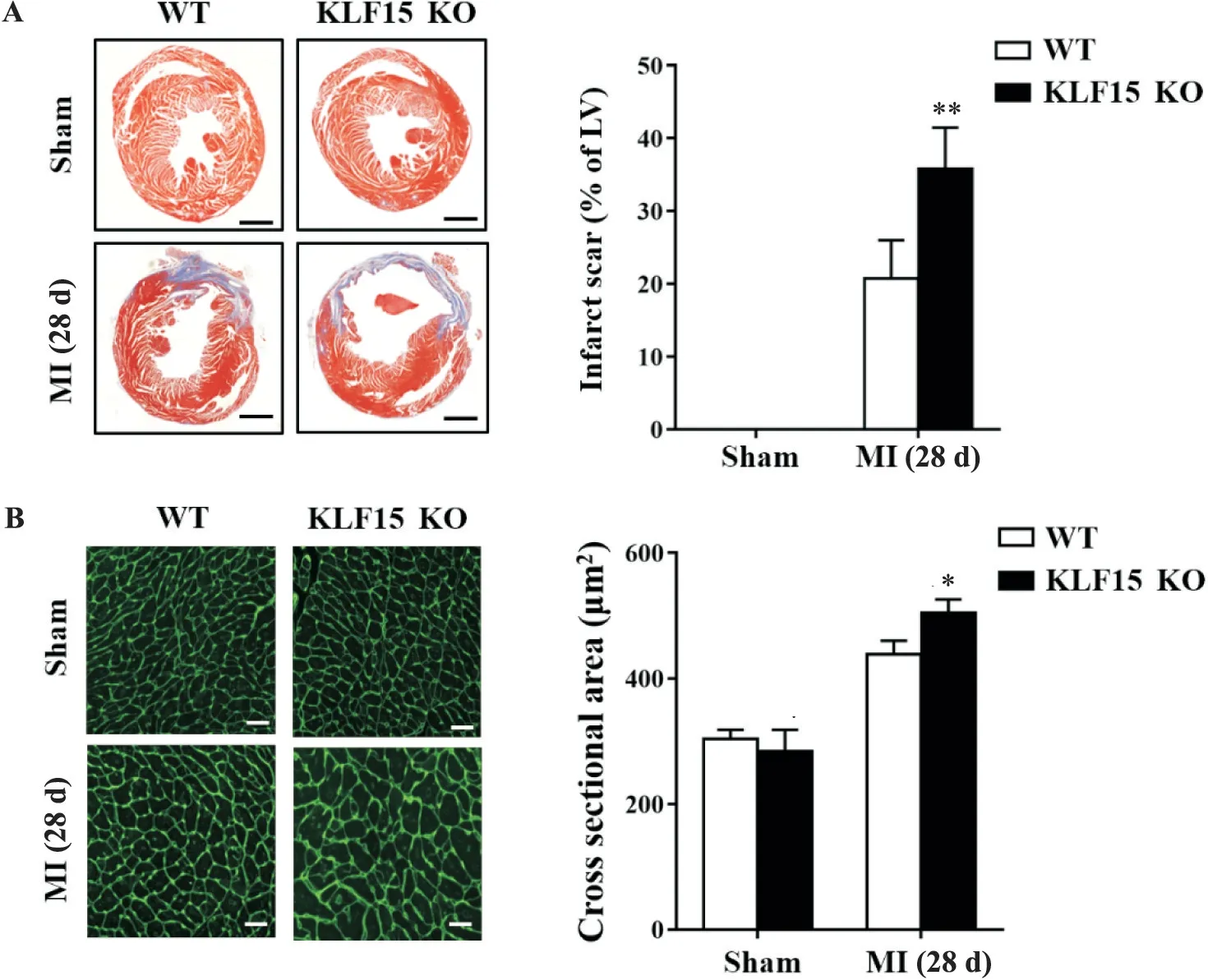
Figure 3.KLF15 deficiency aggravated cardiac remodeling after myocardial infarction(MI).A:representative Masson staining of cardiac sections and quantification of infarct size in WT and KLF15 KO mice at 28 d after MI surgery(scale bar=500µm);B:representative wheat germ agglutinin(WGA)staining of cardiac sections and quantification of cross-sectional cardiomyocyte area in WT and KLF15 KO mice at 28 d after MI surgery(scale bar=50µm).Mean±SD.n=5.#P<0.05,**P<0.01 vs WT.图3 KLF15基因敲除加重心肌梗死后心脏重构程度
NF-κB是细胞缺氧后激活的重要转录因子之一,参与炎症、细胞凋亡等多种生物学过程的调控[7-8]。既往研究证实血管平滑肌细胞中KLF15抑制NF-κB的转录活性,从而抑制粥样硬化中炎症反应[4]。由此推测:KLF15在心肌梗死后对细胞凋亡及炎症因子的表达调控可能与其对NF-κB的转录活性调控有关。为此,我们在H9C2心肌细胞中转染KLF15表达质粒及NF-κB萤光素酶报告质粒并在缺氧条件下培养48 h。萤光素酶活性检测结果显示,缺氧处理的细胞中NF-κB介导的萤光素酶活性显著高于正常对照组(P<0.01),而过表达KLF15则抑制缺氧诱导的NF-κB介导的萤光素酶表达(P<0.01),表明KLF15抑制缺氧诱导的NF-κB活化,见图5A。p65磷酸化是NF-κB活化的重要指标,收集心肌梗死术后3 d的心脏组织,Western blot比较野生及KLF15敲除小鼠心脏组织中p65的磷酸化水平。与野生小鼠相比,KLF15敲除小鼠心脏组织中磷酸化p65蛋白水平显著升高,表明梗死的心脏组织中KLF15基因缺失增强NF-κB活化,见图5B。上述体内、外实验证实KLF15抑制缺氧诱导的NF-κB活化。

Figure 4.Effect of KLF15 on the expression of apoptosis-related proteins and inflammatory cytokines in hearts after MI.A:the mRNA levels of apoptosis-related proteins Bax and Bcl-2 and pro-inflammatory cytokines IL-6 and IL-1βin WT and KLF15 KO mouse hearts at 3 d after MI were assessed by RT-qPCR(n=5);B:Western blot analysis of Bax protein level in hearts at 7 d after MI(n=3);C:ELISA analysis of IL-6 protein level in hearts at 7 d after MI(n=5);D:TUNEL staining(green)of hearts isolated from WT and KLF15 KO mice at day 0 and day 3 after MI(DAPI:blue,nuclei;α-actinin:red,cardiomyocytes;scale bar=50µ;n=5).Mean±SD.*P<0.05,**P<0.01 vs WT;##P<0.01 vs sham group.图4 KLF15调控凋亡及炎症因子表达

Figure 5.KLF15 inhibited hypoxia-induced NF-κB activation in vitro and in vivo.A:H9C2 cells transfected with pcDNA-KLF15,pNF-κB-Luc reporter plasmid and pRL-TK plasmid were cultured under hypoxia or normal condition for 48 h,and relative luciferase activity was analyzed;B:Western blot analysis of the phosphorylation of p65 in WT and KLF15 KO mouse hearts at 3 d after MI surgery.Mean±SD.n=3.△△P<0.01 vs hypoxia;*P<0.05 vs WT.图5 KLF15抑制缺氧诱导的NF-κB活化
讨 论
成年心肌几乎不可再生,因此心肌梗死后的愈合依赖瘢痕修复。冠脉堵塞导致心肌细胞缺血、缺氧而凋亡、坏死。坏死的心肌释放内源性分子,以损伤相关分子模式(damage-associated molecular patterns,DAMPs)激活固有免疫,招募巨噬细胞等炎性细胞浸润,清除梗死区域坏死的细胞及细胞外基质碎片。随后肌成纤维细胞被激活,分泌大量细胞外基质,替代梗死心肌,形成胶原纤维瘢痕[2]。然而形成的胶原纤维瘢痕缺乏有效的收缩功能,为了保证全身血液供应,非梗死区的心肌细胞代偿性肥大。这种心肌梗死后心室形状、室壁厚度以及心肌结构等改变称为心室重构[9-10]。心室重构是心肌梗死后慢性心力衰竭的主要病理基础。本研究发现KLF15基因敲除鼠在心肌梗死后心功能明显低于对照鼠,而梗死瘢痕面积及非梗死区心肌细胞代偿性肥大程度均高于对照组,表明KLF15在心肌梗死后心脏重构过程中发挥保护作用。
心肌梗死时,组织供氧减少,氧化应激,导致细胞膜通透性改变,启动线粒体凋亡通路[11]。其中促凋亡蛋白Bax及抗凋亡蛋白Bcl-2两者共同参与调控心肌梗死后心肌细胞凋亡。本研究发现KLF15基因敲除小鼠在心肌梗死早期(3 d)心肌组织中促凋亡蛋白Bax表达明显高于对照小鼠,而抗凋亡蛋白Bcl-2表达低于对照小鼠,表明KLF15具有抑制心肌梗死后细胞凋亡的内源性保护作用。
心肌梗死早期强烈而短暂的炎症反应是清除梗死区域死亡细胞、激活肌成纤维细胞等修复细胞所必需的。但有效的损伤修复依赖于炎症的及时消退。长期炎症将加重心室重构,最终导致心脏破裂等灾难性结局[2]。多项临床及基础研究证实急性心肌梗死患者血清中TNF-α、IL-1β及IL-6等促炎因子显著升高,并且血清IL-1β等炎症因子水平与心肌梗死后死亡和再发生主要心血管事件风险独立相关。而给予抗IL-1β或者IL-6抗体治疗则显著降低小鼠心肌梗死面积,改善心功能[12-14]。本研究发现KLF15基因敲除鼠在心肌梗死早期(3 d)心脏中炎性因子IL-1β及IL-6的表达水平明显高于对照鼠,表明KLF15具有抑制心肌梗死后炎症反应的作用。
NF-κB是细胞在缺氧损伤后激活的重要转录因子之一,参与炎症、凋亡的调节[7]。NF-κB与心肌梗死后炎症密切相关。坏死心肌释放内源性分子通过DAMP/TLR途径激活NF-κB,活化的NF-κB入核,识别TNF-α、IL-1β及IL-6等炎性基因启动子区的NFκB结合位点,并激活其表达。同时TNF-α及IL-1β等又促进NF-κB的活化,形成正反馈,导致持续的炎性反应[15]。此外,NF-κB与心肌梗死后心肌细胞凋亡也有关,心肌细胞凋亡过程中伴有NF-κB的活化[16]。因此,抑制心肌梗死后NF-κB的转录激活具有抗炎、抗心室重构的作用。本研究借助H9C2细胞中NF-κB介导的萤光素酶活性及梗死心肌中磷酸化p65水平检测,发现KLF15抑制缺氧诱导的NF-κB转录激活。既往研究表明,动脉粥样硬化模型中,血管平滑肌细胞KLF15通过与组蛋白乙酰转移酶p300直接结合,抑制p300对NF-κB p65的乙酰化修饰,从而抑制p65的转录活性及下游靶基因单核细胞趋化因子1(monocyte chemotactic protein 1,MCP-1)等的表达[4]。心肌梗死中KLF15通过何种机制抑制NFκB的活化尚有待探讨。
综上所述,本研究结果显示KLF15基因缺失导致NF-κB活化,促进心肌梗死后心肌细胞凋亡及炎症损伤,增大梗死后瘢痕面积,降低心功能。这表明KLF15通过NF-κB信号通路在心肌梗死中发挥重要作用。

