氯离子通过MAPK/AKT信号通路调控高糖刺激引起的心肌细胞凋亡
苏振宇 李小兵 李红方 黄建成 吕瑛
(河北医科大学第一医院心外科,河北 石家庄 050031)
2型糖尿病(T2DM)是一种全球性的流行病,糖尿病患者患心力衰竭的风险是非糖尿病患者的两倍以上,老年糖尿病患者心力衰竭发病率接近 22%,糖尿病患者心力衰竭发病率的增加即使在排除年龄、高血压、高胆固醇血症和冠心病(CAD)等其他危险因素后仍然存在〔1〕。研究表明,44%的心力衰竭住院患者患有糖尿病,合并疾病的共存增加了临床治疗难度〔2〕。虽然糖尿病合并心力衰竭患者的死亡率与血红蛋白(HbA)呈U形相关,HbA水平为7.1%的患者死亡风险最低,但与非糖尿病合并心力衰竭患者相比,糖尿病患者的死亡和再住院风险更大。此外,较高的HbA水平与心力衰竭发病率增加有关〔2〕。心肌细胞凋亡是多种心血管疾病发生发展的基础,心力衰竭和心肌衰老等疾病均有大量心肌细胞凋亡〔3〕。心肌细胞上有多种离子通道参与心肌的正常代谢,如钠、钾、钙、氯离子等,也与心肌细胞凋亡密切相关〔4〕。高糖可诱发心肌损伤的发生,可能与氧化应激、内质网应激等多种因素有关〔5〕。氯离子通道包括囊性纤维化跨膜调节因子(CFRP)氯离子通道、钙激活氯离子通道(CaCC)等。研究表明氯离子通道具有调节细胞容积及细胞内pH 值、维持细胞静息膜电位、调控细胞活性与分化等多种生物学功能,也可参与内质网应激等过程〔3〕。氯离子通道阻断剂4(DIDS)是CaCC抑制剂,也是研究心肌损伤的常用抑制剂,可以抑制多种凋亡诱导剂导致的细胞凋亡。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)在细胞凋亡过程中起重要作用,其中,Caspase-3是凋亡过程中最主要的终末剪切酶。B淋巴细胞瘤-2基因(Bcl-2)基因是一种原癌基因,可以通过多种机制抑制细胞凋亡,包括抗氧化作用,Bcl-2高表达可以减少活性氧(ROS)的产生。Bcl-2还可以抑制凋亡蛋白酶Caspase激活,维持钙稳态。Bcl-2不仅是Caspase-3的上游基因,还可以作为其底物〔6〕。高血糖可增加自由基和促炎性细胞因子的生成,进一步促进AKT的激活,增加培养心肌细胞的凋亡〔7〕。缺血期间的急性高血糖会损害心肌细胞中AKT的激活〔8〕。高血糖抑制AKT信号可使胰岛素产生抵抗作用〔8〕。p38丝裂原活化蛋白激酶(p38 MAPK)是一种重要的应激信号分子,参与多种细胞功能的调节〔9〕。胰岛素抵抗和(或)2型糖尿病患者血浆游离脂肪酸、炎性细胞因子和(或)葡萄糖水平高,可激活p38 MAPK〔10〕。一旦p38 MAPK途径被激活,它就能够破坏细胞,从而进一步提高细胞内ROS水平。本文重点探讨氯离子/MAPK/AKT信号通路对高糖引起的心肌细胞损伤的影响。
1 材料和方法
1.1材料 0~3 d SD仔鼠购自空军军医大学(第四军医大学)实验动物中心。胎牛血清、DMEM 培养基、5-溴脱氧尿嘧啶核苷(BrdU)购自美国sigma公司;DIDS购自上海生工公司;细胞凋亡检测试剂盒、氯离子荧光探针N-〔6-甲氧喹诺基〕乙酰乙酯(MQAE)、超氧化物阴离子荧光探针(DHE)、羊抗兔抗Caspase-3(货号ab29422)抗体、羊抗兔抗GAPDH抗体(货号ab13522)购自Sigma公司。过氧化物酶复合物(SABC)、二氨基联苯胺(DAB)显色液购自武汉博士德公司。
1.2方法
1.2.1心肌细胞分离、培养、鉴定和分组处理〔11,2,4〕取出生1 d的大鼠乳鼠10只,70%乙醇消毒皮肤,剪开胸腔,去除血污与大血管,取出心脏,操作时应避免拉扯心脏造成的损伤。取下的心脏置于4℃预冷的磷酸盐缓冲液(PBS)中,清洗,剪至1 mm3左右的组织碎块,慢慢洗净组织中残余的血液。加入1 mg/ml的Ⅰ型胶原蛋白酶(0.22 μm过滤除菌)消化组织(37℃)。每次消化时间约7 min,加入与酶液等体积含10% FBS 的DMEM培养基终止消化,离心(200 μg,5 min)收集心室肌细胞,组织进行多次消化,但不超过8次。收集所有得到细胞,重悬细胞,200目滤网过滤后再接种于细胞培养瓶中,培养基为含有10%胎牛血清和终浓度0.1 mmol/L BrdU的DMEM培养基。
采用抗α-肌动蛋白(α-actin)抗体进行鉴定,将细胞以3×105/孔细胞数接种于预先放有消毒盖玻片的12孔板(用0.01 g/L多聚赖氨酸处理30 min,以促进细胞黏附);置于37℃、50 ml/L CO2,饱和湿度孵箱中孵育。取出盖玻片,用预冷(-20℃)的固定液(甲醛∶丙酮1∶1)固定8 min;滴加一抗(Caspase-3,GAPDH,α-actin),1∶100(PBS稀释),放于湿盒中4℃过夜;PBS(pH7.4)漂洗3 min×3次;滴加二抗〔辣根过氧化物酶(HRP)发光羊抗兔〕,1∶100(PBS稀释),室温放置37℃ 30 min;滴加SABC复合物,湿盒内37℃孵育20 min;DAB显色:滴加新鲜配制的DAB显色剂,在镜下观察显色后,流水冲洗终止显色反应,苏木素核复染;常规脱水、透明、中性树胶封片,显微镜下观察。分组:培养1 h后,加入终浓度为100 μmol/L 的BrdU进行培养。将原代培养的心肌细胞分为3组:对照组、高糖组、实验组。高糖组高糖DMEM培养基(33 mmol/L葡萄糖)培养;对照组DMEM培养基(含有5.5 mmol/L葡萄糖)培养;实验组高糖DMEM培养基(含有33 mmol/L葡萄糖)和100 μmol/L DIDS处理〔5,7〕。
1.2.2氯离子荧光探针MQAE检测心肌细胞氯离子浓度 采用MQAE检测细胞内氯离子浓度(检测原理:当细胞外的氯离子进入细胞内,使得细胞内的MQAE被荧光淬灭),将按上述方法分组的心肌细胞接种于48孔板中,处理后吸弃培养基。每孔加入100 μl 10 mmol/L MQAE工作液,孵育1 h,倒置荧光显微镜进行荧光检测,记录并计算荧光强度。
1.2.3MTT和流式细胞术检测心肌细胞存活率和心肌细胞凋亡率 将心肌细胞以5×105个/ml浓度接种于96孔板中,100 μl/孔。按照上述方法处理后,加10 μl剂量为5 mg/ml的MTT溶液与100 μl无血清培养基继续孵育4 h,每孔加150 μl二甲基亚砜,振荡10 min,在酶标仪上计算细胞存活率(波长490 nm)。PBS洗涤2次,用胰蛋白酶消化心肌细胞(不含EDTA),收集1×106个细胞,重悬细胞后,选择膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)染色,采用流式细胞术检测与计算心肌细胞凋亡率。
1.2.4超氧化物阴离子荧光染色检测心肌细胞ROS含量 将细胞接种于含盖玻片的24孔板中,按上述方法处理72 h。吸出培养基,固定、洗涤、封闭。每片加50 μl DHE(5 μmol/L),37℃避光孵育10 min,封片后在镜下记录与观察绿色荧光强度,记录与计算ROS水平。
1.2.5Western印迹 3组细胞3经处理后,在冰冷裂解缓冲液中裂解。用BCA蛋白质测定试剂盒测量蛋白质浓度。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,然后电转移到聚偏氟乙烯(PVDF)膜上。使用以下主要抗体:anti-Bcl-2、anti-Caspase-3、anti-p-AMPK、anti-p-AKT 和anti-GAPDH。将膜与HRP结合的抗兔IgG抗体(1∶5 000稀释;CST,美国)孵育1 h,然后进行增强化学发光(Santa Cruz,美国)和放射自显影。
1.3统计学分析 采用SPSS21.0软件进行配对样本t检验。
2 结 果
2.1抑制氯离子可显著降低高糖诱导所致心肌细胞内氯离子升高的水平 与对照组相比,高糖组氯离子浓度显著升高(P<0.05),而实验组氯离子浓度显著低于高糖组(P<0.05)。见表1。
2.2抑制氯离子增加高糖诱导的心肌细胞活性和降低心肌细胞凋亡 与对照组相比,高糖组心肌细胞活性显著减少(P<0.05)。与高糖组相比,实验组的心肌细胞活性显著升高(P<0.05)。流式细胞数检测发现,与对照组心肌细胞凋亡率相比,高糖组明显升高(P<0.01);实验组心肌细胞凋亡率显著低于高糖组 (P<0.05)。见表1、图1。
2.3抑制氯离子浓度降低高糖诱导心肌细胞产生ROS 与对照组相比,高糖组心肌细胞内ROS生成显著增加(P<0.05);与高糖组心肌细胞相比,实验组心肌细胞内ROS 生成显著减少(P<0.05)。见表1、图2。

图2 抑制氯离子浓度降低高糖诱导心肌细胞ROS的产生(DHE染色,×100)
2.4抑制氯离子浓度对心肌细胞Bal-2和Caspase-3水平的影响 与对照组相比,高糖组心肌细胞内Bcl-2表达显著降低,Caspase-3蛋白表达水平显著增加(P<0.05);与高糖组相比,实验组心肌细胞内Bcl-2显著升高,Caspase-3蛋白表达水平则显著降低(P<0.05)。见表1、图3。

图3 3组心肌细胞Bcl-2和Caspase-3表达水平
2.5抑制氯离子浓度对高糖诱导心肌细胞MAPK/AKT信号通路 与对照组相比,高糖组心肌细胞内p-MAPK表达增加,而显著抑制p-AKT蛋白表达水平(P<0.05);与高糖组相比,实验组心肌细胞内p-MAPK被显著抑制,而p-AKT水平则显著激活(P<0.05)。见表1、图4。
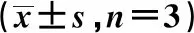
表1 3组细胞内氯离子水平心肌细胞活性、凋亡率及心肌细胞ROS、Bal-2、Caspase-3、p-MAPK、p-AKT水平表达

图4 3组心肌细胞MAPK/AKT信号通路表达水平
3 讨 论
糖尿病患病人数的增加可能是造成心血管疾病发病率居高不下的重要的原因之一〔12〕。糖尿病很早就被确定是心力衰竭的重要危险因素,高血糖在糖尿病心肌病形成过程中起到了关键作用。慢性高血糖既可以引起心肌细胞肥大、坏死和凋亡,其中有直接和间接的机制〔12〕。慢性高血糖可以通过电子链使ROS产生增多,后者可以诱发心肌细胞的凋亡〔13〕。ROS 可以激活聚腺苷酸二磷酸核糖转移酶(PARP),引起糖基化增加并抑制GAPDH,使糖酵解过程转变为引起心肌细胞损伤的级联反应。这其中包括糖基化终末产物的产生增加及己糖胺通路和多元醇通路的激活、蛋白激酶(PK)C的产生增加。高血糖引起的 ROS、PARP、糖基化终末产物、醛糖还原酶产生增加均可以诱发细胞凋亡〔13〕。 氧化应激是导致糖尿病并发症的重要机制。高糖条件下大鼠胚胎的体外培养显示,暴露于高糖后,谷胱甘肽耗尽、活性氧生成过多、生长迟缓和严重畸形〔12〕。使用抗氧化剂如丁羟甲苯、维生素C和E治疗可降低大鼠颅面畸形和骨骼畸形的发生率,而维生素E可降低大鼠冠心病的发生率和严重程度,这提示ROS可能参与大鼠冠心病的进程〔14〕。心肌细胞的凋亡是心肌损伤的主要病理改变,可造成心肌的修复性纤维化。其中容积调节性氯通道不但可被细胞肿胀、改变细胞外液渗透压所激活。本课题发现,抑制氯离子浓度促进高糖诱导的心肌细胞活性和心肌细胞凋亡。高糖刺激可对心肌细胞产生直接或间接作用,通过多种机制造成心肌损伤,根据此原理建立心肌损伤的细胞模型。本实验MTT结果显示氯离子通道阻断后,能够有效减少心肌损伤造成的心肌细胞凋亡。本研究表明在心肌损伤环境中,氯离子外流导致细胞内ROS水平升高。氯离子通道被阻断后,损伤环境下心肌细胞中ROS 的生成量显著减少。容积调节性氯通道除参与调节细胞容积外,在胞内酸碱平衡、细胞的增殖、分化、凋亡等过程中起重要作用。氯离子可能影响ROS及其氧化应激的作用。研究表明Bcl-2与Caspase家族在细胞凋亡调控中起重要作用〔15〕。其中,Caspase-3是凋亡过程的主要执行者,活化的Caspase-3可经蛋白酶解过程激活后,导致细胞凋亡。Bcl-2是凋亡程序中的重要调控基因之一,在细胞内高表达时可抑制凋亡〔15〕。本研究发现,抑制氯离子浓度通过调控Bcl-2和Caspase-3抑制心肌细胞凋亡。体外研究证明,同源类似物A/Rho相关激酶(RhoA/ROCK)途径可通过氧化应激JNK和p38 MAPK通路介导高糖诱导的心肌细胞凋亡〔16,17〕。本研究发现,氯离子可以通过调控 MAPK/AKT信号通路抑制高糖诱导心肌细胞凋亡。
综上,抑制氯离子可降低高糖所致心肌细胞内ROS和Caspase-3水平,升高Bcl-2,进而抑制心肌细胞凋亡,促进心肌细胞活性,导致的心肌损伤得到修复。抑制氯离子可以通过调控 MAPK/AKT信号通路抑制高糖诱导心肌细胞凋亡。

