红花檵木季节性花叶表型及其光合生理响应分析
张艺帆,王 慧,霍雯雯,李 阳,刘 洋,曹福祥,李炎林,于晓英,许 璐
(1.湖南农业大学 园艺学院,长沙 410128;2.湖南省中亚热带优质花木繁育与利用工程技术中心,长沙 410128)
红花檵木(Loropetalumchinensevar.rubrum)又称红檵木、红桎木,为檵木变种。红花檵木因其叶红花艳,适应性强,耐修剪,易造型,而广受欢迎,在长江流域及以南地区作为主要的色叶植物大量应用于公园、道路、工厂、校园、社区等绿化中。近年来在生产苗圃和各类园林绿地应用中发现红花檵木的叶片存在一种异常的“季节性花叶”现象,即在夏秋季节红花檵木叶片呈现“花叶”状,冬春季节“花叶”症状减弱或消失,而且这种现象越来越普遍。已有研究人员发现该种“花叶”症状,认为是植物病毒导致,提出了防治对策,但并未通过试验明确病原种类和致病机制,该现象发生的原因、机制,以及对植株生长发育的具体影响尚未明晰[1]。相关研究表明植物叶片的呈色与其色素的种类、含量、比例密切相关,而色素不仅影响植物呈色,还影响植物的光合生产力,对植物的生长发育和生态适应性有重要影响,是评价植物生长状况的重要指标[2]。毛行简等[3]在对花叶假连翘光合特性的研究中发现,其3种叶色表型叶片光合特性存在的显著差异与叶绿体层间分布不均有直接关系,同时发现花叶假连翘花叶利用强光的能力较强,在强光环境下其性状可保持稳定。目前,国内外对红花檵木花叶研究极少,仅有对其花叶病毒病害症状的描述研究,国内围绕红花檵木的研究主要集中在正常红花檵木的栽培管理、生理特性、化学成分等方面[4]。为了解红花檵木“季节性花叶”具体的表型、机制及对植株生长的影响,本研究在实地勘测、调查、取样的基础上,结合表观特征、发生规律、色素含量、光合特性等对这种“季节性花叶”进行表型分类及其光合能力及适应性的分析,以期为红花檵木的科学应用与养护及对叶片呈色机理更深入地研究与人为干预调控提供参考。
1 材料与方法
1.1 材 料
光合特性分析试验材料为湖南农业大学园林花卉教学基地红花檵木(‘大叶红’)13 a~15 a地栽成年植株(土壤、水肥管理及修剪等栽培养护措施一致)。
1.2 方 法
1.2.1 花叶调查 于2019年5月至2021年8月在长沙市及周边地区有红花檵木应用或生产的园林绿地和苗圃随机抽取1 m×2 m的样方(共计292个)统计红花檵木季节性花叶发生情况, 季节性花叶发生比率=出现花叶的总面积/调查样方总面积×100%。
表型分类:将花叶与正常叶相比,综合叶片的大小和颜色进行表型分类。
1.2.2 叶片横切解剖结构观察 于2021年7月下旬至8月上旬,选取植物材料叶片5~6片,塑封袋装好带回实验室,在干净的载玻片在中间滴加蒸馏水,利用切好的土豆为手持物,将叶片夹在其土豆中间用刀片切取薄片盖上盖玻片后在光学显微镜下观察,并保存拍照。
1.2.3 光合色素的提取及其含量的测定 于2021年7月下旬至8月上旬,按照于相丽等[5]采用的方法,每种花叶表型类型选取3片同一水平的成年叶片为样品,将采集的各类型的样叶用去离子水流水冲洗后拭干其表面,去叶梗及主叶脉,剪碎,用电子天平秤取0.2 g样品置于10 mL离心管中,加入95%的乙醇作为提取液,定容至10 mL,封口并避光浸泡提取24 h后,再充分混匀溶液,待碎叶片下沉后立即移取上清液置于光径为1.0 cm的比色皿中,以紫外分光光度计测定其吸光度,记录提取液在663、645和470 nm处的吸光度,用于计算叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)及总叶绿素[Chl(a+b)]含量,计算公式如下:
Chl a=12.7×A663-2.69×A645×V/1 000W
Chl b=22.9×A645-4.68×A663×V/1 000W
Chl(a+b) =(20.0×A645+8.02×A663)×V/1 000W
Car=(1 000×A470-3.27×Chl a-104×Chl b)/229×V/1 000W
式中:A663、A645与A470分别表示波长在663、645和470 nm处的吸光度;Chl a、Chl b、Chl(a+b)分别表示叶绿素a、叶绿素b和总叶绿素的含量(mg·g-1),Car表示类胡萝卜素的含量(mg·g-1);V为提取溶液的体积,W为叶片样品的质量。
1.2.4 花色素苷含量的测定 花色素苷的提取方法参照黄欣等[6],于2021年7月下旬至8月上旬,称取红花檵木叶片1.0 g,设置3个重复,剪碎后分别置于40 mL离心管中;加入10 mL的1%盐酸乙醇提取液,32 ℃恒温箱中提取 4 h,离心(12 000 r·min-1离心10 min)取上清液,待测,用日立U-2900型分光光度计测定525 nm处吸光度值,用相应的提取液作对照,花色素苷相对含量计算,以每克鲜质量在10 mL提取液中 0.1 OD525为1个色素单位,则:A=吸光度×10(色素单位)。
1.2.5 叶绿素荧光参数的测定 叶绿素荧光的测定使用FluorPen FP 110 手持式叶绿素荧光仪,于2021年7月下旬至8月上旬,各类型的样叶各选取3片同一水平的叶片,叶片表面擦净后用叶片夹将其夹住,暗适应15 min后,测定初始荧光(F0)、最大荧光(Fm)、PSⅡ有效光化学量子效率(Fv/Fm)、PSⅡ潜在光化学活性(Fv/F0)等叶绿素荧光参数,然后用叶片夹夹住20 min后测光化学淬灭系数(qP)[7-8]。
1.2.6 光响应曲线的测定 采用LI-6400XT便携式光合仪进行光响应曲线测定,测定时间为2021年7月下旬至8月上旬,根据刘洁等[9]测定方法,在8:00-11:30 时,样叶各选取 3 片同一水平的叶片,测定时大气温度为 20 ℃~25 ℃,以大气作为CO2源,制作空气缓冲瓶以保持CO2浓度的相对稳定,流速为500 μmol·s-1,在0~ 1 800 μmol·m-2·s-1的光照强度范围内设定15个梯度,分别为2 000、 1 800、1 600、1 400、 1 200、1 000、800、600、400、200、100、80、50、20、 0 μmol·m-2·s-1,每片叶读取5~10个瞬时净光合速率(Pn),参照叶子飘[10]的方法来拟合其光响应曲线,计算表观量子效率(AQE)、最大净光合速率(Pnmax)、光饱和点(Lsp)、光补偿点(Lcp)以及暗呼吸速率(Rd)。
1.3 数据分析
采用Excel 2016对数据进行处理、Origin 2018作图、SPSS 19软件进行显著性差异分析。
2 结果与分析
2.1 红花檵木季节性花叶表型分析
2019年5月至2021年8月在长沙市及周边地区的调查中发现,在园林绿地和苗圃中主栽的红花檵木‘大叶红’‘大叶玫红’‘密枝玫红’‘长叶玫红’等品种都有“季节性花叶”现象,且品种间表型差异不明显。一般自春季5月初开始首先在植株新枝上呈现花叶,然后逐步扩展到老叶、老枝, 7-10月花叶现象最突出,花叶的颜色最鲜艳,冬春季节“花叶”症状减弱或消失。这种“花叶”的主要表型特征是叶色为深浅不同绿黄、红黄相间花叶或完全黄化、白化,或叶色为叶片中有深浅不同红色斑点或斑块;叶片正反两面无明显病症,无虫体及昆虫排泄物和危害痕迹。
综合所有调查的292个样方中花叶表型,根据叶片颜色和大小将红花檵木这种异常花叶类型分为以下5类典型表型(图1):
叶片变小的花叶(A):叶片缩小到正常叶片大小的1/6以上,最小的叶片大小不足0.04 cm2,叶色为深浅不同绿黄、红黄相间花叶或完全苗化、黄/白化表型,不同植株间的代表性表型见图1-A1~A3。
绿黄相间花叶(B):叶片大小没有明显改变,叶色为深浅不同绿黄相间花叶,不同植株间的代表性表型见图1-B1~B3;红黄相间花叶(C):叶片大小没有明显改变,叶色为深浅不同红黄相间花叶,不同植株间的代表性表型见图1-C1~C3;黄化或白化叶(D):叶片大小没有明显改变,叶片叶肉部分完全黄化或白化,不同植株间的代表性表型见图1-D1~D3;红色斑点(块)花叶(E):叶片大小没有明显改变,叶片中有深浅不同红色斑块或斑点,不同植株间的代表性表型见图1-E1~E3。

A1~A3.叶片变小的花叶;B1~B3. 绿黄相间花叶;C1~C3.红黄相间花叶;D1~D3.黄化或白化叶;E1~E3.红色斑点(块)花叶;CK.正常叶
2.2 红花檵木季节性花叶现象发生比率分析
对调查区域292个样方的红花檵木5类季节性花叶表型类型发生概率进行统计,结果如图2所示。从图2中得知表型为红黄相间花叶类型(C)的发生比率明显高于其他4种表型类型,高达42.52%;其次是绿黄相间花叶(B)为 22.12%,红色斑点花叶(E)和叶片变小的花叶(A)的发生比率分别为14.02%和13.86%;完全黄化或白化的表现(D)发生比率最低,仅7.48%。

图2 红花檵木季节性花叶不同表型发生比率Fig.2 Occurrence ratio of seasonal mosaic leaf phenotypes of Loropetalum chinense var. rubrum
2.3 叶片横切解剖结构的观察分析
5类表型的异常花叶与正常叶片的解剖结构见图3。根据栅栏组织花青素的分布,叶片变小的花叶(A)与正常叶(CK)的栅栏组织中以花青素占主要地位,叶绿素含量较少;红黄花叶(C)的花青素含量较少且仅分布于栅栏组织中;红斑叶(E)叶绿素明显较多,花青素含量少并呈散点分布;绿黄花叶(B)横切中叶片富含叶绿素,而未见花青素分布;黄化叶(D)叶绿素含量也较少,叶片失绿,横切面主要呈黄白色。

图3 显微镜下不同异常花叶各横切面解剖结构(40×)Fig.3 Cross-sectional structures of different abnormal mosaic leaves under microscope(40×)
2.4 5类表型异常花叶各色素含量的比较
由表1可知,总叶绿素含量以E类(1.77 mg·g-1)最多,显著高于其他类,D类的总叶绿素含量最少,仅0.15 mg·g-1;CK类花色素苷含量显著高于其他类,高达3.40 mg·g-1,最少的仍为D类,仅有0.47 mg·g-1;D和B类的类胡萝卜素含量明显较高,分别为2.05 mg·g-1和1.89 mg·g-1,最少的是A类,仅为0.14 mg·g-1。通过统计各类3种色素含量的占比可知(图4),A类的花色素苷含量占比高达85%,明显多于其他两种色素含量,其中类胡萝卜素含量极少(4%);B类中类胡萝卜素和总叶绿素含量均较多,占比分别为51%和33%;C类为花色素苷含量最多,约为一半(53%),其次为类胡萝卜素含量较多(36%);D类中类胡萝卜素含量明显较多,占比高达77%,而总叶绿素含量极少(5%);E类的总叶绿素含量占比最大,高达62%;作为CK类的正常叶以花色素苷含量最多(64%),其次为总叶绿素含量(26%)。

表1 不同异常叶色表型叶片的各色素含量Table 1 Pigment content of different abnormal leaf color phenotypes mg·g-1
2.5 5类表型异常花叶叶绿素荧光参数的比较
正常叶CK与5种不同表型花叶的叶绿素荧光特性参数见表2,Fm是PSⅡ反应中心处于完全关闭时的荧光产量,Fm值与叶片吸收和传递光能的能力呈正相关,初始荧光(F0)可评价逆境对植物叶片PSⅡ永久性损伤的程度,并与植物叶片的叶绿素浓度有关[11]。从表2可知,A类的最大荧光Fm值最高(9 579.67),而最低的D类仅为3 787.00,显著低于A类,其余类的Fm值为CK>B>E>C;6类样品中初始荧光值F0最高的是E类(3 835.00),显著高于其他组,而D类F0值为最低(1 869.00),其他类F0值为CK> A>B>C;PSⅡ 的潜在光化学活性Fv/F0值最高的是A类 3.63,其次为CK的3.34及E类的 2.86,3类均显著高于其他类;而Fv/Fm值的规律同Fv/F0值基本一致。光化学淬灭系数qP为CK>E>C>B>A>D,且D类显著低于其 他类。

表2 5类表型异常叶与正常叶的叶绿素荧光特性比较Table 2 Comparison of chlorophyll fluorescence characteristics between five abnormal leaves and normal leaves
2.6 5类表型异常花叶叶片的光合参数比较
植物的光合能力取决于本身的遗传特性,不同种类间光合能力均存在较大差异[12]。不同花叶叶片光合参数的比较如图5和表3所示,在 0~2 000(μmol·m-2·s-1)的光照强度范围内,随着光合有效辐射(PAR)的增加,正常叶色样品和不同类型的异常叶色样品的净光合速率(Pn)均呈线性增加,当PAR达到一定值时,Pn达到最大值,即达到光饱和点,所有样品材料的Pn均先增加达到最大值后趋向稳定。6类样品的表观量子效率(AQE)为D>C>B>A>CK>E,其中D类显著高于其余5类;光饱和点为CK>E>B> C>A>D,且各类间对比差异较大;最大净光合速率为CK>B>C>E>A>D,且CK为12.78 μmol·m-2·s-1,显著高于其他类;光补偿点由高至低依次为C>A>D>E>B>CK,最高的C类(49.52 μmol·m-2·s-1)显著高于CK类 (6.28 μmol·m-2·s-1);暗呼吸速率为A>C>D>B>E>CK,且各类间的差异显著。

图5 5类异常叶与正常叶的光响应曲线比较Fig.5 Comparison of light response curves between five abnormal leaves and normal leaves
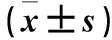
表3 6种类型叶片的光合-光响应曲线特征参数
3 结论与讨论
本研究对分布于长沙7个行政区的居住小区、市政道路和学校校园绿地3类样区中的红花檵木异常叶色发生情况进行调查,将红花檵木异常叶色按叶片颜色和大小为依据分类,共分为叶片变小的花叶(A)、绿黄相间花叶(B)、红黄相间花叶(C)、黄化或白化叶(D)、红色斑点(块)花叶(E)共5类典型表型。其中C类型发生比率最高,D类型发生比率最低,C类型发生比率最高的原因可能是因为红花檵木异常叶色主要发生于枝条顶端修剪后的新叶,正常新叶展叶后应为紫红色所致;而B类花叶的产生可能是由于红花檵木具有高温返青的特点,叶片返青后发生黄化而出现绿黄异常花叶;至于这些季节性的异常花叶具体诱因是生物因子还是非生物因子还有待进一步的深入研究。
总叶绿素、类胡萝卜素及花色素苷含量之间的比例不仅与叶色相关[13],也与光合能力有关,另外,叶绿素荧光参数也能够反映植株叶片的光合效率和潜在能力[14]。有研究表明[15-16],植物体中叶绿素含量越高,越有利于阴生植物在弱光条件下有效地吸收光能;类胡萝卜素既可作为光合色素,又是植物的内源抗氧化剂,在提升叶片利用蓝紫光能力的同时增强叶片的光合效能[17];花色素苷能够防御光破坏,具有维持和完善植物的光合功能的能力[18]。本研究对5类异常花叶光合特性及色素含量的测定中发现,CK叶花色素苷占比最多,总叶绿素次之,类胡萝卜素最少,叶片呈现均匀的紫红色,叶片吸收及传递光能的能力较强,光合作用效率较高,最大净光合速率、表观量子效率及光饱和点较高,光补偿点较低,暗呼吸速率最低,有机物积累能力较强,反映其对光的适应性较强[19]。与CK相比,E类叶叶绿素含量较高,A类叶花色素苷含量较高,各光合参数仅次于CK,叶绿素荧光参数与正常叶较为接近,光合能力及对环境的适应能力较好。此外,根据前人研究结论可知,PSⅡ原初光能转换效率值(Fv/Fm)可代表植物的潜在最大光合能力,PSⅡ 有效光化学量子效率(Fv/F0)指标能体现光系统PSⅡ的潜在光化学活性,且该值越高说明植物的光合性能越强,以上两个指标作为植物发生光抑制的敏感指标,用于评估植物对环境的适应性,来判断植物生长是否受到抑制[8, 20-21],Fv/Fm应在 0.75~0.85[22],实测表观量子效率(AQE)应在 0.03~0.05[23]。本研究发现,仅CK与E的AQE,CK与A的Fv/Fm介于或接近上述范围,表明A、E类花叶抵御光系统破坏的能力相对较好,而B、C、D 3种类型均与此范围相差较远,表明受外界影响较大[24],总体光合能力B优于C、D;且E类qP值较高,表明其有较高的光能利用效率,对自身光合机构保护能力也较强[25],这可能是由于E类叶叶绿素含量显著高于包括对照的其他组,因此并未由于出现红色斑块而降低光合能力;本研究还发现,CK的总叶绿素含量次于E类的红斑叶,而CK的Pnmax是显著高于其他类型花叶。高阳等[26]研究中同样发现,荫蔽环境中的大豆叶片叶绿素含量最多的种类其Pnmax却不是最大的,叶绿素含量并不一定与Pnmax成正比,还需参考其生长环境,根据前期的实际调查发现,本研究的E类叶在荫蔽环境中生长较多,因此有可能是E类叶适应荫蔽环境的一种体现。A类花叶光合面积减少,花色素苷含量同样占比较多,因此抵御外界对光合系统的破坏能力较强。D类叶各种色素含量、光合作用效率、有机物积累能力基本均最低,表明其适应能力最差,受到环境的影响最大。
综上所述,与正常叶相比,红花檵木叶片呈现季节性花叶的表型不同,其光合生理均有不同的响应表现,A、E类的花叶的出现对植株来说受到的消极影响较小;此外,B、C、D 3类花叶的各项指标与CK相比均较差,综合各种指标来说,B优于C,D最差。可见,这3类花叶对植株来说受到的消极影响较大。本研究为今后进一步探究红花檵木花叶形成的具体原因及形成机理奠定基础。

