表没食子儿茶素没食子酸酯对大肠杆菌诱导型奶牛乳腺上皮细胞炎性损伤的影响
徐天乐 朱 浩 刘 润 梁 艳 曹海南 杨章平,*
(1.扬州大学农业科技发展研究院(国际联合实验室),扬州 225000;2.扬州大学动物科学与技术学院,扬州 225000)
乳腺炎、子宫炎和蹄叶炎是影响奶牛生产的3种常见疾病[1]。其中,乳腺炎直接影响奶牛的产奶能力和牛奶品质,是人们一直关注的焦点[2]。乳腺炎一般是由细菌感染引起,根据细菌病原体的不同,将乳腺炎分为2种类型,即传染性乳腺炎和环境性乳腺炎,这2种类型的乳腺炎分别由金黄色葡萄球菌和大肠杆菌感染引起[3-4]。由大肠杆菌引起的奶牛临床乳腺炎给世界各地的奶牛场造成了重大的奶产量损失和动物福利问题。脂多糖是大肠杆菌等革兰氏阴性杆菌的细胞壁成分[5]。大量研究表明,革兰氏阴性菌释放的脂多糖可以诱导奶牛乳腺上皮细胞发生炎症反应以及氧化应激[6]。氧化应激和炎症可以互相诱导激活,机体失衡产生的氧化应激不仅会损伤蛋白质、核酸和脂质等生物大分子,还会激活产生炎症的转录因子,加重炎症反应[7-8]。初步研究表明,脂多糖通过与Toll样受体(TLR)4结合启动细胞内信号转导,而TLR4的激活参与了一系列TLR信号级联反应,最终介导转录因子核因子-κB(NF-κB)的激活,从而导致细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的产生[9]。
在奶牛的日常管理过程中,抗生素常作为治疗乳腺炎的药物,但如果大剂量使用抗生素会造成奶牛体内有很多残留,导致经奶牛乳房挤下来的牛奶中通常会含有抗生素[10]。国内饲料“禁抗令”全面施行之前,抗生素还作为饲料添加剂,用来预防疾病并促进乳畜生长,但这容易危害生态安全以及影响乳品质量,牛奶中残留的抗生素还会进入环境中造成污染,饮用残留有抗生素的牛奶会引起人体过敏反应,导致肠道菌群失调以及免疫能力下降[11]。2020年,我国要求饲料端全面“无抗”,天然植物因其安全有效的优势成为了替代抗生素研究与应用的热点[12]。植物产生的次生代谢产物对畜禽具有促生长、抑菌、抗氧化、抗炎、免疫调控及调节肠道菌群等作用,是理想的抗生素替代品[13]。许多植物提取物,如植物精油也已经被证明可以缓解奶牛乳腺上皮细胞的炎症反应和氧化应激,起到保护乳腺的作用[14]。
表没食子儿茶素没食子酸酯(EGCG)是茶多酚的主要组成部分,具有抑菌、抗炎和抗氧化等功能[15-16]。EGCG在家禽生产中应用较多,是一种良好的饲料添加剂,可以改善鸡蛋品质,提高鸡蛋的抗氧化能力以及提高肉鸡的生产性能[17-18]。Xue等[19]研究表明,在肉仔鸡饲粮中添加600 mg/kg EGCG,能够显著提高肉仔鸡的体重、平均日增重和平均日采食量。但关于EGCG对奶牛乳腺上皮细胞炎症的影响少见报道。因此,本试验利用大肠杆菌建立奶牛乳腺上皮细胞炎症反应及氧化损伤模型,通过添加EGCG,分析EGCG对原代奶牛乳腺上皮细胞(pbMEC)的修复作用和调节机制,为EGCG在改善奶牛健康方面的研究提供理论依据。
1 材料与方法
1.1 试验材料
试验用pbMEC由扬州大学奶牛遗传资源与健康创新团队提供;EGCG购买于Sigma-Aldrich公司;RPMI 1640培养基、青链霉素混合液、胰蛋白酶和胎牛血清购买于Gibco公司;反转录试剂盒和荧光定量PCR检测试剂盒购买于南京诺唯赞生物科技股份有限公司;BeyoClickTM5-乙炔基-2′脱氧尿嘧啶核苷(EdU)-555细胞增殖检测试剂盒、活性氧(ROS)检测试剂盒、丙二醛(MDA)检测试剂盒、免疫荧光染色试剂盒、CCK-8细胞活力检测试剂盒和抗体购买于上海碧云天生物技术有限公司;FuturePAGETM蛋白预制胶、快速转移缓冲液和MOPS-SDS电泳缓冲液购买于南京艾思易生物科技有限公司;倒置荧光显微镜(DMi8)购买于德国徕卡公司,酶标仪(SPARK)购买于瑞士Tecan公司,蛋白印迹成像系统(FluorChem Q)购买于美国Protein Simple公司,实时荧光定量PCR仪(QuantStudio3)购买于美国赛默飞公司。
1.2 试验方法
1.2.1 细胞培养和传代
试验采用传代2~5代的细胞,每24 h更换1次细胞培养液,当细胞密度达到80%~90%时,用胰蛋白酶消化;然后1 000×g离心3 min,弃上清液,将细胞接种在6孔板和96孔板上。
1.2.2 细胞活力测定
在pbMEC中加入不同浓度的EGCG[0(对照)、20、40、60、80和100 μmol/mL]培养12 h,每孔加入含10 μL CCK-8试剂的100 μL RPMI 1640培养液,然后在培养箱中孵育2 h,最后用酶标仪在450 nm处测量每孔的吸光度(OD)值。
1.2.3 试验设计
根据前期实验室研究成果,选用1×107CFU大肠杆菌构建乳腺上皮细胞炎症模型。将培养好的细胞分为3个组,分别为对照组、大肠杆菌处理组(1×107CFU大肠杆菌处理细胞6 h)和EGCG+大肠杆菌处理组(先用60 μg/mL EGCG处理细胞24 h,再用1×107CFU大肠杆菌处理细胞6 h),每组设3个重复。
1.2.4 EdU细胞增殖检测
按照1.2.3步骤处理细胞,在6孔板中加入1 mL工作液,放入培养箱培养2 h,随后加入多聚甲醛室温固定15 min;添加1 mL通透液通透15 min,每孔加入0.5 mL的Click反应液,避光孵育30 min后洗涤细胞;每孔加入1 mL Hoechst 33342反应液,避光孵育10 min;最后用倒置荧光显微镜进行观察。
1.2.5 MDA生成量检测
按照1.2.3步骤处理细胞后,加0.5 mL提取液并混匀,取样0.1 mL于离心管中,水浴40 min,冷却并离心,96孔板中每孔加入250 μL反应液,酶标仪测定各孔在530 nm处的OD值。
1.2.6 活性氧(ROS)含量检测
按照1.2.3步骤处理细胞后,按照1∶1 000用无血清培养液稀释2′,7′-二氢二氯荧光素二乙酸酯(DCFH-DA),去除细胞培养液,每孔加入1 mL稀释好的DCFH-DA,在37 ℃细胞培养箱孵育20 min;洗涤细胞3次,用倒置荧光显微镜观察结果。
1.2.7 RNA提取和实时荧光定量PCR
按照1.2.3步骤处理细胞,提取细胞RNA。采用2步法进行反转录,并将反转录得到的cDNA进行检测。引物序列如表1所示,实时荧光定量PCR扩增条件为:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用2-ΔΔCt法计算目的基因mRNA相对表达量。

表1 引物序列
1.2.8 蛋白免疫印迹检测
将细胞接种到6孔板并按照1.2.3步骤处理细胞,用裂解液提取细胞蛋白,并使用二喹啉甲酸(BCA)试剂盒测定蛋白浓度;将各组的细胞浓度调节到相同水平后,使用预制胶进行电泳,并转移到硝酸纤维素膜上;用牛血清白蛋白(BSA)封闭膜,随后与一抗[TLR4、髓样分化因子88(MyD88)、p65、磷酸化p65(p-p65)和GAPDH]孵育,在4 ℃下过夜,用TBST洗膜5~6次,每次5 min;然后用二抗摇动孵育2 h,并再用TBST洗涤5~6次,每次5 min;最后用蛋白印迹成像系统检测条纹。
1.2.9 免疫荧光检测
将细胞接种到6孔板并按照1.2.3步骤处理细胞,用4%多聚甲醛固定细胞15 min,通透液处理10 min;加入封闭液并处理60 min,然后每孔加入一抗,4 ℃过夜孵育;用异硫氰酸荧光素(FITC)标记的二抗,避光孵育2 h,用4′,6-二脒基-2-苯基吲哚(DAPI)染色液对细胞核进行染色,每孔500 μL;室温避光孵育并清洗,最后使用倒置荧光显微镜避光拍照。
1.3 数据统计分析
试验数据采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,P<0.05表示差异显著,结果以“平均值±标准差(mean±SD)”表示。
2 结果与分析
2.1 EGCG对pbMEC活力的影响
如图1所示,用不同浓度EGCG处理pbMEC 12 h后,在80和100 μmol/mL EGCG处理下,pbMEC活力与对照组相比显著下降(P<0.05);而在20、40和60 μmol/mL EGCG处理下,pbMEC活力与对照组相比无显著差异(P>0.05)。因此,选用60 μmol/mL EGCG进行后续试验。
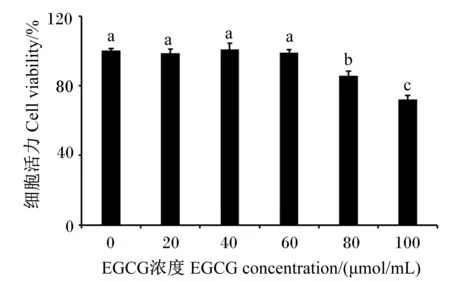
数据柱标记不同字母表示差异显著(P<0.05)。下图同。Data columns marked with different letters indicated significant difference (P<0.05). The same as below.
2.2 EGCG对大肠杆菌处理的pbMEC增殖的影响
采用EdU试剂盒并通过荧光显微镜观察pbMEC增殖情况,如图2所示,大肠杆菌处理组细胞增殖数量明显少于对照组;EGCG+大肠杆菌处理组细胞增殖数量明显多于大肠杆菌处理组。结果表明,EGCG对大肠杆菌抑制的细胞增殖有一定的保护作用。
2.3 EGCG对大肠杆菌处理的pbMEC MDA生成量的影响
EGCG对大肠杆菌处理的pbMEC MDA生成量的影响如图3所示,与对照组相比,大肠杆菌处理组细胞MDA生成量显著提高(P<0.05);与大肠杆菌处理组相比,EGCG+大肠杆菌处理组细胞MDA生成量显著降低(P<0.05)。
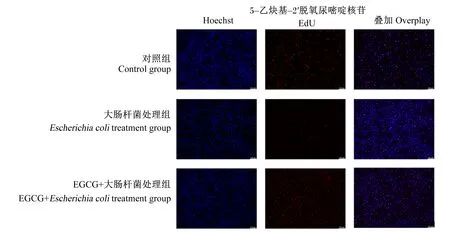
图2 EGCG对大肠杆菌处理的pbMEC增殖的影响
2.4 EGCG对大肠杆菌处理的pbMEC ROS含量的影响
EGCG对大肠杆菌处理的pbMEC ROS含量的影响如图4所示,与对照组相比,大肠杆菌处理组荧光强度(ROS含量)明显增强;与大肠杆菌处理组相比,EGCG+大肠杆菌处理组荧光强度明显降低。
2.5 EGCG对大肠杆菌处理的pbMEC炎症因子mRNA相对表达量的影响
EGCG对大肠杆菌处理的pbMEC炎症因子mRNA相对表达量的影响如图5所示,与对照组相比,大肠杆菌处理组细胞IL-1β、TNF-α、诱导型一氧化氮合酶(iNOS)和TLR4 mRNA相对表达量显著提高(P<0.05);与大肠杆菌处理处理组相比,EGCG+大肠杆菌处理组细胞IL-1β、TNF-α、iNOS和TLR4 mRNA相对表达量显著降低(P<0.05)。
2.6 EGCG对大肠杆菌处理的pbMEC NF-κB通路相关蛋白表达量的影响
EGCG对大肠杆菌处理的pbMEC NF-κB通路相关蛋白表达量的影响如图6所示,与对照组相比,大肠杆菌处理组细胞TLR4、p-p65和MyD88蛋白表达量显著提高(P<0.05);与大肠杆菌处理处理组相比,EGCG+大肠杆菌处理组细胞TLR4、p-p65和MyD88蛋白表达量显著降低(P<0.05)。
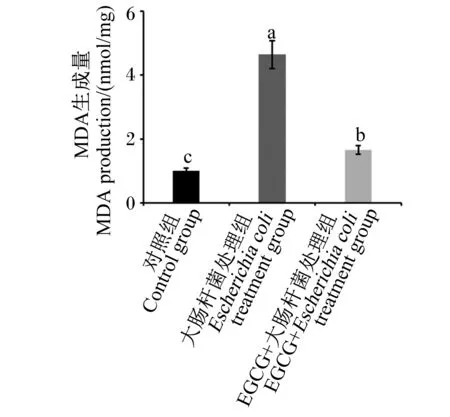
图3 EGCG对大肠杆菌处理的

图4 EGCG对大肠杆菌处理的
2.7 p-p65在pbMEC胞质和胞核中的表达
通过免疫荧光试验检测p-p65在pbMEC胞质和胞核中的表达,如图7所示,与对照组相比,大肠杆菌处理组细胞p-p65荧光强度明显增强;与大肠杆菌处理处理组相比,EGCG+大肠杆菌处理组细胞p-p65荧光强度明显降低。

图5 EGCG对大肠杆菌处理的pbMEC炎症因子mRNA相对表达量的影响

E. coli:大肠杆菌 Escherichia coli;EGCG:表没食子儿茶素没食子酸酯 epigallocatechin gallate;TLR4:Toll样受体4 Toll-like receptor 4;MyD88:髓样分化因子88 myeloid differentiation factor 88;p-p65:磷酸化p65 phospho-p65;GAPDH:甘油醛-3-磷酸脱氢酶 glyceraldehyde-3-phosphate dehydrogenase。

图7 p-p65在pbMEC胞质和胞核中的表达
3 讨 论
本研究通过EdU细胞增殖试验发现,加入适宜浓度的EGCG后,受到大肠杆菌侵袭的pbMEC的增殖比例明显提高。相关研究表明,大肠杆菌是奶牛乳腺炎的主要致病菌之一,其细胞壁特有的脂多糖已被证明可诱导pbMEC的炎症和氧化应激[20]。随着对植物提取物研究的深入,越来越多的活性物质被用于探索抗氧化、抗炎和抗肿瘤等活性功能[21-22],而EGCG作为茶多酚中最主要的活性物质,已经被证明具有抗炎和抗氧化功能。郭子玉等[23]研究发现,EGCG能够通过与大肠杆菌结合,抑制大肠杆菌膜孔蛋白的功能,最终导致大肠杆菌细胞死亡。据此推测,EGCG对大肠杆菌诱导型奶牛乳腺上皮细胞炎性损伤具有一定的抑制作用。本研究结果发现,加入适宜浓度的EGCG可显著降低大肠杆菌处理的pbMEC中TNF-α和IL-1βmRNA的表达。TNF-α是一种涉及到系统性炎症的细胞因子,与大肠杆菌诱导型乳腺炎脂多糖休克有着密不可分的关系[24]。IL-1β是一种关键的促炎细胞因子,参与多种自身免疫性炎症反应和多种细胞活动,包括细胞增殖、分化和凋亡[25-26]。因此,加入适宜浓度的EGCG可以降低大肠杆菌诱导型奶牛乳腺上皮细胞炎性损伤,缓解细胞炎症反应。
从上述结果可以看出,EGCG对大肠杆菌诱导的pbMEC炎症有积极的作用,但研究表明,有效的抗炎症治疗策略不仅需要减少炎症细胞因子的产生,而且还需要减少炎症诱导的氧化应激[27]。在炎症刺激后,细胞产生过多的ROS和活性氮(RNS),它们共同作用导致细胞损伤[28]。在细胞中,iNOS催化产生一氧化氮(NO)[29-30]。IL-1β被报道对iNOS的激活至关重要,随着iNOS表达水平的升高,细胞内NO含量增加,产生毒性物质,引起亚硝化应激;同时,NO水平降低对细胞有利,可预防脂多糖产生的负面作用,减轻炎症反应[31-32]。ROS的主要来源是细胞的线粒体呼吸链,线粒体受外界刺激后,产生过量ROS并且会对线粒体造成损伤,可能引发线粒体自噬[33]。RNS和ROS分子都是活性氧化还原自由基,可以互作形成额外的分子,如过氧亚硝酸阴离子(ONOO-),对细胞造成损伤。iNOS表达水平升高,局部剧增的NO易于被ROS氧化为RNS。RNS也被证明通过蛋白质S-亚硝基化来调节参与ROS稳态关键酶的活性[34-35]。MDA是脂质过氧化物终产物之一,其含量高低可以作为考察细胞受到损伤严重程度的指标之一[36]。而在本试验中,大肠杆菌诱导的炎症反应能显著提高pbMEC中iNOSmRNA相对表达量、ROS含量和MDA生成量,而添加适宜浓度EGCG则可以缓解这种作用,这与上述研究结果基本一致。
此外,本试验中受到大肠杆菌侵袭的pbMEC中TLR4的mRNA相对表达量和蛋白表达量显著提高,而添加EGCG后,这一现象有所缓解。TLR4是一种跨膜蛋白,可以直接识别革兰氏阴性细菌的脂多糖,并且能够激活与适应性免疫有关的基因,其已被证明不仅是抵御病原体入侵的第一道防线,也是识别NF-κB信号通路上游配体的重要受体[37-38]。在细菌入侵期间,pbMEC通过增加TNF-α和IL-1β等促炎细胞因子分泌来触发炎症和免疫反应,这些细胞因子的激活需要TLR4对刺激的识别[39]。研究表明,当细胞产生炎症反应时,NF-κB信号通路被激活,被激活的NF-κB信号可以通过磷酸化激活细胞内的转录因子,从而调节靶基因的表达,产生不同的生理反应[40]。MyD88是TLR信号通路中的一个关键接头分子,在传递上游信息具有重要的作用[41];而p65则是NF-κB家族成员之一,由NF-κB经典通路激活[42]。为了进一步探明EGCG抑制炎性细胞因子产生是否与NF-κB信号通路有关,本试验还检测了p-p65、MyD88和p65这3个蛋白表达量,结果发现,受到大肠杆菌侵袭的pbMEC中p-p65和MyD88蛋白表达量较高,在添加适宜浓度的EGCG后,p-p65和MyD88蛋白表达量显著降低。以上研究结果表明,适宜浓度的EGCG可以降低大肠杆菌诱导的TLR4活性升高,降低p65的磷酸化水平,并进一步抑制IL-1β和TNF-α等炎症因子的释放,从而发挥抗炎作用,保护机体免受炎症损伤。
4 结 论
EGCG能够抑制大肠杆菌诱导的奶牛乳腺上皮细胞炎症因子以及NF-κB通路相关蛋白的表达,对乳腺上皮细胞炎症反应以及氧化应激具有一定的缓解作用。

