自体富血小板凝胶联合脂肪干细胞对糖尿病足大鼠lncRNA的影响*
冯召岚 盛健健 董爱武 李江雄 曹玲玲
糖尿病(diabetes mellitus,DM)为因绝对或相对缺乏胰岛素诱导的慢性内分泌与代谢疾病,以2型糖尿病多见,最新调查发现,中国2 型糖尿病发病率已经达到11.3%,有较高致死率与致残率[1]。DM 患者常伴发踝以下组织感染、深层组织破坏或溃疡,即糖尿病足(diabetic foot,DF)[2],目前治疗DF 主要以控制血糖、抗感染、溃疡清创、促进组织再生等为主[3]。自体富血小板凝胶(autologous platelet-rich gel,APG)最早用于骨科、烧伤整形科、颌面外科等,治疗效果好,而脂肪干细胞(ADSCs)治疗DF 主要依据干细胞可于体内分化成平滑肌细胞及血管内皮细胞,分泌大量的血管内皮生长因子(VEGF),可促进下肢的血流尽快恢复,以治疗该病[4]。长链非编码RNA(lncRNA)作为一种竞争性内源RNA(competing endogenous RNA,ceRNA),通过吸附miRNA 参与调控靶基因表达从而影响细胞的功能已被证实,虽然lncRNA 因缺少完整开放的阅读框而不具有编码蛋白质的能力,但其可有效地调节脂肪细胞分化、糖脂代谢[5]。本研究通过构建DF 大鼠模型,研究APG 联合ADSCs 治疗DF 的效果,并对溃疡组织进行lncRNA 芯片分析,探讨APG 联合ADSCs 对lncRNA 表达的影响,现将结果报道如下。
1 材料与方法
1.1 材料 于2021 年6-9 月选取30 只SPF 级别的C57BL/6 大鼠(江苏艾菱菲生物科技)。体重195~215 g,平均(205.64±5.49)g,放置于洁净实验动物房饲养,自然光线,自由饮食,温度21~27 ℃,湿度42%~61%。肝素(常州千红生化制药股份有限公司)、氯化钠注射液(生产厂家:杭州民生药业股份有限公司,批准文号:国药准字H20043304,规格:1 000 mL∶9 g)、利多卡因(生产厂家:上海朝晖药业,批准文号:国药准字H31021071,规格:20 mL∶0.4 g)、肾上腺素(生产厂家:无锡济民可信山禾药业股份有限公司,批准文号:国药准字H32024032,规格:1 mL∶1 mg)。
1.2 方法
1.2.1 建立大鼠DF 模型 在适应性地喂养1 周后随机分为正常组、对照组、治疗组,各10 只。正常组自由饮水不建模,其余两组建立DF 模型。模型建立方法:经链脲霉素(STZ)(生产厂家:Sigma-Aldrich 公司,货号:S0130)诱导建立模型[6]。予以高糖高脂饲料,包括猪油、蔗糖、胆固醇、猪胆酸盐、鸡蛋、黄豆芽及基本饲料,分别占11.0%、19.0%、2.5%、1.0%、1.0%、29.0%、36.5%,在4 周后腹腔注射1 次30 mg/kg STZ,注射3 d 后采集大鼠尾静脉血,测得的随机血糖在16.7 mmol/L 以上则认为成功造模T2DM。在造模后3周,对大鼠进行麻醉,足背部消毒,后进行DF 造模,采用矩形印章在大鼠足背面剪下矩形(2 mm×5 mm)伤口,锐性移除全层皮肤,制造DF 模型,DF 造模成功标准:肢端出现不同程度紫黯、红肿、溃疡与坏疽。制造全层皮肤创面后第2 天观察并记录24 h 内创面面积大小,测量时重复2 次。
1.2.2 APG 的制备 参考文献[7],经7%(0.3 mL/100 g)水合氯醛腹腔注射麻醉大鼠,取5 mL 注射器,吸取0.3 mL 4%的枸橼酸钠抗凝剂,注射器连接硬膜外管,在大鼠颈静脉取3 mL 的静脉血,以1 100g离心10 min,后加0.3 mL 氯化钙50 mg/mL以激活,静置后中间淡黄色凝胶即为APG 凝胶,留取备用。
1.2.3 ADSCs 的制备 参考文献[8],采用250 mL氯化钠注射液+2%利多卡因10~15 mL+肾上腺素0.25 mg 的肿胀液对脂肪组织区域进行局麻,以20 mL注射器配备口径1.5~3.5 mm、侧孔3.0~5.0 mm 的吸脂针,进入供区,形成负压后呈扇形手动而均匀地吸取脂肪组织,吸出3~5 mm3脂肪组织颗粒,若脂肪组织颗粒较大,则需予以手工剪制。
1.2.4 分组处理及观察 治疗组于溃疡处注射APG+ADSCs(用量均依据创面大小确定,0.1 mL/cm2),对照组注射等量磷酸缓冲盐溶液(phosphate buffered saline,PBS)于DF 动物溃疡处,正常组同样在动物足部相同位置注射等量PBS。(1)三组均连续注射14 d,采集治疗前(建模大鼠于建模成功时采集,对照组与正常组于同时间采集)、治疗后尾静脉血,经血糖仪测定大鼠血糖水平;(2)注射14 d 后将溃疡组织固定在4%多聚甲醛溶液中。在治疗前及治疗后采用免疫印迹法测定炎症因子[白介素-6(IL-6)、C 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)]、VEGF、碱性成纤维细胞生长因子(bFGF)水平,以β-actin 为内标。
1.2.5 lncRNA 芯片分析 在治疗后收集对照组、治疗组的溃疡组织,以及正常组对应位置组织,进行lncRNA 芯片分析,测定lncRNA 表达谱变化,探针为60 met 长寡核苷酸。先提取总RNA,cDNA 逆转录,荧光标记,排列杂交、清洗。后予以荧光强度扫描,扫描图像传至NumbleScan 软件,以Agilent Gene Spring 软件进行差异基因、功能富集研究。
1.3 统计学处理 采用SPSS 23.0 软件对数据进行统计学处理,计量资料以()表示,组间比较采用单因素方差分析及LSD-t检验、独立样本和配对样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 三组血糖水平检测结果比较 治疗14 d后,正常组血糖与治疗前比较,差异无统计学意义(P>0.05);对照组血糖水平显著高于治疗前,治疗组血糖水平明显低于治疗前,且治疗组低于对照组(P<0.05)。见表1。
表1 三组血糖水平检测结果比较[mmol/L,()]

表1 三组血糖水平检测结果比较[mmol/L,()]
*与对照组比较,P<0.05。
2.2 两组炎症因子及血管生成因子水平比较 治疗前,两组的IL-6、CRP、TNF-α 水平比较,差异均无统计学意义(P>0.05);治疗14 d后,对照组的IL-6、CRP、TNF-α 水平均高于治疗前,治疗组上述指标水平均低于治疗前,且治疗组均低于对照组(P<0.05);治疗14 d后,对照组的VEGF、bFGF 水平均低于治疗前,治疗组上述指标水平均高于治疗前,且治疗组均高于对照组(P<0.05)。见表2、3。
表2 两组炎症因子水平比较()
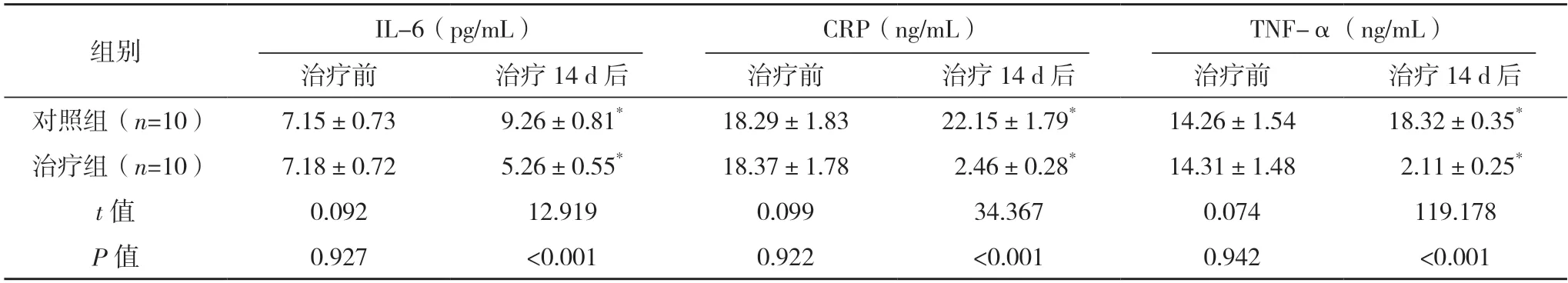
表2 两组炎症因子水平比较()
*与治疗前比较,P<0.05。
表3 两组血管生成因子水平比较[ng/100 μg,()]

表3 两组血管生成因子水平比较[ng/100 μg,()]
*与治疗前比较,P<0.05。
2.3 各组lncRNA 表达谱分析 对照组与正常组比较存在1 627 个显著差异的lncRNA,治疗组与正常组比较存在1 896 个显著差异的lncRNA,对照组与治疗组比较存在2 576 个显著差异的lncRNA。
2.4 lncRNA 表达差异谱的靶基因预测 将靶基因代入差异mRNA 数据,筛选得到DF 相关的靶基因有8个,分别为DLX6-AS1、CHI3L1、CAMTA1、STRADB、ARAP1-AS1、ARAP1-AS2、PVT1、ROR,其中DLX6-AS1、CHI3L1、STRADB、ARAP1-AS2、PVT1、ROR 高表达,CAMTA1、ARAP1-AS1 低表达。
3 讨论
慢性并发症DF 为DM 患者慢性皮肤溃疡的主要原因,DF 所致的截肢占我国住院截肢者的28.2%。APG 为目前治疗DF 的新方法,当APG 形成后,血小板被快速地激活,在5~10 d 后释放出多种生长因子,其含有的丰富纤维蛋白及营造的相对潮湿低氧环境均有利于创面修复,预防感染[9],而ADSCs 有多向分化潜能,在增殖速度、生长动力学和衰老凋亡方面与胚胎干细胞无差异,既往李雪阳等[10]发现,ADSCs+APG 可促进大鼠创面修复,其机制可能和调控TGFβ1-Smad、基质金属蛋白酶表达存在关系,但目前关于APG 联合ADSCs 是否可改善DF 血管新生及血供目前尚未见报道。
本次实验发现,治疗14 d后,对照组血糖水平显著高于治疗前,治疗组血糖水平明显低于治疗前,且治疗组的血糖低于对照组(P<0.05),表明APG联合ADSCs 对DF 大鼠血糖有较好调节作用。APG属于自体富血小板血浆与促凝剂按照一定比例混合后形成的有生物修复能力的物质,属于新型溃疡治疗方式,其含有丰富血小板,且具备高浓度的纤维蛋白、白细胞,其中白细胞能杀灭体内局部病原体,提高患者抗感染力,而纤维蛋白有组织构建作用,为避免白细胞与血小板流失,可将其进行严密包裹,为细胞修复供应支架,干细胞可经促进胶原蛋白Ⅰ、Ⅲ及细胞角质蛋白19(CK19)表达而促进外皮形成,继而改善溃疡,改善DF 的血糖水平[11]。
CRP、IL-6、TNF-α 在DF 发病中起着重要作用,其中CRP、IL-6 可加快体内淋巴细胞分化,大量产生免疫球蛋白G,加速杀伤性T 淋巴细胞激活,可使体内胰岛β 细胞发生凋亡,TNF-α 是单核巨噬细胞生成且具备多种生物学功能的多肽类细胞因子,可损伤血管内皮功能,加速DF 发展[12]。VEGF 表达能有效地促进血管通透性及表皮细胞增殖,加速新生血管生成,bFGF 表达则对机体修补增生肌肤表层细胞有直接的影响,能促进细胞增殖分化,替代衰老细胞。本次研究发现,治疗后治疗组IL-6、CRP、TNF-α 均低于对照组,而VEGF、bFGF 均高于对照组(P<0.05)。APG 可促进机体组织恢复,此外APG 制备方法简单,治疗成本较低[13-14]。ADSCs 取材容易、对机体损伤性较小、体内的储备量高[15]。故ADSCs 联合APG 对降低DF 大鼠炎症因子水平,促进新生血管形成具有积极影响。
本次研究发现,与正常组比较,对照组存在1 627 个显著差异的lncRNA,治疗组存在1 896 个显著差异的lncRNA,对照组与治疗组比较存在2 576 个显著差异的lncRNA,将靶基因带入差异mRNA 数据,筛选得到DF 相关的靶基因有8个,分别为DLX6-AS1、CHI3L1、CAMTA1、STRADB、ARAP1-AS1、ARAP1-AS2、PVT1、ROR,表明APG联合ADSCs 可能通过改变lncRNA 的表达,而对DF 发挥降糖及治疗作用。DLX6-AS1 参与细胞分化及形态学发展,属于转录因子家族,在DF 中也发挥重要作用,既往李杰玉[16]发现,DF 患者血清中lncRNA DLX6-AS1 表达量升高,可能参与DF 发生及发展过程,并可能作为临床诊断的分子标记物。CHI3L1 为一种分泌型糖蛋白,主要由软骨细胞、平滑肌细胞、巨噬细胞、肿瘤细胞等细胞分泌,且参与细胞外基质重构、急慢性反应的病理过程,也可能对胰岛素信号通路有阻断作用从而诱导胰岛素的分泌水平发生缺陷障碍[17]。CAMTA1 的活化对体内糖脂代谢有重要调节作用,STRADB 则能较好地维持胰岛素分泌平衡,既往李晓燕等[18]也发现,APG 与脐带干细胞联用后经靶基因筛选得到CHI3L1、CAMTA1、STRADB 差异表达。ARAP1可通过调控Rho 激酶及表皮生长受体参与糖尿病肾病的发生,而lncRNA-ARAP1-AS1、lncRNAARAP1-AS2 均为位于11 号染色体上的lncRNA[19]。研究显示表达下调的lncRNA-ARAP1-AS1 及表达上调的lncRNA-ARAP1-AS2 作用于靶基因mRNAARAP1,使mRNA-ARAP1 在糖尿病与糖尿病肾病中表达上调,可能通过调控Rho 激酶与EGF 受体途径,参与糖尿病与糖尿病肾病的发生[20]。lncRNA PVT1 于多种肾细胞中均有表达,可能有助于糖尿病肾病肾小球特征性细胞外基质积累的增加,叶凤等[21]发现,敲低lncRNA PVT1 可上调Nephrin和WT-1 的表达,下调Desmin 的表达,减少足细胞的凋亡,敲低PVT1 表达则可改善高糖刺激足细胞损伤与凋亡。lncRNA ROR 位于人18 号染色体,为一种非编码RNA,可能参与面部皮肤的老化演变,其机制为lncRNA ROR 通过正向调控UCP1 及PRDM16 的表达水平,促进脂肪源性干细胞发生棕色化,及lncRNA ROR 通过表达参与TGF-β 信号通路过度激活,共同引起dWAT 过度减少从而加速面部皮肤的老化,既往有研究发现,lncRNA ROR在脂肪源性干细胞中过表达与面部皮肤老化的发生发展有显著的相关性[22]。因此APG 联合ADSCs可能通过改变lncRNA(DLX6-AS1、CHI3L1、CAMTA1、STRADB、ARAP1-AS1、ARAP1-AS2、PVT1、ROR)的表达,而影响炎症因子和血管生成因子水平,而对DF 发挥降糖及治疗作用,但本研究也存在局限性,如一个lncRNA 可调节多个靶基因,而靶基因也可受多个lncRNA 调节[23],后期可继续完善研究,为明确APG 联合ADSCs 调控DF 的机制提供依据。
综上所述,APG 联合ADSCs 可能通过改变lncRNA DLX6-AS1、CHI3L1、CAMTA1、STRADB、ARAP1-AS1、ARAP1-AS2、PVT1、ROR 的表达,而对DF 大鼠的炎症因子与血管生成因子水平产生影响,继而发挥降糖及治疗作用。

