潮间带原油污染对泥蚶(Tegillarca granosa)抗氧化酶活性影响与综合生物标志物响应研究
陈帆,潘玉英,2*,徐青霞,刘铭华,杨金生,杨灿灿,牟成彬,蓝青萍
1.浙江海洋大学水产学院,浙江舟山 316022
2.浙江省海洋渔业装备技术研究重点实验室,浙江舟山 316022
3.浙江海洋大学石油化工与环境学院,浙江舟山 316022
近年来,随着海洋石油勘探开发项目的不断涌现,溢油事件时有发生,必然会影响潮间带生态环境.石油的主要成分是烃类,在200~300种之间,组分复杂[1].海洋溢油扩散形成的油膜会影响海气交换与光合作用,导致水体缺氧;同时,石油中含有的多环芳烃(polycyclic aromatic hydrocarbons,PAHs)为溢油的主要致毒组分[2],能够导致海洋生物DNA被破坏甚至中毒死亡[3-4].潮间带是海洋与陆地交汇的过渡地带,其生态体系受到陆地和海洋的共同影响.当潮间带受到溢油污染后,石油会在潮汐作用下持续释放,扩散至沉积物深层或近岸,危害周围生态环境[5].因此,探究潮间带底栖生物能否作为石油污染评估的哨兵物种,并且寻找合适的生物标志物来反映环境变化对生态风险评估具有重要意义.
随着环境监测技术的不断进步,国内外学者逐渐将目光聚焦于寻找合适的生物标志物指示污染及评估其生物毒性效应.Turja等[6]通过抗氧化防御系统(antioxidant defense system,ADS)等一系列生物标志物,探究油黑壳菜蛤(Mytilustrossulus)等生物暴露于原油中的变化,发现在2种高暴露浓度(0.120和0.750 mg/L)下,试验生物PAHs的累积呈在暴露前期增加、后期减少的特征,且不同类型PAHs在生物体的累积率存在显著差异.蒋凤华等[7]利用栉孔扇贝(Chlamys farreri)鳃和消化腺组织中超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性的变化来反映原油水溶性组分(water soluble fraction of crude oil,WSF)的生物毒性,结果表明,栉孔扇贝鳃和消化腺组织中SOD和CAT活性在时间-效应上随暴露时间的增加一般表现为降低−升高−降低的趋势.Shirani等[8]分析经长期石油污染的弹涂鱼(Periophthalmuswaltoni)中5种生物标志物的变化,发现7-乙氧基-3-异吩恶唑酮-脱乙基酶(7-ethoxyresorufin O-deethylase,EROD)、胆汁荧光芳香化合物(fluorescent aromatic compounds,FACs)和谷胱甘肽转硫酶(glutathione s-transferase,GST)对PAHs敏感,三者可能成为检测石油污染的生物标志物.王重刚等[9]研究发现,梭鱼(Mugil so-iuy)暴露于低浓度苯并(a)芘(benzopyrene,BaP)和芘(Pyrene)后,其肝脏中SOD活性表现为被抑制,暴露于高浓度BaP和芘后SOD活性先被抑制后被诱导.林芳等[10]发现,翡翠贻贝(Pernaviridis)暴露于BaP和滴滴涕(dichlorodiphenyltrichloroethane,DDT)污染24和48 h后,随暴露浓度的升高SOD、碱性磷酸酶(alkaline phosphatase,AKP)活性均表现为先被抑制后被诱导.
生物标志物中的抗氧化酶系统对环境污染响应灵敏,且具备早期预警功能[11-12].SOD、CAT、GST、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等在协同、互补、代偿、保护等作用下,能够帮助生物体在污染暴露时清除活性氧自由基(reactive oxygene species,ROS),从而降低细胞损伤程度,保护机体[13-14].根据污染物对生物的毒性效应,可选取几种在特定生物中对污染有显著响应的生物标志物来检测污染[15].综合生物标志物响应(integrated biomarker response,IBR)作为一种更全面可靠的指标,目前已被应用于生物毒性效应评估[16-17],该指标通过整合量化多个不同生物标志物进行综合分析,判断综合生物毒性响应.
海洋生态系统复杂且生物种类繁多,少量基础数据样本不足以满足污染评估的实际需求,国内外开展了许多关于石油烃对海水中鱼类、贝类中生物酶活性的研究,但有关潮间带沉积物原油污染对底栖生物酶活性影响及IBR综合评价的研究较少,尤其是对潮间带典型滤食性生物—泥蚶(Tegillarca granosa)的毒性效应研究更为鲜见.因此,该研究以泥蚶作为受试生物,在实验室条件下模拟受不同浓度原油污染的潮间带生境,以SOD、CAT、GST和GPx活性为测定指标,探究原油污染下泥蚶鳃和消化腺中抗氧化酶活性的变化,并通过IBR指标评估原油污染对泥蚶的综合生物毒性效应,以期为潮间带生物及环境保护提供理论依据.
1 材料与方法
1.1 仪器与试剂
试验仪器选用紫外可见分光光度计(UV-1100B型,上海美谱达仪器有限公司)、高速离心机12Pro(宁波群安电子科技有限公司)、XH-C旋涡混合器(常州越新仪器制造有限公司)、HWS-24型电热恒温水浴锅(上海一恒科学仪器有限公司)等.试验试剂以SOD、CAT、GST和GPx试剂盒(南京建成生物工程研究所有限公司)及无水乙醇和冰醋酸(国药集团化学试剂有限公司)等分析纯为主.
1.2 试验材料
试验用泥蚶购自浙江省舟山市老街菜市场.原油取自舟山市岙山岛,为流动相轻质原油.海水为实验室自配海水,盐度为19.00±1.00.沉积物取自舟山市长峙岛马鞍村附近潮间带,晾干后筛至粒径小于1 mm备用.室内模拟泥蚶实际生存环境,沉积物本身含有盐分导致上层海水盐度最终升至24.50±1.00,介于泥蚶最适生存盐度20.0~26.2之间[18].
1.3 试验方法
参照GB 18668−2002《海洋沉积物质量》(石油类含量一类、二类和三类标准分别为500、1 000和1 500 mg/kg),并结合实际溢油后高浓度污染情况,设置对照组和5个原油浓度处理组,各试验组原油浓度分别为0、500、1 000、1 500、10 000和15 000 mg/kg,每组设3个平行.基于原油浓度差异,规定1 500 mg/kg及以下的浓度组为低浓度处理组,高于1 500 mg/kg的浓度组为高浓度处理组.按照不同设置组别,分别选用体积为44 cm×30 cm×26 cm的聚乙烯养殖槽,先加入与原油混合均匀的5 kg沉积物,后加入5 kg实验室自配海水静置24 h.选取暂养一周后平均壳质量为(10.36±1.13)g的泥蚶,随机分成18组,每组50只,平均安置于室内模拟环境中.试验期间连续充氧,控制溶解氧浓度为(9.40±0.50)μmol/L,水温为17.50~18.50℃,每隔72 h换水50%.不同处理组及对照组沉积物和上层海水原油浓度的理论值和试验期间的实测平均值如表1所示,结果显示实测环境原油浓度较理论值普遍偏高.上述结果可能是由于沉积物本身含有部分石油;除此之外,供试沉积物有机质含量较高(委托浙江省海洋生态环境监测中心测定沉积物中有机质含量为6 920 mg/kg),处理组添加的石油可能会溶解部分有机质,导致实测原油浓度偏高.由于沉积物中部分原油会释放至上层海水,故随着暴露浓度的升高,上覆水中原油含量增加.
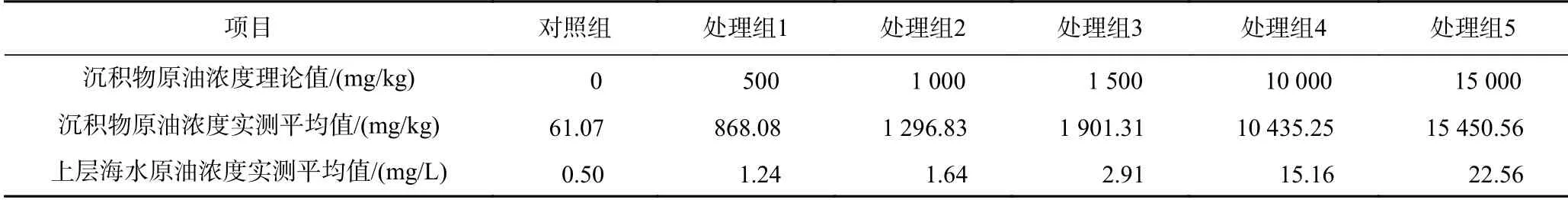
表1 不同试验组沉积物和上层海水中原油浓度的理论值和实测平均值Table 1 Theoretical and average measured values of oil concentration in sediment and upper seawater at different test groups
试验中分别于第1、3、6、9、12天采样,每次随机选取2只泥蚶.为方便分析,规定第1、3天为污染前期,第6天为污染中期,第9、12天为污染后期.采样时仔细分离出鳃与消化腺,用预冷的超纯水冲洗并用滤纸吸干水分,称量并转移至冻存管中用液氮冷冻,−20℃保存.
1.4 样品预处理
取于冰浴条件下研磨后的鳃与消化腺,按体积比为1∶3添加86%的生理盐水,制成25%的组织匀浆,2 500 r/min离心10 min.根据前期预试验,鳃中SOD、CAT、GST、GPx、蛋白质测定所需最佳取样浓度分别为2.5%、2%、5%、20%、2%,而消化腺中最佳取样浓度分别为2.5%、2.5%、2.5%、20%、2%.依据不同组织中各指标最佳取样浓度,取适量25%组织匀浆离心后的上清液,用生理盐水稀释,用于酶活性以及蛋白含量的测定.
1.5 酶活性与蛋白含量测定
抗氧化酶(SOD、CAT、GST和GPx)活性和总蛋白含量测定均严格按南京建成生物工程研究所试剂盒说明书进行.根据试剂盒说明并参照文献[19],采用黄嘌呤氧化酶法测定SOD活性(U/mg,以每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量计);参照钼酸铵法测定CAT活性(U/mg,以每mg组织蛋白每s分解1μmol H2O2的量计);依据分光光度法测定GST和GPx活性〔U/mg,以每mg组织蛋白每min扣除非酶促反应使反应体系中谷胱甘肽(GSH)浓度降低1μmol/L的量计〕;蛋白含量参考考马斯亮蓝法测定.
1.6 数据处理
1.6.1 差异显著性分析
采用SPSS软件进行正态分布和方差齐性检验后,以单因素(ANOVA)方差分析或非参数检验(Kruskal-Wallis检验)对数据进行差异显著性分析,其中,P<0.05表示组间差异显著,P<0.01表示组间差异极显著.通过比较4种酶活性的最大诱导率及最大抑制率〔见式(1)〕,可进一步分析泥蚶鳃和消化腺在不同时间点对不同浓度原油的敏感性.
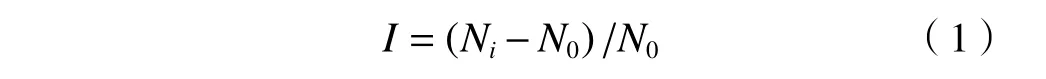
式中:I为诱导率或抑制率;Ni为试验组受诱导后的酶活性,U/mg;N0为相应对照组的酶活性,U/mg.I值>0,表现为诱导作用;I值<0,表现为抑制作用.
1.6.2 IBR分析
将SOD、CAT、GST和GPx作为4种目标生物标志物,进行IBR计算.将每种生物标志物数据按浓度、时间均一化处理,然后与所有取样时间点中该标志物均一化数据最小值的绝对值相加计算得到各时间点单个生物标志物的得分(Bi值),并转化为星状图中辐射线的长度,最后计算星状图三角形面积之和可得IBR值[19].
2 结果与分析
2.1 原油污染对泥蚶鳃中SOD、CAT、GST、GPx活性变化的影响
受原油污染后,泥蚶鳃4种酶活性变化如图1所示,在不同原油污染浓度和暴露时间下4种酶活性存在差异.由图1(a)可见,时间-效应上,随着污染暴露时间的延长,泥蚶鳃各试验组的SOD活性均呈升高−降低−升高的变化特征,在污染第3天处理组1的SOD活性达到峰值(210.220 U/mg).剂量-效应上,随原油浓度的上升,除第1天处理组2和第9天处理组3外,第1、6、9天各试验组SOD活性总体呈先降低后升高的趋势;第12天除处理组4外,其余试验组的SOD活性总体呈先升高后降低的趋势,与第3天变化趋势一致.总体上,高浓度处理组泥蚶鳃中的SOD活性在第1、3、9天表现为被抑制,在低浓度处理组SOD活性随时间能够逐渐恢复至接近对照组的水平.
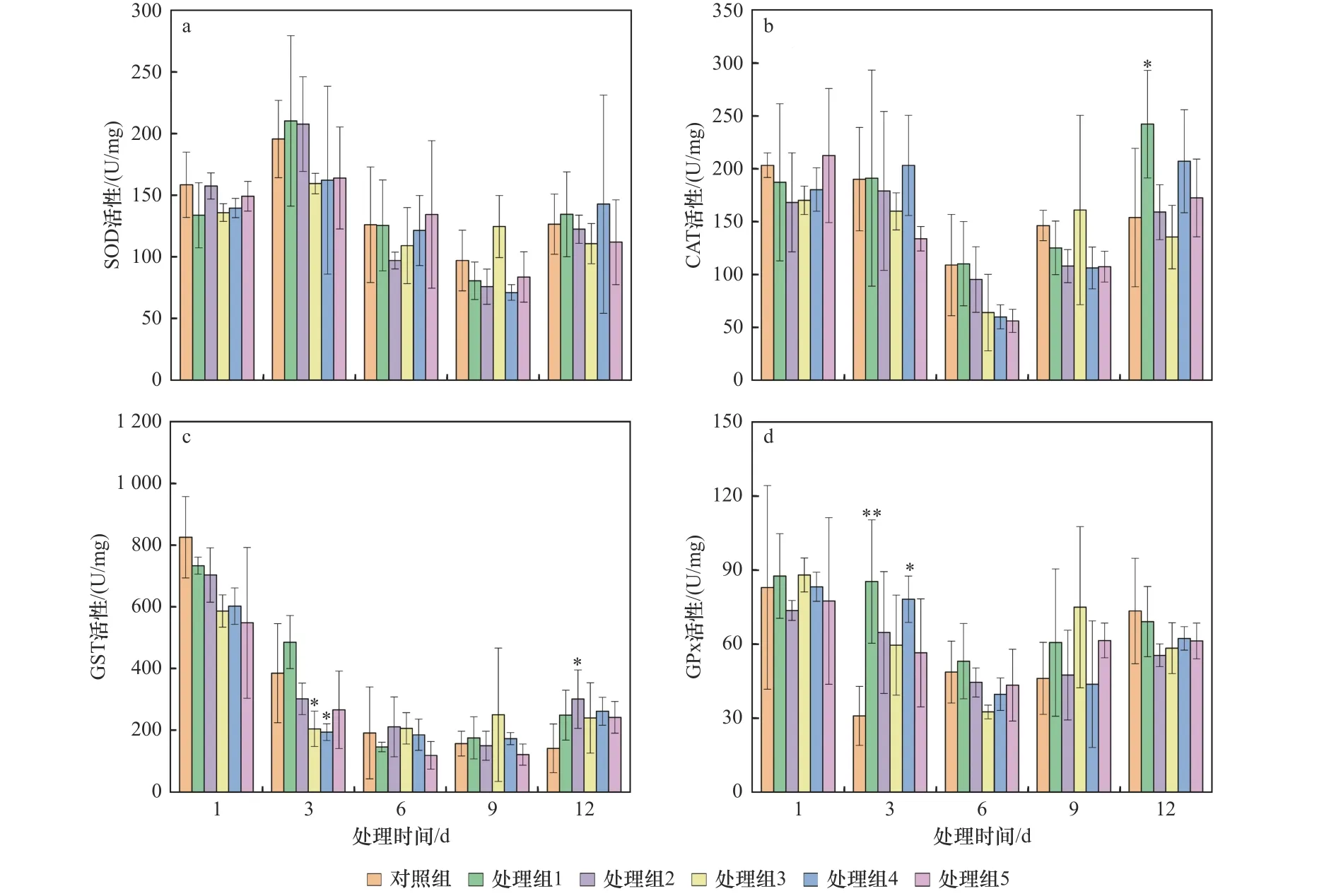
图1 不同浓度原油污染对泥蚶鳃中4种酶活性的影响Fig.1 Effectsof crude oil on four enzyme activities in gills of Tegillarca granosa
由图1(b)可见,随处理时间的增加,各试验组CAT活性总体呈先降低后升高的趋势.在暴露于原油第6天后,泥蚶鳃的CAT活性降至最低点.随原油浓度的上升,CAT活性在第1天表现为先被抑制后被诱导的特征,在第6天原油对CAT活性的抑制效果增强.第12天,处理组1鳃中CAT活性升至试验期峰值(242.08 U/mg),且此时CAT活性显著高于对照组(P<0.05).各试验组CAT活性在第6天均降至最低.
由图1(c)可见,随处理时间的增加,各处理组GST活性随时间总体呈先降低后升高的趋势,且在第6或第9天达最低值,而对照组GST活性则持续下降.随原油浓度的上升,各处理组GST活性在试验前期(第1、3天)总体呈被抑制趋势,活性逐渐降低,而试验后期(第12天)呈先强后弱的被诱导趋势.第3天,处理组3、4的GST活性均显著低于对照组(P均小于0.05),分别为159.63、203.11 U/mg;第12天,处理组2的GST活性为158.89 U/mg,显著高于对照组(P<0.05).总体而言,第3天是泥蚶鳃GST活性大幅下降的一个时间分界点,且各处理组GST活性在污染前期被抑制,在污染后期被诱导.
由图1(d)可见,随处理时间的增加,除处理组3外,其他试验组泥蚶GPx活性均呈先降低后升高的趋势,处理组3的GPx活性在第12天出现下降.在受原油污染的第6天,各处理组GPx活性均降至试验期最低值.随原油浓度的上升,第3天各处理组GPx活性整体表现为被诱导,第12天则表现为被抑制,其中第3天处理组1的GPx活性(85.29 U/mg)极显著高于对照组(P<0.01),处理组4的GPx活性(78.12 U/mg)显著高于对照组(P<0.05).总体上,随处理时间的变化各试验组鳃中GPx活性总体变化规律较明显.
2.2 原油污染对泥蚶消化腺中SOD、CAT、GST、GPx活性变化的影响
暴露于原油后,泥蚶消化腺4种酶活性变化如图2所示.由图2(a)可见,时间-效应上,随处理时间的增加,除处理组1外,其余处理组消化腺中SOD活性总体呈先降低后升高的趋势,且均在第9天出现最低值.剂量-效应上,受低浓度原油污染时泥蚶消化腺中SOD活性被诱导,受高浓度原油污染时被抑制,其中第12天各处理组的SOD活性差异最明显.第1天处理组3、4和第12天处理组3、5的SOD活性均显著低于对照组(P均小于0.05);而第12天处理组1的SOD活性(56.47 U/mg)极显著低于对照组(P<0.01).受原油污染后,各处理组泥蚶消化腺中SOD活性在试验前期和后期的变化与对照组差异较大.
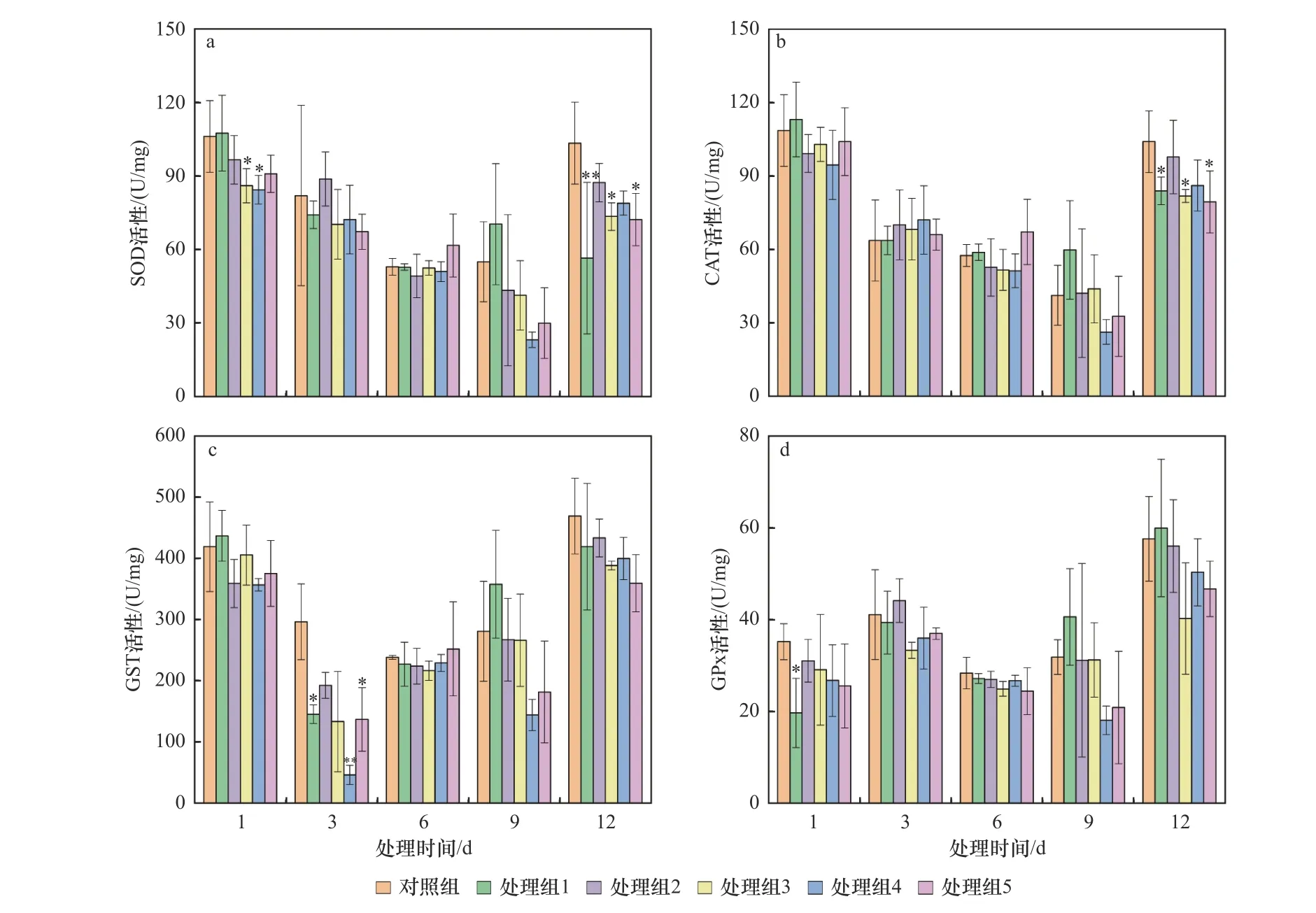
图2 不同浓度原油污染对泥蚶消化腺中4种酶活性的影响Fig.2 Effects of crude oil on four enzyme activities in digestive gland of Tegillarca granosa
由图2(b)可见,随处理时间的增加,各试验组CAT活性总体呈先降低后升高的趋势.随原油浓度的上升,第3、6天各处理组泥蚶消化腺中CAT活性较稳定,第1、9天呈先被诱导后被抑制的趋势,而第12天总体被抑制,且第12天处理组1、3、5的CAT活性均显著低于对照组(P均小于0.05).总体上,在污染后期,泥蚶消化腺中CAT活性开始与对照组出现显著差异.
由图2(c)可见,随处理时间的增加,除2个高浓度处理组GST活性呈“W”型变化特征外,其余各试验组GST活性总体呈先降低后升高的趋势,各处理组GST活性均在第3天降至最低值.受低浓度原油污染时,泥蚶消化腺GST活性于第1、9天总体表现为被诱导;受高浓度原油污染时被抑制,而第3、12天总体表现为被抑制.其中,第3天处理组4的原油浓度(10 000 mg/kg)对泥蚶消化腺中GST活性抑制效果最强,其活性(46.14 U/mg)极显著低于对照组(P<0.01);另外,第3天处理组1、5的GST活性均显著低于对照组(P均小于0.5),分别为145.32、136.73 U/mg.总体上,第3天泥蚶消化腺中GST对原油污染最敏感,具体表现为GST活性与对照组相比被显著抑制.
由图2(d)可见,随处理时间的增加,试验组GPx活性总体呈升高−降低−升高的趋势,高浓度处理组的GPx活性均在第9天降至最低值后回升.随原油浓度的上升,污染前期(第1、3天)各试验组GPx活性均被不同程度的抑制,而污染后期(第9、12天)则呈低浓度污染时被诱导、高浓度污染时被抑制的特征. 另外,第1天处理组1的GPx活性(19.67 U/mg)显著低于对照组(P<0.05).总体上,各处理组消化腺中GPx活性在第6天与对照组最接近.
结合图1、2发现,各试验组鳃和消化腺中4种酶活性随处理时间的增加均存在不同程度的降低后回升的现象,其中鳃中SOD和消化腺中GPx活性在第3天还出现短暂升高现象.另外,低浓度处理组酶活性回升时间早于高浓度处理组,可能是泥蚶鳃和消化腺对低浓度原油有较好的适应能力或在此环境中仍有较好的自我调节能力.
2.3 鳃和消化腺中4种酶活性的最大诱导率及最大抑制率
原油对泥蚶鳃和消化腺中4种酶活性的最大诱导率、最大抑制率及其对应原油浓度和出现时间如表2所示.由表2可见:除鳃中GPx外,2种组织中4种酶活性的最大诱导率均出现在低浓度处理组的污染后期(第9、12天);除鳃中GST、GPx以及消化腺中GPx外,2种组织中4种酶活性最大抑制率均出现在高浓度处理组,出现时间均在9天前.此外,原油对鳃中4种酶活性的最大诱导率均大于最大抑制率.与SOD和CAT相比,2种组织中GST和GPx的最大抑制率出现时间更早.

表2 泥蚶鳃和消化腺中4种酶活性的最大诱导率及最大抑制率Table2 Maximum induction rates/inhibition rates of four enzyme activitiesin gills and digestive gland of Tegillarca granosa
2.4 鳃和消化腺中4种酶活性的综合生物标志物响应(IBR)变化
根据取样时间,不同原油浓度胁迫下泥蚶鳃和消化腺中4种抗氧化酶活性均一化处理后得分(Bi)的星状图如图3、4所示.由图3、4可见:在污染前期(第1、3天)鳃中SOD和GST的Bi值分别激增和骤降,到污染中期(第6天)GPx的Bi值骤降,而在污染后期(第9、12天)CAT和GPx的Bi值较高;消化腺中SOD、CAT和GST的Bi值在污染前期(第1、3天)骤降,在污染中期(第6天)4种酶的Bi值均较低,而在污染后期(第9、12天)SOD和GPx的Bi值均随原油浓度变化较大.
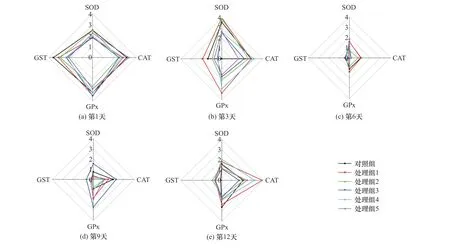
图3 泥蚶鳃中4种酶活性的Bi值星状图Fig.3 Bi value star plots of four enzyme activitiesin gill of Tegillarca granosa
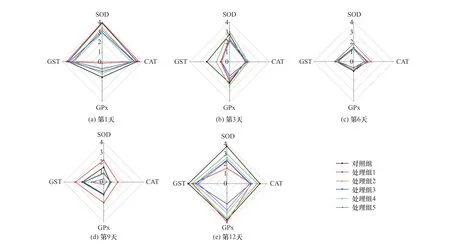
图4 泥蚶消化腺中4种酶活性的Bi值星状图Fig.4 Bi value star plotsof four enzymeactivities in digestive gland of Tegillarca granosa
通过计算上述星状图面积,得到泥蚶鳃和消化腺中4种酶的IBR值.由图5可见,各试验组泥蚶2种组织的IBR值均随处理时间的增加呈先降低后升高的趋势.鳃和消化腺中4种酶的IBR值分别于第6天、第9天降至最低值后回升,但消化腺中回升幅度远大于鳃.鳃中4种酶的IBR最高值出现在第1天,而消化腺中出现在第12天.2种组织中各处理组的IBR值均在第6天与对照组最接近,而在污染后期(第9、12天),与鳃相比,消化腺中高浓度处理组的IBR值与对照组差异更大.

图5 不同试验组泥蚶鳃和消化腺中4种酶的IBR值随时间的变化Fig.5 Changes of IBR values in gills and digestive gland of Tegillarca granosa with time in different experimental groups
3 讨论
3.1 原油暴露后泥蚶鳃和消化腺中4种抗氧化酶活性的变化
抗氧化酶活性变化是一个动态过程,能指示生物氧化胁迫和氧化损伤程度[20].当生物抗氧化和解毒能力下降及污染物胁迫超出防御系统自我修复能力时,可能出现中毒反应[21].石油烃进入水生生物体后,可通过自身或中间代谢产物的氧化还原反应产生大量活性氧自由基,如超氧阴离子自由基、羟自由基、H2O2等,使机体无法维持低水平、稳定平衡的生理性自由基含量而造成机体细胞非特异性氧化损伤[22].
SOD作为抵抗ROS的第一道防线,是以氧自由基连锁反应前体物超氧阴离子自由基为唯一底物的天然酶类清除剂,当受到外界污染胁迫时,其活性变化较其他几种抗氧化酶更灵敏[19].笔者研究发现,消化腺中SOD平均活性(132.29 U/mg)约为鳃(69.34 U/mg)的2倍.尚泰宇等[23]在生物胁迫试验中发现,在高浓度氰氟草酯(Cyhalofop-butyl)污染环境下,生物体内SOD活性随污染物浓度的升高呈先被诱导后被抑制的趋势,与笔者试验中SOD活性的剂量-效应结果基本相符.针对处理组5中SOD活性基本都小于对照组的现象,可能是高浓度(15 000 mg/kg)原油对泥蚶鳃和消化腺造成了一定的不可逆损伤,故处理组SOD活性无法回升至对照组水平[9-10].
CAT能催化H2O2生成水和氧气,避免过多的ROS堆积,从而保护机体[24-25].在解毒作用上,SOD与CAT具有协同作用,但活性变化存在时间差.随着污染物浓度的增加,鳃和消化腺中CAT与SOD的活性变化趋势相同或部分相同[26].在原油暴露第1天,鳃中CAT活性随原油浓度的升高先被抑制后被诱导,与黄海胆(Glyptocidariscrenularis)在低浓度180号燃料油污染暴露试验中CAT活性被抑制[27]的结果相同.参照最大诱导率及最大抑制率的结果(见表2),在高浓度原油污染暴露下,泥蚶CAT总体比SOD更敏感,因此与SOD相比,CAT更适合作为高浓度石油污染监测的生物标志物.
GST是一种具有多种生理功能的同工酶,是生物体内重要的解毒酶,发挥解毒与清除体内活性氧自由基的双重功能[8,28].在时间-效应上,鳃中GST活性总体表现为先被抑制后被诱导;剂量-效应上,处理组GST活性在试验后期(第9、12天)总体呈先升高后降低的特征,此规律与已有研究结果[29]相符.对比最大诱导率和最大抑制率发现,在高浓度原油暴露环境(处理组4)中,消化腺中GST活性能在短时间内(第3天)被显著抑制.结合笔者研究及已有研究成果[30-31],GST有望成为短期高浓度石油污染监测的高效生物标志物.
GPx利用GSH作为底物,能与抗氧化防御系统中的SOD和CAT一起将超氧阴离子自由基和H2O2还原为H2O,从而保护生物体[19,32].时间-效应上,泥蚶鳃中GPx活性总体表现出先降低后升高的趋势,消化腺中则相反.剂量-效应上,消化腺中GPx活性在原油污染前期被抑制;在后期,低浓度原油污染时被诱导,在高浓度原油污染时被抑制,与大弹涂鱼(Boleophthalmus pectinirostris)原油污染暴露试验结果[33]相同.笔者研究显示,泥蚶鳃和消化腺中GPx活性的最大抑制率在原油浓度较低、污染时间较短时出现,表明泥蚶鳃和消化腺中GPx活性都能在短时间内对外界污染胁迫作出反应.比较泥蚶鳃和消化腺中GPx对原油污染胁迫时的活性变化发现,鳃中GPx对原油更敏感,表明受原油污染胁迫时鳃中GPx活性的激发程度更高或鳃是GPx发挥作用的主要器官.
在抗氧化酶发挥其防御作用时,SOD最先参与反应,而其中间产物H2O2可作为CAT的催化底物,也能作为GPx的部分底物.上述3种酶与作为Ⅱ相解毒酶的GST形成一个整体,最终对生物起到保护作用.结合时间-效应与剂量-效应,受原油污染后,泥蚶鳃中SOD与CAT活性能较快恢复至对照组水平,而GST与GPx活性均能在污染前期做出较强烈的反应;消化腺中CAT活性变化晚于SOD,而GST活性较GPx更早表现出受原油污染的特征.综上,生物作为有机整体,其抗氧化酶活性的变化是一个连锁反应,各种酶对于清除ROS具有协同作用.
3.2 原油暴露对泥蚶毒性效应的IBR评价
将各生物标志物的标准化结果以星状图的形式呈现,有助于深入挖掘综合生物毒性效应[34].通过观察星状图面积的变化,可更直观地展现出泥蚶受原油污染胁迫的时间-效应与剂量-效应.笔者研究发现,鳃中4种酶IBR最低值出现的时间早于消化腺;在污染后期,与鳃相比,泥蚶消化腺中4种酶的IBR值与对照组差异更大.总体而言,鳃和消化腺中4种酶的IBR值变化与4种酶的活性变化趋势基本吻合,表明IBR可作为评估原油污染对潮间带生物综合生物毒性效应的有效指标[35].
4 结论
a)泥蚶受原油污染后,鳃和消化腺中SOD、CAT、GST和GPx的活性均表现出不同程度的被诱导或被抑制的效应,通过比较2种组织的抗氧化酶活性大小、最大诱导率及最大抑制率对应的浓度和出现时间发现,抗氧化酶活性变化是一个受多种因素影响制约的动态过程.
b)根据生物体代谢机制,4种酶存在相互作用.SOD和CAT协同解毒作用在鳃和消化腺中均有体现,SOD活性总体表现为受低浓度原油污染时被诱导,受高浓度原油污染时被抑制的特征.CAT活性在时间-效应上与SOD活性变化规律相似,但其响应时间具有滞后性,GST与GPx活性的时间-效应总体相似.
c)从原油污染对4种抗氧化酶活性影响的角度分析,泥蚶消化腺中酶活性的变化较腮中更具规律性和显著性.GST和GPx作用机理相似,且对高浓度原油污染的生物响应更高效和显著.因此,对比其他抗氧化酶与组织,该研究中泥蚶消化腺中GST更适于作为短期高浓度石油污染监测的有效生物标志物.
d)通过计算IBR进一步发现,泥蚶鳃和消化腺的IBR值均随暴露时间的增加呈先降低后升高的趋势.星状图和IBR值能更直观且全面深入地探讨综合生物毒性效应,因此IBR可作为综合生物毒性评价的指标.

