植物源多酚对梨酒抗氧化能力及其感官品质的影响
刁体伟,陈晓姣,冷银江,魏鑫,赖晓琴,马懿*
1(四川轻化工大学 生物工程学院,四川 宜宾,644005)2(四川省酿酒专用粮工程技术研究中心,四川 宜宾,644000)
库尔勒香梨是我国新疆最具代表性的优良梨种。研究表明,饮用库尔勒香梨酒不仅能生津止渴、润肠通便,还对高血压、心脏病、失眠症等患者有较好的辅助治疗作用[1]。梨酒在酿造过程中易被氧化褐变,需要添加大量SO2来起到抗氧化的作用。而果酒中高残量SO2会产生异杂味(H2S、硫醇)并具有致敏性(荨麻疹、腹泻、皮炎),SO2的过量摄入和累积甚至会对重要器官造成毒性损伤[2]。因此,少硫或者无硫发酵是酿造业的重点和难点,而目前无硫果酒主要是依靠各种天然化合物的添加以及使用创新的酿酒技术来完成[3]。
白藜芦醇和茶多酚均属于植物源天然提取物,具有来源广泛、安全性高、活性强等特点[4]。白藜芦醇是一种具有芪类结构的非黄酮类多酚化合物,由葡萄、桑树和虎杖等植物次生代谢产生,属于植物的保护素和抗毒素[5];茶多酚是茶叶中酚类及其衍生物的总称,主要包括儿茶素类、黄酮类、花色苷类及黄酮醇类等化合物,是一种天然的抗氧化剂[6]。白藜芦醇与茶多酚因具有良好的抑菌、抗氧化、免疫调节等生物特性而被广泛应用于保健食品、食药加工、果蔬保鲜等领域[5,7]。PASTOR等[8]将白藜芦醇用于葡萄酒酿造,生产的葡萄酒具有较好的物理、化学和感官特性。谢天柱等[9]研究发现茶多酚能够显著提高苹果酒的抗氧化能力。
相比于抗氧化剂SO2酿造果酒,白藜芦醇与茶多酚的添加还能减少果酒中H2S、硫醇含量,赋予果酒更好的功能性。添加了0.1%茶多酚的酒及饮料具有显著去除口臭效果[10]。LEFVRE-ARBOGAST等[11]指出在饮食中搭配红酒和茶多酚能够有效降低患阿尔茨海默病风险。未来果酒及饮料逐渐向着安全、功能型方向发展,因而植物源多酚作为绿色抗氧化剂具有一定发展潜力。然而,植物源多酚应用于梨酒中的抗氧化性能以及对梨酒风味感官的影响尚无相关研究报道。
基于此,本研究主要比较不同浓度的白藜芦醇、茶多酚与SO2(70 mg/L)对库尔勒香梨酒抗氧化能力及其风味感官品质的影响,旨在促进新型抗氧化剂在梨酒酿造中的应用,以期为低硫梨酒开发研究,推动果酒行业发展提供理论参考。
1 材料与方法
1.1 材料与试剂
库尔勒香梨、白砂糖,市售;果酒干酵母,安琪酵母股份有限公司;果胶酶,上海源叶生物科技有限公司;DPPH、ABTS标准品、福林酚、茶多酚(纯度≥98.0%),合肥博美生物科技有限责任公司;没食子酸标准品(纯度≥98.0%)、白藜芦醇(纯度≥98.0%),成都市科龙化工实剂厂;福林-丹尼斯试液,厦门海标科技有限公司;仲辛醇(色谱纯),上海麦克林生化科技有限公司。
1.2 仪器与设备
JYZ-E25榨汁机,九阳股份有限公司;GZ-250-HS11恒温恒湿箱,广智科技设备有限公司;STARTER 2C型pH计,奥豪斯仪器有限公司(上海);LX-B75L高压蒸汽灭菌锅,成都宜恒实验仪器有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限公司;UitraScan VIS台式色差仪,HunterLab(美国)有限公司;7890A气相色谱仪,四川蜀科仪器有限公司;i-Nose 电子鼻测定仪、SmarTongue,美国isenso公司。
1.3 实验方法
1.3.1 梨酒酿造工艺流程与操作要点
梨酒酿造工艺如图1所示。

图1 梨酒酿造工艺流程图Fig.1 Flow chart of pear wine brewing process
香梨榨汁与成分调整:选择新鲜成熟的香梨洗净去核榨汁,添加0.3 g/L果胶酶,室温酶解12 h。过滤采用8层纱布;分别加入一定量白砂糖与KHCO3,调节糖度到20Bx,pH调至4.5。
SO2、白藜芦醇与茶多酚的添加:根据酵母对三者耐受性并考虑应用于梨酒发酵适用性(预实验发现多酚添加量超过250 mg/L时,梨酒色度会加深,影响美观),将试验共分为10个组(每组3个平行):
空白(无添加):CK组;
SO2:S组(70 mg/L);
白藜芦醇:R1组(100 mg/L)、R2组(150 mg/L)、R3组(200 mg/L)、R4组(250 mg/L);
茶多酚:T1组(70 mg/L)、T2组(80 mg/L)、T3组(90 mg/L)、T4组(100 mg/L)。
发酵:称取2 g果酒干酵母加入30 mL质量浓度为50 g/L蔗糖水中,置于30 ℃活化30 min,随后加入10 mL香梨汁,室温放置30 min,将4 mL酵母活化液分别添加到10组梨汁中用于发酵。发酵温度控制为25 ℃,发酵完成后过滤陈酿20 d装瓶。
1.3.2 基础理化指标的测定
可溶性固形物采用手持糖度仪测定,pH测定使用pH计,酒精度、还原糖、总酸测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》。
1.3.3 体外抗氧化能力的测定
参照由璐等[12]的方法,以DPPH自由基和ABTS阳离子自由基清除率代表抗氧化能力。
取0.5 mL待测样品与3.5 mL DPPH溶液混合并充分摇匀,避光静置30 min,然后在517 nm处测定吸光度(A样品)。同时,以等量蒸馏水代替样品作空白对照试验(A空白)。DPPH自由基清除率按公式(1)计算。
(1)
吸取1 mL待测样品与3 mL ABTS阳离子自由基工作液,混合10 s后立即置于暗处准确反应6 min,在734 nm下测定吸光度(A样品)。同时,以等量蒸馏水代替样品作空白对照试验(A空白)。ABTS阳离子自由基清除率按公式(2)计算。
(2)
1.3.4 多酚相对聚合度的测定
参照张大为等[13]的方法测定多酚相对聚合度。
1.3.5 总酚含量的测定
总酚含量使用福林-肖卡法[14]测定,以没食子酸质量浓度计。测定标准曲线结果为:y=0.019 42x+0.021 7,y为吸光度,x为没食子酸含量,相关系数R2=0.997。
1.3.6 氨基酸含量的测定
参照伍清芳等[15]的方法使用异硫氰酸苯酯柱前衍生高效液相色谱法对梨酒中17种氨基酸测定。
色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm)。流动相A:称取1.64 g无水乙酸钠,加适量水溶解,加入0.5 mL三乙胺,用水定容至1 L,用20%(体积分数)乙酸溶液调pH至6.20,0.45 μm水系滤膜过滤。流动相B:V(乙腈)∶V(水)=8∶2。流量1.0 mL/min;进样体积10 μL;柱温40 ℃;检测波长254 nm。
1.3.7 挥发性物质的测定
参照周文杰等[1]的顶空固相微萃取-气质联用法(solid phase micro-extraction gas chromatography mass spectrometry,SPME-GC-MS)并加以改进。在15 mL顶空瓶中准确加入8.0 mL梨酒,并加入1 g NaCl。酒样在45 ℃条件下预热10 min后,将老化后的微萃取头插入顶空瓶中,同时推出纤维头(距离梨酒液面1.5 cm),于顶空位置吸附35 min,吸附后,收回纤维头并迅速送至GC送样口,在250 ℃热解析3 min。GC条件:DB-WAX毛线管色谱柱(60 m×0.25 mm×0.25 μm);进样口温度250 ℃;采用不分流进样模式;程序升温:初始温度40 ℃,保留5 min,以2 ℃/min升温至60 ℃,以5 ℃/min升温至180 ℃,保留5 min,以10 ℃/min升温至230 ℃,保留10 min;载气为高纯He,恒定流速1.2 mL/min。MS条件:电子轰击电离源(EI),离子源温度230 ℃,电子能量70 eV,采集模式为全扫描,MS四极杆温度150 ℃,溶剂延迟3 min。
挥发性物质定性定量:色谱峰对应的质谱通过与NIST/Wiley Database进行检索比对,保留匹配度大于80%的鉴定结果。通过内标物(仲辛醇)的峰面积和梨酒中各组分的峰面积比值,计算各个组分的质量浓度。
1.3.8 电子鼻检测方法
参照张清安等[16]的方法略作修改,取20 mL样品放置于50 mL离心管中并密封,用电子鼻对其顶空气体进行测定。电子鼻采样参数设置如表1所示。

表1 电子鼻传感器及对应性能描述Table 1 Description of electronic nose sensor and its corresponding performance
1.3.9 电子舌检测方法
参照张清安等[16]的方法。取每个样品20 mL放置于电子舌仪器专用测量杯内进行分析测定。仪器选取6个探测器,采样时间和传感器自动清洗时间共计4 min,分别提取各传感器的特征值进行分析。
1.3.10 数据分析
利用SPSS进行数据分析,并用Origin 2018作图,所有数据均用平均值±标准差表示。显著性分析使用Duncan检验法,结果采用标记字母法表示,以上所有实验均设置3个重复。
2 结果与分析
2.1 梨酒的基础理化指标
由表2所示,发酵完成后10个组的酒精度、还原糖、pH、可溶性固形物、总酸含量各指标并无显著性差异(P>0.05)。表明与SO2相比,白藜芦醇和茶多酚对梨酒的基础理化指标没有显著性影响,发酵能够正常完成。此外,R1~R4组发酵周期(7 d)比其他组均少1 d,原因可能是白藜芦醇的添加影响了酵母的生长代谢,从而加快了发酵进程。尽管发酵过程中酵母生长趋势不同,但并不影响发酵完成梨酒的理化指标。
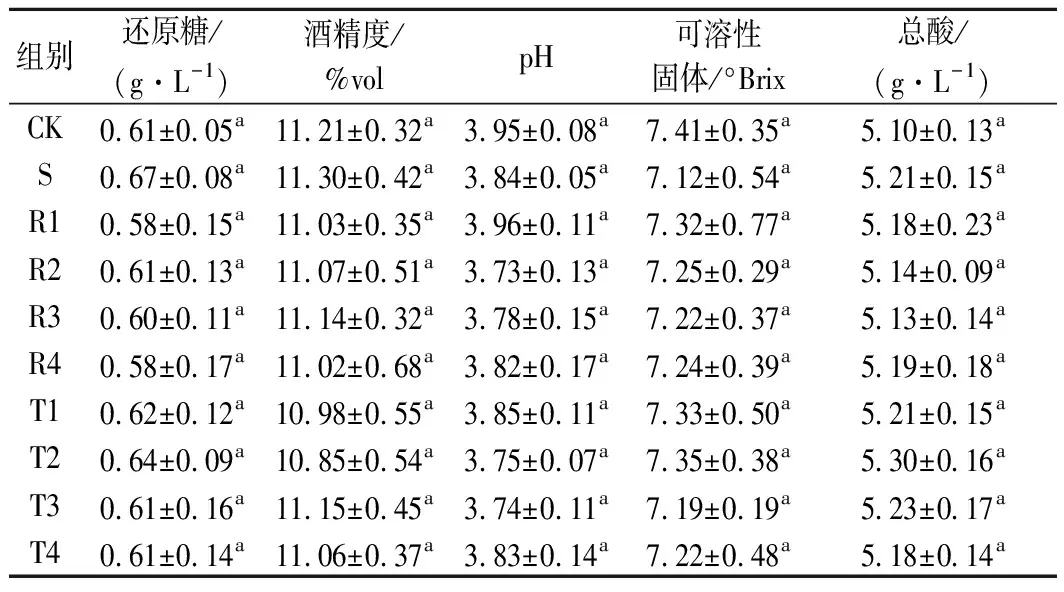
表2 不同组梨酒的基础理化指标Table 2 Basic physical and chemical indexes of pear wine in different groups
2.2 梨酒的抗氧化活性
自由基清除率越高就代表物质的抗氧化能力越强,但由于反应机制和特性差异,故抗氧化能力测定通常使用2种及以上方法[17]。由图2可知,添加不同浓度白藜芦醇和茶多酚的梨酒对DPPH自由基和ABTS阳离子自由基清除率有所差异。R3组对自由基清除率高于S组(P<0.05),R2、T3、T4组抗氧化能力与S组并无显著性差异,但清除率都远高于CK组(P<0.05),表明白藜芦醇(150~200 mg/L)、茶多酚(90~100 mg/L)同SO2一样,具有增强梨酒抗氧化能力的作用。梨酒抗氧化能力随着白藜芦醇(100~200 mg/L)和茶多酚(70~100 mg/L)浓度的增加而增强(浓度范围内),原因可能是植物源多酚的添加使得酒体中酚类物质得以更多的保留,从而提升了梨酒抗氧化能力[18]。LPEZ-VÉLEZ等[19]研究显示,葡萄酒中的白藜芦醇具有显著的抗氧化性和清除自由基活性;李变变[20]提出,0.02%质量浓度的茶多酚能够提高苹果酒的抗氧化能力,这都与本试验结果相似。此外,尽管白藜芦醇和茶多酚都表现出抗氧化性,但并不是用量越多越好,抗氧化成分被氧化后所产生的过氧化自由基具有一定的氧化作用,会引起连锁的消极副反应。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率图2 不同组梨酒抗氧化能力Fig.2 Antioxidant capacity of pear wine in different groups
2.3 梨酒的总酚含量与多酚聚合度
总酚作为梨酒中不可缺少的功能性物质,对人体健康有着积极的影响。相比于CK组,SO2、白藜芦醇和茶多酚的添加都能显著增加酒体总酚含量(图3-a),其中R3组总酚含量最高(242.87 mg/L),比S组含量高9.62 mg/L(P<0.05)。R1~R4组总酚含量均出现先上升后下降规律,可能与白藜芦醇在梨酒中低溶解度和不稳定性有关[21]。相关性分析结果显示,总酚含量与DPPH自由基和ABTS阳离子自由基清除率有较为显著的相关性,相关系数分别为0.838(P<0.01)和0.893(P<0.01),表明梨酒中酚类物质是其抗氧化能力的重要物质基础。如图3-b所示,不仅S、R3、T3三组多酚聚合度有明显降低,所有处理组的多酚聚合度较对照组均有显著减少。聚合度的降低会削弱芬顿反应,从而达到抑制梨酒中多酚被氧化的作用,使得发酵过程中可以更多地保留营养物质。

a-总酚含量;b-多酚聚合度图3 不同组梨酒总酚含量与多酚聚合度Fig.3 Total polyphenol content and the degree of polyphenol polymerization of pear wine in different groups
2.4 氨基酸含量的测定
氨基酸不仅是梨酒中重要的营养物质,还是呈味物质,其具有酸味、甜味、苦味、鲜味和涩味,与酒体中醇、醛、酮类等物质发生协同作用后能提高味觉的层次感[22]。将抗氧化活性和多酚含量表现优异的2组(R3、T3)同CK组与S组做氨基酸含量比较。结果如表3所示,梨酒中富含常见17种氨基酸,其中精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、甲硫氨酸(Met)、赖氨酸(Lys)为主体氨基酸。CK组氨基酸总含量为4 521.32 mg/L,以丙氨酸、甲硫氨酸和赖氨酸含量为主体,感官上主要呈现臭味和甜味;S组氨基酸总含量最高,为4 767.68 mg/L(P<0.05),以苏氨酸、亮氨酸、赖氨酸为主体,主呈苦、甜味;R3组为4 275.26 mg/L,以精氨酸,异亮氨酸、赖氨酸为主体,主呈苦味;T3组为4 467.34 mg/L,以精氨酸、苏氨酸、赖氨酸为主体,主呈苦、甜味。由此可见,抗氧化剂的加入能增加酒体中苦、鲜型氨基酸的含量,同时减少臭型氨基酸的生成,总体或能提高梨酒味觉层次感。不同组中氨基酸含量的差异性可能是因为添加物会影响酵母的生长能力和代谢途径,导致在发酵过程中酵母对氨基酸利用率的不同[23]。
2.5 梨酒中挥发性物质含量
2.5.1 挥发性物质构成及比较分析
综合考虑白藜芦醇与茶多酚抗氧化活性能力及感官指标,R3组与T3组具有较好的适用梨酒酿造潜力,故将R3、T3、S、CK组挥发性成分进行比较分析。由表4所示,4组挥发性物质共检出38种,主要分为6类(酯类、醇类、烷类、醛类、酸类、酚类),其中酯类和醇类是香梨酒中主要挥发性物质。在CK组中共检出挥发性物质20种,总含量为12 278.54 μg/L;S组31种,总含量11 499.99 μg/L;R3组25种,总含量9 102.51 μg/L;T3组29种,总含量10 190.67 μg/L。R3组种类和含量都低于其他3组(P<0.05),其差异性可能是添加物对杂菌的抑制效果不同或是间接影响了酵母的代谢。
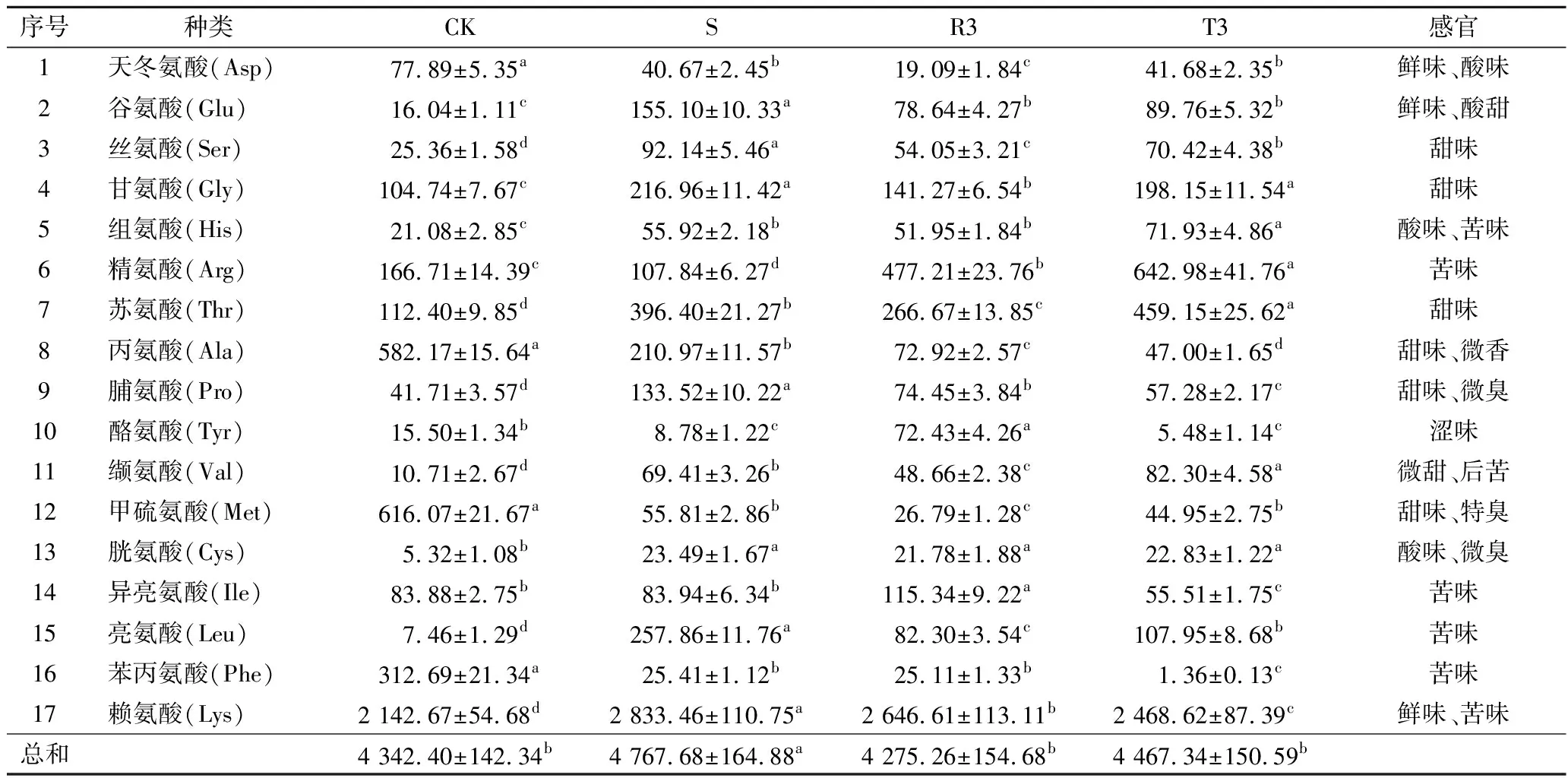
表3 不同添加物梨酒中氨基酸含量 单位:mg/L

表4 不同添加物梨酒中香气物质含量 单位:μg/L

续表4
4组梨酒总酯含量依次为CK组(651.41 μg/L)>T3组(475.48 μg/L)>S组(429.23 μg/L)>R3组(355.72 μg/L),R3组的酯类含量最低,并与其他3组有显著性差异。梨酒中乙酸乙酯、乙酸异戊酯、辛酸乙酯能突显酒体果香型气味,表明CK组果香味相对突出。
醇类物质总含量依次为S组(13种)>T3组(12种)>R3组(10种)>CK(9种)。S组、T3组与CK组在总醇含量上并无显著性差异(P>0.05),R3组含量最低,为8 469.22 μg/L,比S组少1 966.68 μg/L。结果显示,异丁醇、苯乙醇、异戊醇为梨酒中主要醇类物质,其中CK组与S组异戊醇含量显著高于R3组与T3组(P<0.05),异戊醇含量过高会导致酒体风味不协调,产生苦味且引发头痛。此外,T3组中3-甲基-3-丁烯-1-醇、正辛醇含量相对于其他3组较高(P<0.05),使得酒体具有更强的典型性。S组中3-甲硫基丙醇含量显著高于其他3组,原因可能是SO2的胁迫促进了酵母对硫元素的同化,从而导致甲硫氨酸下游产物3-甲硫基丙醇含量的增加[24]。醇类含量和种类的差异性可能是由于不同添加物引起发酵过程中的醇类被酯化或还原。
烷类、醛类、酸类、酚类等其他香气成分对梨酒的特征香气成分起到修饰作用,增加酒体的复杂性。S组与T3组含量相比于CK组差异性较小,R3组含量最低,酒体香气相对单一。此外,辛酸含量CK组(123.22 mg/L)>T3组(23.18 mg/L)>S组(14.90 mg/L)>R3组(5.38 mg/L),辛酸是果酒酸类成分的主体,能够带给酒体果味、草莓味、糖果味。
2.5.2 挥发性物质主成分分析(principal component analysis,PCA)
对6类挥发性物质含量进行PCA,相关矩阵的特征值及贡献率见表5。PC1的贡献率为43.10%,PC2的贡献率为32.01%,PC3的贡献率为24.89%,三者累积贡献率为100%。由于三维图不易观察样品分布情况,故取前2个主成分做PCA因子载荷图(图4)。各指标之间相关性强的变量聚集在一起,距离越近,相关性越大。由图4所示,4组梨酒发生明显分离,PC1与PC2能够明显区分CK、S、R3与T3梨酒,表明不同添加物梨酒的挥发物相似度较低。
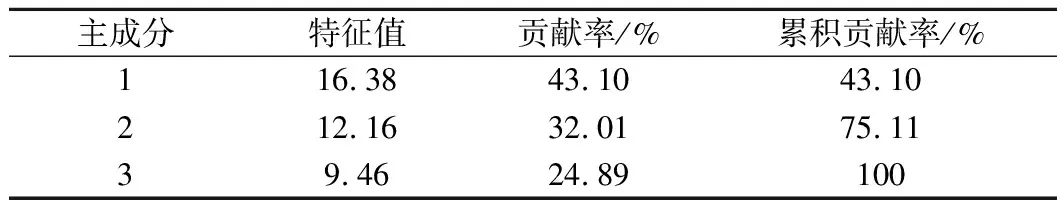
表5 主成分的特征值及贡献率Table 5 Characteristic values and contribution rates of principal components
2.6 电子鼻与电子舌结果
2.6.1 电子鼻测定结果
通过提取各个传感器的响应值建立不同添加物梨酒样品的气味雷达图,结果见图5。S1、S6、S8、S9、S14传感器对不同添加物梨酒的气味响应值差异不大。相比于CK组,S2(H2S、硫)和S12(硫化物)探头对S组梨酒响应强度较大,对R3组反应强度最低,表明SO2的添加会增加酒体中硫化物的生成,而白藜芦醇添加可能对硫化物生成有抑制作用;此外,S4(有机溶剂)对CK组响应较强、S5(食物烹饪挥发性气体)对R3响应较大,S11(芳香族化合物)对T3组响应较大。

图4 挥发性化合物PCA载荷图Fig.4 PCA loading plot of volatile compounds

图5 不同梨酒样品的电子鼻测定响应值的雷达图Fig.5 Radar diagram of response values determined by electronic nose of different pear wine samples
基于14个探头信号数据建立电子鼻主成分二维图,结果见图6-a,PC1(94.3%)远大于PC2(2.3%),梨酒样品方差总贡献率为96.6%,全部传感器的响应结果基本包含在内。判别因子分析(discriminant factor analysis,DFA)显示DI=98.42(图6-b),表明样品之间基本没有重叠性,即不同抗氧化剂的加入时,梨酒样品的嗅觉指标(电子鼻传感器响应值)有显著差异,对其挥发性风味品质的影响较大。

a-PCA;b-DFA图6 不同抗氧化剂对梨酒的电子鼻PCA和DFA结果Fig.6 PCA and DFA results of different antioxidants on pear wine by electronic nose
2.6.2 电子舌测定结果
采用电子舌方法评价不同组梨酒样品的PCA与DFA结果如图7所示。在PC1的贡献率为59.15%,PC2的贡献率为11.32%,PCA主要成分累计贡献量为70.47%。DFA显示DI=99.92,说明样品之间具有差异性,不同抗氧化剂的添加对梨酒的口感具有一定的影响。

a-PCA;b-DFA图7 不同抗氧化剂对梨酒的电子舌PCA和DFA结果Fig.7 PCA and DFA results of different antioxidants on pear wine by electronic tongue
3 结论
本试验以酒体基础理化指标、总酚含量、抗氧化性及感官特性来比较白藜芦醇、茶多酚和SO2作用梨酒品质的影响。结果表明,白藜芦醇(100~250 mg/L)和茶多酚(70~100 mg/L)在梨酒酿造中均能起到抗氧化作用,能够改善酒体颜色,使得梨酒拥有较好的感官层次特性。白藜芦醇(200 mg/L)相比SO2(70 mg/L)的添加,能赋予梨酒更强的抗氧化性,其总酚含量(242.86 mg/L)显著高于SO2组(233.25 mg/L)。各组主体氨基酸比较显示,CK组中丙氨酸(582.17 mg/L)、甲硫氨酸(616.07 mg/L)相对含量较高;S组苏氨酸(396.40 mg/L)、亮氨酸(257.86 mg/L)含量突出;R3组以精氨酸(477.21 mg/L)、异亮氨酸(115.34 mg/L)为主;T3组精氨酸(642.98 mg/L)、苏氨酸(459.15 mg/L)含量较高。根据对各组挥发性物质的比较和PCA结果,白藜芦醇、茶多酚与SO2的加入对酒体风味物质有一定影响,特别是酯类和醇类含量差异明显。白藜芦醇、茶多酚均能降低梨酒中异戊醇、3-甲硫基丙醇等不良气体的含量;茶多酚能使乙酸乙酯和乙酸苯乙酯含量分别增加30.09、44.13 mg/L,保留了更好的果香味,能使酒体表现更强层次感。添加白藜芦醇与茶多酚的梨酒挥发性物质总含量与种类低于SO2组,可能是因为两者的不稳定性和低溶解度而限制其功能活性的表达。总体表明,白藜芦醇(200 mg/L)和茶多酚(90 mg/L)同SO2(70 mg/L)一样具有良好的抗氧化性,但对部分氨基酸、酯醇类风味物质含量有一定影响,与添加SO2的梨酒在感官上具有差异性。

