RNAi 在农业病虫害防控中的应用研究进展
冯家阳, 李常凯, 丁胜利, 刘 佳, 尹新明,安世恒, 那日松, 刘晓光
(省部共建小麦玉米作物学国家重点实验室/河南省害虫绿色防控国际联合实验室/河南农业大学 植物保护学院,郑州 450002)
RNA 干扰 (RNA interference,RNAi) 是由双链RNA (double-stranded RNA,dsRNA) 诱发,经过体内一系列作用,引起与之匹配的mRNA 降解或表达受到抑制,从而降低靶基因表达的一种生物学现象。RNAi 广泛存在于植物、微生物和动物中。植物中最早由Jorgensen 等[1]在研究矮牵牛的两种不同色素基因叠加时发现;微生物中则是Cogoni[2]在研究粗糙脉胞霉Neurospora crassa内源性类胡萝卜素基因时,首次检测到该基因的转录可受到外源同源基因片段抑制;动物中,最早由Guo 等[3]在研究野生型秀丽线虫Caenorhabditis elegans生殖细胞不对称分裂和细胞极性的建立中观察到。随后,经Fire 等进一步研究,验证了外源dsRNA 可阻碍C.elegans特定基因的转录,进而导致靶标基因的沉默或下调,并将这一现象正式命名为RNAi[4]。由于RNAi 对靶标基因沉默的特异性和高效性,因而可作为一种便捷手段用于病虫害防控及农药新靶标的筛选与鉴定[5]。至今,RNAi 技术已被广泛研究并应用于现代农业领域,主要包括植物改良、有害生物基因功能研究及防控应用等方面。
1 RNAi 类型及作用机制
诱发RNAi 的分子可分为小干扰RNA (small interfering RNA,siRNA)、微小RNA (microRNA,miRNA) 和P 转座子诱导互作RNA (P-elementinduced wimpy testis interacting RNA,piRNA) 等类型。siRNA 是由外源RNA 或外源载体等进入细胞后产生的一系列小RNA,可与目标mRNA 互补[6-7];大多数miRNA 属内源性RNA,首先在RNA 聚合酶II 参与下转录生成初级转录物pri-microRNA,随后经过两次剪切成熟,其降解功能的行使不一定需与靶标mRNA完全互补;而piRNA 常与Piwi家族蛋白结合,可通过从头合成 (初级) 与“乒乓”循环 (次级) 两种路径产生,在生殖或其他细胞中,通过对转录水平或转录后水平这两个阶段的精细调控,实现转座子的沉默[8-10]。在不同生物中,RNAi 作用机制类似,但又不尽相同。外源dsRNA 或内源性前体微小RNA (Pre-miRNA) 可被Dicer 酶特异性识别后进行有效切割而形成,加上生殖细胞中形成的piRNA,共同形成有RNAi功能的、长度一般稳定在21~26 nt 的RNA 片段,这些短链RNA 中的反义链与细胞质内Argonaute(AGO) 等蛋白作用,组成RNA 诱导的沉默复合物(RNA-induced silencing complex,RISC),该复合物能够特异性识别靶mRNA并与之结合,随后引起靶mRNA 片段降解、切割,进而引起靶基因的沉默或表达下调。同时,在植物中以及某些其他非植物物种中,外源性siRNA 在RNA 依赖的RNA 聚合酶 (RNA-depend RNA polymerase,RdRP) 作用下,将自身的反义链作为扩增引物,以靶标mRNA 为模板,重新复制成dsRNA,经过降解形成新的siRNA (次级siRNA,secondary siRNA)。这种新形成的siRNA 可以继续与RISC复合物结合并作用于mRNA,使其降解,该过程不断循环,进入级联放大效应阶段,从而提升了与靶标基因结合的特异性和干扰的高效性,为RNAi 的应用奠定了基础[11,12]。
2 RNAi 技术在农业病虫害防控中的研究及应用
RNAi 技术主要通过两种方式应用于病虫害防控,即寄主诱导的基因沉默 (host-induced gene silencing,HIGS) 和喷雾诱导的基因沉默 (sprayinduced gene silencing,SIGS)。HIGS 主要通过在转基因作物中表达出一类针对害虫或病原物的dsRNA,SIGS 则更类似于传统农药的施用方法,通过非转基因手段,将体外合成的dsRNA 直接施用。不同途径产生的dsRNA 一旦传递至有害靶标生物体内,可进一步将靶标基因沉默而使其失去功能,最终抑制有害生物的正常生长发育或提高宿主植物的抗逆能力,为作物安全生产提供保障[8,13-18]。
2.1 RNAi 在害虫防控中的研究及应用
作为一种反向遗传工具,RNAi 可引起靶基因的缺失或下调,最终通过基因功能或表型缺失来验证已知或探索未知基因的功能[19-20]。RNAi 技术在昆虫领域的应用最初见于遗传学家构建的大量黑腹果蝇Drosophila melanogaster转基因品系 (见http://flybase.org/),以此推动了果蝇遗传发育机制的解析。随着该技术的不断完善,目前已作为一种常规手段被用于昆虫生理生化研究,在鞘翅目[21-23]、鳞翅目[24-26]、半翅目[27-28]、膜翅目[29]、直翅目[30-31]和缨翅目[27,32]等农业昆虫及蜚蠊目[33-34]和双翅目[35-36]等卫生害虫中得到了广泛使用,为该技术在害虫综合防控领域的应用提供了重要的理论基础。
康乐团队利用RNAi 技术,分别对飞蝗Locusta migratoria重要神经肽NPF (neuropeptide F) 与细胞色素P450 (cytochrome P450,CYP450) 家族基因的功能进行了深入挖掘,首次揭示了NPF与CYP305M2基因在参与飞蝗群居型和散居型转变、适应环境以及躲避天敌中的分子生态学机制,为监测蝗虫种群动态变化及开展有害生物生态治理提供了重要依据[37-38]。而张友军团队[39]利用人工合成dsRNA 和VIGS (virus induced gene silencing,病毒诱导的基因沉默) 构建转基因植物的方法,通过RNAi 反向遗传技术,解析了烟粉虱Bemisia tabaci体内一个关键基因即酚糖丙二酰基转移酶 (phenolic glucoside malonyltransferase,PMaT) 基因1,参与了试虫取食正常番茄叶片后对体内植物次生代谢产物的解毒代谢过程,并系统证明了该基因是烟粉虱在长期演化过程中成功从植物基因组、经水平遗传获得,在一定程度上揭示了烟粉虱生态适应性增强的重要原因,为进一步开展生态治理和新的生物或化学农药开发提供了全新的思路。Arce 等[40]通过RNAi 技术对玉米根叶甲Diabrotica virgifera幼虫CO2候选受体基因DvvGr2的功能验证,一定程度解释了地下害虫在苗期如何为害作物根部、以及巧妙定位寄主植物的重要生态学机制。同样,这些生态理论的不断完善和发展,也极大促进和调整了RNAi 的应用范围与害虫防控策略,即通过干扰参与害虫生长发育的重要基因,并将其作为杀虫靶标,进而应用于害虫防控,这些领域也逐渐成为研究热点。
Mao 等[41]首次构建了能够表达含有棉铃虫Helicoverpa armigera(Hübner)P450基因dsRNA片段的转基因棉花,在幼虫取食该转基因棉花叶片后,通过将害虫体内棉酚解毒基因P450表达量调低,成功抑制了幼虫的取食为害,为有害生物防控提供了里程碑式的新策略。而早期转基因抗虫植物一般采用的是植物细胞核遗传转化 (nuclear transformation) 技术,随后又建立了植物叶绿体转化技术 (chloroplast transformation)[16,42],进一步研究发现,由于植物细胞的质体 (叶绿体) 中缺少RNAi 途径所需要的Dicer 酶,使得叶绿体能够稳定地积累长dsRNA (图1)。相比而言,通过叶绿体转化dsRNA 较之细胞核转化更具干扰效果。因此,可利用植物表达昆虫特异性外源dsRNA/hpRNA(hairpin RNA),确保昆虫通过不同取食方式摄入的长dsRNA 的完整性,一旦这些长dsRNA 进入昆虫肠道,即可被Dicer 酶特异性识别,从而提升干扰效率及杀虫效果[43]。还有研究者利用参与昆虫激素合成的基因或激素参与的信号通路中某些重要基因,将其作为靶标基因去合成相应的dsRNA,之后,该dsRNA 或掺入饲料饲喂试虫,或直接注射虫体,其结果或显著抑制了幼虫取食,或减轻了虫体重量,或形成畸形蛹等表型,甚至引起虫体最终死亡,为筛选高致死性靶标基因、拓展RNAi 害虫防控策略提供了新的研究思路[41,43-44]。
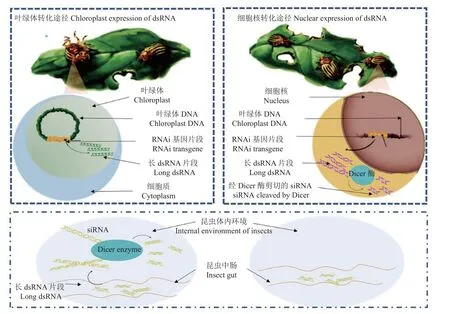
图1 不同RNAi 转基因策略 (经修改,引自Whyard[46])Fig.1 Different strategies of RNAi transgene[46]
随着研究的进一步深入,诸多具有致死效应的潜在靶基因通过RNAi 的方法被鉴定出来,如ATP 结合盒转运蛋白 (ATP-binding cassette transporter,ABC transporter) H1 基因、还原型烟酰胺腺嘌呤二核苷酸磷酸脱氢酶 (reduced nicotinamide adenine dinucleotide phosphate dehydrogenase,NADPH dehydrogenase) 基因、甘油醛-3-磷酸脱氢酶 (glycerol-3- phosphate dehydrogenase,G3PDH)基因、雄性特异性致死3 蛋白 (male-specific lethals,MSL3) 基因[45]、GW182 同源蛋白家族(GW182 homologue,GAWKY) 基因、驱动蛋白Kinesin 基因、Sec23、蔗糖非发酵蛋白7 (sucrose non-fermenting protein 7,SNF7) 基因、26S 核糖体酶调节亚基 (26S protease regulatory subunit 6B,26Sprot) 基因[47-48]、蛋白酶亚基5 (proteasome subunit beta 5,PSMB5) 基因和酚糖丙二酰基转移酶1 (phenolic glucoside malonyltransferases,PMaT1) 基因[39]等。根据这些基因片段合成相应的dsRNA,以不同方式饲喂幼虫,最终可造成靶标昆虫的较高死亡率,为利用RNAi技术开展害虫防控提供了潜在的靶标基因。目前,含有能够表达Snf7dsRNA 的转基因玉米品种已开始用于防控玉米根叶甲,该玉米品种于2017 年经美国环保署(EPA) 批准,成为全球第一个以RNAi为基础的转基因玉米[48];而开发的带有PSMB5基因的dsRNA生物农药目前也正在加紧申请美国EPA 注册,有望成为第一款可喷施dsRNA 类生物杀虫剂的上市产品[49]。近几年的研究成果 (表1) 进一步表明,RNAi 技术在害虫防控中正发挥着越来越重要的作用。
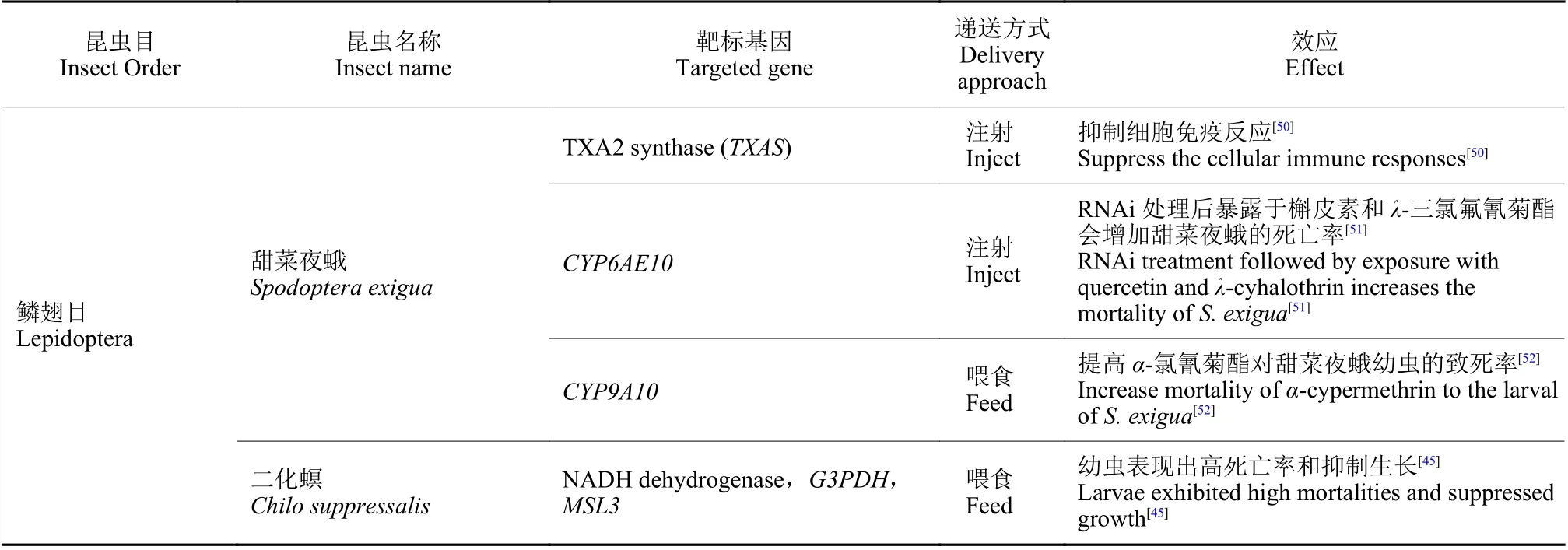
表1 近年来RNAi 技术在害虫防控中的研究及应用Table 1 The application of RNAi technology in pest control in recent years
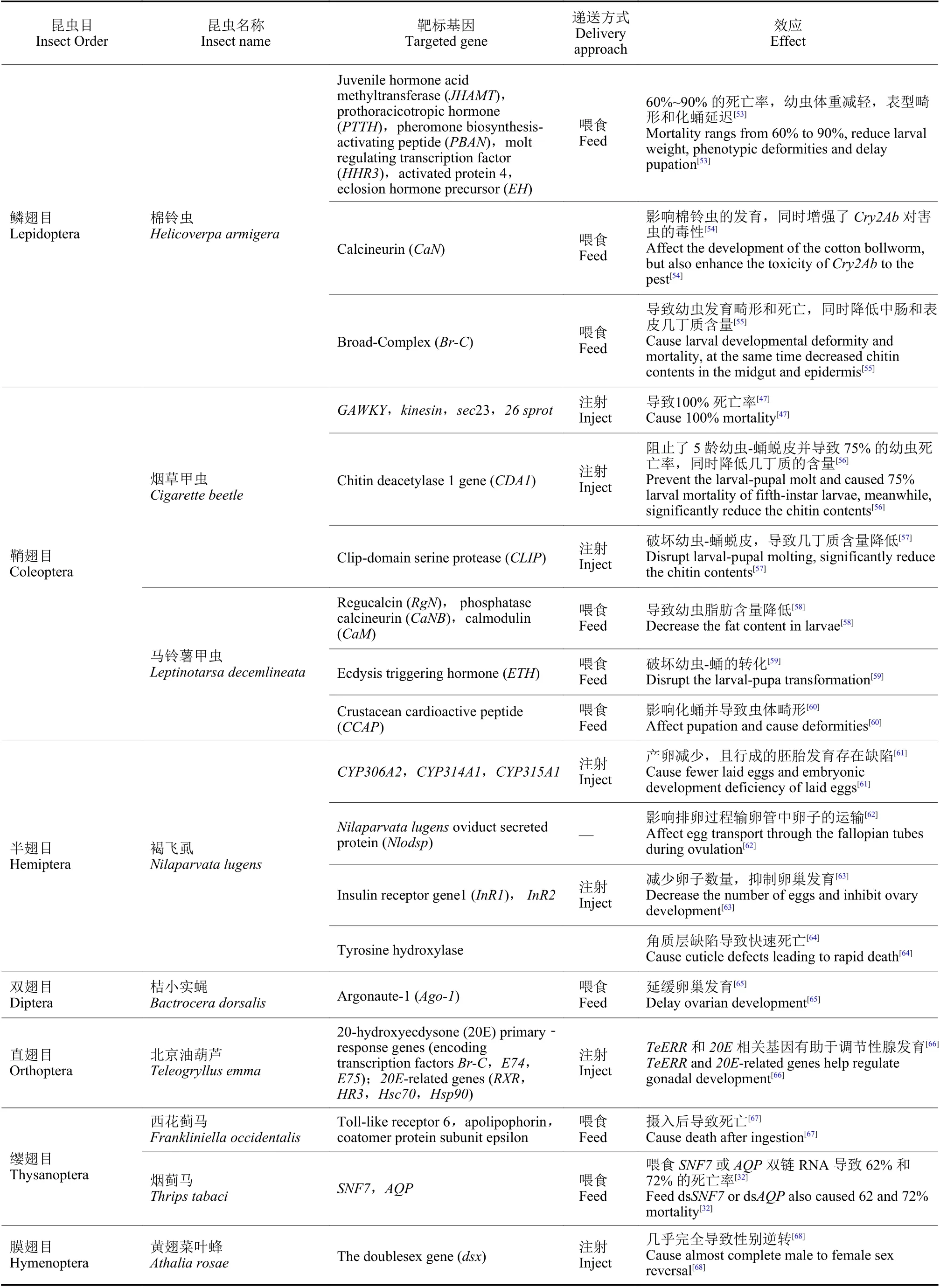
续表1Table 1 (Continued)

续表1Table 1 (Continued)
2.2 RNAi 技术在真菌等病害防控中的研究及应用
同害虫防控类似,研究者在将RNAi 用于植物病害研究与防控时,也主要采用HIGS 和SIGS两种策略[27,71]。对于大多数真菌病害的防控,不同学者在采用HIGS 策略上也做了大量工作。例如,目前已明确与病原菌侵染寄主毒力相关的基因有Chs3b[72],Ave1、Sge1和NLP1[73]以及致病效应蛋白基因SvrPm3a1/f1[74]等,利用这些靶标基因构建的dsRNA 瞬转植株或稳转植株,均能够在一定程度上抵御多种真菌病害的进一步侵染。而SIGS 作为HIGS 策略的模拟与补充,具有其显著优势,首先其不需要开发稳定的转化植物,其次在公众认知上具有一定的接受度,目前已被证明可以通过该方法有效控制灰葡萄孢和禾谷镰刀菌等真菌的侵染[75,76]。
此外,针对由植物感染病毒引起的病害则需要区别对待,由于病毒大多由刺吸式害虫传播,因此RNAi 的应用策略需要转移至防虫以控病。比如灰飞虱Laodelphax striatellus是传播黑条矮缩病毒 (rice black-streaked dwarf virus,RBSDV) 的主要媒介,因此,通过防虫以阻断病毒传播是其综合治理的首选,可将防病间接转化为利用RNAi防控昆虫的策略而实现[77]。其次,还可利用病毒传播阻断机制,根据媒介昆虫参与病毒复制和装配的潜在功能蛋白,通过RNAi 将该功能蛋白表达水平显著调低,从而可显著降低刺吸式害虫对病毒的传播[78]。同时,还可进一步深入挖掘植物、昆虫与病原菌三者的营养关系,提升作物自身的抗逆水平[79]。此外,也可单纯从植物病毒本身出发,利用RNAi 开展防控工作。Bonfim 等[80]根据病毒AC1基因的序列区,成功构建了能够产生高抗菜豆金色花叶病毒 (bean golden mosaic virus,BGMV) 的转基因菜豆Phaseolus vulgaris。Holeva 等[81]根据黄瓜花叶病毒 (cucumber mosaic virus,CMV) 外壳蛋白 (coat protein,CP) 等关键基因序列区,成功合成了相应的dsRNA,并同时在体外和活体植株进行了抗病毒测定:在体外抗病毒测定中,dsRNA 无论是在接种前或与病毒同时接种,均具有很好的抗病毒效果;而在活体植株中检测,则发现CPdsRNA 具有更好的防效。类似地,Vadlamudi 等[82]和Ravelonandro 等[83]以CP 基因为靶点,构建了抗番木瓜环斑病毒 (papaya ringspot virus,PRSV) 和李痘病毒 (plum pox virus,PPV) 的转基因植株,例如转基因木瓜华农1 号番木瓜的成功培育,为我们国家番木瓜农业健康生产构筑了坚实的保障[84]。Ghag 等[85]全面总结了利用RNAi 技术防控香蕉种植中多种由病毒、真菌和细菌等病原物所致病害的防控效果。这些最新研究成果 (表2) 明确了RNAi 策略在总体上能够有效保证植物免受病毒的侵袭,为进一步研究奠定了理论基础。

表2 近年来RNAi 技术在植物病原真菌防控中的研究及应用Table 2 The application of RNAi technology in the control of plant fungal diseases in recent years

续表2Table 2 (Continued)
2.3 RNAi 技术在植物线虫防控中的研究及应用
RNAi 技术在植物抗寄生线虫中的研究也有较大进展,研究者将部分线虫基因通过转基因植物介导途径,获得了能够产生相应dsRNA 基因的转基因作物,可有效防控线虫的为害。Huang 等[95]通过体外合成并在拟南芥中表达了南方根结线虫Meloidogyne incongnita16D10基因的发夹结构,用其饲喂包括南方根结线虫在内的4 种常见植物病原线虫,发现与用对照植株饲喂的线虫相比,转基因组线虫侵染活力均呈现不同程度下降。Dalzell等[96]将根结线虫RNase III 酶相关基因drosha、dicer以及辅因子pasha分别合成相应的siRNA,利用浸润方式处理线虫卵,发现可引起根结线虫卵的不规则生长和胚胎死亡。类似的现象在孢囊线虫中也有发现。Tian 等[97]采用大豆胞囊线虫Heterodera glycines为研究对象,以该线虫特异蛋白HgY25 和HgPrp17基因为模板,在转基因大豆中表达相应的siRNA,结果表明,该转基因大豆根中胞囊线虫 (卵) 量平均减少了70%以上,对大豆包囊线虫后代的种群抑制效果显著。以RNAi为基础,结合生物防控等传统防控技术,Blyuss等[98]研究了禾谷孢囊线虫H.avenae及其寄主植物小麦遭受包囊线虫侵染后的转录组数据,最终挖掘出一系列特异性的si/miRNA,这类si/miRNA既能够特异性沉默因线虫侵染引起上调的小麦内源性mRNA,又能够直接沉默线虫中与生长周期、侵染效应相关联的基因,从而在一定程度上提升了小麦对孢囊线虫的抗逆性。Dutta 等[99]进一步扩大了对禾谷孢囊线虫候选靶标基因的筛选,将其中的一些神经肽基因、蛋白酶基因、蛋白酶抑制基因、管家基因、分泌蛋白基因、细胞壁修饰酶基因、应激效应基因、分泌蛋白基因、生殖适合度关联基因和化感效应基因等诸多功能基因分别成功构建了能够表达靶标基因dsRNA 片段的质粒载体,培育出了含有相应基因片段对应dsRNA的转基因小麦,随后对各转基因小麦开展抗逆试验检测,最终筛选出了一批能够显著抵御线虫穿透植物组织、影响线虫发育和生殖的重要候选靶标基因。随着RNAi 技术的不断提高,更多具有潜在抗植物寄生线虫功能的靶基因正被陆续筛选出来,为培育出更多可有效抗 (耐) 寄生性线虫的植物新品种提供了理论基础[100]。
3 RNAi 技术的机遇与挑战
RNAi 作为自然界普遍存在的现象,从发现至今已走过30 余年。该技术从早期的表象发现逐渐到深入的机理探索,从基因功能的研究到有害生物靶标基因的挖掘筛选,从单一载体非专一性传递至借助各种先进材料精准靶向,正逐步走向现代农业甚至精准医学开发与应用。RNAi 作为21世纪初十大科学发现之首,在将来一段时间内,必将得到更广泛的研究与应用,同时不可避免地面临着诸多机遇和挑战。
3.1 RNAi 面临的机遇
RNAi 对于靶标mRNA 的沉默具有高特异性和选择性等优点,因此,可以通过基因的筛选和设计,达到对靶标物种精准防控而不影响有益或非靶标物种的目的[101]。随着人们对RNAi 技术的深入探索,可深度挖掘的潜在基因众多,对新农药靶标筛选具有重要意义[102]。
如何借助合成生物学,开发高效传递载体和挖掘特异性新靶标等是目前研究的热点[103]。RNAi技术并不排斥现有防控技术,既能将RNAi 产品延伸,形成一种新的、安全且环境友好的、与传统防控优势互补的防控策略[104-105];也可将RNAi与常规杀虫剂组合应用,达到环保增效的双重效果[106]。在载体研究方面,通过质体、纳米颗粒负载dsRNA 或将dsRNA 与一部分穿梭多肽连接[33,107],可以提高dsRNA 进入生物体内的效率,保证dsRNA 的有效性。其中,借助开发高效的农药载体材料等一系列创新技术,是实现将其成功推向市场的最有效途径[107-108];或者通过对dsRNA 产品进行改良,将传统靶标基因小片段进行重复串联,形成串联重复dsRNA (concatemerized dsRNAs,C-dsRNAs)。与传统非串联长dsRNA(non-concatemerized long dsRNA,NCL-dsRNA) 相比,C-dsRNAs 的干扰效率显著提升,而且其使用剂量也有大幅下降[109]。此外,在靶基因的筛选和功能验证过程中,还可借助CRISPR (clustered regularly interspaced short palindromic repeats) 技术的优势,快速、高效地开展基因筛选工作,从而避免因传统RNAi 筛选造成的脱靶效应[110]。在对RNAi 有效靶标基因不断进行挖掘的同时,提升其干扰效率的技术开发也在稳步推进中,因此,基于RNAi 技术的生物农药有望以转化性 (以转基因形式) 和非转化性 (以传统农药使用方式,作为诱饵或陷阱、纳米载体、根茎 (树干) 注射剂、茎叶喷雾剂、种子处理剂、土壤浇灌或造粒缓释剂,重组共生菌或病毒等) 的形式开发出来,最终进入市场[111-112]。相信随着RNAi 技术应用范围的进一步拓展,结合目前可在基因组水平上批量甚至借助人工智能手段大规模筛选药物靶标等技术的嵌入,将来一定会发现更多的潜在药物靶标,从而大大降低成本,显著提升dsRNA 产品的杀虫效率,进一步加快新农药的研发和应用[113]。
3.2 RNAi 面临的挑战
事实上,RNAi 技术同样也面临着巨大的挑战,目前其在实际研究和应用中还存在一些突出的短板。首先,田间病虫害种类繁多,且在各自发生环境中具有典型的物种多样性,即使针对某一同源基因的不同靶标害虫或同一害虫不同靶标位点的选择,在干扰效率上都可能存在显著差异,这些关系到有害生物防控广度和深度的具体问题均值得深入思考。其次,由于不同生物体内dsRNA 的吸收效率和传递方式各异,不可避免地造成干扰效率及干扰效果的差异,因此,如何提高RNAi 药物的干扰效果亦至关重要[114-116]。另外,农户最为关心的就是防控成本,即如何将RNAi产品成本控制在用户可接受范围内。最后,RNAi面临的最大挑战是抗性风险评估这一重要环节,而任何科技的发展和新技术的应用都可能存在不可预知的潜在风险。
有关RNAi 杀虫谱的问题,我们需要进一步借助基础研究,以病原微生物或昆虫为分类单元,分别深入挖掘不同有害生物中的共同靶标基因,既要保证基于RNAi 技术的产品 (RNAi 产品)其杀虫效果在同类有害生物中的高度特异性,同时还要避免对天敌昆虫或有益微生物造成的危害,保证其高度选择性。此外,针对该产品面临的吸收效率及稳定性问题,则可以通过对RNAi农药剂型的研究和改进加以解决;同时,有效改善田间环境中由于雨水、紫外线、高温等复杂自然条件而引起的RNAi产品持效期过短的现状,可避免无法有效保障其防控效果的问题[103]。至于成本问题,相信随着科技的发展,有望通过简化生产工艺,避免或减少RNAi 的脱靶效应、提升干扰效果以降低使用量,从而最终降低RNAi 产品成本[104]。另外,抗性问题是研究者最为关注的问题,虽然目前田间尚未报道相关抗性事件,但在室内模拟已有类似结果[117],因此,在研究开发RNAi 产品的过程中,需要预先考虑到延缓或避免其抗性产生的应对措施,要充分根据病虫害抗性机理、RNAi 作用机制及dsRNA 传输效果、靶标有害生物的微环境和剂量累积效应等方面制定合理的抗性治理策略,如选择多个不同功能的靶基因、将化学农药或生物农药与dsRNA联合使用、与常规转Bt 基因优化组合构建新的转基因品种等,充分发挥有害生物综合治理策略,同时还需加强抗性监测[118]。
4 展望
近年来,依托RNAi 技术开发出的众多产品,作为新兴农药正逐步在室内和田间展开各种途径的试验与应用,为农业可持续发展绘就了一幅新蓝图[119]。未来一段时间内,我们既要面对各国抢占RNAi 各项技术新高地的激烈竞争局面,又要有防范RNAi 走向市场化后所带来的潜在风险意识,这就需要相关科研单位与专门机构共同探讨与商议,最终确定一套逐步完善的、标准化的评估方案,对样品逐步实现标准化控制,将田间数据和原始数据收集整理后放置于公共开源平台(如:国家农业科学数据中心),以科学、开放的态度将其向前推进,确保整个行业上下游的健康发展。未来,相信基于RNAi 技术的病虫害防控应用策略将继续焕发新的活力,为植保综合防控提供新理念。
致谢:感谢河南农业大学关若冰老师在文章修改过程中的大力帮助与指导。

