基于代谢组学的赤霉酸生物合成研究进展
殷凯楠, 吴酬飞, 尹良鸿*,, 林海萍*,
(1. 浙江农林大学 生物农药高效制备技术国家地方联合工程实验室,浙江 临安 311300;2. 湖州师范学院 生命科学学院,浙江 湖州 313000)
赤霉酸 (gibberellic acid,GA) 是一类天然植物生长调节剂,具有提高种子发芽率、促进植株生长和调节开花等重要作用,同时具有绿色环保的优点,因而一直以来备受关注,市场需求日益增大,产量急需提高。国内外赤霉酸的研究已有较长的历史[1]。近年来,随着赤霉酸的结构和功能被逐渐认识,赤霉酸合成途径和关键酶得到了更全面的阐释[2-3],如何通过微生物高效生产赤霉酸日益成为学者们的关注重点。众多研究人员在此基础上提出了基于培养基组成、发酵条件控制、菌种分子改造等生产优化策略,显著提高了赤霉酸的产量,但目前国内外大部分研究成果还不能实时、动态地掌握细胞内赤霉酸代谢途径的变化。
代谢组学作为一项新兴技术已在微生物[4-5]、植物[6-7]、中医[8-9]、食品工程[10-11]、疾病诊断[12-13]、药物毒性和机理[14-15]等研究领域得到了广泛应用,并取得了重要成果。但基于代谢组学技术分析,实现微生物体内赤霉酸高效合成的研究还鲜见报道。近年来,随着高通量测序、基因编辑等技术的快速发展,特别是代谢组学技术的日益成熟,为研究赤霉酸的动态合成提供了新的方法与思路,利用代谢组学探究赤霉酸的合成机理具有巨大潜力,可为提高赤霉酸发酵产量提供新路径。本论文综述了基于代谢组学的赤霉酸生物合成国内外研究进展,通过代谢组学分析技术,探究藤仓赤霉菌Gibberella fujikuroi赤霉酸高效合成的机理,旨在为提高赤霉酸产量提供新的研究与应用思路。
1 赤霉酸概述
1.1 赤霉酸种类
赤霉酸是一类四环双萜羧酸化合物,可由绿色植物、真菌和细菌产生,与生长素、脱落酸、细胞分裂素、乙烯合称植物五大激素。赤霉酸自1935 年首次被发现以来,至今已鉴定出136 种不同结构的GA,按照发现的先后顺序依次命名为GA1、GA2……GA136,统称赤霉酸类 (GAs),其中具有生物活性的赤霉酸主要有GA1、GA2、GA3、GA4、GA7等[16]。赤霉酸是植物激素中种类最多的一种,而且在同一植物中往往出现多种赤霉酸并存的现象。
1.2 赤霉酸生产菌种
藤仓赤霉菌为当前工业上生产赤霉酸的主要菌种,是隶属于真菌界 (Fungi)、子囊菌门 (Ascomycota)、子囊菌纲 (Ascomycetes)、肉座菌目(Hypocreales)、肉座菌科 (Hypocreaceae)、赤霉菌属 (Gibberella) 的一种丝状真菌。菌丝生长最适条件为25~28 ℃。子囊呈圆筒形,内含4~8 个无色椭圆形子囊孢子。有大小两型分生孢子,以小型为主,呈卵形、椭圆形或纺锤形,无色,一般无隔,于分生孢子梗上簇生成球状;大型分生孢子呈镰刀形,无色,有3~5 个隔;产孢细胞单复梗并存[17]。
1935 年,赤霉酸首次在藤仓赤霉菌发酵液中被分离出来。随后,在多种真菌和细菌中也陆续发现了赤霉酸,如Khan 等[18]在筛草Carex kobomugi根部分离出一株毛竹基腐病菌Arthrinium phaeospermum,发现其能产生多种活性赤霉酸,但产量很低,均在10 ng/mL 以下。Kang 等[19]从土壤中分离得到一株乙酸钙不动杆菌Acinetobacter calcoaceticus,发现其具有生产赤霉酸和溶解磷酸盐的能力,但产量更低,其中具有生物活性的GA1、GA3和GA4产量仅分别为0.45、6.2 和2.8 ng/100 mL。因此其他菌种无法满足赤霉酸工业化生产要求,而由藤仓赤霉菌生产的GA3产量可达1 000~1 200 mg/L,远远超过其他可生产赤霉酸的菌种,因此藤仓赤霉菌具有广阔的应用前景。
为进一步提高藤仓赤霉菌的商业价值,国内外学者纷纷开展菌株改造,以期获得赤霉酸产量更高的优质菌株。1960 年,科研人员首次将自然界分离得到的产赤霉酸与不产赤霉酸藤仓赤霉菌的菌株进行杂交,获得了产赤霉酸种类和产量均不同的杂交菌株[20]。Candau 等[21]利用亚硝基胍诱变手段得到了能大量积累GA7却不产生GA4的突变菌株。20 世纪70 年代,国内通过发酵生产赤霉酸的开创者“九二零菌种选育协作组”筛选出了高产变种“4303”,成为当时国内赤霉酸工业化生产的主要菌株。李武军等[22]通过原生质体诱变,获得了可将赤霉酸产量提高25%以上的突变菌株。这些研究成果使藤仓赤霉菌生成赤霉酸的优势更加突出。
1.3 赤霉酸生产
赤霉酸的生产方法主要有3 种,分别为植物提取、化学合成和微生物发酵。虽然多数植物都可以合成赤霉酸,但是提取率很低,远远不能满足生产需求;而化学合成法存在成本高、效率低、污染大等缺点。因此,赤霉酸的大规模工业化生产主要通过微生物发酵法进行。目前应用最广泛的赤霉酸为GA3,工业生产菌种主要是藤仓赤霉菌[23],国内GA3的工业化产量为1 200~2 000 mg/L,而国外采用液态深层发酵,GA3产量可达3 900 mg/L。与GA3相比,新型赤霉酸GA4能打破植物休眠,但不影响植物抗倒伏性,也不会造成植物果皮破裂,对苹果树大小年的调节和缓解苹果褐锈病十分有效[24-25],因此GA4具有更优的功能和更广阔的应用前景。通过发酵条件优化可有效提高GA4的合成效率,但增幅较为有限[26]。随着赤霉酸的广泛应用,对其需求也日益增长,目前的发酵产量已不能满足市场需求,因此探究提高赤霉酸产量的策略迫在眉睫[27-28]。
1.4 赤霉酸的应用
赤霉酸在生物体内起着内源性激素的作用,能调节多种植物的生长发育,广泛应用于蔬菜、水果、粮食作物等打破种子休眠、缓解逆境胁迫、提高抗倒伏性及保花保果等方面。在农林业、酿造业,特别是粮食生产等领域创造了巨大的经济效益与社会效益。
1.4.1 打破种子休眠 种子休眠是指有活力的种子在适宜的温度、水分等萌发条件下仍不发芽的现象,种子过度休眠,会影响萌发率或造成萌发推迟。有研究表明,赤霉酸可以解除种子休眠,促进种子萌发[29]。DELLA 蛋白家族是赤霉酸信号途径中的关键负调控因子,可抑制赤霉酸途径的基因表达从而抑制种子发芽,但这种抑制作用可以被外源赤霉酸解除[30]。此外,一定浓度的赤霉酸对种皮的蜡质层具有腐蚀作用,浸种后能提高种皮的透水、透气性,增强种子内生理生化过程与呼吸作用,促进胚生长,从而能促进种子萌发[31]。刘彩红等[32]发现,用300 μg/g 的赤霉酸溶液浸泡吉生羊草Leymus chinensis种子48 h,能有效促进种子的发芽率、发芽指数、发芽势和活力指数,并使幼苗高度有效增长。聂莹莹等[33]用不同浓度的赤霉酸溶液处理呼伦贝尔黄花苜蓿Medicago sativa种子,发现其发芽势、发芽率、发芽指数、发芽速率以及根长随着赤霉酸浓度的增加而增加,当赤霉酸质量浓度为200 mg/L 时效果最好。此外,对于需要光照和低温才能萌发的种子,赤霉酸可代替光照和低温打破休眠,这是因为赤霉酸可提高胚内酶如α-淀粉酶、蛋白酶等水解酶的活性和代谢活动,催化种子内贮藏物质的降解,以供胚胎的生长发育[34]。Kępczyński等[35]通过对野生燕麦Avena fatua的研究,发现赤霉酸影响了野生燕麦种子萌发过程中α-淀粉酶的活性,提高了种子的萌发率。李振华[36]研究发现,萌发过程需要光照的烟草Nicotiana tabacum种子,通过赤霉酸处理,可代替光照从而促进休眠的烟草种子萌发。牡丹Paeonia suffruticosa植株上的芽在深秋即进入休眠状态,必须要经过一段时间的低温才能打破休眠而萌发,而以500~1 000 mg/L 的GA3处理3~4 次,解除花芽休眠的有效率在90%以上,可大大缩短发芽时间,提高发芽率[37]。
1.4.2 缓解逆境胁迫 当植物受到逆境胁迫时,赤霉酸可以有效缓解逆境带来的危害。例如,当植物受到干旱等外界胁迫时,光合作用会受到严重抑制,导致光合速率下降[38]。高等植物内源赤霉酸水平与光合活性呈正相关,提高内源赤霉酸水平能提升光合活性[39]。同时,大量研究表明,通过施加外源赤霉酸,可以使叶片的叶绿素含量、光合速率等一系列指标有不同程度的提高,以达到增强植物光合作用的目的[40]。刘文婷[41]用赤霉酸处理苇状羊茅Festuca arundinacea,其叶绿素含量显著高于干旱胁迫下的对照组,最高增加了25.77%。郝鹏等[42]用1 mg/L 的赤霉酸处理辣椒Capsicum annuum幼苗,发现处理组叶绿素a、叶绿素b 和类胡萝卜素含量显著高于空白组。研究发现,外源赤霉酸可通过提高活性氧清除剂超氧化物歧化酶 (SOD) 和过氧化氢酶 (CAT) 的活性调节脂质过氧化,从而抑制植株衰老[43]。外源喷施赤霉酸后,植株体内丙二醛 (MDA) 的含量显著降低,有效阻止了活性氧自由基对保护酶的破坏,延缓了膜系统的衰老[44]。石全梅[45]发现,在盐胁迫条件下,通过对药用丹参Salvia miltiorrhiza外源施用GA3能显著缓解盐胁迫对幼苗的伤害,其原因是GA3可以显著提高叶片中CAT、SOD等抗氧化酶活性,使叶片中MDA 含量下降,从而有效缓解膜脂过氧化过程,提高植物抗盐性。
1.4.3 提高抗倒伏性 有报道称赤霉酸可通过增加侧根的数量与植株的节间距以促进作物抗倒伏能力[46]。高建芹等[47]在油菜Brassica napus幼苗期喷施赤霉酸,发现可以有效降低油菜株高,而且其根颈加粗,根干质量和单位长度茎秆干质量增加,植株抗倒能力增强。张大雷[48]研究表明,在分蘖盛期喷施赤霉酸,拔节期喷施多效唑能在不影响其产量的情况下显著增加水稻Oryza sativa的抗倒伏性。有研究表明,GA4增强植物抗倒伏性作用显著优于GA3,这是因为GA4在打破植物休眠的同时不会引发胚轴的过度生长[49]。樊炎迪[50]在利用GA3和GA4处理铁皮石斛Dendrobium officinale时发现,GA3仅能促进其纵向伸长,而GA4在保证其正常纵向生长的同时增加了茎粗,从而提高了抗倒伏性。
2 代谢组学研究进展
2.1 代谢组学概念
代谢组学产生于20 世纪90 年代中期,是继基因组学、转录组学和蛋白质组学这3 大组学后的又一新型组学技术,作为系统生物学的重要组成部分,代谢组学是3 大组学的延伸和补充。代谢组学概念最初由英国帝国理工大学J. Nicholson于1999 年提出,他认为人体作为一个完整的系统,机体的生理病理过程应该作为一个动态的系统来进行研究,并且将代谢组学定义为生物体对病理生理或基因修饰等刺激产生的代谢物质动态应答的定量变化[51]。但德国学者Fiehn 在2000 年却提出了不同的观点,他认为代谢组学中代谢物的定性和定量研究应处于静止状态[52]。虽然两位学者的观点有所差异,但在后续的实际研究和应用中发现二者的观点存在相似之处和互相借鉴的现象。
2.2 代谢组学优点
代谢组学是通过现代分析技术对生物体内的小分子代谢产物进行定性和定量分析,可以直观反映细胞内生理生化动态过程,从而探究细胞内生化途径,揭示生命现象的内在规律[53-55]。与其他组学相比,代谢组学处于系统生物学的最下游,在各种组学研究中最接近表型。除了遗传因素,培养基组分与培养条件的变化均会影响菌体合成代谢过程中关键基因及酶的变化,从而直接或间接影响相关代谢产物的产量[56]。同时,这些代谢产物又会对细胞的基因表达、菌体生长等产生影响。
与基因组学、转录组学及蛋白组学等其他组学相比,代谢组学具有以下优点:基因、蛋白等微小的变化会通过最终的代谢物得以体现和放大,可以更加直观地观测到结果;省去了工作量巨大的全基因测序、建立大量表达序列标签数据库等流程;代谢物的种类远远小于基因和蛋白的数量,使得测定和分析更为便利;通过对生物体的代谢物分析可了解机体系统的生理或病理状态;通过生物体在各种内外环境扰动后的不同应答,可以区分同种不同个体之间的表型差异;代谢组学以其高灵敏度、高分辨率、高通量的技术特点以及无创、便于实施等优点在癌症等医学研究领域得到了广泛应用[57]。
2.3 代谢组学研究方法
根据研究目的不同,代谢组学可分为非靶向、靶向和广泛靶向3 种[58-59]。
非靶向代谢组学是一种对有机体内的代谢物进行全面和无偏向的分析方法,具有检测物质的信息量大、覆盖面广等优点。但是,由于标准品缺乏,非靶向代谢组学可能会产生假阳性信号,造成重复性差且不能定量的结果[60]。在非靶向代谢组学中目前常用的研究方法主要有两类。第1 类为核磁共振技术 (nuclear magnetic resonance,NMR)。由于NMR 可深入物质内部而不破坏样品,并具有迅速、准确、分辨率高等优点而得以迅速发展和广泛应用,但NMR 检测灵敏度相对较低、动态范围有限、只能鉴别出很少一部分代谢物,且很难同时测定生物体系中共存的浓度相差较大的代谢物[61-63]。第2 类为色谱与质谱联用技术,包含气相色谱-质谱联用 (gas chromatographymass spectrometry, GC-MS) 和液相色谱-质谱联用(liquid chromatograph-spectrometry, LC-MS) 以及毛细管电泳和质谱联用 (capillary electrophoresismass spectrometry, CE-MS)。GC-MS 的优势在于具有较高的分辨率和检测灵敏度,并且有可供参考与比较的标准谱图库,可以方便地得到待分析代谢组分的定性结果,但GC-MS 只能对样品中的挥发性组分进行分析,无法得到难挥发的代谢组分信息,因此局限性也很明显[64-66]。与GC-MS 技术相比,LC-MS 不需要对样品进行衍生化预处理,并且适用于热不稳定、不易挥发且相对分子质量较大的物质,这些优点都使LC-MS 技术的应用频率大大提高。而CE-MS 技术具有分离效率高、分析时间短、样品需要量少且一般不需要进行样品预处理等优势,但是其检测灵敏度较低,且主要只能用于分析氨基酸、有机酸等极性带电化合物[67]。
靶向代谢组学主要是通过标准品或同位素内标对有机体内特定的一类代谢物进行定性或定量分析。相比于非靶向,靶向代谢组学关注特定种类的代谢物,所以可以对数据进行准确定性和绝对定量,具有较好的重复性和灵敏度,而且数据分析比非靶向更简单。但是,靶向代谢组学通量相对较低且需要购买标准品[68]。在使用方法和数据库应用方面,靶向和非靶向代谢组学相似[69]。
广泛靶向代谢组学结合了非靶向检测的广谱性和靶向检测的准确性,主要通过多反应监测技术 (multiple reaction monitoring, MRM) 采集数据,并建立数据库来实现对代谢物的精确定性与定量[70]。广泛靶向代谢组学整合了非靶向和靶向代谢组学的优点,具有通量高和定性准确等优点。但是,它的应用需要自建数据库,由于生物体内代谢物种类的复杂性和多样性,数据库并不能覆盖生物体内所有的代谢物[71]。
代谢产物经过检测、分析与鉴定后,需进行后期数据分析处理。为了降低误差,提高数据分析的准确性,需要对采集的数据进行归一化或标准化预处理,其中应用最多的是主成分分析 (principal component analysis, PCA) 和偏最小二乘-显著性分析联合法 (partial least squares discrimination analysis,PLS-DA)。当PLS-DA 无法很好区分不同组别的样品时,还可以用正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA)[72-74]。同时根据相应的代谢物或代谢途径数据库如MassBank、KEGG 等查找相应数据,最后对数据进行整合分析[75]。
2.4 代谢组学中赤霉酸的测定
赤霉酸作为自然界中种类最多的一类植物激素,在化学结构上具有共同的基本骨架,即赤霉烷。各种赤霉酸的结构非常相似,仅在羧基数目和位置上有差异,但却具有不同的生物活性,在生物体内的作用也大不相同。因此,对不同种类的赤霉酸建立准确、可靠的定性、定量测定方法十分重要。
仪器联用已成为色谱分析技术的发展趋势,其中最常用的是色谱分离技术与质谱联用[76]。在代谢组学研究中,为了快速高效地测定赤霉酸,通常选择高效液相色谱-质谱联用 (high performance liquid chromatograph-mass spectrometry, HPLCMS)技术。1997 年,Castillo 等[77]首次建立了微生物发酵液中赤霉酸含量测定的反向高效液相色谱法。该技术既有高效液相色谱分离能力强、操作简便等优点,又避免了气相色谱繁琐的衍生化,同时兼具质谱法的灵敏和准确,因此是目前检测复杂体系中赤霉酸含量最常用的方法[78-79]。近年来,HPLC-MS 被广泛应用于蔬菜、水果、茶叶、保健品等产品中赤霉酸的测定,一般采用非靶向代谢组学和高效液相色谱-三重四级杆串联质谱检测方法[80-83],李伟等[84]研究了超高效液相色谱-四级杆飞行时间串联质谱法测定松花粉中赤霉酸的含量,取得了较好的测定效果。
3 代谢组学在赤霉酸生物合成中的应用
由藤仓赤霉菌发酵生产赤霉酸的生物合成途径及中间代谢产物已较为清晰,主要可分为3 个阶段:上游部分由乙酰辅酶A (acetyl-coA)合成二萜类化合物的共同前体牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphat, GGPP);中游部分GGPP 通过烯萜合成酶 (terpene synthases, TPSs) 的催化形成GA12醛;下游部分GA12醛通过P450单加氧酶 (cytochrome P450 monooxygenases, P450s)的一系列氧化形成赤霉酸[85]。
3.1 基因改造对赤霉酸合成的影响
基因改造对某些微生物表型特征的影响并不明显,而利用代谢组学能有效地探测基因改造引起的变化。近年来,藤仓镰刀菌Fusarium fujikuroi和拟南芥Arabidopsis thaliana中的赤霉酸生物合成基因已被克隆出来,研究表明,尽管它们能产生相同的赤霉酸,但高等植物和真菌合成赤霉酸的途径并不完全相同,而且与赤霉酸合成相关的基因在高等植物和真菌中也存在差异[86]。基因的克隆、敲除突变体的构建、基因的过表达会对赤霉酸合成种类及效价产生影响[87-88]。通过代谢组学分析基因改造前后代谢物的差异,可以进一步探究影响赤霉酸代谢合成的机理,为进一步改造菌株、高效合成赤霉酸提供理论依据。表1 从分析工具、优化位点、应用功能3 个方面,列出了基于基因改造的代谢组学在赤霉酸生物合成中发挥的作用。

表1 基于基因改造的代谢组学在赤霉酸生物合成中的应用Table 1 Application of metabolomics based on genetic modification in the biosynthesis of gibberellic acid (GA)
此外,还可以在代谢组研究的基础上使用不同的突变体来大量生产与赤霉酸生物合成途径相关的前体物质,如内根-贝壳杉烯 (ent-kaurene)、内根-贝壳杉烯酸 (ent-kaurenoic acid) 或GA14等。Tudzynski 等[89]发现,P450-4基因上游存在一个ORF3基因,将其敲除后的突变株 (6314) 与野生菌株 (m567) 发酵产物进行代谢组学分析,发现6314 发酵液中不存在GA4与GA3,表明ORF3基因缺失后,GA7不能向GA3转变,从而提高了GA7的产量。为了进一步确认去饱和酶基因DES的作用,在敲除了DES与ORF3的双基因缺失突变体(6314Δorf3-1) 中,用放射性14C 标记的GA4作为底物进行试验,通过GC-MS 分析代谢产物发现GA4为唯一产物,表明DES基因在分解GA4的过程中发挥着重要作用,见图1。这个结论可为实际生产提供思路,如敲除DES基因可提高GA4产品纯度。Tudzynski 等[90]进一步对处于赤霉酸合成基因簇中的P450-2基因进行了敲除突变体的构建,然后利用薄层色谱法 (thin-layer chromatography,TLC)、HPLC 和GC-MS 法进一步分析,表明敲除了P450-2的突变体中只合成GA14,丧失了向下游继续合成赤霉酸的能力。可见P450-2基因是GA4、GA7、GA3与GA1合成的关键基因。

图1 3 个菌株的高效液相色谱图[89]Fig.1 High-performance liquid chromatographic analysis of three strains[89]
3.2 非生物胁迫对赤霉酸合成的影响
微生物可通过合成相应物质来抵抗营养物质、温度、酸碱度、渗透压、氧化还原电位异常等不利生存环境带来的影响,因此代谢产物会随着培养条件的改变而改变。代谢组学可通过代谢物差异有效检测出微生物在不同环境胁迫下细胞内的代谢差异。氮源在赤霉酸合成过程中至关重要,高浓度的氮源会抑制赤霉酸的合成,在氮源限制的情况下赤霉酸才能大量积累[91]。张万存等[92]利用LC-MS 法对不同培养阶段蝉棒束孢Isaria cicadae菌丝体的代谢物进行检测,发现赤霉酸在发酵后期快速合成并大量积累,比发酵前期的赤霉酸产量提高了44 倍,这可能是因为随着发酵的进行,培养基中的氮源含量不断降低,消除了高浓度氮源对GA 合成的抑制作用。除氮源外,镁、钾、锌等无机盐也是影响赤霉酸合成的重要因素,可能是因为无机盐的加入不仅为酶活性的发挥提供离子,还具有控制氧化还原电位、平衡细胞渗透压等作用[85]。Jefferys[93]发现,在藤仓赤霉菌发酵过程中加入微量锌能有效促进赤霉酸的生成。储修云等[94]通过在培养基中添加镁、硼、磷等物质提高了赤霉酸的产量。李冠军等[95]利用HPLC 法和GC-MS 法对木麻黄Casuarina equisetifolia内生真菌 (炭团菌属Hypoxylon) 代谢产物进行分析,发现其在不同浓度氯化钠下代谢产物差异显著,当氯化钠质量分数达到5.0%时,赤霉酸产量达到最高点。
当前基于代谢组学技术对非生物胁迫影响赤霉酸产量的相关报道较少,可借鉴其他成熟案例进行赤霉酸合成研究。戚晓雪等[96]通过PCA、PLS-DA、差异代谢物聚类分析等方法,筛选、鉴定出了砷胁迫下库德毕赤酵母Pichia kudriavzevii的差异代谢物,结果如图2 所示。他们进一步对差异代谢物进行了KEGG 富集通路分析,结果(图3) 表明,差异代谢物主要富集在糖酵解、三羧酸循环、氧化磷酸化和脂肪酸、谷胱甘肽与氨基酸代谢等通路,可见库德毕赤酵母通过提高能量供给、还原砷等方式以应对砷胁迫导致的毒性效应,减少砷对菌体的损伤。

图2 库德毕赤酵母在砷胁迫下的代谢物差异[96]Fig.2 Metabolite difference of P. kudriavzevii under arsenic stress[96]

图3 库德毕赤酵母在砷胁迫下的KEGG 富集通路气泡图[96]Fig.3 Bubble diagram of KEGG enrichment pathway in P. kudriavzevii under arsenic stress[96]
3.3 前体物质对赤霉酸合成的影响
前体物质是指加入到培养基中能被微生物直接利用或参与目标产物的生成,进而提高产物产量的物质。通常来说,前体物质的添加可以使得次级代谢过程避开初级代谢对目标产物的调控,从而增加次级代谢产物的产量。目前,利用代谢组学方法研究前体物质对赤霉酸合成影响的报道较少,可通过其他物质的研究报道为提高赤霉酸的产量提供思路。汪泽[97]在小白链霉菌Streptomyces albulus发酵ε-聚赖氨酸 (ε-poly-L-lysine,ε-PL) 过程中,添加了前体物质L-赖氨酸,通过超高效液相色谱法 (UPLC) 分析发酵产物,发现ε-PL 的产量显著提高,增长率达到20.8%。Guan 等[98]对产酸丙酸杆菌Propionibacterium acidipropionici进行代谢组学分析,确定了影响丙酸 (PA) 合成的关键节点。对差异较大的代谢物进一步分析,发现糖酵解中间产物、氨基酸中间体等对PA 均有显著影响,通过外源添加这些中间产物后PA 含量提高了54.9%。国内外学者也应用代谢组学,初步研究了前体物质对赤霉酸合成的影响。Cihangir 等[99]在研究添加前体物质对黑曲霉Aspergillus niger生长及产物产量影响时,发现向发酵体系中添加少量甲羟戊酸 (mevalonic, MVA) 作为前体物时,代谢产物中赤霉酸产量显著提高。王卫[100]通过在培养基中添加草酰乙酸、葡萄糖酸钙、维生素B2等前体物质,大大提高了发酵液中GA 的产量。由图4 可知,以上前体物质的添加分别使乙酰CoA、磷酸戊糖途径、柠檬酸循环的代谢通量r17、r7、r13比对照提高了11.0%、78.8%和降低了19.8%。同时,目标产物GA3的代谢通量r20提高了10.12%。这是因为草酰乙酸的加入解除了糖酵解途径的抑制,并通过降解产生了丙酮酸 (Pyr) 参与EMP 反应;葡萄糖酸钙则可以促进磷酸戊糖途径途径畅通,提高GA3合成所需的还原力;维生素B2是能量代谢过程中重要的辅酶,适当补充有助于能量的高效利用。
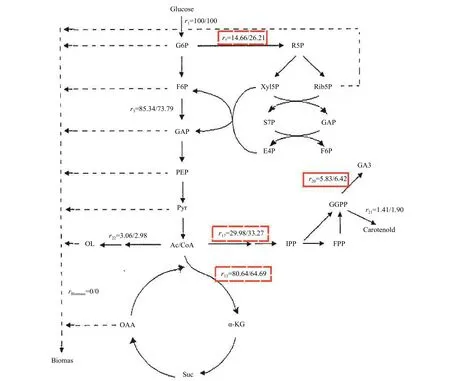
图4 添加前体物质对代谢通量的影响[100]Fig.4 Effect of precursor addition on metabolic flux[100]
4 总结与展望
赤霉酸的合成与调控是一个涉及基因、蛋白、代谢的全局过程,通过基因改造、环境胁迫、外源添加前体物质等手段均可提高赤霉酸的合成效率[101]。近年来随着分子生物学的发展,组学技术被应用于提高赤霉酸产量。与其他组学相比,代谢组学不仅可以明确赤霉酸生产菌株在合成赤霉酸过程中对内外环境变化的响应,以期从宏观角度创新发酵方式,优化发酵条件,实现提高赤霉酸产量,满足工业需求的目标;而且可以从代谢物变化解析影响赤霉酸代谢合成的调控机制,从微观角度挖掘GA 合成途径中的关键中间产物及其关键作用,进而探究赤霉酸的高效合成机理。
代谢组学近年来应用广泛,但大部分集中在动植物研究领域。郭凤丹等[102]概述了代谢组学在植物遗传与代谢途径研究中的应用,田菁等[103]综述了代谢组学在农业动物领域取得的最新成果。而本论文则聚焦微生物藤仓赤霉菌合成赤霉酸,从不同角度阐述了代谢组学的重要作用。除此之外,现阶段关于藤仓赤霉菌的研究主要局限于基因和赤霉酸合成层面。Malonek 等[104]从基因工程和赤霉酸生产两个方面综述了目前藤仓赤霉菌研究的工具和方法。王冰璇等[85]综述了藤仓赤霉菌赤霉酸生物合成途径、关键酶、环境因素、代谢流调控等方面的研究进展。本论文则是在介绍赤霉酸的基础上,主要从基因改造、非生物胁迫、前体物质3 个方面综述了代谢组学技术在藤仓赤霉菌合成赤霉酸中的作用,为工业生产中赤霉酸产量的进一步提升提供了新的思路。
随着各种组学技术的联系日益紧密,代谢组学分析结果可为基因组学、转录组学、蛋白组学提供数据支撑,因此采用多组学联合的分析方法极具潜力[105-106],可从不同维度解析影响赤霉酸合成的代谢途径和生物学过程,进而站在全局角度提出更全面精准的赤霉酸生物合成调控策略。

