植物环状RNA的研究新进展
赵杰 李安 梁刚 靳欣欣 潘立刚
(1.北京市农林科学院质量标准与检测技术研究所,北京 100097;2.农业农村部农产品质量安全风险评估实验室(北京),北京 100097)
环状 RNA(circular RNAs,circRNAs)是真核细胞中广泛存在的一类内源性非编码RNA分子,不具有5′末端帽子和3′末端poly(A)尾巴,以共价键形成闭合环形结构[1-2]。circRNAs于20世纪70年代首次在植物病毒体中发现[3]。由于较低的表达丰度及非线性的特点,最初circRNAs被视为RNA异常剪接中的副产品或“转录噪音”,并未受到足够的重视[4]。近年来,高通量测序、基因编辑等先进技术的发展以及生物信息学的进步极大地加速了环状RNA研究进展,其在生命活动中的重要作用也逐渐被揭示出来[5-6]。不同于线性RNA,circRNAs独特的环形结构使其不容易被核酸外切酶和核糖核酸酶降解,因而较线性RNA稳定性更高[7]。另外,研究表明植物circRNAs还具有保守性以及细胞或者组织特异性表达等特点,使其有作为生物标志物的潜在优势[8-10]。目前,研究者们已对拟南芥[11]、番茄[12]、大豆[13]、水稻[14]、玉米[15]、小麦[16]、马铃薯[17]、葡萄[18]、沙棘[19]、杜梨[20]、猕猴桃[21]、茶叶[22]等多种植物中的circRNAs进行了鉴定并开展了相关的研究。表1统计了不同植物中已鉴定出的circRNAs数量。本文简要介绍植物circRNAs的分类和特征,重点总结植物circRNAs参与的生物学过程及其作为潜在生物标志物的研究进展,最后展望未来circRNAs的研究方向。

表1 不同植物组织中已鉴定出的circRNAs数量统计(2017-2021)Table 1 Statistics of identified circRNAs in different plant tissues(2017-2021)
1 植物circRNAs的分类和特征
1.1 植物circRNAs的分类
植物circRNAs长度主要介于200-600 bp之间,目前已发现的circRNAs根据其在基因组来源区域可以分为外显子circRNA(ecircRNA)、外显子-内含子 circRNA(EIciRNA)、内含子 circRNA(ciRNA)、转运RNA 内含子circRNA(tricRNA)等,各类circRNA 的形成过程见图1[23]。
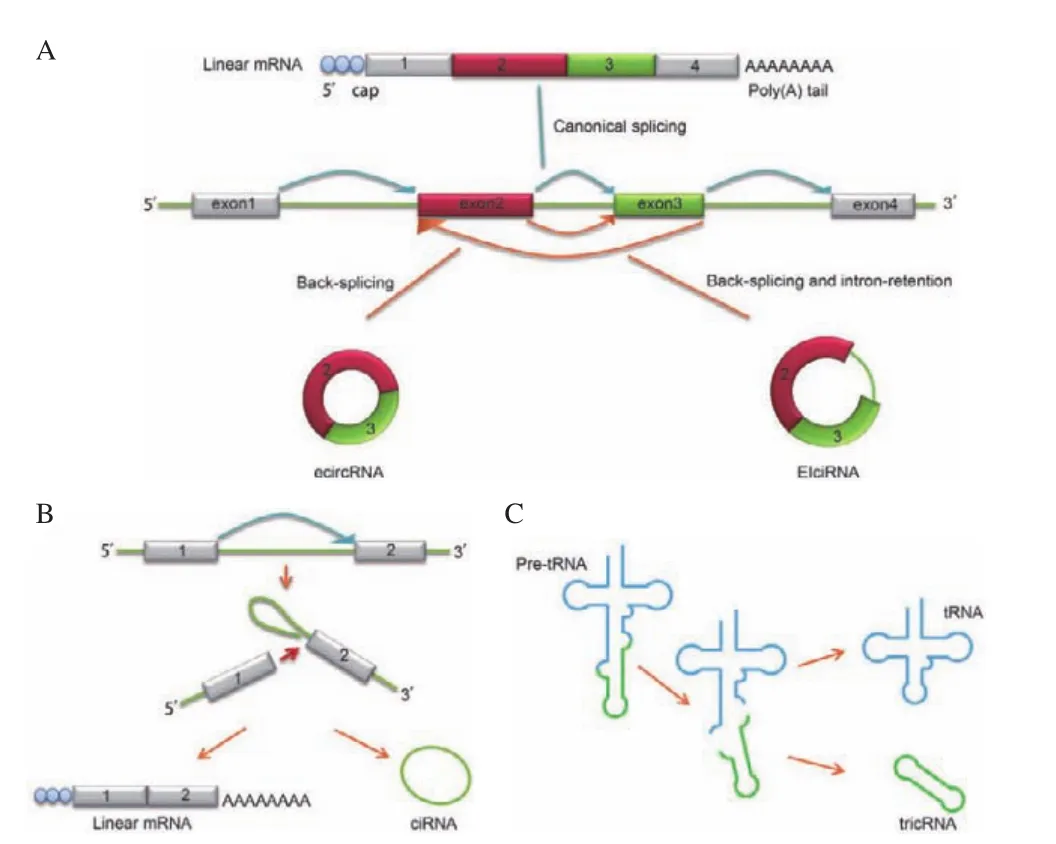
图1 circRNAs的分类Fig.1 Classification of circular RNAs
1.2 植物circRNAs的特征
(1)植物circRNAs具有较高的稳定性。与线性RNA不同,circRNAs无游离的5′端和3′端,特殊的共价闭合环状结构使其对核酸酶具有抗性[24-25]。因此,许多研究为从样本中富集circRNAs,采用核酸外切酶RNase R来处理提取得到的RNA,用于后续研究[26]。另外,circRNAs的稳定性还体现在其较长的半衰期上,与mRNA半衰期只有10 h相比,大部分circRNAs的半衰期超过48 h,较好的稳定性更有利于对其进行鉴定和进一步的研究[27-28]。
(2)植物circRNAs具有进化保守性。研究发现circRNAs在不同物种之间存在一定的保守性。研究人员比较了来自大豆、拟南芥和水稻同源基因的circRNAs发现,大豆和拟南芥之间有685对circRNAs高度同源,大豆和水稻之间有1 095对circRNAs高度同源,三者之间有551对circRNAs高度同源[13]。但物种间的保守性也具有差别,如Chen等[29]的研究表明,玉米2 804个circRNAs中与拟南芥和水稻间的保守性就非常低,分别为3对和47对。
(3)植物circRNAs具有组织/发育特异性表达的特点,在特定的组织、细胞类型或发育阶段circRNAs的表达通常存在差异[30]。Zhao等[13]研究了大豆不同组织中circRNAs的表达模式,在大豆中共鉴定出5 372个circRNAs,其中叶、根、茎分别为776个、3 171个和2 165个,3个组织中相同circRNAs比例不足3.0%,而各组织中的特异表达的分别为49.3%、30.6%和9.0%。在沙棘果实形成的3个不同阶段,绿熟期、破色期、黄熟期,鉴定得到的2 616个circRNAs中,3个阶段检测到的circRNAs总数分别为1 580、1 646 和1 340个,其中差异表达有252个,每个阶段特异性表达的circRNAs分别为 52、38和 30个[19]。circRNAs的这些特性,有助于其作为潜在的生物标志物进行鉴定和进一步的研究应用。
2 植物circRNAs的生物学功能
尽管研究证明circRNAs在真核生物中是普遍存在的,但其对生命体的功能在很大程度上仍不清楚。不过,越来越多的证据表明,circRNAs可能在各种生物过程中发挥重要的功能作用,如与miRNA、蛋白结合,参与转录及转录后调控等[31-34]。circRNAs具有的生物学功能如图2所示[23]。
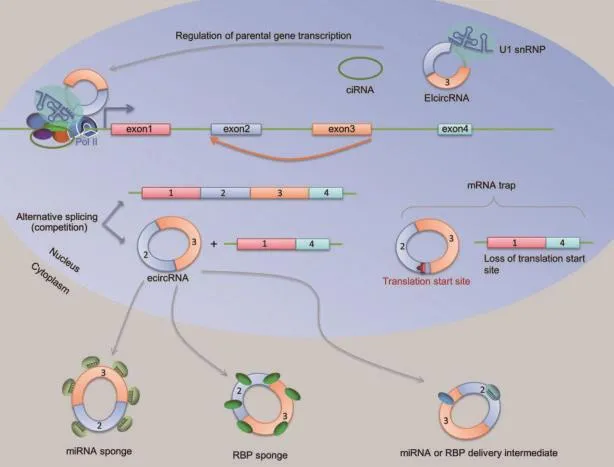
图2 circRNA的功能Fig.2 circRNA functions
2.1 作为miRNA的海绵
含有多个miRNA结合位点并抑制miRNA活性的转录本被称为miRNA海绵。根据之前的动物研究结果,circRNAs最显著的功能是充当miRNA海绵或参与miRNA相关通路来调控基因的表达[31,35-36]。虽然植物中的circRNAs大多不具有大量的miRNA结合位点,但也可以作为miRNA海绵,并通过结合miRNA来调节基因表达。Lu等[26]对水稻的研究表明,共有235个circRNAs具有miRNA结合位点,其中31个circRNAs具有两个或更多推定的miRNA结合位点。Zeng等[37]研究了枸橘早花突变体,与野生型相比,共发现176个差异表达的circRNAs,其中29个circRNAs可以作为16个miRNA的潜在靶标。Capelari等[27]在拟南芥花中鉴定了5个可能具有miRNA海绵功能的circRNAs,并通过PCR和测序技术对其中一个进行了验证。Zhou等[38]利用CRISPR-Cas9基因编辑工具获得水稻4种单个circRNA的无效突变体(null mutant),对4种无效突变体植株表型验证发现,突变体后代表现出耐盐性提高或者种子萌发后生长速度加快、幼苗叶绿素A/B含量较高等特点,通过构建circRNA-miRNA-mRNA调控网络,发现突变体通过结合一个重要的保守miRNA发挥了表型调控作用,结果表明,circRNA去除可以释放对应大量的miRNA,进而影响植株的性状。circRNAs通过与miRNA相互作用,发挥其在多种生物过程中的调控作用,包括代谢过程、发育过程、生殖过程、非生物和生物应激反应,这些功能可通过交联免疫沉淀和高通量测序做进一步验证[39]。
2.2 参与植物应激反应
研究表明,非编码RNA可直接与DNA、RNA和蛋白质相互作用,调控环境应答基因的表达[40-42]。植物circRNAs广泛参与包括病原入侵、干旱、寒冷、热、营养缺乏等生物胁迫和非生物胁迫应答过程。在植物circRNAs参与生物胁迫应答中,Wang等[43]研究感染了番茄黄叶卷曲病毒(TYLCV)的植株,在TYLCV感染的样本鉴定出83个特异性表达的circRNAs,其中约62%的circRNAs来源于蛋白质编码基因的外显子,并且发现这些circRNAs在TYLCV感染中起负调控作用以降低植株中病毒的积累。研究人员采用RNA测序技术,对接种过丁香假单胞菌的猕猴桃不同类群叶片的circRNAs进行了鉴定,共鉴定出584个差异表达的circRNAs,其中外显子和内含子circRNAs都与亲本蛋白编码基因显著正相关,而且与外显子circRNAs相比,内含子circRNAs是一类非常显著的亲本基因调控因子。研究还发现了一组与植物防御反应密切相关的circRNAs,表明circRNAs在植物免疫应答中发挥重要作用[21]。Xiang等[44]研究了棉花感染黄萎病后circRNAs的表达情况,在构建的黄萎病抗性植株与易感植株中共鉴定出了280个差异表达的circRNAs,这些差异表达的circRNAs中有247个可以找到其亲本基因,NCBI的保守域分析显示,13个具有非冗余亲本基因且与防御反应有关的circRNAs其亲本基因中有11个为NBS(nucleotide binding site)家族基因,并含有与抗病相关的NB-ARC结构域,因此推测NBS家族基因可能对棉花黄萎病具有一定的抗性,并且在棉花抗病过程中可能受到circRNAs的调控。
此外,circRNAs也广泛参与植物非生物胁迫反应,包括营养缺乏、强光、高温、寒冷、干旱或盐等。近年在该方向的研究报道较多。Wang等[45]对低温胁迫下大豆circRNAs进行了全基因组鉴定,研究结果表明,circRNAs在响应低温胁迫时表现出特定的表达模式。在鉴定出的749个circRNAs中,对照组(25℃)检测到451个,实验组(4℃)检测到546个,其中特异性表达的数量分别为203个和298个。另外,显著差异表达的13个circRNAs与亲本基因的表达水平呈显著正相关,这表明circRNAs可能通过顺式调控亲本基因在低温应答调控中发挥关键作用。通过GO(gene ontology)分类及KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析等绘制了gma_circ_0000569及gma_circ_0000741在冷胁迫下的调节网络示意图(图3)[45]。Liu等[46]鉴定了杨树在低氮胁迫下circRNAs的表达谱,其中163个(约6.5%)在低氮条件下显著差异表达,且其表达模式与其宿主蛋白编码基因之间存在正相关。同时,通过circRNA-microRNA-mRNA网络发现上调的 circRNA1006、circRNA1344、circRNA1941、circRNA901和circRNA146可通过miR5021成员介导使MYB61转录水平升高,这与低氮处理杨树木材中木质素浓度升高相对应。进一步证明circRNAs在调控杨树于低氮环境下的基因表达发挥了重要作用。番茄叶片在干旱、高温及二者共同胁迫下,与对照组相比,分别有4、7和9个circRNAs发生差异表达。这些circRNAs在光合作用、淀粉和蔗糖代谢、RNA转运、RNA降解等方面发挥作用[47]。同时,大豆在低磷[48]及干旱[49]、杜梨在干旱[20]、番茄在低温[50]及高温[51]、玉米和拟南芥在干旱等环境胁迫下其circRNAs也存在特异性的变化,且有过表达实验证实了circRNAs所具有的调控潜力[52],因此植物在非生物胁迫下通过调控circRNAs表达进一步影响宿主基因表达,可能是植物应对非生物胁迫的方式之一。表2列出了近年circRNAs在植物应激反应中的相关研究。

表2 circRNAs在植物应激反应中的研究(2017-2020)Table 2 Studies on plant circRNAs in responding to biotic or abiotic stresses(2017-2020)

图3 大豆circRNAs-gma_circ_0000569及gma_circ_0000741在冷胁迫下的调节网络Fig.3 Regulation network of circRNAs-gma_circ_0000569 and gma_circ_0000741 of soybean under cold stress
2.3 调控亲本基因表达
越来越多的研究表明circRNAs可通过影响其线性副本及调节其亲本基因的转录来参与基因表达调控[53]。Huang等[14]研究了在水稻剑叶衰老过程相关circRNAs的表达情况,通过加权基因共表达网络分析(WGCNA)发现,有6个连续下调表达的circRNAs,18个连续上调表达的circRNAs和15个转折点高表达的circRNAs与叶片衰老高度相关。此外,共有17个与衰老相关的circRNAs被预测具有亲本基因,其中3种circRNAs对其亲本基因的调控利用RT-qPCR得以验证。在拟南芥中,源于SEPALLATA3(SEP3)基因的circSEP3可以与其同源基因座紧密结合,并形成一个RNA∶DNA杂交产物,该产物导致转录暂停,并导致具有外显子跳跃性的选择性拼接SEP3 mRNA的形成,进而调控SEP3的表达。研究人员进一步利用转基因技术过表达SEP3基因第6外显子形成的1个circRNA,结果导致了花器官表现出更少的雄蕊和更多的花瓣,这与直接过表达SEP3.3(缺少外显子6)表型一致。进一步研究发现,来源于SEP3基因第6个外显子形成的circRNA可与其DNA 座形成R-loop结构,并增加可变剪接体SEP3.3的表达[54]。Xu等[16]对与小麦根系长度相关的circRNAs进行了研究,鉴定了10个与对照组根系显著差异表达的circRNAs,其中3个circRNAs具有多个推测的miRNA结合位点。通过实时荧光定量PCR进一步验证表明,具有结合miRNAs的8个circRNA中,有6个在长根小麦和短根小麦之间的表达水平存在显著差异。Tan等[55]在番茄中过表达来自八氢番茄红素合成酶1(PSY1)基因的circRNA,考查后代株系中果实颜色的变化情况,结果表明,过表达该circRNA后代果实有一定比例呈现了黄色,且黄色果实中的番茄红素和β-胡萝卜素的积累量均显著下降。同时,该转基因株系中PSY1的mRNA表达量也呈现下调趋势。这项研究表明过表达circRNA后,对应的线性mRNA表达量下调,可能是导致转基因株系出现异常表型的原因。
2.4 circRNAs作为生物标志物
circRNAs在植物不同组织细胞中普遍存在,且在不同的物种中具有进化保守性,并表现出特定的表达模式,同时具有的高稳定性、高丰度等特性,使其具有成为生物标志物的潜质。到目前为止,研究表明circRNAs已经与多种人类疾病相关,包括糖尿病[56-57]、神经系统疾病[58-59]、心血管疾病[60]、慢性炎症疾病[61-62]和癌症[63-64]等。同时,在多种癌症诊断[65-67]、癌症治疗效果监测[68-70]及预后评估[71-72]等方面有望成为癌症诊断和分子靶向治疗的新分子标志物。
在植物研究中,人们很早就开始探索生物标志物在植物育种中的应用潜能。如Yang等[73]研究了玉米在氮有限、氮充足以及氮匮乏过程中植株的转录反应,发现在玉米转录组中有约7%的转录组对氮反应敏感,进一步利用复合基因表达评分系统确定了可以定量地评估植物对不同氮条件响应的基因表达谱,这种独立于基因型、发育阶段、组织类型或环境的基因表达模式比表型观察更快速,对于缩短育种周期具有很大帮助。但是,植物研究中以circRNAs作为生物标志物目前处于起步阶段。Gao等[18]对一年生的葡萄枝条进行冷胁迫处理,考查了4℃条件下处理0、4、12 h样本circRNAs的表达情况。采用find_circ、CIRI及CIRCexplorer三种circRNA检测工具,在葡萄叶片中共鉴定出475个差异表达的circRNAs。对差异表达的circRNAs进行GO分类及KEGG注释发现,这些circRNAs的靶基因主要参与对寒冷的响应、光合作用、不饱和脂肪酸生物合成过程以及在光合系统II中参与光合电子传递。同时,该研究选取了一个来源于3-磷酸甘油酰基转移酶(ATS1)且表达量丰富的circRNA:VvcircATS1并在拟南芥中进行了过表达实验,结果发现,过表达植株在应对寒冷胁迫方面的能力明显增强,并且叶绿素含量也远高于对照组。进一步对拟南芥进行4℃处理24 h,测序结果表明该circRNA参与调控多个与耐寒性及刺激相关基因的miRNA的表达。该研究为阐明circRNAs如何调节植物冷应激反应及葡萄中circRNAs的生物学功能提供了参考。Zhang等[52]研究了玉米和拟南芥在干旱条件circRNAs的响应情况,研究发现大量与干旱相关的circRNAs宿主基因在干旱反应中呈现保守的或物种特异性。在玉米幼苗中,与编码钙依赖蛋白激酶和细胞分裂素氧化酶/脱氢酶基因有关circRNAs的表达水平与耐旱性密切相关,表明circRNAs在玉米干旱反应中发挥重要作用,或可能作为耐旱性玉米育种的生物标志物。同时,过表达circGORK(保卫细胞外向整流K+通道)的拟南芥植株对脱落酸敏感,但对干旱不敏感,表明circGORK在抗旱中发挥了积极作用。说明circRNAs可作为作物抗旱性遗传改良的有效生物标志物。
circRNAs作为植物生物标志物仍是一个新概念,但由于其半衰期长,不易降解,同时检测也具简便性和特异性,因此,未来有着广泛的应用前景。
3 总结与展望
近十年来,在人类疾病及动物研究方面,circRNAs的生物合成和分子功能研究取得了很大的进展,许多circRNAs的生物功能得以明确。circRNAs的表达通常与细胞类型、组织和发育阶段有关,而且在动物和植物中也具有胁迫诱导表达的特性,这表明circRNAs可能代表了转录后基因调控的一个新层面[74]。越来越多的研究已经证实circRNAs在真核生物中普遍存在,但是其形成机制、功能特性及相应的作用机制还有待进一步研究。未来植物circRNAs的研究可以从以下几个方面进一步开展:(1)circRNAs的功能研究。关于circRNAs最新的研究进展已经揭示其在生物学功能中的重要作用,但我们需要更多地了解circRNAs在植物生长发育、生物胁迫及非生物胁迫等过程中circRNAs的调节功能。现有的可用于circRNAs功能验证的方法,如构建circRNAs无效突变体、circRNAs过表达载体等,未来随着单细胞测序技术[75]、数字空间分析(Digital Spatial Profiling)[76]和牛津纳米孔测序技术(Oxford NanoporeMinION)[77-78]更多地应用于circRNAs定量及表征上,circRNAs的功能解析将取得更大的进展。(2)circRNAs的降解机制。目前对circRNAs的形成机制了解相对充分,但是circRNAs在生物体内是通过何种途径被降解的还不清楚。现有的降解组测序技术只适用于线性转录本,要想更清楚的解析circRNAs的降解机制,还需要开发更有针对性的方法。(3)circRNAs作为生物标志物的可行性验证及应用。在透彻了解circRNAs的基础上,明晰其作为生物标志物的可行性,将在作物育种、抗逆改良等方面发挥重要的作用。基于以上,在植物circRNAs领域还有许多需要探索和解析的问题,期待在众多研究者的不懈努力下,不久的将来取得更加有意义的研究发现。

