抑制上游转录因子2的表达对胃癌BGC-823细胞增殖和凋亡的影响
王绪斌,高慎硕,张智凯,马岩,郭晓波
0 引言
我国胃癌的发病率和病死率均处于较高水平[1-3]。胃癌的早期症状不明显,确诊时大多已经发展到晚期阶段。目前,胃癌的治疗手段主要是手术和放化疗,患者症状有所改善但总体生存率仍然不高。近年来,癌症基因层面的检测和治疗应用越来越广。上游转录因子2(upstream transcription factor 2,USF2)已被证实在多种肿瘤中发挥作用[4-5],本课题组前期的研究已经发现USF2在胃癌组织中高表达[6],但USF2基因是否参与胃癌细胞的增殖和凋亡尚不明确。本研究旨在分析USF2与胃癌细胞增殖和凋亡的关系,因此我们通过敲低胃癌细胞中USF2的表达,观察胃癌细胞增殖和凋亡的变化,为寻找胃癌诊疗的新思路提供依据。
1 材料与方法
1.1 材料
人胃癌细胞株GES-1、AGS、HGC-27、MKN-45、MGC-803、SGC-7901和BGC-823购自上海中国科学院生物化学与细胞生物学研究所。BGC-823细胞在RPMI1640完全培养液中常规培养,培养液中含10%胎牛血清。在温度37℃、含5%的CO2细胞培养箱中培养。RPMI1640培养基、胎牛血清和胰蛋白酶试剂购自美国Gibco公司;USF2 siRNA和阴性对照siRNA均购自上海吉满公司;PCR引物及试剂盒购自广州锐博公司,Lipofectamine™3000转染试剂和兔多克隆抗体(USF2)购自美国Invitrogen公司。兔抗人GAPDH抗体和二抗均购自武汉三鹰公司。
1.2 方法
1.2.1 细胞培养和siRNA转染 细胞在含有10%胎牛血清的RPMI 1640培养基中于37℃、5%CO2的条件下培养。当细胞融合度达到70%时,用1×PBS(pH7.4)洗涤,然后使用Lipofectamine™3000将siRNA-USF2、siRNA-NC分别转染至BGC-823细胞中,空白对照组不转染。实验分为空白对照组、siRNA-NC组和siRNA-USF2组,细胞转染72 h后收集细胞用于后续实验操作。
1.2.2 实时荧光定量PCR法检测USF2 mRNA的表达 细胞转染48 h后,使用TRIzol试剂提取细胞的总RNA,用紫外分光光度计测定RNA的浓度及纯度,使用反转录试剂盒将RNA反转录为cDNA,用cDNA进行PCR扩增检测mRNA的表达,β-actin用作内源对照。解链曲线用于评估非特异性扩增。实时荧光定量PCR反应程序如下:95℃持续30 s,95℃ 5 s和60℃ 30 s进行40个循环。使用2-ΔΔCt方法计算相对表达水平。引物序列如下:USF2:Forward-AAAGGAGGGATCCTGTCCAA,Reverse-CAGGGCGTTCTCATTCTTCA;β-actin:Forward-GCATCGTCACTGGGGAC,Reverse-ACCTGG CCGTCAGGCAGCTC。
1.2.3 Western blot检测USF2蛋白的表达 细胞转染72 h后,用冷PBS冲洗细胞两次。吸干水分后用RIPA裂解液裂解细胞获取细胞总蛋白,然后用BCA(bicinchoninic acid)蛋白质浓度测定试剂盒计算蛋白质浓度,使用10%聚丙烯酰胺凝胶通过SDS-PAGE分离蛋白质(每个样品30 μg)。蛋白质通过电泳按分子量分离,然后通过转膜转移到NC膜上。用快速封闭液封闭NC膜,再与适当的一抗(抗USF2,抗GADPH)在4℃孵育过夜,所有抗体均在4℃按说明书稀释。第二天将NC膜用TBST洗涤3次,每次5~10 min,然后在室温下与HRP连接的二抗共同孵育1 h。GADPH用作内部对照。通过Amersham Imager 680,用增强的化学发光方法对蛋白质条带进行曝光。
1.2.4 CCK-8实验检测细胞增殖能力 将上述转染24 h后的三组细胞以2×103个/孔接种于96孔板中,每组设3个复孔,置于37℃培养箱中继续培养,分别在24、48、72和96 h采用CCK-8法检测细胞的增殖能力,即在各时间点每孔分别加入10 μl CCK-8试剂,置于37℃细胞培养箱中孵育1 h,使用酶标仪检测波长在450 nm处的光密度值,细胞增殖活性=实验组光密度值-空白组光密度值。
1.2.5 平板克隆实验检测细胞克隆形成能力 将上述转染24 h后的三组细胞以每个培养皿1 000个的密度重新铺板,每组设3个平皿。每3天更换一次培养基。培养14天后弃培养基,PBS洗涤细胞,4%多聚甲醛固定20 min,1%结晶紫染色20 min,冲洗干净后以进行可视化和计数,比较克隆形成率。
1.2.6 流式细胞术检测细胞凋亡率 将上述转染24 h后的三组细胞常规消化后,用冷PBS洗涤细胞,然后离心收集细胞,重复1次,用1 ml的结合缓冲液重悬细胞,分别添加5 μl Annexin V-FITC和10 μl PI,轻轻摇匀细胞,室温(25℃)避光孵育15 min,然后每管再加入4 ml结合缓冲液,立即上流式细胞仪检测。分析各组细胞的凋亡率。
1.3 统计学方法
所有实验独立重复3次。结果用平均值±标准误差平均值(SEM)表示。使用SPSS19.0软件执行两个独立的样本t检验或方差单向分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌细胞系和GES-1细胞中USF2 mRNA的表达
实时荧光定量PCR法检测结果示,USF2 mRNA在各组细胞中的表达,见图1。与GES-1细胞相比较,各组胃癌细胞系中USF2 mRNA的表达均升高(P值分别为0.1514,0.1206,0.0694,0.0230,0.0015,0.0001)。因此我们选择表达最高的BGC-823细胞敲低后进行后续实验。
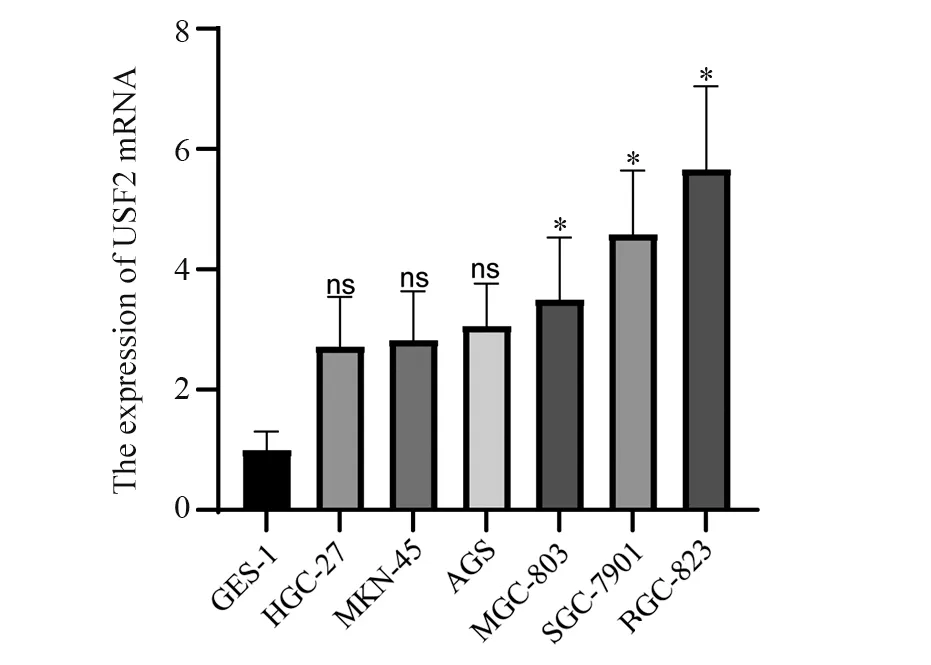
图1 胃癌细胞系和GES-1细胞USF2 mRNA的表达Figure 1 USF2 mRNA expression in gastric cancer cell lines and GES-1 cells
2.2 各组BGC-823细胞中USF2 mRNA和蛋白的表达水平比较
BGC-823细胞转染USF2 siRNA 48 h后,实时荧光定量PCR法检测结果示,空白对照组、siRNA-NC组和siRNA-USF2组BGC-823细胞中USF2 mRNA的表达水平分别为1.00±0.07、0.96±0.00和0.44±0.09,siRNA-USF2组BGC-823细胞中USF2 mRNA的表达水平明显降低,与空白对照组和siRNA-NC组相比差异具有统计学意义(P=0.0001、0.0002)。BGC-823细胞转染USF2 siRNA 72 h后,Western blot法检测结果示,空白对照组、siRNANC组和siRNA-USF2组BGC-823细胞中USF2蛋白的表达水平分别为0.25±0.01、0.26±0.00和0.08±0.00,siRNA-USF2组BGC-823细胞中USF2蛋白的表达水平明显降低,与空白对照组和siRNA-NC组相比差异具有统计学意义(均P<0.0001),见图2。
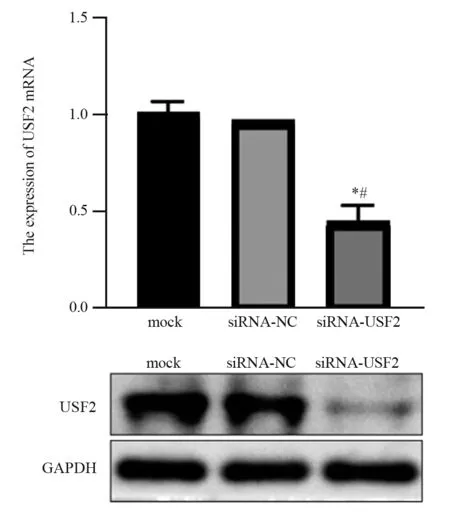
图2 各组BGC-823细胞中USF2 mRNA和蛋白的表达水平Figure 2 The mRNA and protein expression levels of USF2 in BGC-823 cells
2.3 各组BGC-823细胞的增殖和克隆形成能力比较
CCK-8检测结果显示,与空白对照组和siRNA-NC组相比,siRNA-USF2组BGC-823细胞在第1、2、3和4天时的吸光度值均明显降低(第1天:P=0.1224、0.0559;第2天:均P<0.0001;第3天:均P<0.0001;第4天:P=0.0001、<0.0001),见表1、图3。平板克隆实验结果显示,空白对照组、siRNA-NC组和siRNA-USF2组的克隆形成数分别是81.67±10.02、85.67±9.30和38.00±6.25个。siRNA-USF2组BGC-823细胞的克隆数明显减少,与空白对照组和siRNA-NC组相比差异均具有统计学意义(P=0.0020、0.0013),见图4。
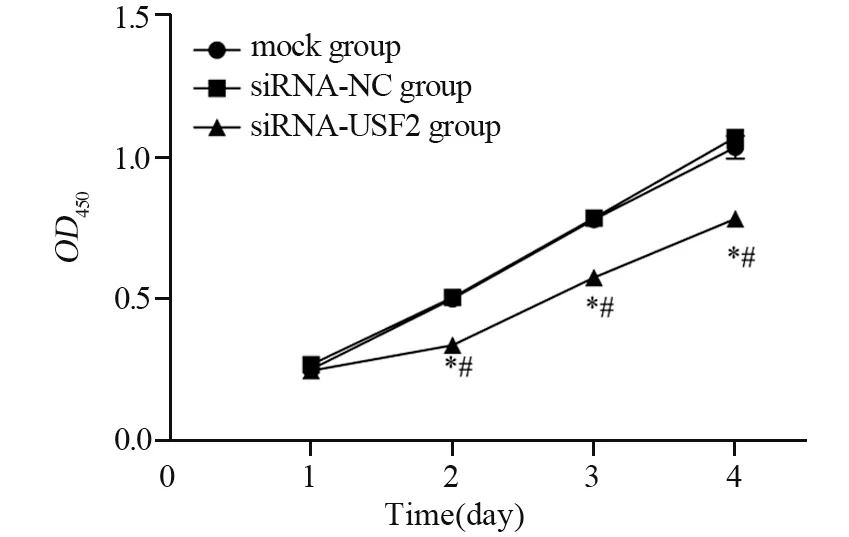
图3 CCK-8法检测各组胃癌BGC-823细胞的增殖能力Figure 3 Proliferation of BGC-823 cells in each group detected by CCK-8 method
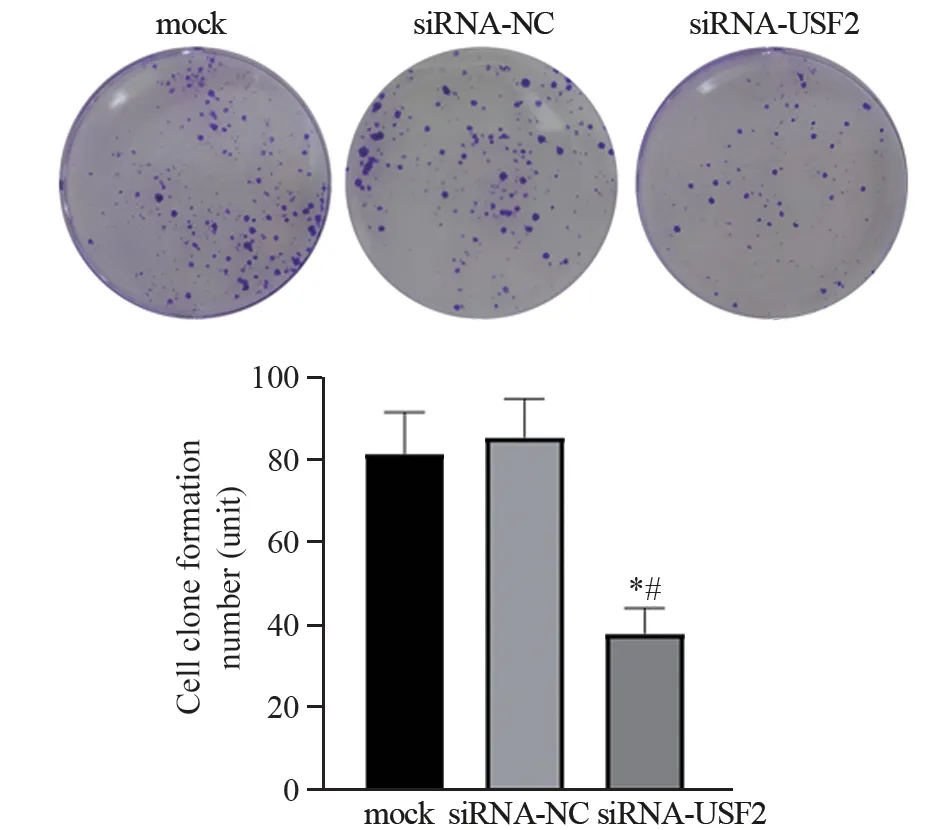
图4 平板克隆形成实验检测各组BGC-823细胞的克隆形成能力Figure 4 Clonogenesis ability of BGC-823 cells in each group detected by plate clonogenesis assay
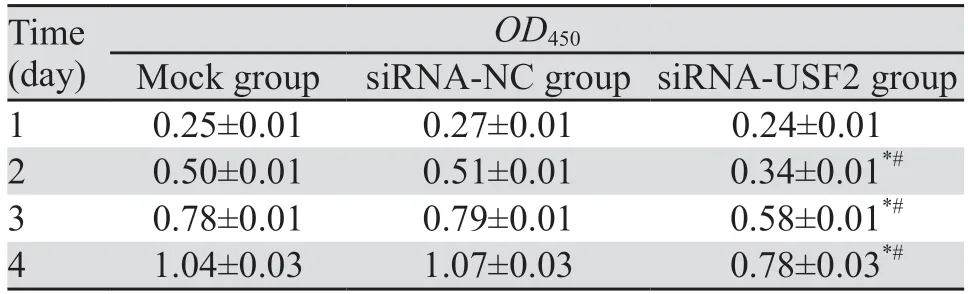
表1 不同时间点各组胃癌BGC-823细胞的增殖活性Table 1 Proliferation activity of BGC-823 cells at different time points in each group
2.4 各组BGC-823细胞的凋亡率比较
流式细胞术实验显示,空白对照组、siRNANC组和siRNA-USF2组的BGC-823细胞凋亡率分别是(3.67±1.58)%、(2.87±0.15)%和(11.27±0.65)%。siRNA-USF2组BGC-823细胞的凋亡率明显升高,与空白对照组和siRNANC组相比差异均具有统计学意义(P=0.0002、P=0.0001),见图5。

图5 USF2 siRNA对胃癌BGC-823细胞凋亡率的影响Figure 5 Effect of USF2 siRNA on apoptosis rate of gastric cancer BGC-823 cells
2.5 各组BGC-823细胞的PCNA、Bax和Bcl-2蛋白的表达水平比较
Western blot法检测显示,空白对照组、siRNA-NC组和siRNA-USF2组PCNA蛋白的表达量分别为1.30±0.25、1.21±0.14和0.86±0.10,siRNA-USF2组PCNA表达量明显降低,与空白对照组和siRNA-NC组相比差异均具有统计学意义(P=0.0487、P=0.0456)。空白对照组、siRNANC组和siRNA-USF2组Bax蛋白的表达量分别是1.10±0.00、0.10±0.00和0.18±0.00,siRNA-USF2组Bax蛋白的表达量明显升高,与空白对照组和siRNA-NC组相比差异均具有统计学意义(均P<0.0001);空白对照组、siRNA-NC组和siRNAUSF2组Bcl-2蛋白的表达量分别是0.68±0.13、0.68±0.13和0.18±0.24,siRNA-USF2组Bcl-2蛋白的表达量明显下降,与空白对照组和siRNA-NC组相比差异均具有统计学意义(均P<0.0001),见图6。
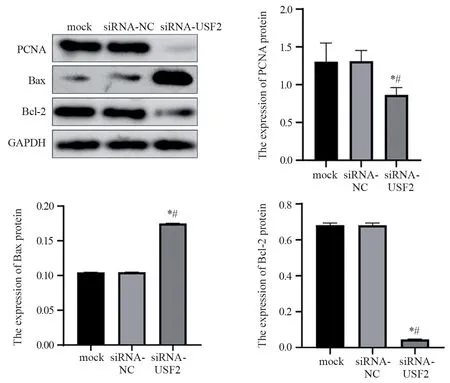
图6 Western blot法检测各组胃癌BGC-823细胞中PCNA、Bax和Bcl-2蛋白的表达水平Figure 6 Expression levels of PCNA,Bax and Bcl-2 proteins in GC BGC-823 cells of each group detected by Western blot
3 讨论
胃癌是常见的消化系统恶性肿瘤之一,在我国癌症发病率中居第六位,致死率高居第二位,严重影响着人们的健康生活和生命安全[1-3]。目前胃癌的治疗仍以手术和放化疗为主。随着胃癌分子分型及发病机制研究的不断进展,胃癌治疗也逐渐进入靶向治疗、精准医疗及免疫治疗的新时代,基因靶向治疗的发展为临床提供了新思路。通过靶向抑制胃癌促癌基因或上调抑癌基因的表达,探讨其对胃癌细胞增殖、迁移和侵袭、凋亡等生物学特性的影响,已经成为了胃癌基因治疗研究的主要思路。人上游转录因子最初是从HeLa细胞中提取获得的两个表观分子量分别为43和44 kDa的USF多肽,分别称为USF1和USF2[6-8]。USF2是由异二聚体和重叠基因编码的碱性螺旋-环-螺旋转录因子。剪接产生的同型在特定的启动子环境中表现出不同的转录活性。尽管人们普遍认为不同组织中USF2的表达和相对丰度不同,但它在组织中与其他因子协同作用,并具有刺激特异性转录的调控作用[9-10]。USF2是一个蛋白编码基因,编码一个亮氨酸拉链转录因子家族的成员,编码的蛋白质可以通过富含嘧啶的启动子(Inr)元件和E-box基序激活转录,参与调节多种细胞过程。
已有研究表明,USF2在肺癌、前列腺癌、乳腺癌和结直肠癌的发展中起着重要作用[4-5,11-17]。USF2与胃癌的关系尚不明确。本研究检测了USF2在不同胃癌细胞系和GES-1细胞中的表达,发现USF2在胃癌细胞系中的表达均高于GES-1细胞系,并选择将表达最高的BGC-823细胞敲低后进行后续实验。将USF2 siRNA转染至BGC-823细胞中,通过实时荧光定量PCR法和Western blot实验检验转染效果,显示转染后USF2 mRNA和蛋白的表达均明显下降,说明转染USF2 siRNA能够成功抑制BGC-823细胞中USF2的表达。抑制USF2的表达后,CCK-8实验和平板克隆实验结果均显示,BGC-823细胞的增殖能力和克隆形成能力明显减弱。流式细胞术检测显示,BGC-823细胞的凋亡率明显增加。这些结果说明USF2 siRNA能明显抑制胃癌BGC-823细胞的增殖,诱导细胞凋亡。
PCNA为DNA聚合酶的辅助蛋白,与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的良好指标。本研究发现,抑制BGC-823细胞中USF2的表达后,PCNA的表达水平明显降低,说明BGC-823细胞的增殖能力受到抑制。促凋亡蛋白Bax和抗凋亡蛋白Bcl-2是Bcl-2蛋白家族成员,Bax可以通过介导细胞膜的通透性来促进细胞色素C的释放,启动细胞凋亡级联反应。Bcl-2的功能则刚好相反,其抑制细胞色素C的释放,阻止细胞凋亡的级联反应。Bax和Bcl-2的比例决定细胞凋亡的启动与否。本研究Western blot实验结果表明,抑制USF2表达后,Bax的表达水平明显升高,Bcl-2的表达水平明显降低,提示BGC-823细胞的凋亡增加。这些结果表明USF2 siRNA能够抑制胃癌BGC-823细胞的增殖,诱导细胞凋亡,与下调细胞中PCNA和Bcl-2蛋白以及促进Bax蛋白的表达有关。
综上所述,转染USF2 siRNA抑制USF2的表达后,人胃癌BGC-823细胞的增殖受到抑制,凋亡增多,这一过程可能与下调细胞中PCNA和Bcl-2蛋白以及促进Bax蛋白的表达相关。本研究表明USF2在胃癌的增殖和凋亡中发挥重要作用,为胃癌的基因治疗提供了新的思路和靶点。

