miR-101-3p在胃癌中的表达及其靶向STC-1基因调控PI3K/AKT信号通路对癌细胞侵袭转移和血管生成的影响
刘强,孙少明,王文俊
0 引言
胃癌是常见的消化道癌症,具有发病隐匿、发展迅速、恶性程度高及预后较差等特点,且发病趋于年轻化,因此及早对胃癌进行诊断,实施早期干预,是改善胃癌患者预后的关键。目前临床上通常采用胃镜、病理活检及肿瘤标志物癌胚抗原等对胃癌进行筛查,但以上方法均具有一定的局限性,因此寻找新型的胃癌早期诊断标志物尤为重要。微小RNA(miRNA)在多种肿瘤中表达异常,通过调控肿瘤细胞的增殖、迁移、侵袭以及凋亡等过程,参与肿瘤的发生发展,在肿瘤的早期诊断、预后预测及防治中具有潜在重要价值。有研究表明[1],miR-101-3p在胃癌组织中呈低表达,与胃癌黏膜下浸润及患者预后相关,可能参与了胃癌的发生发展。随后Xu等[2]也发现胃癌组织中miR-101-3p水平较低,同时miR-101-3p能抑制癌细胞增殖,增强对5-氟尿嘧啶的化学敏感度,且另有研究表明miR-101-3p能抑制胃癌细胞的存活和转移[3]。以上研究结果提示miR-101-3p可能抑制胃癌的恶性进展。斯钙素1(stanniocalcin 1,STC-1)是一种糖蛋白激素,在多种肿瘤组织中高表达,与癌细胞增殖、侵袭、凋亡和血管生成等密切相关[4]。近年来研究显示STC-1在胃癌患者癌组织和外周血中高表达,且与胃癌增殖和转移有关[5]。然而miR-101-3p和STC-1是否存在关联以及两者对胃癌的作用机制尚不清楚。因此,本研究拟探讨miR-101-3p与STC-1的关系,对PI3K/AKT信号通路和对胃癌BGC-823细胞侵袭转移和血管生成的影响,以期为胃癌的临床靶向治疗提供理论依据。
1 资料与方法
1.1 病例资料
选择80例2019年1月到2020年10月在大连大学附属中山医院急腹症外科诊治的80例胃癌患者为胃癌组,其中男47例,女33例,年龄为35~79岁。收集患者的病历资料及手术切除的胃癌组织标本。采集的标本保存于液氮(-196℃)中。一般临床资料包括患者年龄、肿瘤位置、肿瘤大小、TNM分期、淋巴结转移、分化程度等信息。纳入标准:(1)经胃镜和病理组织学确诊为胃癌;(2)无其他重大疾病者。排除标准:(1)癌旁组织有明显的炎性反应细胞浸润;(2)胃溃疡、胃糜烂者;(3)其他恶性肿瘤者。另外选取40例健康体检者为对照组,年龄34~75岁。各组年龄差异无统计学意义(t=0.767,P=0.445),具有可比性。所有患者均签署知情同意书,本研究已获得大连大学附属中山医院伦理委员会批准(K2018021)。
1.2 研究材料
正常胃黏膜上皮细胞株GES-1(上海沪震生物科技有限公司);胃癌细胞株BGC-823(上海博研生物科技有限公司);BALB/c雌性裸鼠(斯贝福(北京)生物技术有限公司,使用许可证号:SYXK(京)2019-0030));RPMI1640培养液、胰蛋白酶(美国Gibco公司);胎牛血清(中国四季青生物公司);NC mimic、miR-101-3p mimic、pcDNA-STC-1、pcDNA-NC质粒(上海生物工程有限公司);LipofectamineTM2000转染试剂盒(美国Invitrogen公司);miR-101-3p、STC-1、U6、GAPDH引物(上海华大基因科技有限公司);BCA试剂盒、ECL显影剂(中国碧云天公司);STC-1、PI3K、p-PI3K、AKT、p-AKT(美国Abcam公司);MMP-2、MMP-9、血管内皮生长因子(VEGF)、血管生成素2(Ang2)抗体(美国CST公司);二抗(北京博尔西科技有限公司);Thermo酶标仪(上海热电仪器有限公司);冷冻离心机(美国Beckman公司);Bio-Rad蛋白电泳仪、转膜仪、凝胶成像仪(美国伯乐公司)。
1.3 方法
1.3.1 细胞培养与分组 细胞培养[6]:BGC-823细胞株用含10%胎牛血清的RPMI1640培养基,在37℃、5%CO2条件下常规培养。每2天更换新鲜培养基,当细胞密度达到80%时,用胰蛋白酶进行消化并传代。
细胞分组[7]:将BGC-823细胞分为对照组、miR-NC组(转染NC mimic的细胞)、miR-101-3p组、pcDNA-NC组、STC-1组、miR-101-3p+pcDNA-NC组、miR-101-3p+STC-1组。根据LipofectamineTM2000说明书,将100 μl质粒终浓度为100 nmol/L的LipofectamineTM2000混合溶液加入各组BGC-823细胞。对照组仅加入LipofectamineTM2000溶液。转染4 h后更换培养基,24 h后通过qRT-PCR及Western blot检测是否转染成功。
1.3.2 在线生物数据库分析 使用GEPIA数据库分析STC-1在正常胃组织和胃癌组织中的表达水平及对患者预后生存期的影响。
1.3.3 靶基因预测及双荧光素酶实验 使用生物信息学数据库TargetScanHuman预测miR-101-3p的相关靶基因,发现STC-1基因可能是miR-101-3p的靶基因。以STC-1质粒为载体,分别构建野生型3’UTR(STC-1 3’UTR-WT)和突变型3’UTR(STC-1 3’UTR-MUT)质粒。将两种质粒分别与NC mimic、miR-101-3p mimic混合,通过LipofectamineTM2000分别共转染至细胞,转染48 h后,收集各组细胞制备细胞裂解物,按试剂盒要求检测荧光素酶活性。
1.3.4 qRT-PCR检测胃癌组织及细胞中miR-101-3p和STC-1 mRNA的表达 采用Trizol试剂从胃癌组织和细胞中提取总RNA。使用反转录试剂盒将RNA反转录为cDNA,并使用SYBR Green法进行扩增,U6作内参。反应条件:95℃预变性5 min,95℃ 60 s,60℃ 40 s,共40个循环。使用2-ΔΔCT公式计算miR-101-3p、STC-1 mRNA的相对表达水平。PCR引物序列:miR-101-3p-F:5’-ATGCAAGUCAAUAGUGUCAUG-3’,miR-101-3p-R:5’-GTGCAGGGTCCGAGGT-3’。U6-F:5’-CTCGCTTCGGCAGCACA-3’,U6-R:5’-AACGCTTCACGAATTTGCGT-3’。STC-1-F:5’-TTCTGGTGCTGGTGATCAGTG-3’,STC-1-R:5’-TTTGGGCACAGTGGTATGTCT-3’。GAPDH-F:5’-GAAGGTGAAGGTCGGAGT-3’,GAPDH-R:5’-GAAGATGGTGATGGGATTTC。
1.3.5 划痕实验检测细胞迁移能力 将BGC-823细胞接种于6孔板,细胞分组及培养条件同1.3.1。细胞培养48 h后进行胰酶消化,后接种于新6孔板中,每组设3个复孔,当细胞呈现单壁生长时,使用200 μl移液器枪头划痕,PBS洗去脱落的细胞,加入无血清培养液,显微镜下观察并记录划痕宽度。继续培养24 h后,显微镜下再次观察记录划痕宽度。细胞划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,用细胞划痕愈合率表示细胞迁移率。
1.3.6 Transwell小室实验检测细胞侵袭能力 在Transwell小室平板平铺一层Matrigel基质胶(约50 μl),并将无血清培养基中的各组单细胞悬液加至上室,在下室平铺含有10%胎牛血清的RPMI1640培养基,置入37℃、5%CO2培养箱中培养24 h,PBS清洗后,甲醛固定,结晶紫染色后,显微镜下观察并对穿膜细胞进行统计计数。
1.3.7 Matrigel体外成管实验检测细胞的血管生成能力 96孔板每孔铺50 μl Matrigel基质胶,待Matrigel胶凝固,以每毫升1×104个的密度将各组BGC-823细胞接种于96孔板培养24 h,每孔设3个复孔,于倒置显微镜(100×)下观察细胞血管生成情况并拍照。
1.3.8 Western blot法检测STC-1、PI3K/p-PI3K、AKT/p-AKT、MMP-2、MMP-9、VEGF和Ang2的表达 BGC-823细胞加入细胞裂解液,离心所得的上清液即为蛋白样品。用BCA蛋白检测试剂盒测定各组蛋白浓度,蛋白定量变性后进行SDS-PAGE电泳分离蛋白,电泳后迅速转至PVDF膜上,放入含5%脱脂牛奶TBST溶液中室温封闭2 h,分别加入对应一抗STC-1、PI3K、p-PI3K、AKT、p-AKT、MMP-2、MMP-9、VEGF、Ang2(浓度为1:2 000)4℃过夜。TBST洗涤3次后,加入二抗(浓度为1:10 000)室温孵育2 h,最后避光下加入ECL显色剂显色,Bio-Rad凝胶成像仪记录蛋白灰度并拍照,以GAPDH作为对照,对各组蛋白进行相对定量分析。
1.3.9 裸鼠致瘤实验[8]将40只裸鼠随机平均分为5组,在裸鼠右肩背部皮下分别注射0.2 ml 1×107/ml接种慢病毒的BGC-823细胞悬液:对照组(注射未处理的细胞)、miR-NC组(注射感染miR-NC慢病毒质粒的细胞)、miR-101-3p组(注射感染miR-101-3p过表达慢病毒质粒的细胞)、pcDNA-NC组(注射感染对照慢病毒质粒的细胞)、STC-1组(注射感染STC-1过表达慢病毒质粒的细胞)。正常饲养,观察裸鼠皮下成瘤情况。第30天处死裸鼠,完整取出皮下肿瘤称重并测量体积。实验过程中做到了减少、替代、优化的3R原则,实验开展前获得实验动物伦理委员会审批(IACUC-20180513)。
1.4 统计学方法
2 结果
2.1 miR-101-3p和STC-1在胃癌组织中的表达
胃癌组织中STC-1表达水平明显高于正常组织,且STC-1高表达的患者生存期短(P<0.05),见图1。Western blot结果显示,与正常胃组织(1.65±0.52)相比,胃癌组织中miR-101-3p mRNA的表达量(1.12±0.36)明显降低(t=11.312,P=0.000),STC-1 mRNA的表达量明显升高(0.94±0.28vs.3.47±1.05,t=32.260,P=0.000),且两者呈负相关(r=-0.835,P<0.001)。
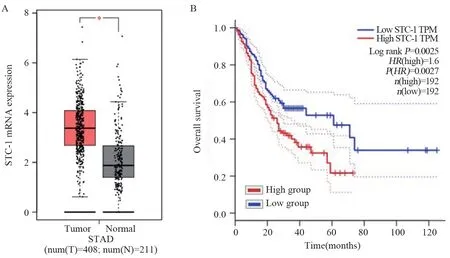
图1 STC-1在胃癌组织中的表达Figure 1 Expression of STC-1 in gastric cancer tissues
2.2 miR-101-3p表达水平与胃癌患者临床病理因素的关系
为了验证miR-101-3p在胃癌发生、发展过程中的作用,将80例患者按照miR-101-3p相对表达量分为低表达组(24例)、高表达组(56例)。结果显示,miR-101-3p的表达水平与年龄、性别、肿瘤位置、肿瘤直径无显著相关性(P>0.05),而与肿瘤分化程度、TNM分期、淋巴结转移有显著相关性,见表1。
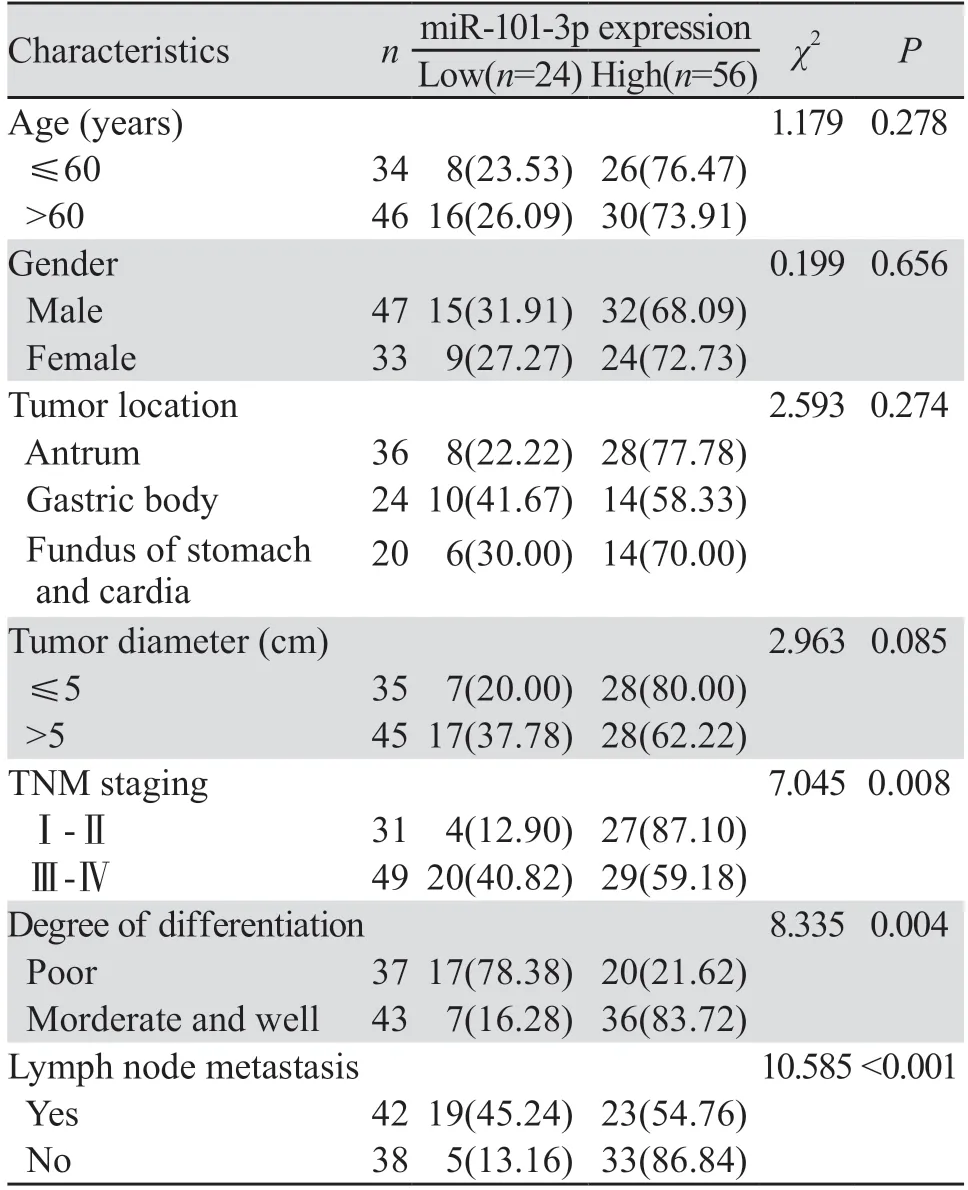
表1 miR-101-3p表达水平与胃癌患者临床病理因素的关系(n(%))Table 1 Relationship between the expression level of miR-101-3p and the clinicopathological factors of gastric cancer patients (n(%))
2.3 miR-101-3p靶向抑制STC-1
TargetScanHuman在线数据库筛选出STC-1作为miR-101-3p的靶基因,miR-101-3p与STC-1在3’UTR区存在结合位点,见图2A。荧光素酶报告基因实验结果表明miR-101-3p对野生型STC-1表达有明显下调作用(t=46.965,P=0.000),而对突变型没有明显作用,说明miR-101-3p直接靶向作用于野生型STC-1,见图2B。同时,qRTPCR检测发现,与miR-NC组相比,miR-101-3p组miR-101-3p mRNA表达上调、STC-1 mRNA表达量下调(t=55.213,P=0.000;t=8.392,P=0.000);与pcDNA-NC组相比,STC-1组中miR-101-3p mRNA表达下调,STC-1 mRNA表达量上调(t=6.889,P=0.002;t=49.263,P=0.000);与miR-101-3p+pcDNA-NC组相比,miR-101-3p+STC-1组中miR-101-3p mRNA表达下调,STC-1 mRNA水平上调(t=41.256,P=0.000;t=14.781,P=0.000),说明过表达miR-101-3p靶向抑制了STC-1的表达,见图2C~D。
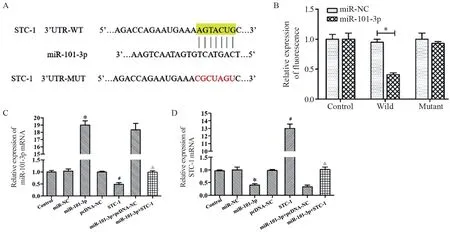
图2 miR-101-3p靶向作用STC-1Figure 2 miR-101-3p targets STC-1
2.4 miR-101-3p过表达靶向调控STC-1抑制胃癌细胞BGC-823的侵袭转移
与miR-NC组相比,miR-101-3p组划痕变宽,愈合率降低,细胞侵袭数减少,MMP-2和MMP-9蛋白表达降低(t=9.535,P=0.000;t=8.947,P=0.000);与pcDNA-NC组相比,STC-1组划痕变窄,愈合率提高,细胞侵袭数增多,MMP-2和MMP-9蛋白表达升高(t=65.327,P=0.000;t=57.630,P=0.000);与miR-101-3p+pcDNA-NC组相比,miR-101-3p+STC-1组划痕变窄,愈合率提高,细胞侵袭数增多,MMP-2和MMP-9蛋白表达升高(t=10.026,P=0.000;t=11.233,P=0.000),见图3。说明过表达miR-101-3p靶向STC-1抑制胃癌细胞BGC-823的侵袭转移。

图3 miR-101-3p过表达靶向调控STC-1对胃癌细胞BGC-823侵袭转移的影响Figure 3 Effect of miR-101-3p overexpression and targeted regulation of STC-1 on the invasion and metastasis of gastric cancer cell line BGC-823
2.5 miR-101-3p过表达靶向调控STC-1抑制胃癌细胞BGC-823的血管生成
与miR-NC组相比,miR-101-3p组管腔结构明显减少,VEGF、Ang2表达下调(t=7.535,P=0.000;t=9.667,P=0.000);与pcDNA-NC组相比,STC-1组基本形成了完整的闭合管腔结构,环形结构组成了蜂窝状,VEGF、Ang2表达上调(t=31.205,P=0.000;t=28.569,P=0.000);与miR-101-3p+pcDNA-NC组相比,miR-101-3p+STC-1组管腔结构明显增加,VEGF、Ang2表达上调(t=7.895,P=0.000;t=10.214,P=0.000),见图4。说明过表达miR-101-3p靶向STC-1能抑制胃癌细胞BGC-823的血管生成。
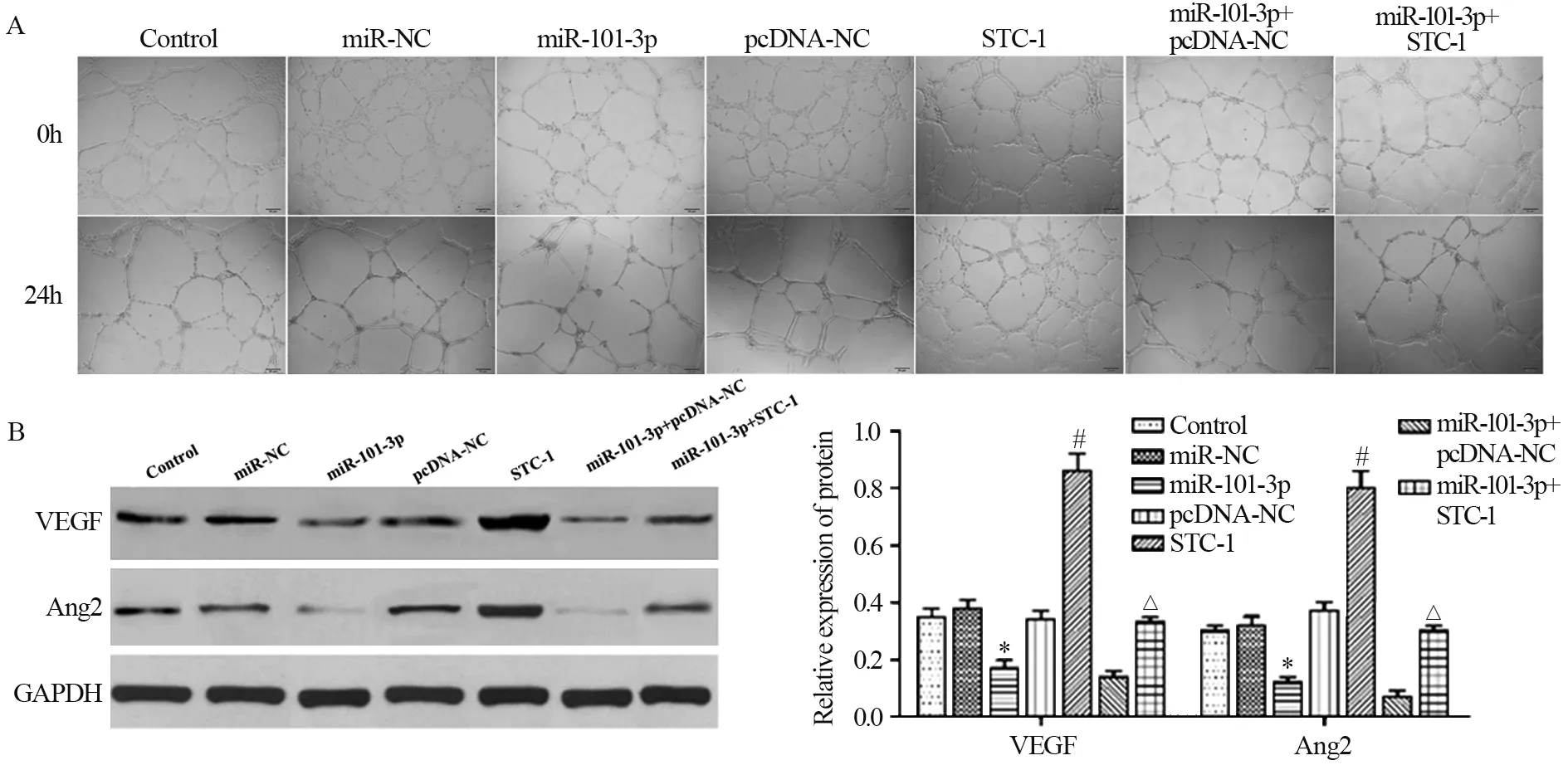
图4 miR-101-3p过表达靶向调控STC-1对胃癌细胞BGC-823血管生成的影响Figure 4 Effect of miR-101-3p overexpression and targeted regulation of STC-1 on the angiogenesis of gastric cancer cell line BGC-823
2.6 miR-101-3p过表达靶向调控STC-1抑制胃癌细胞BGC-823 PI3K/AKT信号通路
与miR-NC组相比,miR-101-3p组p-PI3K/PI3K、p-AKT/AKT表达下调(t=12.010,P=0.000;t=14.630,P=0.000);与pcDNA-NC组相比,STC-1组p-PI3K/PI3K、p-AKT/AKT表达上调(t=28.539,P=0.000;t=29.077,P=0.000);与miR-101-3p+pcDNA-NC组相比,miR-101-3p+STC-1组p-PI3K/PI3K、p-AKT/AKT表达上调(t=11.096,P=0.000;t=12.127,P=0.000),见图5。说明过表达miR-101-3p调控STC-1抑制胃癌细胞BGC-823 PI3K/AKT信号通路。

图5 miR-101-3p过表达靶向调控STC-1对胃癌细胞BGC-823 PI3K/AKT信号通路的影响Figure 5 Effect of miR-101-3p overexpression and targeted regulation of STC-1 on the PI3K/AKT signaling pathway in gastric cancer cell line BGC-823
2.7 miR-101-3p过表达抑制裸鼠体内移植瘤生长
与miR-NC组相比,miR-101-3p组肿瘤体积、质量下降(t=7.329,P=0.000;t=6.329,P=0.002);与pcDNA-NC组相比,STC-1组肿瘤体积、质量增加(t=22.541,P=0.000;t=25.794,P=0.000),见图6。说明miR-101-3p抑制体内肿瘤生长,与体外实验结果一致。
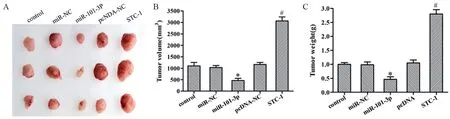
图6 miR-101-3p过表达对裸鼠体内移植瘤生长的影响Figure 6 Effect of miR-101-3p overexpression on the growth of transplanted tumor in nude mice
3 讨论
miRNAs作为致癌基因或抑癌基因,能够调控肿瘤的发生、转移和凋亡等进程。其中miR-101-3p是miRNA101家族成员,为抑癌基因,可调控靶基因表达,参与多种肿瘤的增殖、侵袭转移和血管生成等生物学行为。Wang等[9]发现过表达miR-101-3p可消除长链非编码RNA核仁小分子RNA宿主基因6,从而抑制胆管癌细胞增殖、迁移和血管生成。Lu等[10]发现下调miR-101-3p的表达可抑制胃癌细胞的侵袭和转移,提示miR-101-3p高表达与胃癌进展有关。Cao等[11]发现胃癌细胞中miR-101-3p通过抑制AMP依赖的蛋白激酶途径抑制胃癌进展,但miR-101-3p是否调控胃癌血管生成鲜有报道。本研究发现miR-101-3p在胃癌组织及胃癌细胞BGC-823中低表达,其表达水平与肿瘤分化程度、TNM分期、淋巴结转移有显著相关性。细胞实验显示,过表达miR-101-3p可抑制BGC-823细胞的侵袭转移和血管生成,抑制体内移植瘤的发展,提示miR-101-3p在胃癌细胞中发挥抑癌作用。
STC-1参与组织和器官的生长、分化和发育,在胃癌组织和细胞中呈高表达,发挥促癌基因作用[12]。Arigami等[13]发现STC-1 mRNA在胃癌组织和细胞中高表达,其表达与肿瘤浸润深度和肿瘤分期显著相关,可用于预测肿瘤侵袭性。He等[14]发现STC-1在体内外均能促进血管生成,其通过调控细胞外调节蛋白激酶1/2促进VEGF表达,进而促进胃肿瘤生长。本研究通过GEPIA数据库发现胃癌组织中STC-1表达水平升高,且预后较差,同时发现STC-1在胃癌组织中的表达量上调,TargetScanHuman数据库预测miR-101-3p与STC-1具有结合位点,且双荧光素酶报告实验、qRT-PCR及Western blot实验显示miR-101-3p可靶向负调控STC-1。进一步实验表明,高表达STC-1可部分逆转miR-101-3p对BGC-823细胞迁移、侵袭和血管生成的影响,说明miR-101-3p和STC-1在胃癌中存在调控关系,miR-101-3p表达可能与胃癌进展相关。
PI3K/AKT信号通路不仅调节肿瘤细胞的增殖和存活,而且与肿瘤的血管新生、侵袭转移密切相关[15]。MMP在肿瘤细胞突破基底膜屏障而浸润转移中起重要作用,MMP-2、MMP-9在许多肿瘤组织中呈高表达[16]。血管新生是恶性肿瘤发生、发展的重要条件,不仅原发肿瘤依赖于血管形成,而且其在肿瘤的生长和转移中也发挥重要作用[17]。在血管生成过程中,需要多种细胞因子共同调节。其中VEGF对血管内皮细胞具有较强的亲和作用,能够诱导内皮细胞的增殖、迁移,促进机体血管形成。Ang2是一种新型的调节血管生成的蛋白,主要参与内皮细胞的稳定、血管及肌肉纤维化进程,其过度表达促进肿瘤的生长和血管化。Shu等[18]发现支链氨基酸转移酶1(BCAT1)通过激活PI3K/AKT/mTOR通路促进胃癌细胞的增殖、侵袭和血管生成。Wu等[19]发现芥花内酯通过PI3K/AKT信号通路降低MMP-2、MMP-9活性,进一步抑制了胃癌细胞的侵袭和迁移。Mahfouz等[20]发现端粒酶抑制剂BIBR-1232和贝伐单抗通过抑制PI3K/AKT/mTOR通路降低胃癌细胞VEGF的表达和分泌,从而减轻胃癌细胞血管生成能力。本研究中过表达miR-101-3p后MMP-2、MMP-9、VEGF、Ang2、p-PI3K/PI3K和p-AKT/AKT表达降低,而过表达STC-1可逆转此效应。说明miR-101-3p和STC-1通过调控PI3K/AKT信号通路调节胃癌细胞的侵袭转移和血管生成,由此我们推断过表达miR-101-3p靶向STC-1基因能够抑制癌细胞的侵袭转移和血管生成,其机制可能与抑制PI3K/AKT信号通路有关,见图7。
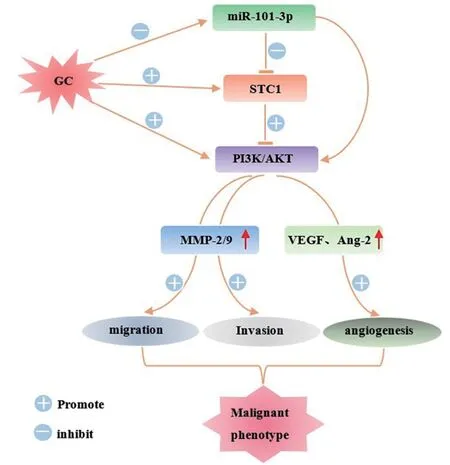
图7 miR-101-3p靶向STC-1基因影响胃癌细胞恶性表型的作用机制Figure 7 Mechanism of miR-101-3p targeting the STC-1 gene to affect the malignant phenotype of gastric cancer cells
综上所述,miR-101-3p在胃癌中表达下调,能够靶向STC-1调控PI3K/AKT信号通路抑制胃癌细胞BGC-823的侵袭转移和血管生成及体内移植瘤的发展。本研究从microRNA的角度探讨了miR-101-3p在胃癌发展中的作用机制,从而为胃癌的靶向治疗提供参考依据。但是miR-101-3p和STC-1能否作为临床有效的预测和治疗靶标应用于胃癌患者治疗有待进一步研究,今后还将从可变剪切等其他作用机制进一步探索非编码RNA对胃癌发生与进展的调控,为胃癌的基因与靶向治疗提供新思路。
——一道江苏高考题的奥秘解读和拓展

