基于金属有机框架材料UIO-66的荧光传感器检测美洲大蠊多肽
姚靖雯,胡 筱,林婉真,许惠凤,伍丽坤,余丽双
基于金属有机框架材料UIO-66的荧光传感器检测美洲大蠊多肽
姚靖雯1,胡 筱1,林婉真1,许惠凤2,伍丽坤1,*余丽双1
(1.福建中医药大学药学院,福建,福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建,福州 350122)
利用金属有机框架材料 UIO-66 构建荧光传感器,开发了一种能够快速检测美洲大蠊肽的方法。实验表明美洲大蠊多肽 DPSFNSWG-NH2可以有效淬灭 UIO-66 的荧光,基于美洲大蠊多肽和 UIO-66 材料之间的荧光内滤效应(Inner Filter Effect,IFE),构建了一种“turn-off”型荧光传感器用于美洲大蠊多肽的检测。该体系中,UIO-66作为荧光的供体,美洲大蠊多肽 DPSFNSWG-NH2作为荧光的淬灭剂,在最佳条件下,所设计的荧光传感器线性范围为50.00 ~ 600.00 μg/mL,检测限为34.56 μg/mL,且具有良好的重复性和稳定性。同时,该荧光传感器成功用于加标人尿液样品中多肽的检测。
药物分析;金属有机框架;荧光传感器;多肽
动物药用药历史悠久,临床意义重大,是我国传统中药的重要组成部分,我国历代本草书籍都有关于动物药的记载,《神农本草经》中对动物药的记载占药物总数的18.36%[1-2];明代李时珍的《本草纲目》中,动物药记载占药物总数四分之一[3],2020年版《中国药典》一部共收载成方制剂和单味制剂1607种,其中含有动物药材中成药品种504种[4],占31.36%。我国动物种类颇为丰富,动物药资源潜力巨大,具有广阔的开发前景。
但动物药基原种类繁多,其成分复杂、特殊,蛋白质、多肽、核苷等是大多数动物药的主要组成成分[5],亦是许多动物药材发挥独特疗效的重要物质基础。动物药美洲大蠊最早在《神农本草经》中就有应用记载,其体内含有多种多肽成分[6],具有抗菌[7]、抗肿瘤[8]、抗炎[9]、组织修复[10]等作用,随着生物制药研究的深入,市面上出现了越来越多的多肽类药物,并且较低浓度的多肽给药量就能达到良好的治疗效果,因此对于多肽类药物中多肽的含量测定以及人体中多肽含量的测定也具有了重要的意义和更高的要求。例如“康复新液”、“心脉龙注射液”等药物现已广泛用于治疗胃肠道溃疡和慢性心力衰竭[11],在临床研究中取得了有益的疗效,但由于缺乏对其多肽活性成分测定的分析方法,美洲大蠊的多肽提取物尚未完全开发用于临床用途,并且由于多肽的特殊性以及其它物质的干扰,需要结合生物学、免疫学和理化分析等方法才能得到比较可靠检测的结果。
目前,多肽类成分的测定方法众多,主要分为化学分析法[12]、光谱法[13-14]、色谱法[15]三大类,其中,凯氏定氮法、双缩脲法、Lowry 法(即福林 - 酚试剂法)、Peterson 法、双辛可宁酸( BCA) 法、考马斯亮蓝法、OPA 法(邻苯二甲醛法)均为化学分析法;光谱法有紫外分光光度法和荧光分光光度法;色谱法有 HPLC 法和毛细管电泳法[16]。其余的还有高效毛细管电泳联用质谱法和同位素标记法等[17]。但是多肽是具有生物活性的大分子,结构复杂,太过复杂的检测过程也容易使多肽失去活性,由于缺乏适宜的研究思路与方法,中药动物药质量评价研究不够系统与完善,制约着动物药各方面的应用与发展[18]。光谱法中的荧光分光光度法具有检测速度快,灵敏度高,检测方法多样性等优点[19],是近几年的研究热点之一。它能够将分子识别到的信息转化为可视的荧光信号(比如荧光增强或者猝灭、荧光特征峰位置的移动、荧光寿命的变更等),从而对特定物质实现检测[20]。基于荧光改变过程的各种荧光传感方法,包括有静态猝灭效应(SQE)、动态猝灭效应(DQE)、光致电子转移(PET)、共振能量转移(FRET)、电子能量转移(EET)、表面能量转移(SET)和分子内电荷转移(ICT)[21]。荧光传感具有灵敏度高、操作简便、检测时间短等优点,作为新兴的检测手段受到广泛关注。构建荧光传感器需要提供荧光的发光体,相比于传统荧光分子,荧光纳米材料具有形貌尺寸可调控、光学稳定性高等优点[22]。目前新型荧光纳米材料,有金属纳米粒子/团簇、金属有机框架、碳点及其复合纳米材料[23]。
金属有机框架(metal-organic framework,MOF)是一类含有机组分的晶态多孔材料,由金属簇(例如金属羧酸盐簇和金属唑酸盐簇)、金属原子或棒状簇和含有氧或氮供体的多齿有机连接体之间的配位键组成,形成了一个具有一维、二维以及三维的多孔晶体结构[24],由于其较大的比表面积使得 MOF 在催化[25]、吸附[26]等方面有了广泛的应用,并含有可以产生荧光的光致发光组分[27],具有作为荧光探针的潜力。UIO-66是一种三维多孔结构MOF,它以Zr为金属中心,对苯二甲酸(H2BDC)为有机配体,中心孔笼呈八面体,8个角笼为四面体[28],并且在 280 nm 激发后在 390 nm 波长处表现出峰值荧光[29]。Schaate等[30]首先发现制备过程中加入乙酸和苯甲酸可以有效地将共生的 UIO-66 晶体转化为八面体,并且苯甲酸的添加量会影响粒径。UIO-66 具有优异的热稳定性和化学稳定性,并具有气体吸附[31]、催化[32]和药物输送[33]等功能。基于 UIO-66 的荧光特性和多孔性、生物相容性[34]等各方面优点,在荧光传感器方面也引起了学者广泛的关注,Ruan等[35]开发了具有双发射中心的 SRB@UIO-66 可用作 Fe3+的比率传感器由于其高灵敏度和选择性,可在水溶液中进行 Fe3+检测。Lu等[36]通过 MOF 纳米材料UIO-66与铜离子配位键合制备Cu/UIO-66。Cu/UIO-66含有大量金属缺陷位点,可通过磷酸盐与锆的强配位与磷酸盐修饰的核酸适体结合,形成“turn-on”传感器检测氯霉素。MOF 相对于其他发光材料的潜在优势包括结合了有机和无机成分的灵活性,以及非常高的比表面积和结构灵活性,这些特性使得 MOF 的电子性质能够通过改变连接的配体或其相对空间排列,以此引入所需的功能,为特定的应用进行定制,这也是一系列具有荧光特性的UiO-66功能材料(UIO-66-Type)合成的基础,常见的 UIO-66 功能化衍生物有UIO-66-NH2,UIO-66-ONa,UIO-66-OH以及复合材料AuNCs@UIO-66等,均可被用于各种目标物的检测[37]。
与其他荧光猝灭材料相比,MOF 在生物传感器方面具有许多优势:通过调节金属离子、有机配体或反应条件能够使 MOF 具有不同物理化学性质、形状和大小;具有较高的比表面积、孔隙率和可调的多孔结构,有利于材料与生物分子之间的相互作用;金属离子和有机配体含有丰富的易于功能化的活性位点,可以结合不同的生物分子或修饰特定的官能团,以满足现实的传感要求。目前在生物领域中 MOF 的应用也得到了广泛的研究,尤其是在蛋白质组学和肽类研究的样品制备中[38-39],并也成功应用于基于核酸的开关荧光生物传感器的构建,用于体外检测不同类型的分析物,包括 DNA、RNA、酶、蛋白质、抗生素、重金属离子和其他分析物[40],这为我们检测多肽提供了新的方向。目前对多肽的研究还较少,尤其是动物药中的多肽,因为动物药中的成分更为复杂,提取过程也更加困难。为了动物药的长远发展,需要更为准确和灵敏的检测方法。结合荧光传感的优点和 MOF 的各方面特性,基于内滤效应[41]建立了一种“turn-off”型荧光传感器用于检测美洲大蠊多肽,并对该传感器进行条件优化,实验表明该方法具有良好的重现性和稳定性,操作简便,检测速度快,并且成功用于加标人尿液样品中多肽的检测,表明该方法在生物样品和中药材的检测中具有潜在的应用前景。
1 实验部分
1.1 试剂与仪器
试剂:UIO-66,多肽DPSFNSWG-NH2标准品,氯化锆(ZrCl4),甲醇(分析纯,西陇科学股份有限公司),对苯二甲酸(H2BDC,上海阿拉丁生化科技股份有限公司),N-N-二甲基甲酰胺(DMF,上海阿拉丁生化科技股份有限公司)。
仪器:KQ-500DE型超声波清洗器(昆山市超声仪器有限公司),紫外分光光度计(UV-3200,Mapada),FS5型荧光光谱仪(英国Edinburgh公司),XS105电子分析天平(梅特勒-托利多国际股份有限公司),ZF-20D 暗箱式紫外分析仪,1mL 注射器,0.22 μm 微孔滤膜。
尿液样本来源于实验室成年健康志愿者在未服用任何药物情况下取得的空白尿液。
1.2 实验方法
1.2.1 对照品的制备
精密称取多肽DPSFNSWG-NH2标准品 3.00 mg,加入1.0 mL 超纯水制备成3.00 mg/mL 的多肽DPSFNSWG-NH2标准品溶液,之后再用超纯水稀释至所需浓度,分装后置于 -20℃ 保存备用。
1.2.2 UIO-66的合成
根据文献[24]的方法进行合成 UIO-66 材料:将(0.223 g,1.0 mmol)ZrCl4和(0.166 g,1.0 mmol)H2BDC分别溶解在 30 mL DMF 溶剂中,超声分散15 min后将 2种溶液混合搅拌 10 min,向混合液中加入12 mL的醋酸,再继续匀速搅拌60 min,将混合母液密封放入 100 mL 聚四氟乙烯内衬不锈钢高压釜中于120℃烘箱保温24 h。样品自然冷却后离心分离取出固体,用 DMF 和甲醇离心洗涤多次,将最后获得的固体放置在 70 ℃烘箱干燥12 h,即可得到UiO-66样品。
1.2.3 美洲大蠊多肽对UIO-66荧光的响应
将1.00 mg UIO-66 分散在超纯水中,通过超声10 min 形成稳定的悬液。将不同浓度的美洲大蠊多肽DPSFNSWG-NH2溶液分别加UIO-66 悬液中,在250 nm 激发波长下用荧光光度计检测荧光强度。
1.2.4 实际样品的处理
将人尿样品过0.22 μm的微孔滤膜,取续滤液备用。向人尿样品续滤液中加入DPSFNSWG-NH2多肽标准品,稀释成所需浓度。然后将含不同浓度DPSFNSWG-NH2多肽的尿液 50 μL 混合加入200 μL UIO-66 悬液,设置激发波长为250 nm,利用建立的荧光传感器进行检测。
2 实验结果与讨论
2.1 UIO-66的表征
UIO-66 可通过 ZrCl4和H2BDC 配体直接自组装,用酸性 DMF 溶液处理。利用扫描式电子显微镜观察合成的UIO-66(如图1),可以观察到合成的 UIO-66 像是相互团聚在一起的不规则小晶体,尺寸约为200 nm。

图1 扫描式电子显微镜下的UIO-66
2.2 多肽DPSFNSWG-NH2对UIO-66荧光的响应
利用金属有机框架材料 UIO-66 为荧光探针,考察在DPSFNSWG-NH2多肽存在的情况下材料荧光信号的变化。荧光结果如图 2 所示,在激发波长为250 nm的情况下,UIO-66在 480 nm至530 nm 范围内有荧光,在500 nm左右有很强的荧光。而在加入多肽DPSFNSWG-NH2后荧光信号明显降低。这一结果表明多肽DPSFNSWG-NH2能够有效淬灭 UIO-66 的荧光。
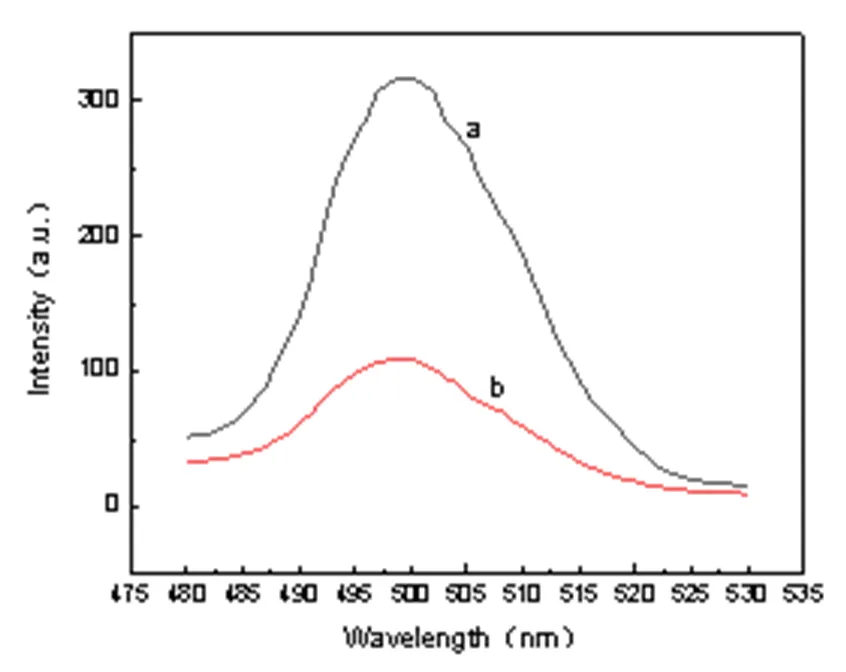
图2 加入DPSFNSWG-NH2前(a)、后(b)的荧光光谱
2.3 条件优化
2.3.1 最大激发波长的选择
将 UIO-66 分散在超纯水中,超声10 min,制备成100 μg/mL 的 MOF 材料稳定悬液。设置不同激发波长进行荧光测定,观察不同激发波长下的荧光强度。从图3中可以看出,当激发波长为255 nm时,UIO-66 峰形发生了改变,故选择 250 nm 为最佳激发波长。
(a.240 nm; b.245 nm; c.250 nm; d.255 nm)
2.3.2 UIO-66 浓度的选择
将 UIO-66 分散在超纯水中,超声10 min,制备成1.00 mg/mL 的稳定悬液,再用超纯水稀释成不同浓度,设置激发波长为250 nm进行荧光测定,观察不同浓度的 UIO-66 的荧光强度。从图 4 中可以看出,当浓度为200 μg/mL 时,UIO-66 荧光强度最大。但是考虑到合成的UIO-66 材料的量较少,选择100 μg/mL 的浓度仍然可以达到理想的实验现象,综合各方面因素选择100 μg/mL 的浓度进行后续实验。

(a.500 μg/mL;b.200 μg/mL;c.100 μg/mL;d.50 μg/mL)
2.3.3 溶剂的选择
精密称取1.0 mg UIO-66,用超纯水制备成 1.0mg/mL的母液,再分别用不同的溶剂(超纯水,PBS,PB,Tris-HCl)稀释成100 μg/mL,混匀后设置激发波长为250 nm,检测其荧光强度,结果如图 5 所示。在选定的溶剂中用超纯水的荧光强度最强,故选用超纯水作为溶剂。

(a.H2O;b.PBS;c.Tris-HCL;d.PB)
2.3.4 响应时间
在最佳波长、浓度、溶剂的条件下,将终浓度为100 μg/mL 的多肽 DPSFNSWG-NH2加入到UIO-66 溶液中,测定反应不同时间多肽对 UIO-66 的荧光淬灭的程度。结果如图 6 所示,从图中可以看出,随着时间变化淬灭率并无明显改变,保持稳定,因此将多肽 DPSFNSWG-NH2加入到UIO-66 溶液中,随后混匀即可立即检测荧光。
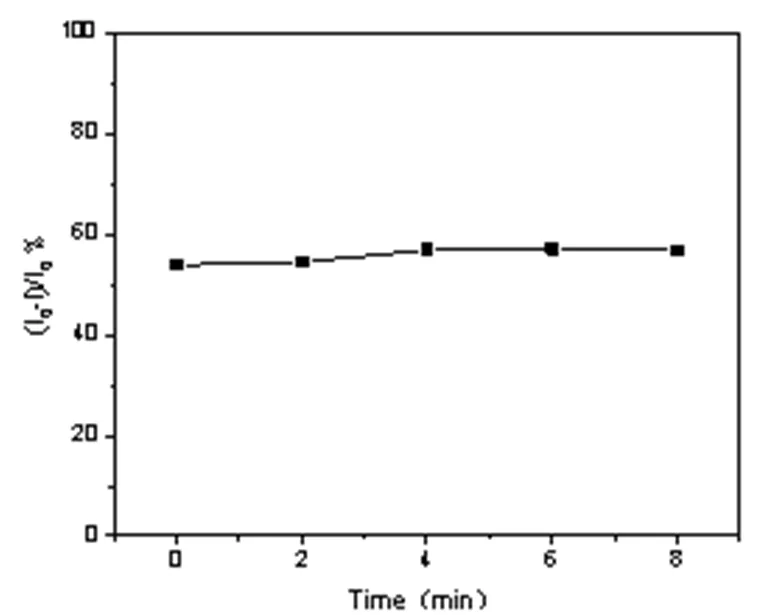
图6 UIO-66 对DPSFNSWG-NH2的响应时间
2.4 方法学验证
2.4.1 线性方程
实验研究不同浓度多肽 DPSFNSWG-NH2对 UIO-66 材料荧光强度的影响。从图7中可以看出,随着多肽 DPSFNSWG-NH2浓度的增加,UIO-66 荧光强度逐渐降低。同时发现多肽浓度在 50.00 ~ 600.00 μg/mL 范围内有良好的线性关系,回归方程是:I0-I =0.3240C+25.9362,=0.9914(C是多肽 DPSFNSWG-NH2的浓度(μg/mL),I0是 UIO-66 的荧光强度,I为加入不同浓度 DPSFNSWG-NH2后UIO-66 的荧光强度,是相关系数)。

(a.0 μg/mL;b.50 μg/mL;c.100 μg/mL;d.150 μg/mL;e.200 μg/mL;f.300 μg/mL;g.450 μg/mL;h.600 μg/mL)
2.4.2 检测限和精密度
通过三倍信噪比计算出该方法的检测限为35.23 μg/mL。
对同一样品进行6次测定,得到结果的 RSD 为4.35%,说明该方法具有较好的精密度。
2.4.3 重复性试验
在最佳条件下制备6份浓度相等的多肽DPSFNSWG-NH2溶液,各取 50 μL 加入200 μL 的100 μg/mL的UIO-66 混悬液中,分别测定者六份样品的荧光强度。得出的结果的 RSD为3.99%,说明该方法的重复性良好。
2.5 多肽DPSFNSWG-NH2的淬灭机理研究
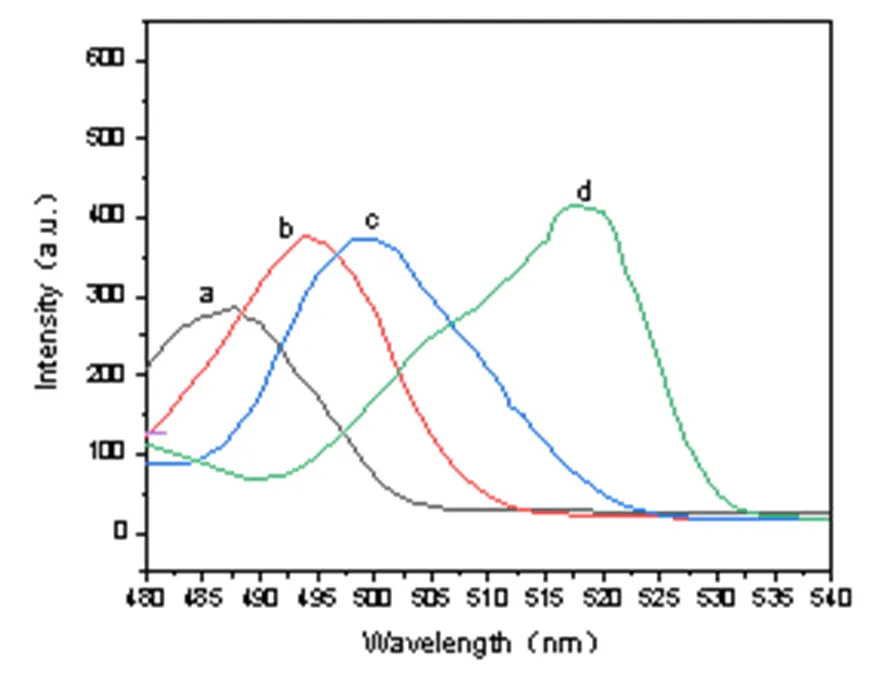
荧光内滤效应(inner filter effect, IFE)是指吸收体对荧光体激发光或发射光(或对两者同时)的吸收,导致荧光体的荧光强度降低的现象。多肽DPSFNSWG-NH2的紫外吸收图谱显示多肽DPSFNSWG-NH2在250 nm至 270 nm处有紫外吸收,275 nm附近有强吸收峰。由图8 可以看到多肽DPSFNSWG-NH2的紫外吸收与UIO-66 的激发光谱有部分重叠,DPSFNSWG-NH2能够吸收 UIO-66 的激发光从而导致UIO-66 荧光强度下降,符合荧光内滤效应。从图9中可看出,当加入淬灭剂DPSFNSWG-NH2后,UIO-66荧光寿命有明显降低。故推测多肽DPSFNSWG-NH2对UIO-66淬灭为动态淬灭机制。因此内滤效应和动态淬灭效应为多肽DPSFNSWG-NH2有效淬灭UIO-66材料荧光的主要机理。

图8 UIO-66的荧光激发(a)与发射(c)光谱图及DPSFNSWG-NH2 的紫外吸收图谱(b)
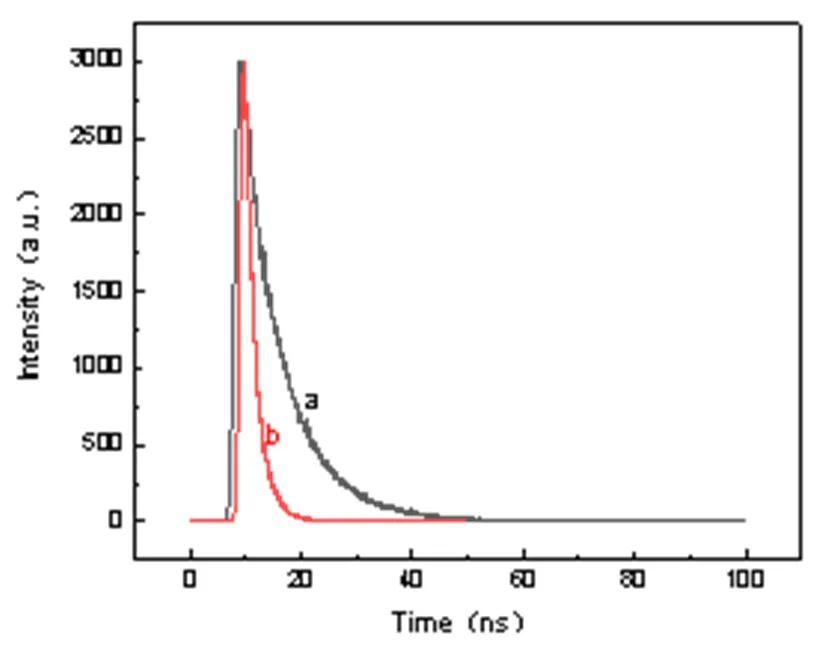
图9 加入DPSFNSWG-NH2前(a)、后(b)的UIO-66荧光衰减曲线
2.6 加标样品的测定
将三种不同浓度的DPSFNSWG-NH2多肽标准品溶液加入尿样中,检测样品对 UIO-66 荧光淬灭程度,以此验证该荧光传感器可能用于检测尿液样品中的DPSFNSWG-NH2多肽。测量浓度由标准曲线确定,实验结果表明多肽DPSFNSWG-NH2的回收率在93.32% ~ 1.06%之间,表明该方法具有应用于检测尿液中多肽的潜力。
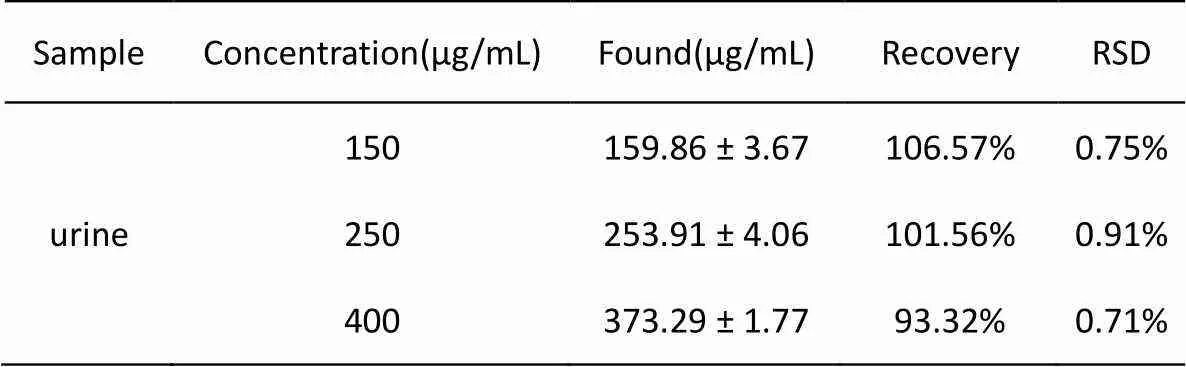
表1 尿液中多肽含量的测定
3 分析与讨论
内滤效应 (IFE) 是荧光光谱法中重要的非辐照能量转换模型,它是由检测系统中吸收体吸收激发或发射光产生的结果。基于 IFE 的传感方法具有显著优点:(1)基于 IFE 的荧光传感系统不需要吸收器与荧光器的连接,具有相当大的灵活性和简便性;(2)可以通过控制吸收器和荧光器的相对量来调整系统的响应斜率、动态工作范围和检测极限;(3)对分析物的荧光响应比使用低浓度水平的紫外-可见吸收要灵敏,提高了检测灵敏度。然而基于IFE的传感方法也存在一些缺点:(1)材料选择有限;(2)传统吸收器通常的消光系数小,这限制了基于 IFE 的荧光分析的灵敏度;(3)在复杂的生物环境中的应用潜力容易受到外部环境的干扰而导致的灵敏度不足。MOF为固体发光材料的发展提供了一个独特的平台,因为它们具有一定程度的结构可预测性,新型材料的发展和合成技术的进展将会为荧光光谱法提供更多种可能。
UIO-66 材料合成过程中pH对 UIO-66 的结构和比表面积均有较大影响,因此在合成过程中加入了醋酸作为酸度调节剂,研究表明UIO-66 粒径随着酸度调节剂添加量增加而增大,并呈现出更具规则的八面体结构,根据研究本实验合成过程中采用n(ZrCl4):n(H2BDC):n(HAc)= 1:1:200的比例进行材料的合成。同时也更需要关注在检测环境中体系抗酸碱度、温度干扰的问题,这仍需要进一步分析和完善。
与传统的多肽测定方法相比,如柱前或柱后衍生的氨基酸分析方法测定多肽水解后得到的各种氨基酸及其含量[42],本实验建立的方法具有操作更为简便,成本低以及检测速度快等优点,在这方面具有一定的研究价值。在探究该方法选择性的过程中,由于动物药药材中多肽种类多且相似性较高,该方法目前无法区分不同序列美洲大蠊多肽,但UIO-66具有明确的孔径与良好的生物相容性,运用于物质复杂多样的生物样品中,可以排除生物大分子的干扰,故本方法可为尿样等复杂生物样品中多肽的检测提供新思路和新方法。
目标分析物是生物分子(如核酸、多肽、酶)的荧光生物传感器涉及与目标分析物的特异性结合,可以通过相关的生化反应实现对目标的特异性生物识别感知,产生荧光信号响应。为了进一步提高方法的选择性和降低检测限,后续拟进一步进行体系的条件优化以及结合多肽的抗体或是核酸适配体等进行荧光免疫传感器的研究。
4 小结
以 ZrCl4为中心,H2BDC 为配体直接自组装,再用酸性 DMF 溶液处理能够得到具有荧光性能的 UIO-66 材料。在扫描式电子显微镜下观察所获得的UIO-66材料呈团聚的颗粒状,形态良好,并且经过荧光检测表明其具有作为荧光探针的条件。本实验研究基于 IFE 利用制备的 UIO-66 材料构建“turn-off型传感器,并对传感器的各方面条件进行优化,实验结果表明该方法能够对生物样品中的美洲大蠊多肽 DPSFNSWG-NH2进行检测,且具有灵敏度高,检测速度快,操作简便,成本低等优点,这为多肽的检测提供了新思路和新方向。但是由于多肽生物活性成分的复杂性和不稳定性,对于药材中多肽含量测定也依旧存在着挑战。随着 MOF 材料的发展以及生物学、免疫学和理化分析等方法的发展,更加简便、准确的技术将成为今后多肽检测的主要发展方向,为中药动物药的开发和现代化、产业化、国际化的发展提供技术支持。
[1] 朱建华.略谈《神农本草经》中的动物药[J].中医杂志, 1995(5):310.
[2] 李晶峰,张辉,孙佳明,等. 我国药用动物资源近三年研究进展与展望[J]. 中国现代中药, 2017,19(5):729-734.
[3] 赵润怀,贾海彬,周永红,等. 我国动物药资源供给现状及可持续发展的思考[J].中国现代中药, 2020,22(6):835-839.
[4] 边学峰,李晶峰,金力群,等.对2020年版《中国药典》中动物药质量标准的商榷[J].吉林中医药,2021,41(6):809-816.
[5] 吴越,李贤煜,杨洪军.动物类中药抗癌机制研究[J]. 中国中医基础医学杂志, 2021,27(4):671-677.
[6] Zeng H, Qin Y, Du E, et al. Genomics- and peptidomics-based discovery of conserved and novel neuropeptides in the american cockroach[J]. J Proteome Res, 2021,20(2): 1217-1228.
[7] Lee H, Hwang J S, Lee D G. Periplanetasin-4, a novel antimicrobial peptide from the cockroach, inhibits communications between mitochondria and vacuoles[J]. Biochem J, 2019,476(8):1267-1284.
[8] Zeng C, Liao Q, Hu Y, et al. The role of periplaneta americana ( blattodea: blattidae ) in modern versus traditional chinese medicine[J]. J Med Entomol, 2019,56(6):1522-1526.
[9] Nguyen T, Chen X, Chai J, et al. Antipyretic, anti-inflammatory and analgesic activities of periplaneta americana extract and underlying mechanisms[J]. Biomed Pharmacother, 2020,123:109753.
[10] 王钦,刘克娜,孔彩华,等. 美洲大蠊有效成分的提取及药理活性研究进展[J].中华中医药学刊,2021,39(8):108-111.
[11] 王钦,刘克娜,孔彩华, 等. 美洲大蠊提取物的活性成分及其抗氧化应激的研究现状[J]. 中华中医药学刊, 2021,39(7):124-127.
[12] 徐妍.美洲大蠊抗肝纤维化活性提取物质量标准研究[D].大理:大理大学, 2019.
[13] 卫国,边海旭,奚苗苗,等.福林酚比色法测定优泌嘉胶囊中多肽[J].中成药, 2016,38(01):91-93.
[14] 周天琼,俞保彬,倪燕红,等. 转移因子胶囊中多肽与核糖含量测定方法研究[J].浙江科技学院学报, 2014,26(3):172-176.
[15] 秦翠芳.多肽分子的荧光光谱特性及其在金属离子检测上的应用研究[D].上海:华东师范大学, 2016.
[16] 陈卉,李智勇,王洛临. 虫类药物中蛋白、多肽类成分的提取与检测方法研究进展[J]. 中华中医药学刊, 2015,33(4):966-970.
[17] 韩宁娟,方欢乐,刘建利. 生物样品中多肽定量分析方法[J]. 生物化工, 2021,7(1):157-159.
[18] 刘睿,赵明,段金廒. 基于“蛋白质/肽组学-修饰组学”研究动物药功效物质基础的思路与方法[J]. 药学学报, 2020,55(8):1735-1743.
[19] 曹志俊,徐丹,邵钰茹,等. 同步荧光光谱法在分析化学中的应用研究综述[J]. 石化技术, 2020,27(12):149-150.
[20] 李悦,郭东升,阮文娟. 光致发光与荧光传感——光化学基本原理的应用[J]. 大学化学, 2019,34(4):45-50.
[21] Chen S, Yu Y L, Wang J H. Inner filter effect-based fluorescent sensing systems: A review[J]. Anal Chim Acta, 2018,999:13-26.
[22] 李敏. 荧光金纳米簇、碳点及其复合纳米材料的合成与传感应用研究[D].太原:山西大学, 2018.
[23] Liu Y, Liu C Y, Zhang Z Y. Synthesis and surface photochemistry of graphitized carbon quantum dots[J]. J Colloid Interface Sci, 2011,356(2):416-421.
[24] Samanidou V F, Deliyanni E A. Metal Organic Frameworks: Synthesis and Application[J]. Molecules, 2020,25(4).
[25] 石佳玉,夏畅,李莹莹,等.由电泳沉积ZIF-67薄膜制备高效染料敏化太阳能电池对电极[J].井冈山大学学报:自然科学版, 2020,41(2):23-28.
[26] 丁美丽,江海龙.金属有机框架材料的结构穿插对染料吸附性能的影响[J]. 中国科技论文,2017,12(12): 1327-1330.
[27] Li J M, Huo R, Li X, et al. Lanthanide-organic frameworks constructed from 2,7-Naphthalenedisulfonate and 1H-Imidazo [4,5-f][1,10]-phenanthroline: Synthesis, structure, and luminescence with near-visible light excitation and magnetic properties[J]. Inorg Chem, 2019,58(15):9855-9865.
[28] 马允. 酸促UiO-66的合成及其对废水中头孢抗生素的处理效率[J]. 中山大学学报:自然科学版, 2021:1-6.
[29] Decker G E, Stillman Z, Attia L, et al. Controlling size, defectiveness, and fluorescence in nanoparticle UiO-66 through water and ligand modulation[J]. Chem Mater, 2019,31(13):4831-4839.
[30] Schaate A, Roy P, Godt A, et al. Modulated synthesis of Zr-based metal-organic frameworks: from nano to single crystals[J]. Chemistry, 2011,17(24):6643-6651.
[31] Ahmadijokani F, Ahmadipouya S, Molavi H, et al. Impact of scale, activation solvents, and aged conditions on gas adsorption properties of UiO-66[J]. J Environ Manage, 2020,274:111155.
[32] Abdelhamid H N. UiO-66 as a catalyst for hydrogen production via the hydrolysis of sodium borohydride[J]. Dalton Trans, 2020,49(31):10851-10857.
[33] Xie C, Guo B, You H, et al. Synthesis and surface modification of mesoporous metal-organic framework (UiO-66) for efficient pH-responsive drug delivery and lung cancer treatment[J]. Nanotechnology, 2021,32(29).
[34] Singh N, Qutub S, Khashab N M. Biocompatibility and biodegradability of metal organic frameworks for biomedical applications[J]. J Mater Chem B, 2021,9(30):5925-5934.
[35] Ruan B, Yang J, Zhang Y J, et al. UiO-66 derivate as a fluorescent probe for Fe(3+) detection[J]. Talanta, 2020,218:121207.
[36] Lu Z, Jiang Y, Wang P, et al. Bimetallic organic framework-based aptamer sensors: a new platform for fluorescence detection of chloramphenicol[J]. Anal Bioanal Chem, 2020,412(22):5273-5281.
[37] 陈隆,胡丹,魏振,等.荧光UiO-66系列功能材料的设计与应用[J]. 化工新型材料, 2021:1-10.
[38] Bie Z, Huang A, Zhang Y, et al. Boronate affinity Metal-Organic frameworks for highly efficient cis-diol molecules in-situ enrichment and surface-assisted laser desorption/ionization mass spectrometric detection[J]. Anal Chim Acta, 2019,1065:40-48.
[39] Zhong H, Li Y, Huang Y, et al. Metal-organic frameworks as advanced materials for sample preparation of bioactive peptides[J]. Anal Methods, 2021,13(7):862-873.
[40] Huo Y P, Liu S, Gao Z X, et al. State-of-the-art progress of switch fluorescence biosensors based on metal-organic frameworks and nucleic acids[J]. Mikrochim Acta, 2021,188(5):168.
[41] 杜晓宁,宋明鸣. 多肽类物质分析检测方法的研究进展[J]. 上海化工, 2009,34(11):6-11.
[42] 谢勇,韩明杰,徐钰豪,等.荧光内滤效应在环境检测领域的应用[J].化学进展, 2021,33(8):1450-1460.
DETECTION OFPOLYPEPTIDE BY FLUORESCENCE SENSOR BASED ON METAL ORGANIC FRAME MATERIAL UIO-66
YAO Jing-wen1,HU Xiao1,LIN Wan-zhen1,XU Hui-feng2,WU Li-kun1,*YU Li-shuang1
(1. College of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian 350122, China; 2. Fujian Key Laboratory of Integrative Medicine on Geriatrics, Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian, 350122, China)
The metal organic framework material uio-66 was used to construct a fluorescent sensor, and a method for rapid detection ofpeptide was developed. Experiments show thatpolypeptide DPSFNSWG-NH2could effectively quench the fluorescence of uio-66. Based on the inner filter effect (IFE) betweenpolypeptide and uio-66 material, a "turn off" fluorescent sensor was constructed for the polypeptide detection. In this system, uio-66 was used as the fluorescence donor andpolypeptide DPSFNSWG-NH2was used as the fluorescence quencher. Under the optimum conditions, the linear range of the designed fluorescence sensor was 50 ~ 600 μg/mL, the detection limit was 34.56 μg/mL, and had good repeatability and stability. At the same time, the fluorescent sensor was successfully used to detect peptides in the spiked human urine samples.
pharmaceutical analysis; metal organic framework; fluorescent sensor; polypeptide
TP212.3
A
10.3969/j.issn.1674-8085.2022.06.004
1674-8085(2022)06-0019-08
2022-02-28;
2022-04-28
国家自然科学基金项目(82074005);福建省科技厅项目(2021J01925)
姚靖雯(1998-),女,福建漳州人,硕士生,主要从事药物化学分析方法学研究(E-mail:654229463@qq.com);
*余丽双(1982-),女,福建莆田人,研究员,博士,博士生导师,主要从事中药化学分析方法学研究(E-mail:yuls66@fjtcm.edu.cn).

